预浓缩-GC-MS/FID测定环境空气中116种挥发性有机物
刘 强, 任昶宇, 史 箴, 何吉明, 熊 杰, 王若男, 张璐涛, 曹 阳
(四川省生态环境监测总站, 四川 成都 610091)
挥发性有机物(VOCs)作为臭氧(O3)与大气细颗粒(PM2.5)污染的重要前体物[1-3],是引起光化学烟雾、灰霾复合污染等大气污染的主要因素。VOCs是一类低沸点、强挥发性的有机化合物,包括烷烃、烯烃、卤代烃、芳香烃、醛酮、酯和醚等,对人体和生态环境危害极大[4-6],部分VOCs为有毒有害气体,可刺激人体感觉器官、增加患癌风险[7-8],现已成为中国城市大气中最受关注的污染物之一[9-12]。VOCs由于其大气中含量低[13](通常是10-9级或更低),种类多[14](达300种以上)、且物理性质、化学性质均不相同,部分组分不稳定,对监测和分析技术要求较高[15]。目前较为主流的监测方法是预浓缩-气相色谱-质谱/氢火焰离子化检测器联用法[16-18],但大多研究集中在建立方法的起步阶段,本研究则在此基础上通过不断优化仪器参数条件,确定最优参数,并对此条件下方法的稳定性和准确性进行了系统评估,该研究可为相关VOCS分析测定及大气污染防控提供借鉴参考。
1 实验部分
1.1 仪器与试剂
Agilent 7890A/5975C气相色谱-质谱联用仪(配备FID检测器、冷柱箱、Deans Switch中心切割装置);Nutech 8910预浓缩仪及自动进样器、Nutech 2203静态稀释仪、Nutech 2104苏玛罐清洗仪、Entech苏玛罐(3.2 L、6 L)。
标准气:116种VOCs标准气体,购于美国Linde公司,内标气:一溴一氯甲烷、1,2-二氟苯、氯苯-d5及4-溴氟苯,购于中国测试技术研究院,标准气及内标气浓度均为1μmol·mol-1;液氮、高纯氦气、高纯氮气、高纯氢气、零级空气纯度均大于99.999%;超纯水:电阻率为18.25MΩ·cm。
1.2 实验方法
苏玛罐清洗:在60℃下,使用苏玛罐清洗仪用高纯氮气、超纯水加湿加热清洗,循环清洗6次,清洗完毕后,将苏玛罐压力抽至<6.7 Pa(50 mtorr),待用。此外,每清洗20个苏玛罐取一个注入高纯氮气,压力至14.5 psi,按照实际样品的分析步骤进行测定,确保苏玛罐清洁无污染。
标准使用气配制:用静态稀释仪,将1 μmol·mol-1的116种VOCs标准气体用高纯氮气稀释至10 nmol·mol-1(超纯水加湿),作为标准使用气;将1 μmol·mol-1的内标气用高纯氮气稀释至100 nmol·mol-1,作为内标使用气。充分平衡后待用,保质期20 d。
1.3 仪器条件
样品经预浓缩系统的三级冷阱浓缩,进入气相色谱,经DB-1色谱柱分离后,再通过Deans Switch将C2~C3组分(乙烯、乙烷、乙炔、丙烯、丙烷)切割至HP-PlotQ-PT色谱柱上进行二次分离,并在FID检测器上测定,其他组分经毛细管空柱进入MS测定,具体仪器条件如下。基准进样体积:300 mL。内标进样体积:30 mL,Deans Switch切割时间10.9 min。
1.3.1 条件1
预浓缩系统条件。一级冷阱(玻璃珠冷阱):捕集温度:-50℃,捕集速率:40 mL·min-1,解析温度:5℃,烘烤温度:180℃;二级冷阱(Tenax吸附剂冷阱):捕集温度:-50℃,解析温度:235℃,解析时间:1.5 min,烘烤温度:240℃;三级冷阱(冷聚焦冷阱):聚焦温度:-170℃,解析温度:80℃,解析时间:0.5 min,烘烤温度:100℃;传输线温度:100℃。
色谱条件。进样口温度:150℃,载气:高纯氦气,分流比20∶1,色谱柱1:Agilent DB-1(60 m×0.25 mm×1.0 μm),恒流:1.0 mL·min-1,色谱柱2:Agilent HP-PlotQ(30 m×0.32 mm×20 μm),恒流:2.5 mL·min-1,阻尼柱:毛细管空柱(3.5 m×0.15 mm×0 μm),升温程序:初始温度35℃,保持6 min;以2.5℃·min-1升至90℃;再以12℃·min-1升至220℃,保持8 min;再以20℃·min-1升至240℃。
FID/MS条件。FID检测器:温度:300℃,氢气流量:40 mL·min-1,空气流量:400 mL·min-1,尾吹气(高纯氮气)流量:25 mL·min-1。MS检测器:离子源:EI源,调谐文件:BFB调谐,溶剂延迟时间:3 min,接口温度:250℃,离子源温度:230℃,四极杆温度:150℃,传输线温度:250℃,采集方式:定性分析采用全扫描(SCAN),扫描范围:29~350 amu。
1.3.2 条件2
预浓缩系统条件。一级冷阱(玻璃珠冷阱):捕集温度:-50℃,捕集速率:40 mL·min-1,解析温度:5℃,烘烤温度:180℃;二级冷阱(Tenax吸附剂冷阱):捕集温度:-50℃,解析温度:235℃,解析时间:1.5 min,烘烤温度:240℃;三级冷阱(冷聚焦冷阱):聚焦温度:-170℃,解析温度:80℃,解析时间:0.5 min,烘烤温度:100℃;传输线温度:100℃。
色谱条件。进样口温度:150℃,载气:高纯氦气,分流比20:1,色谱柱1:Agilent DB-1(60 m×0.25 mm×1.0 μm),恒流:1.0 mL·min-1,色谱柱2:Agilent HP-PlotQ(30 m×0.32 mm×20 μm),恒流:2.5 mL·min-1,阻尼柱:毛细管空柱(3.5 m×0.15 mm×0 μm),升温程序:初始温度-20℃,保持3 min;以5℃·min-1升至150℃;再以15℃·min-1升至220℃,保持9 min;再以20℃·min-1升至240℃。
FID/MS条件。FID检测器:温度:300℃,氢气流量:40 mL·min-1,空气流量:400 mL·min-1,尾吹气(高纯氮气)流量:25 mL·min-1。MS检测器:离子源:EI源,调谐文件:BFB调谐,溶剂延迟时间:3 min,接口温度:250℃,离子源温度:230℃,四极杆温度:150℃,传输线温度:250℃,采集方式:定性分析采用全扫描(SCAN),扫描范围:29~350 amu。
1.3.3 条件3
预浓缩系统条件。一级冷阱(玻璃珠冷阱):捕集温度:-50℃,捕集速率:40 mL·min-1,解析温度:35℃,烘烤温度:180℃;二级冷阱(Tenax吸附剂冷阱):捕集温度:-50℃,解析温度:235℃,解析时间:1.5 min,烘烤温度:240℃;三级冷阱(冷聚焦冷阱):聚焦温度:-170℃,解析温度:80℃,解析时间:0.5 min,烘烤温度:100℃;传输线温度:100℃。
色谱条件。进样口温度:150℃,载气:高纯氦气,分流比20∶1,色谱柱1:Agilent DB-1(60 m×0.25 mm×1.0 μm),恒流:1.0 mL/min,色谱柱2:Agilent HP-PlotQ(30 m×0.32 mm×20 μm),恒流:2.5 mL·min-1,阻尼柱:毛细管空柱(3.5 m×0.15 mm×0 μm),升温程序:初始温度-20℃,保持3 min;以5℃·min-1升至150℃;再以15℃·min-1升至220℃,保持9 min;再以20℃·min-1升至240℃。
FID/MS条件。FID检测器:温度:300℃,氢气流量:40 mL·min-1,空气流量:400 mL·min-1,尾吹气(高纯氮气)流量:25 mL·min-1。MS检测器:离子源:EI源,调谐文件:BFB调谐,溶剂延迟时间:3 min,接口温度:250℃,离子源温度:230℃,四极杆温度:150℃,传输线温度:250℃,采集方式:定性分析采用全扫描(SCAN),扫描范围:29~350 amu。
1.3.4 条件4
预浓缩系统条件。一级冷阱(玻璃珠冷阱):捕集温度:-50℃,捕集速率:40 mL·min-1,解析温度:5℃,烘烤温度:180℃;二级冷阱(Tenax吸附剂冷阱):捕集温度:-20℃,解析温度:235℃,解析时间:1.5 min,烘烤温度:240℃;三级冷阱(冷聚焦冷阱):聚焦温度:-170℃,解析温度:80℃,解析时间:0.5 min,烘烤温度:100℃;传输线温度:100℃。
色谱条件。进样口温度:150℃,载气:高纯氦气,分流比20∶1,色谱柱1:Agilent DB-1(60 m×0.25 mm×1.0 μm),恒流:1.0 mL·min-1,色谱柱2:Agilent HP-PlotQ(30 m×0.32 mm×20 μm),恒流:2.5 mL·min-1,阻尼柱:毛细管空柱(3.5 m×0.15 mm×0 μm),升温程序:初始温度-20℃,保持3 min;以5℃·min-1升至150℃;再以15℃·min-1升至220℃,保持9 min;再以20℃·min-1升至240℃。
FID/MS条件。FID检测器:温度:300℃,氢气流量:40 mL·min-1,空气流量:400 mL·min-1,尾吹气(高纯氮气)流量:25 mL·min-1。MS检测器:离子源:EI源,调谐文件:BFB调谐,溶剂延迟时间:3 min,接口温度:250℃,离子源温度:230℃,四极杆温度:150℃,传输线温度:250℃,采集方式:定性分析采用全扫描(SCAN),扫描范围:29~350 amu。
2 结果与讨论
2.1 气相色谱-质谱条件优化
由于目标化合物数量多、沸点跨度大,色谱柱需采用程序升温方式方能达到较好的分离度、峰形和响应。若VOCs沸点较低时,降低GC分析的初始温度和增加初始温度的保持时间有利于提高分离度,但过低的初始温度使色谱进样前平衡时间延长,对实验室环境温度要求较高,而过长的初始温度保持时间将延长样品分析时间,降低工作效率。合适的升温速率既能保证较小的保留时间,也能保证较大的分离度。综合考虑,选择条件一及条件二,使程序升温的初始温度分别为35℃与-20℃,保持时间分别为6 min与3 min,考察了程序升温为35℃至240℃及-20℃至240℃的两种方式对目标化合物的分离效果。两种程序升温条件下目标化合物谱图如图1所示。结果表明,在35℃至240℃的分析条件下,大部分低沸点目标化合物分离度极差,即便增加初始温度的保留时间和降低程序升温速率,也难以保证低沸点目标化合物有较好的响应,实现较好的分离。而针对高沸点目标化合物逐步趋于正常,两者差别并不明显。而在-20℃至240℃的分析条件下,116种 VOCs 可在较短时间(56.7 min)内完全出峰,基线平稳、峰形良好,除间/对二甲苯、间/对-乙基甲苯不易被分离外,其余目标物均得到了有效分离[19]。
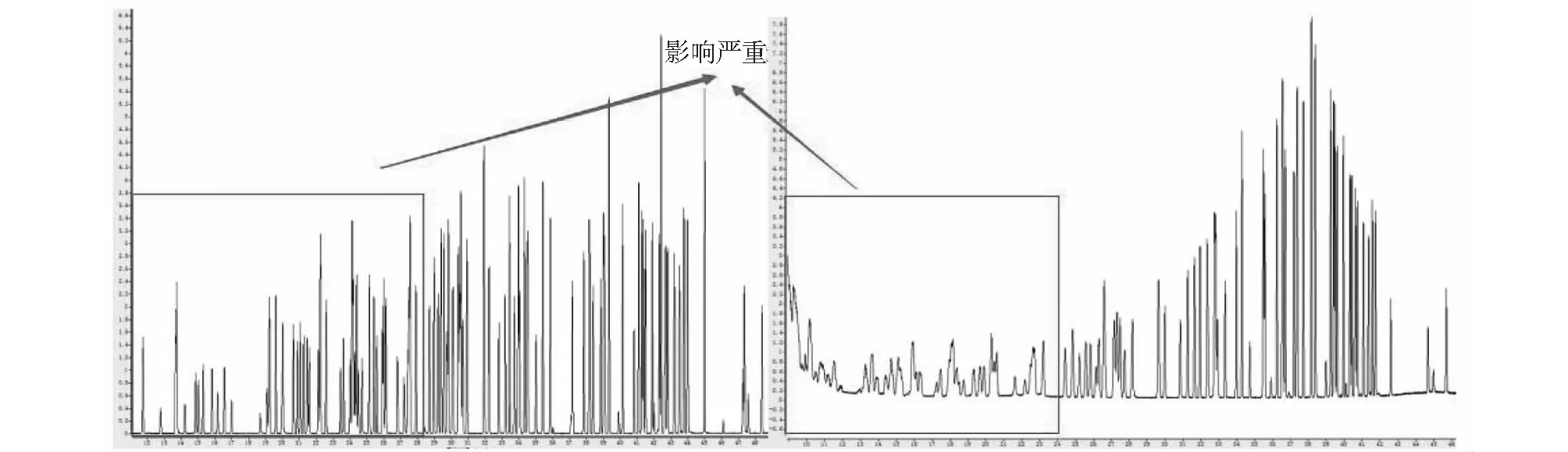
图1 两种程序升温条件下目标化合物谱图
2.2 预浓缩系统条件优化
预浓缩系统采用经典三级冷阱方式:一级冷阱(玻璃珠冷阱)将气态水变成固态冰,实现目标化合物和水的分离;二级冷阱(Tenax吸附剂冷阱)使目标化合物与CO2及样品中其他主要成分分离,然后聚焦到三级冷阱(冷聚焦冷阱)中进一步浓缩。其中,一级冷阱及二级冷阱是116种VOCs分析中的关键环节,直接关系到样品的水分去除及目标化合物的捕集效果,对定性和定量均有重要影响。
一级冷阱为空阱,利用温度越低饱和水含量越低的原理去除水分。虽温度越低,除水效果越好,但目标化合物同时也被牢牢富集住,即使升温(温度不宜太高,否则水分会继续进入二级冷阱)脱附也无法彻底使部分目标化合物自由穿透至二级冷阱,特别是高沸点目标化合物。故设置捕集温度为-50℃,确保水汽完全被富集在该处,同时最大限度减少高沸点目标化合物的损失。选择条件三及条件二,考察解析温度分别为35℃与5℃时各目标化合物的测定情况。两种一级冷阱解析温度条件下目标化合物结果图2所示。结果表明,解析温度为35℃时MS检测器中部分目标化合物出现响应降低、重复性降低、峰形变差、峰拖尾、出峰时间偏移等情况[20],尤其对低沸点目标化合物影响最为严重,中沸点目标化合物次之,随目标化合物沸点升高影响逐渐降低并趋于正常;FID检测器中C2组分(乙烯、乙炔、乙烷)响应极低,峰型极差,C3组分(丙烯、丙烷)表现正常。究其原因,主要是因为一级冷阱用于实现目标化合物与水的直接分离,水汽在低温(-50℃)条件下被冷冻富集,水的熔点为0℃,当解析温度为35℃时,冷阱中冷冻的水汽随温度的不断升高逐渐液化,在载气的推动作用下与目标化合物一并进入下一环节,进而影响分析测定,尤其对低沸点目标化合物影响更为明显;当解析温度为5℃则能很好的避免上述问题的出现,该温度略高于水汽固液两相的临界温度,解析过程中,仅目标化合物随载气进入下一环节,水汽则很好的被继续富集在冷阱中,不会对后续分析测定产生影响。

图2 两种一级冷阱解析温度条件下目标化合物谱图
二级冷阱是对目标化合物高效捕集的关键环节。液氮制冷温度可达-190℃,虽温度越低捕集效果越好,但超低温(-100℃以下)也伴随着液氮的大量消耗。同时该冷阱自身含有Tenax吸附填料,系统通过填料吸附与低温制冷相结合的方式捕集目标化合物,在超低温与极低温(-100℃至-50℃)条件下,均可完成全部目标化合物的高效捕集[21]。故结合实际探讨低温(-50℃至-20℃)与极低温条件下对目标化合物的捕集效果,选择条件四及条件二,考察捕集温度分别为-20℃与-50℃时各目标化合物的测定情况。两种二级冷阱捕集温度条件下目标化合物结果如图3所示。结果表明,捕集温度为-20℃与-50℃时,针对MS检测器中测定的目标化合物,两者响应、重复性、峰形均能较好匹配、无明显差异;针对FID检测器中测定的C3组分(丙烯、丙烷)响应相当,但C2组分(乙烯、乙炔、乙烷)几乎无响应。二级冷阱除了用于使目标化合物与CO2及样品中其他杂质分离外,更用于实现目标化合物的有效富集,C2组分沸点最低(乙烯为-103.7℃、乙炔为-83.8℃、乙烷为-88.6℃),当冷阱温度仅为-20℃时,C2组分通过二级冷阱时,无法实现对此类物质的高效捕集,在解析之前便随载气一并流失,色谱图则表现为无响应。而冷阱温度达到-50℃时,所有组分在二级冷阱处实现高效捕集,测定结果表现为正常。
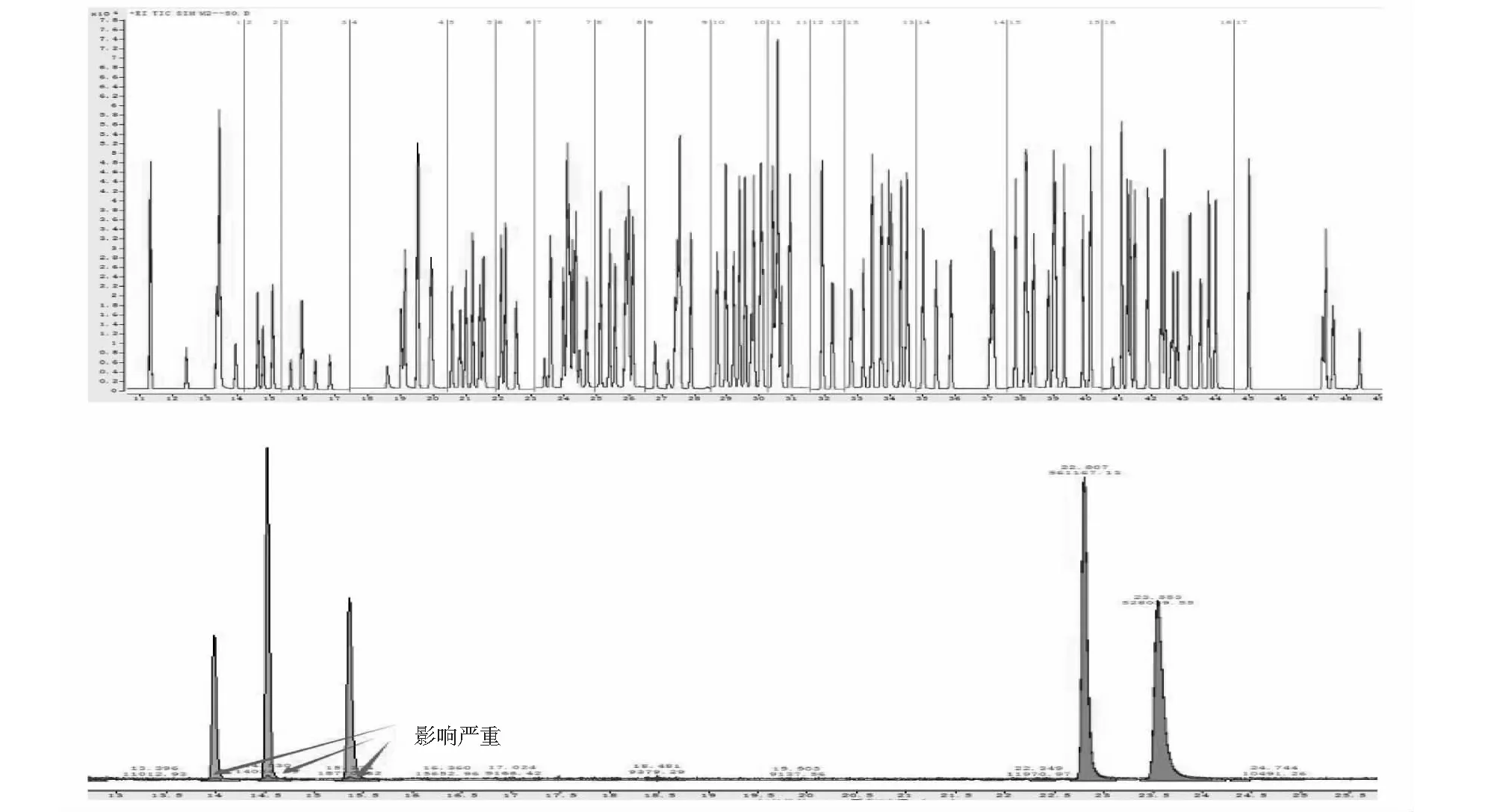
图3 两种二级冷阱捕集温度条件下目标化合物谱图
2.3 线性范围、精密度及准确度考察
综上所述,当程序升温为-20℃~240℃、一级冷阱解析温度为5℃及二级冷阱捕集温度为-50℃时(条件2)目标化合物测定效果更佳。在此基础上,考察分析测定时的线性范围、精密度及准确度。
2.3.1 线性范围
分别抽取 15、30、60、150、300、450、600 mL混合标准使用气,同时加入30 mL内标使用气(内标气浓度为100 nmol·mol-1),使对应校准曲线点浓度分别为0.5、1、2、5、10、15、20 nmol·mol-1,内标浓度为10 nmol·mol-1,在优化条件下进行测定,每个校准点重复2次。其中FID检测器测定的C2~C3组分采用峰面积响应值(y)对其浓度(x)绘制标准曲线,其余MS检测器测定的目标化合物以外标与内标的定量离子峰面积之比(y)对其浓度之比(x)绘制标准曲线。结果显示,116种VOCs在各自的浓度范围内线性良好,相关系数(R2)为0.994~0.9999,测定结果见表1。
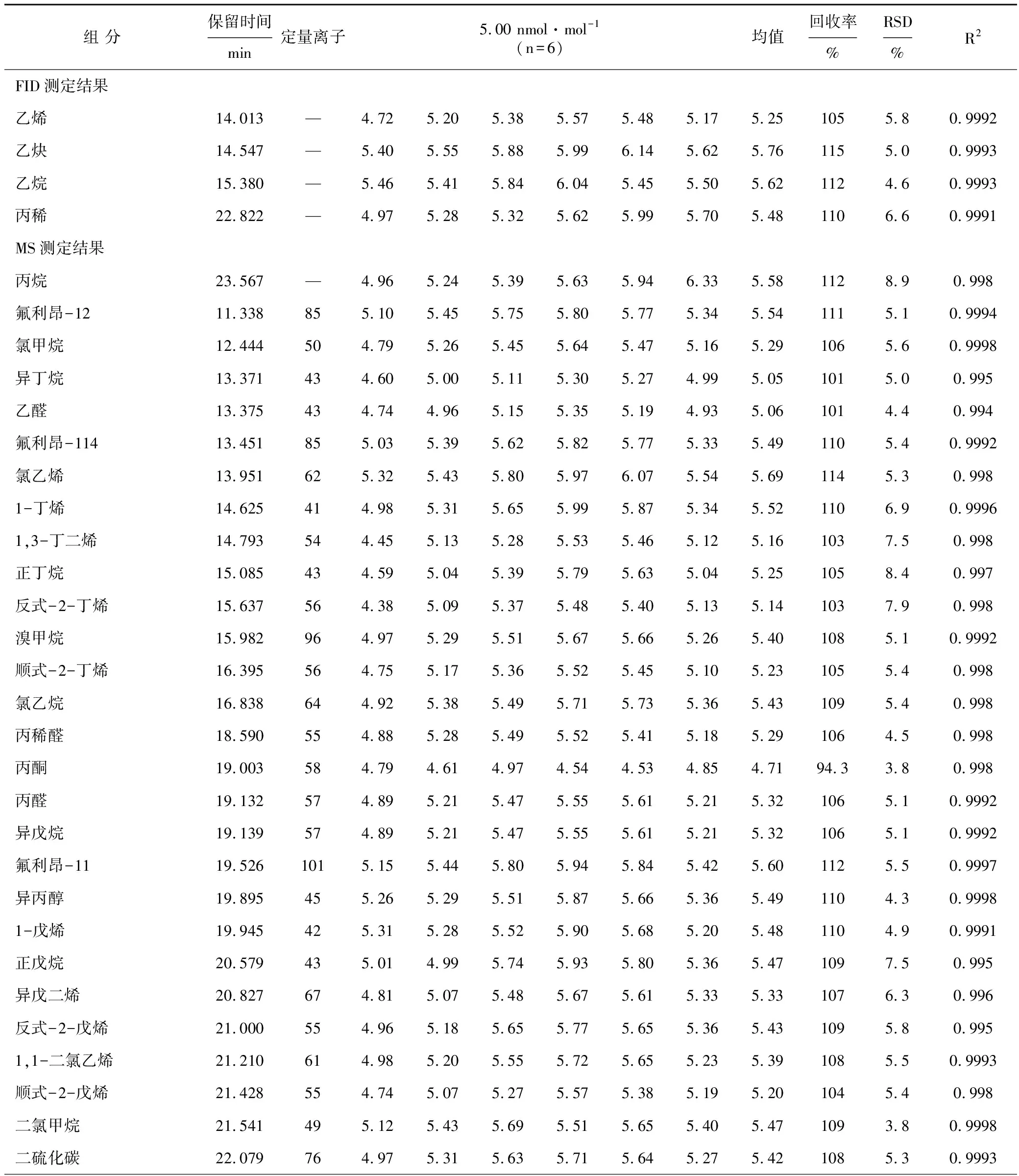
表1 116种VOCs组分监测结果表
2.3.2 精密度及准确度
分别抽取基准体积为150 mL的116种VOCs标准使用气(标准气浓度为10 nmol·mol-1),同时加入30 mL内标使用气(内标气浓度为100 nmol·mol-1),分别连续进样6次,结果发现,在5.00 nmol·mol-1加标浓度水平下,回收率范围为91.2%~117%,RSD在2.3%~12%,符合116种VOCs组分监测相关要求,测定结果见表1。
2.4 实际样品测定
用苏玛罐采集成都市某区域的环境空气样品,连续采样24 h,进样体积300 mL,同时加入30 mL内标使用气(内标气浓度为100 nmol·mol-1),选择程序升温为-20℃~240℃、一级冷阱解析温度为5℃及二级冷阱捕集温度为-50℃的最优方法(条件2)进行测定。定量结果表明,实际样品中丙酮、乙烷、丙烷、乙炔、二氯甲烷、氯甲烷、异丁烷等浓度均大于0.5 nmol·mol-1,为主要检出目标化合物,具体谱图见图4。

图4 实际样品谱图
3 结论
建立了一种利用预浓缩-气相色谱-质谱/氢火焰离子化检测器联用法测定环境空气中116种挥发性有机物(VOCs)的分析方法。对不同参数条件下的测定效果进行对比,结果表明:当程序升温为-20℃~240℃,能实现目标化合物的有效分离;当一级冷阱解析温度为5℃时能实现样品水分的有效去除;当二级冷阱捕集温度为-50℃时能实现目标化合物的高效捕集。此条件下定性定量目标化合物线性良好,相对标准偏差(RSD)、精密度及加标回收率均符合监测要求,能够保证方法的稳定性与准确性。该方法可用于环境空气中116种VOCs的定性定量分析。

