戈舍瑞林与比卡鲁胺间歇用药治疗老年晚期前列腺癌的临床效果
曾智辉
作者单位: 364000 福建省龙岩市,福建医科大学附属龙岩第一医院
前列腺癌临床发病率较高,且呈逐年递增趋势,其主要病因与前列腺上皮细胞增殖、增生密切相关[1-2]。相关研究指出,前列腺癌早期症状缺乏特异性,且目前尚无有效的筛查手段,大部分患者自觉明显不适乃至确诊时病情已发展至晚期,已错失手术治疗时机,此时通常采用内分泌治疗方案,以提高患者生存质量,延长生存期[3]。戈舍瑞林主要经下丘脑—垂体—性腺轴抑制睾酮生成,药物特性属促性腺激素释放激素。比卡鲁胺为雄性激素受体抑制剂,对恶性前列腺细胞生成抑制作用明显[4]。上述药物治疗老年晚期前列腺癌患者虽有确切疗效,但单一用药疗效不足,联合用药时间长又会增加患者机体负担,出现智力、性欲降低等,影响患者生存质量。因此,在有效延长前列腺癌患者生存期的前提下如何提高用药安全,减轻患者机体负担,是当前临床亟待解决的问题。本研究观察戈舍瑞林与比卡鲁胺间歇用药治疗老年晚期前列腺癌患者的临床效果,报道如下。
1 资料与方法
1.1 临床资料 回顾性选取2020年4月—2021年4月福建医科大学附属龙岩第一医院收治的老年晚期前列腺癌患者80例,依据给药方法差异性分为观察组和对照组,每组40例。观察组年龄61~83(71.33±4.48)岁;病程6个月~2.5年,平均(1.45±0.31)年;临床分期:ⅣA期30例,ⅣB期10例。对照组年龄62~84(70.92±4.65)岁;病程5个月~2年,平均(1.22±0.45)年;临床分期:ⅣA期28例,ⅣB期12例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准。
1.2 选择标准 纳入标准:经临床相关检查,确诊为前列腺癌;预计生存期≥12个月;以骨痛、尿频、排尿困难等症状为主要表现。排除标准:确诊糖尿病及其他恶性肿瘤者;合并造血功能障碍疾病者;对戈舍瑞林、比卡鲁胺有过敏症状者。
1.3 治疗方法 对照组给予醋酸戈舍瑞林缓释植入剂(AstraZeneca UK Limited生产)3.6 mg皮下注射,每隔4周注射1次;比卡鲁胺片(AstraZeneca UK Limited生产)50 mg口服,每天1次。观察组给予醋酸戈舍瑞林缓释植入剂与比卡鲁胺片间歇给药,药物生产厂家、用药方式、剂量参见对照组,同时每个月检测前列腺特异性抗原(PSA),指标<0.2 ng/ml时需停止用药,指标>4 ng/ml时继续用药。2组患者疗程均为1年。
1.4 观察指标与方法 (1)前列腺癌相关因子:抽取患者空腹静脉血进行血清分离,采用酶联免疫吸附试验检测。PSA、游离PSA(F-PSA)、血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)水平。(2)免疫功能:抽取静脉血3 ml作检测标本,使用贝克曼CytoFLEX型流式细胞仪检测2组患者治疗前后CD3+、CD4+、CD8+,之后计算CD4+/CD8+。(3)生存质量:记录患者治疗前后生存质量变化,主要采取扩展性前列腺癌复合指数量表(EPIC)进行评估,维度选择性功能、泌尿功能、肠道功能、激素功能,各项评分0~100分,患者生存质量与评分呈正比。(4)不良反应包括肝功能异常、骨质疏松、胃肠道反应、勃起障碍等。
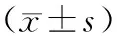
2 结 果
2.1 前列腺癌相关因子比较 治疗前,2组患者PSA、F-PSA、VEGF、IGF-1水平比较差异无统计学意义(P>0.05);治疗1年后,2组患者PSA、F-PSA、VEGF、IGF-1水平均低于治疗前,差异有统计学意义(P<0.01),但组间比较差异无统计学意义(P>0.05),见表1。

表1 对照组与观察组治疗前后前列腺癌相关因子比较
2.2 免疫功能指标比较 治疗前,2组患者CD3+、CD4+、CD8+及CD4+/CD8+比较差异无统计学意义(P>0.05);治疗1年后,2组患者CD3+、CD4+、CD4+/CD8+高于治疗前,CD8+低于治疗前,差异均有统计学意义(P<0.01),但组间比较差异无统计学意义(P>0.05),见表2。

表2 对照组与观察组治疗前后免疫功能指标比较
2.3 EPIC评分比较 治疗前,2组患者性功能、泌尿功能、肠道功能、激素功能评分比较差异无统计学意义(P>0.05);治疗1年后,2组患者性功能、泌尿功能、肠道功能、激素功能评分较治疗前降低(P均<0.01),但观察组评分高于对照组,差异有统计学意义(P<0.01),见表3。

表3 对照组与观察组治疗前后EPIC评分比较分)
2.4 不良反应比较 观察组不良反应总发生率为7.50%,低于对照组的35.00%,差异有统计学意义(χ2=9.038,P=0.003),见表4。
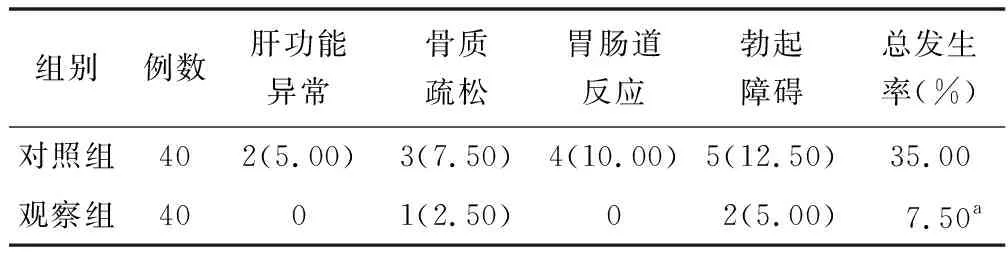
表4 对照组与观察组不良反应比较 [例(%)]
3 讨 论
前列腺为雄性激素依赖性器官,在前列腺组织中,60%的双氢睾酮来源于睾丸,40%来源于肾上腺,这些物质会转化为雄性激素,与雄性激素受体结合后会持续刺激前列腺细胞的增殖,进而诱发癌变[5-6]。据全球数据统计,欧美地区前列腺癌发病率最高,且仅次于肺癌发病率。前列腺肿瘤包括前列腺上皮来源或间叶来源肿瘤,大部分为恶性,包括前列腺癌、前列腺肉瘤等。前列腺癌的发病原因目前尚未明确,现有报道提示,遗传是主要因素之一,同时外源性因素也有一定影响,如过多摄入动物脂肪含量高的食物、缺乏运动等。近年来相关统计显示,我国男性前列腺癌发病率呈逐年增高趋势,多见于>70岁群体,对患者生存质量造成不利影响。该病早期症状并不明显,多表现为尿频、尿急和夜尿次数增加等,与前列腺增生症状相似,故当患者自觉明显不适,严重影响日常生活时,病情已发展至晚期,常规手术治疗已无法治愈,采用药物保守治疗可有效延长生存期[7]。因此,寻找合理、有效的用药方法来提高患者免疫功能和改善预后,是当前临床亟待解决的问题。
基于此,本研究分析戈舍瑞林与比卡鲁胺不同给药方式在老年前列腺癌晚期患者治疗中的临床效果,结果显示,治疗1年后,2组患者PSA、F-PSA、VEGF、IGF-1水平均低于治疗前,但组间比较差异无统计学意义;2组患者CD3+、CD4+、CD4+/CD8+均高于治疗前,CD8+低于治疗前,但组间比较差异无统计学意义。表示两种给药方式均可有效改善患者免疫功能和发挥抗肿瘤效果。其中,戈舍瑞林和比卡鲁胺是治疗内分泌障碍的常用药物,也是晚期前列腺癌患者常用药物。戈舍瑞林为治疗前列腺癌的基础药物,作用机制经下丘脑—垂体—性腺轴系统降低患者睾丸激素,抑制前列腺癌细胞的增殖[8]。同时,药物能在人体中进行生物降解,对垂体分泌的促黄体生成素有一定的抑制效果,进而降低PSA和F-PSA水平。比卡鲁胺可抑制肿瘤生长,药物进入体内与雄性激素受体结合消除二氢睾酮,进而起到抗癌作用。同时比卡鲁胺可抑制睾丸素转化为活性二氢睾丸素的过程,从而延缓癌细胞的生长速度,抑制肿瘤细胞DNA合成,产生抗癌效果[9]。联合两种药物用于晚期前列腺癌治疗,可抑制前列腺组织新生血管,改善免疫功能异常,且二者在药动学、药效学方面无交互作用,持续或间断用药均可控制肿瘤扩散,避免药物对机体造成过大负荷,促进前列腺指标下降,从而提高患者机体免疫功能[10]。
本研究结果显示,2组患者治疗后性功能、泌尿功能、肠道功能、激素功能评分较治疗前出现降低,但观察组评分高于对照组;观察组不良反应总发生率低于对照组。表示间歇用药对生存质量影响更小,也更安全。前列腺癌患者在某种程度上对激素产生依赖性,持续用药导致前列腺癌发展成激素依赖型,同时长期用药会增加体内药物累积,不利于骨质生成,同时影响肝功能[11]。药物在肝脏代谢和转化期间导致转氨酶升高,从而使肝功能出现异常。两种抗雄性激素药物联用会影响患者下丘脑雄性激素受体的合成,增加勃起障碍发生风险,此外持续性用药会增加患者治疗费用。戈舍瑞林与比卡鲁胺间歇用药的生物学依据:雄激素间歇抑制存活的肿瘤细胞,在延缓前列腺癌向雄激素非依赖性发展的同时改善患者泌尿系统功能,延长生存时间,提高患者生存质量,且间歇疗法可减少肝功能异常、骨质疏松等不良反应的发生,提高治疗安全性[12]。
综上所述,戈舍瑞林与比卡鲁胺用于老年晚期前列腺癌患者治疗,间歇用药和持续用药均可有效提高患者机体免疫力,强化抗癌效果,间歇用药对患者生存质量影响小且用药安全性高,值得推广应用。
利益冲突:所有作者声明无利益冲突。

