缺血性肝炎
张瀚予,罗 娟,缪应雷
1.昆明医科大学第一附属医院消化内科(昆明 650032)
2.云南省消化系统疾病临床医学研究中心(昆明 650032)
1979 年,Bynum 等人报道了7 例血清氨基转移酶显著升高的心血管疾病患者,其肝脏病理主要表现为肝小叶中央细胞坏死,在排除了病毒及药物导致的肝损伤后,首次提出了“缺血性肝炎(ischemic hepatitis,IH)”的概念[1]。既往认为休克导致的肝脏低灌注是IH 发生的先决条件,因此IH 也被称为“休克肝(shock liver)”。但Henrion 等人的研究证实,约50%的IH 病例并无明显的血流动力学障碍,低血压和休克是IH 发生的主要原因但非必需条件,并在此基础上提出了“缺氧性肝炎(hypoxic hepatitis,HH)”的概念[2]。
IH 是严重基础疾病的常见并发症,多数情况下,其导致的肝功能异常在诱发因素得到有效干预后可快速恢复,但近期有研究表明,IH 可能是导致ICU 患者发生急性肝衰竭(acute liver failure,ALF)的主要原因,且与高死亡率相关[3-4]。由于IH 起病较隐匿,临床对该病的重视尚不足,早期诊断及治疗可能被延误。因此,提高对该疾病的认知,促进早期识别对改善预后至关重要。本文就IH 的流行病学、病因、发病机制及诊治进展进行综述。
1 流行病学与病因
IH 的发病率在普通病房中从0.03%~0.2%不等,在ICU 病房中从1.5%~4%不等[5-9]。部分研究中IH 在ICU 的发病率高达10%~20%[6,10]。其显著差异可能与各研究之间样本数量、疾病进程、诊断标准不同相关。另外,近年来随着人类寿命的提高,合并症的增加亦可能导致IH发病率升高。
IH 多发生于心力衰竭、呼吸衰竭或循环衰竭基础之上。在所有病因中,心血管疾病(急/慢性心力衰竭、急性心肌梗死、急性心内膜炎、扩张型心肌病、肺栓塞、心脏/心血管大手术等)最常见[11],其次为败血症/脓毒性休克以及呼吸系统疾病(慢性阻塞性肺病、肺炎、阻塞性睡眠呼吸暂停综合征等)。除此之外,失血性休克、心脏骤停复苏后[12-13]、严重贫血[14]、一氧化碳中毒、可卡因/麦角胺中毒、中暑、过敏反应、大面积烧伤、糖尿病酮症酸中毒、主动脉夹层、肝移植、外伤[15]、高强度运动[16]、肝癌、肝硬化[17]、门静脉血栓形成[18]、急性肝静脉阻塞症(Budd-Chiari 综合征)等均可能引起IH[19]。有报道指出,当呋塞米口服剂量达80 mg/d 时,IH 发生风险可能会增加[20-21],严重的慢性贫血在治疗初期大量补液亦可能会诱发IH[14]。
2 发病机制
目前IH 公认的发病机制包括缺氧性损伤(肝脏血流减少、肝脏被动淤血、低氧血症),肝细胞摄氧能力下降以及缺血再灌注损伤(ischemiareperfusion injury,IRI)。
2.1 缺氧性损伤
2.1.1 肝脏血流减少
肝脏血流量占心输出量的25%,需氧量约占全身脏器耗氧量的20%,为保证血液供应,肝脏具备肝动脉及门静脉两套供血系统。肝动脉血流一方面依赖于自身调节:肝内储存的血液可在门静脉压力下降时被动排入中心静脉,静脉回流增加以维持心输出量、增加肝动脉血流;另一方面依赖于肝动脉缓冲反应:门静脉压力降低时,血流速度减慢导致终末肝小动脉、门静脉小支及终末小胆管周围的Mall 间隙内腺苷浓度升高,继而扩张肝动脉[22];门静脉血流则主要依赖于肠系膜循环和门静脉、肝静脉之间的压力梯度进行调节[23]。有研究认为,IH 是两套系统同时出现血流量减少的结果[8]。全身血流动力学障碍或肝脏局部灌注急剧下降时,上述调节机制失代偿,激活NF-kB等信号通路,产生炎症因子介导线粒体损伤,细胞内ATP 生成减少、乳酸蓄积、pH 下降,Ca2+内流激活蛋白酶及磷脂酶,细胞骨架破坏导致细胞水肿及脂肪样变,当缺血时间超过3 h 可引起细胞不可逆损伤[19,24]。
2.1.2 肝脏被动淤血
目前认为,慢性心力衰竭导致的肝脏淤血是IH 发展的潜在先决条件,在肝脏淤血基础上引发的急性血流动力学改变和低氧血症可成为IH 的触发因素[25-26]。充血性心力衰竭导致肝脏组织结构发生一系列变化,肝细胞更容易受到缺氧性损伤。在此基础上短暂、微小的动脉压波动可能尚不足以引起临床症状,但15~20 min 的系统性低血压足以产生大规模肝细胞坏死,诱导IH 的发展[8,20,23]。
2.1.3 低氧血症
呼吸系统疾病引起的通气/换气障碍可导致严重的动脉低氧血症,当动脉血氧分压低于40 mmHg(1 mmHg=0.133 kPa)时,可在没有血流动力学障碍的条件下引起IH[24]。严重贫血、一氧化碳中毒等疾病则因为红细胞减少、携氧障碍导致机体缺氧,肝细胞需氧-供氧失衡,导致IH的发生[27]。
2.2 肝细胞摄氧能力下降
肝细胞摄氧能力下降常与败血症相关,脓毒性休克时白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)等细胞因子介导的炎症反应诱导肝细胞凋亡,炎症介质和内毒素的释放进一步降低了肝细胞利用循环中氧气的能力,加上细胞氧气需求的增加,肝细胞可能因ATP 耗竭而坏死[7]。
2.3 缺血再灌注损伤
目前普遍认为,缺血缺氧损伤并非导致IH 的唯一机制,当缺血的肝脏恢复血液供应后,组织再灌注诱发的氧化应激反应可对肝细胞造成二次损伤。再灌注期早期Kupffer 细胞产生大量活性氧物质(ROS)、趋化因子及炎症介质,后期大量中性粒细胞在趋化因子作用下募集至肝脏,级联释放多种炎症介质,氧自由基爆发并释放蛋白酶,直接损伤肝实质细胞,最终导致细胞坏死[19,28]。
3 病理学特点与临床表现
IH 的典型病理表现为小叶中央细胞坏死[29],坏死可局限于中央静脉周围或呈弥漫性,坏死区周围肝细胞常有脂肪变性,并有窦性水肿、肝实质淤血表现,胆汁淤积通常不明显(图1)[30],这与肝脏解剖特点及其血流调节机制相关:肝小叶中央区(3 区)接受的血液含氧量较周围带(1区及2 区)更少,对营养物质的摄取也更少,因此当肝脏暴露于缺血缺氧环境时,3 区肝细胞更易受到损伤,发生坏死、凋亡[23]。这种特征性病理改变有助于将IH 与病毒性肝炎及胆道梗阻性疾病区分开来,后两者多表现为泛小叶损伤且胆汁淤积较常见。
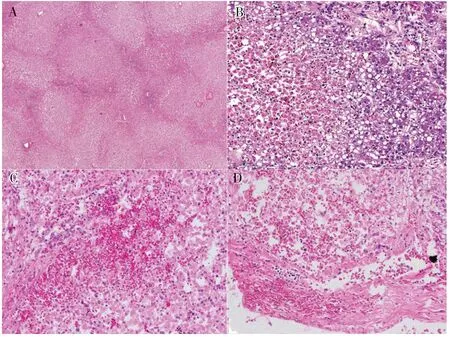
图1 IH患者的肝脏HE染色[30]Figure 1.Hematoxylin eosin staining of liver in patients with ischemic hepatitis[30]
IH 通常缺乏特异性临床表现,患者症状主要与引起IH 的基础疾病相关。肝淤血患者可有上腹部疼痛症状,充血性心力衰竭可能导致下肢水肿、颈静脉充盈等症状;当患者存在心输出量急剧下降、严重低氧血症时可有低血压、呼吸困难、胸痛、胸闷等症状。部分患者可出现黄疸,其可能增加感染、急性肾损伤等并发症发生风险,并与不良预后相关[31]。意识障碍并不少见,但可能与基础疾病(休克时脑灌注不良、心肺复苏后缺氧性脑损伤等)关系更大而并非肝性脑病(hepatic encephalopathy,HE)的表现[7,24]。
4 辅助检查
4.1 实验室检查
IH 的标志性酶学变化为血清氨基转移酶水平的急剧升高,通常在肝细胞损伤后12~48 h 内发生,72 h 内达峰值(可达正常上限的25~250 倍),天冬氨酸转氨酶(aspartate aminotransferase,AST)上升水平往往比丙氨酸转氨酶(alanine aminotransferase,ALT)更高,这可能与AST 在肝小叶中央区浓度更高有关[13]。在基础疾病得到有效干预后,氨基转移酶水平可在7~10 d 内恢复,这有助于与病毒性肝炎相鉴别[19,32]。
与ALT 及AST 相比,乳酸脱氢酶(lactate dehydrogenase,LDH)升高的速度更快,恢复正常所需的时间更长[33],且当AST ∶ LDH <1.5 时,可有助于鉴别IH 与病毒性肝炎[34]。由于胆汁淤积通常不严重,IH 患者的碱性磷酸酶(alkaline phosphatase,ALP)水平通常可保持正常。胆红素水平变化一般不大(通常<3 mg/dL),但胆红素水平持续升高可能提示预后不佳且与高死亡率相关[31]。
凝血酶原时间可正常或轻度延长,国际标准化比值(international normalized ratio,INR)可能轻度升高,当其持续升高时可能提示ALF 的发生[35]。血清白蛋白(albumin,ALB)基线水平是重症IH患者早期死亡率的独立预测指标,有研究报道,当基线ALB 水平低于28 g/L 时,重症IH 患者心血管相关死亡率可升高5 倍[36],但针对其水平变化的监测在IH 的早期诊断中可能意义有限[37]。动脉氨水平升高可能提示IH 继发ALF,是IH 患者发生HE 的独立预测指标[38]。
部分IH 患者可能合并急性肾损伤而导致肌酐水平升高,这在其他病因导致的肝损伤中很少见[39-40]。有研究表明吲哚菁绿血浆清除率(ICGPDR)用于评估IH 患者肝功能的准确性可能高于AST、INR 等指标[41]。另有研究发现部分IH 患者血清铁蛋白浓度明显升高,但目前尚缺乏更充分的证据证明其与IH 之间存在必然联系[42]。
4.2 影像学检查
影像学检查的目的主要在于发现潜在的基础疾病。肝脏淤血的患者腹部超声检查可有肝脏体积增大、上腔静脉及下腔静脉管径扩张的表现;心电图检查可协助发现潜在的心律失常、心肌梗死等心脏疾患;心脏彩超检查对于心肌炎、器质性心脏病和肺动脉高压等可有一定提示作用[43]。
5 诊断
IH 目前尚无统一的诊断标准,需在排除其他原因所致肝损伤的基础上,结合患者基础疾病、临床检验指标以及组织病理学检查做出诊断。
对于存在以下情况的患者,应考虑可能存在IH:①既往或目前患有心脏疾患;②心电图检查提示异常;③影像学检查提示肺部疾患;④典型的肝脏生化指标改变:氨基转移酶水平明显升高,但胆汁淤积和肝功能衰竭的表现不明显;⑤急性肾损伤表现。结合腹部超声检查提示腔静脉管径扩张、心脏彩超阳性发现可帮助快速诊断[5]。
目前诊断一般包含3 条标准:①存在心力衰竭、呼吸衰竭、循环衰竭或患有可导致上述情况的基础疾病;②短暂而显著的血清氨基转移酶水平升高,峰值达正常值上限20 倍以上,并可在短期(7~10 d)内恢复至正常或接近正常水平;③排除其他已知病因导致的肝损伤,包括病毒、细菌、真菌、毒物或药物、自身免疫性疾病等。
当符合上述3 条标准时,可直接做出IH 的诊断而无需肝组织活检。对于氨基转移酶水平低于正常值上限20 倍的患者,可结合肝组织活检、特征性的小叶中央细胞坏死表现辅助诊断;但鉴于大部分IH 患者基础疾病重,常有严重的出血倾向或需要应用抗凝药物,是否活检需依据患者个体情况谨慎决定[7]。有研究认为,对于已有心脏、呼吸或循环衰竭表现的重症患者,即使其氨基转移酶水平轻度升高,也应积极寻找潜在的血流动力学或呼吸不稳定的危险因素,帮助早期识别IH[5]。
6 治疗
目前IH 尚无特异性治疗方案,其治疗的核心在于及时找到肝脏缺血缺氧的危险因素,积极治疗基础疾病,纠正潜在的血流动力学障碍或呼吸障碍,维持脏器灌注及组织氧供,同时防治并发症,保护肝细胞。
6.1 基础疾病管理
心源性休克患者可通过维持有效血容量、改善心脏射血能力等措施维持脏器灌注;慢性充血性心衰时应积极纠正心衰,减少肝脏淤血[26],同时应注意呋塞米等利尿剂的剂量及给药方式,在减轻心脏负荷同时保证肝脏有效灌注;严重的低氧血症可通过吸氧、使用呼吸机等治疗措施改善;重度贫血可通过输血提高血液携氧能力;败血症则应积极抗感染治疗,同时避免使用有可能引起低血压及具有肝毒性的药物[7,44];对患有潜在基础疾病患者进行手术时,应尽量减少术中血压波动并优化氧合以预防围术期IH 的发生[45]。
6.2 并发症的管理
由于全身灌注减少,IH 常合并其他器官功能障碍。在一项研究中,67%的IH 患者发生急性肾损伤,46%发生横纹肌溶解,25%发生缺血性胰腺炎,约一半患者存在肝肺综合征[23];继发性硬化性胆管炎、自发性低血糖/血糖升高亦被报道[46]。并发症的发生可能导致不良预后,因此需监测相关指标并及时进行干预。
6.3 药物治疗
N-乙酰半胱氨酸(N-acetylcysteine,NAC)在IH 治疗中的应用已被广泛认可,其可通过减轻ROS 介导的组织损伤起到有效的抗氧化作用;此外,NAC 还可增加血液中一氧化氮浓度,通过血管扩张作用改善组织氧供。有研究证实其早期应用可在一定程度上降低IH 的发生率,并可改善败血症继发ALF 患者的预后[47-49]。
近期有研究表明,β-受体阻滞剂卡维地洛在急性心力衰竭引起的IH 中可通过改善肝脏微循环、修复内皮细胞功能、减少血小板聚集、抑制炎症反应、抗氧化及改善IRI 等途径促进IH 患者肝功能恢复,但目前其对于IH 的总体生存益处尚未明确[35]。也有研究指出,他汀类药物应用于重症IH 可降低患者28 d 死亡率,其可能通过减少肝细胞IRI 而发挥作用,但其远期疗效尚待观察[4]。其它研究发现,GIT-27NO 作为一种NO衍生物,其可能通过扩张血管、拮抗氧化应激反应减轻肝脏IRI,并被证实在体内具有良好的治疗窗口,可能是治疗IH 的理想候选药物之一[28]。
有学者发现,鼠李糖乳杆菌(lactobacillus rhamnosusGG,LGG)可改善败血症相关IH 患者的预后,其可能通过调节NF-kB 通路减弱氧化应激反应、减少促炎细胞因子的生成而发挥作用,但其疗效的确切性尚需更多临床研究证实[50]。而另一项针对败血症相关性肝损伤 (sepsis-associated liver injury,SALI)的研究发现BRG1 可以直接激活TLR4 转录来调节SREBP1a 表达,后者已被证实与肝损伤之间存在联系,推荐将小分子BRGI抑制剂用于SALI 的治疗,这可能为IH 的药物治疗提供更多选择[51]。
6.4 人工肝支持系统
人工肝是肝衰竭治疗的有效措施之一,近年来分子吸附再循环系统(molecular adsorbent recirculatory system,MARS)在临床中运用较为广泛,其利用血液吸附原理选择性地清除体内毒素及代谢产物,从而改善肝功能。Drolz 等人报道了1 例经MARS 治疗后肝功能快速恢复的重症IH 患者,肯定了其在ALF 治疗中的作用,推测MARS可能是治疗IH 的有效手段之一,但目前MRAS对于肝衰竭患者总体生存率的影响尚存争议,需更多临床研究来证明其有效性[52]。
6.5 肝移植
对重症IH 导致的ALF,多数患者因合并症较重及凝血功能障碍而无肝移植条件,因此肝移植在IH 的治疗中并不常见,其可能是预后不良、无系统性基础疾病患者的最终治疗措施[15]。
7 早期识别及预后评估
IH 的肝细胞损伤通常较重,但当潜在病理机制解除后,肝细胞可迅速再生,这可能是因为短暂性缺血缺氧损伤并未导致肝小叶的网状框架受损[25,35],因此IH 本身具有自限性,但当缺血缺氧时间过长,损伤的肝细胞超过70%这一阈值时,肝脏细胞可能无法再生,最终导致ALF。研究证实IH 的发生可使住院患者的病死率升高,据统计,在ICU 中发生IH 的患者死亡率为44.1%~53%[40,53-54],大部分死亡与基础疾病密切相关,而非IH 的直接作用,患者预后主要取决于基础疾病的治疗情况及对IH 的早期识别[7-8]。
因此,开发更具有针对性的评分量表可能有助于临床早期识别IH。有研究开发了SALI 住院死亡率的预测模型,其表明SALI 类型、发病时间、急性呼吸衰竭、急性心肌梗死、血液透析、体温、尿量、红细胞体积分布宽度、部分凝血活酶时间是评估预后的独立预测指标[55]。另有针对心源性疾病导致IH 的研究提出,血氧饱和度监测可帮助判断肝细胞受损情况,有助于临床病情的评估[33]。
近期有研究发现部分miRNA(miR-4524a-3p、miR-23b-5p、miR-28-3p、miR-1247-5p) 在IH患者中明显升高,其变化可发生在ALT 之前,且对治疗的应答更加敏感,开发循环miRNA 水平检测的实用临床分析工具或许可为IH 的早期诊断及预后评估提供支持[56]。亦有学者提出对线粒体动力相关蛋白(PGC-1α、Mtf2、DNM1L)及其生物标志物miRNA-17 等进行监测可对肝损伤进行早期评估,并在病程诊疗中评估治疗疗效及药物反应[57]。
8 结语
综上,IH 并不罕见,且是重症患者死亡的独立危险因素。在大多数医疗机构中其早诊早治可能被延误,目前尚需更进一步的研究制定明确的诊断标准。其治疗依赖于基础疾病的诊治,不良预后通常与诊断延误及基础疾病的治疗效果不理想相关。临床可借助评估量表定期对患者肝功能进行评估,早期识别潜在的血流动力学障碍及呼吸障碍,及时对潜在致病因素进行干预,在治疗同时注重药物的潜在风险,进而改善患者预后,降低危重症患者的病死率,提高该病的诊疗水平。

