甘毕舒HPLC特征图谱的建立及与药材共有峰归属研究
王欢 李彩虹 代龙 宋景 刘朝阳 刘亚东

摘 要:本试验采用高效液相色谱法,流动相为甲醇溶液(A)-0.1%磷酸水溶液(B),采用梯度洗脱和变波长检测,流速1.0 mL/min,进样量10 mL,柱温 30 ℃,建立甘毕舒的特征谱图并与药材谱峰对比。结果表明:3批甘毕舒样品特征图谱中共有11个共有峰,并指认出其中10个特征峰,各批次之间的相似度均大于0.93;单味药材共有峰归属中除没食子酸、柚皮苷、芍药苷、黄芩苷、汉黄芩苷、绿原酸、新绿原酸、黄芩素、汉黄芩素、甘草酸外,7号峰来自黄芩药材的未知成分。综上所述,该方法具有重复性好、准确性稳定的特点,可作于甘毕舒的质量控制。
关键词:甘毕舒;HPLC特征图谱;中兽药
中图分类号:S853.7 文献标识码:B 文章编号:1673-1085(2023)08-0003-06
甘毕舒是我公司根据多年的家禽临床用药经验,由茵陈、蒲公英、黄芩、白芍、陈皮、甘草等中药配伍而成,临床辨证为肝气郁结兼见湿热,用于肝肿大、肝发黑等家禽肝病的防治。本公司已经开展了甘毕舒的药学研究,初步建立了其定性质量控制的方法[1],但制剂整体质量控制还缺乏研究。中兽药制剂是多组分的复杂体系,汤剂复杂的化学成分是其发挥多靶点疗效的物质基础,也是质量评价的重点和难点[2-3]。特征图谱具有整体性、特征性及可量化等突出优势[4],已逐步应用于中兽药制剂的质量控制中。本研究建立甘毕舒的高效液相特征图谱,通过指认图谱中共有峰的指标性成分,并对其药材归属进行研究,获得了专属性强、重复性良好、准确性稳定的特征指标,本研究所建立的特征图谱,可作为甘毕舒的内控质量方法。
1 仪器和试剂
LC-2030型高效液相色谱仪(日本岛津公司);KQ-500DV型数控超声波清洗器(昆山超声仪器有限公司);JA5003B型电子天平【上海越平科学仪器(苏州)制造有限公司】;H21-X8型电陶炉(杭州九阳生活电器有限公司)。
甘毕舒口服液,三批,批号分别为20220414、20220402、20220605的样品来自石家庄市九洲兽药有限公司。新绿原酸对照品(批号B21396),纯度≥98%,购自上海源叶生物科技有限公司。甘草酸铵对照品(批号110731-202122),浓度为94.4%,购自中国食品药品检定研究院。没食子酸对照品(批号wkq21090111)、柚皮苷对照品(批号wkq22012906)、黄芩苷对照品(批号wkq22010409)、汉黄芩苷对照品(批号wkq22022807)、芍药苷对照品(批号wkq22030506)、绿原酸对照品(批号wkq22032106)、黄芩素对照品(批号wkq22030204)、汉黄芩素对照品(批号wkq22012903),纯度均≥98%,购自四川省维克奇生物科技有限公司。甲醇、乙腈、磷酸均为色谱纯,其它试剂均为分析纯。水为纯净水,购自杭州娃哈哈集团有限公司。
茵陈、白芍、蒲公英、黄芩、陈皮、甘草药材均由石家庄市九洲兽药有限公司提供。经专家鉴定,茵陈为菊科植物滨蒿(Artemisia scoparia Waldst. et Kit.)的干燥地上部分,白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根,蒲公英為菊科植物蒲公英(Taraxacum mongolicum Hand. -Mazz.)的干燥全草,黄芩为唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根,陈皮为芸香科植物橘(Citrus reticulata Blanco)及其栽培变种的干燥成熟果皮,甘草为豆科植物甘草(Glycyrrhiza uralensis Fisch.)的干燥根和根茎。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的配制 精密称取适量的各对照纯品,加甲醇配制成相应的对照品溶液:没食子酸51.27 μg/mL,柚皮苷26.08 μg/mL,芍药苷34.29 μg/mL,黄芩苷60.41 μg/mL,汉黄芩苷50.56 μg/mL,绿原酸459.7 μg/mL,新绿原酸191.10 μg/mL,黄芩素519.40 μg/mL,汉黄芩素28.02 μg/mL,甘草酸221.60 μg/mL。
2.1.2 供试品溶液的配制 精密量取甘毕舒口服液2.5 mL,置于50 mL容量瓶中,加水约12.0 mL,混匀,加甲醇定容至刻度,混匀后,用0.22 μm微孔滤膜过滤即得。
2.1.3 单味药材溶液的配制 取茵陈、蒲公英、黄芩、白芍、陈皮、甘草药材各10 g,分别加水150 mL煎煮,武火(功率2 200 W)煮沸,文火(功率400 W) 保持微沸1 h,煎液用150目滤布滤过,冻干,精密称取黄芩冻干粉0.2 g,其余药材冻干粉0.5 g,置具塞锥形瓶中,加入70%甲醇25 mL,超声(250 W,40 KHZ)30 min,放冷,滤过,滤液用0.22 μm微孔滤膜过滤即得。
2.2 色谱条件
色谱柱为kromasil 100-5-C18柱(250 mm×4.6 mm,5 μm);采用梯度洗脱,流动相为甲醇溶液(A)-0.1%磷酸水溶液(B),流速1.0 mL/min;柱温30℃;进样量10 μL,检测波长变化为:0~10 min,283 nm;10~22 min,327 nm;22~37 min,283 nm;37~58 min,254 nm;流动相梯度变化为:0~10 min,10%~20% A;10~20 min,20%~40% A;20~40 min,40%~70% A;40~50 min,70%~95% A;50~52 min,95% A;52~54 min,95%~10% A;54~58 min,10% A。
2.3 方法学考察
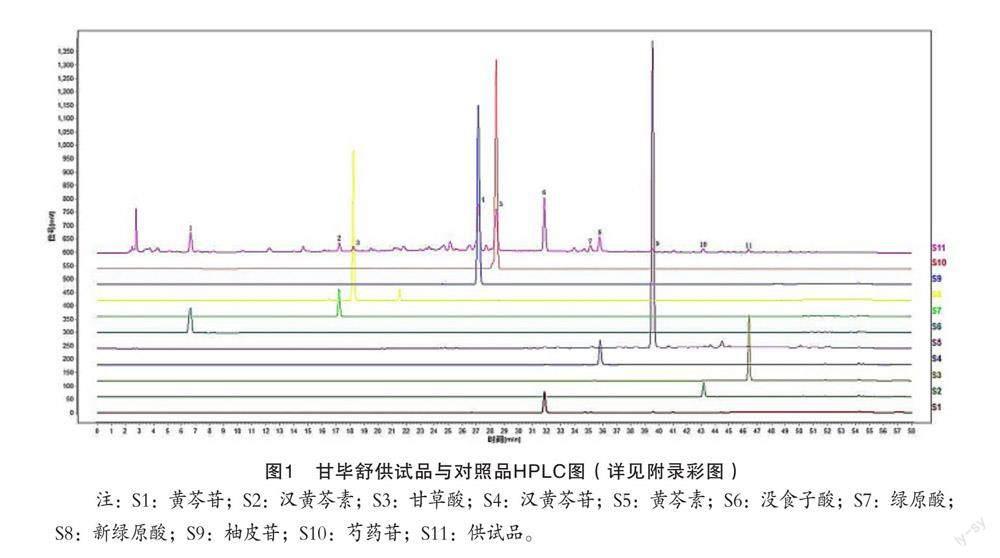
2.3.1 专属性试验 分别精密量取上述各对照品溶液,供试品溶液各10 μL,进样测定,色谱结果显示,经过与对照品色谱图对比,在供试品色谱图中,没食子酸、柚皮苷、芍药苷、黄芩苷、汉黄芩苷、绿原酸、新绿原酸、黄芩素、汉黄芩素、甘草酸对照品保留时间相对应的色谱峰有较好的分离度。另有1个未知峰(峰7来源于黄芩)在供试品色谱峰中分离度较好,峰面积较大且稳定,也可用于专属性检验,见图1。
2.3.2 确定参照峰 经高效液相色谱仪分析,在供试品溶液与对照品溶液的比较中,黄芩苷的色谱峰相较其它稳定且含量较高,故选黄芩苷作为参照峰,计算共有峰的相对保留时间。
2.3.3 精密度试验 取“2.1.2”项下供试品溶液(批号20220414),按照“2.2”项下色谱条件重复进样6次,进行测定。结果表明,特征峰相对保留时间的相对标准偏差(RSD)均不大于0.03%,结果说明了仪器的精密度良好。
2.3.4 重复性试验 精密量取样品(批号20220414)2.5 mL,按照“2.1.2”项下的方法制备供试品溶液6份,按照“2.2”項下的色谱条件分别进样测定,结果表明,特征峰相对保留时间的RSD均不大于0.4%,表明该方法具有良好的重复性。
2.3.5 稳定性试验 取“2.1.2”项下供试品溶液(批号20220414),放置于室温,分别于0、4、8、12、16、24 h时,按照“2.2”项下的色谱条件进样分析,结果表明特征峰相对保留时间的RSD均不大于0.07%,说明供试品溶液在24 h内具有良好的稳定性。
2.4 特征图谱的建立及相似度评价
2.4.1 特征图谱的建立 样品所得的色谱数据通过中药色谱指纹图谱相似度评价系统(2012A版)软件进行分析,生成全谱峰匹配图。供试品特征图谱中应呈现与对照品色谱峰保留时间相对应的色谱峰。其中与参照物峰(峰6,黄芩苷)保留时间对应的峰为S峰,分别在相对保留时间为0.209(峰1,没食子酸)、0.541(峰2,绿原酸)、0.572(峰3,新绿原酸)、0.853(峰4,柚皮苷)、0.892(峰5,芍药苷)、1.000(峰6,黄芩苷)、1.103(峰7,未知峰,汉黄芩苷附近)、1.124(峰8,汉黄芩苷)、1.241(峰9,黄芩素)、1.356(峰10,汉黄芩素)、1.457(峰11,甘草酸)呈现11个共有峰,见图2。
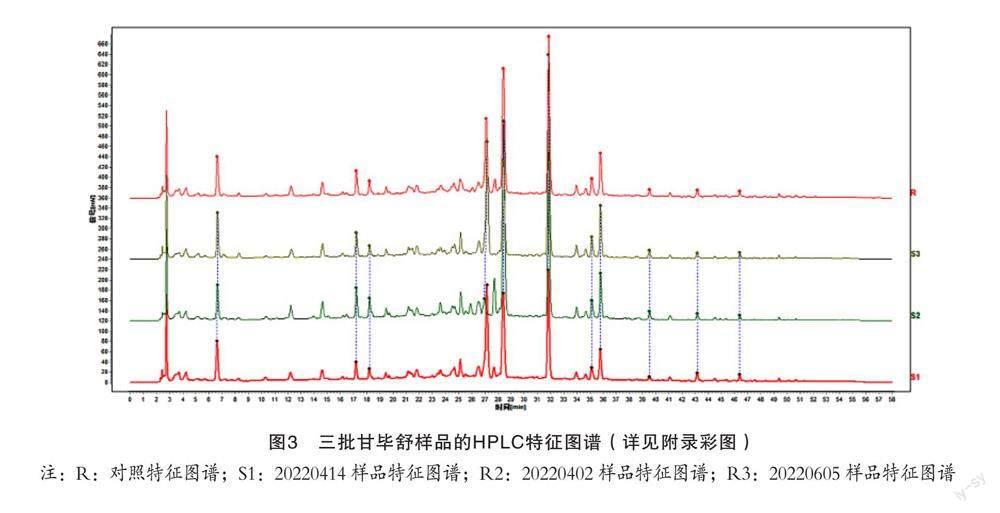
2.4.2 相似度评价 3批甘毕舒物质基准的特征图谱见图3,特征图谱相似度结果为20220414(S1)0.97,20220402(S2)0.937,20220605(S3)0.97。从结果可知,3批甘毕舒的物质基准特征图谱相似度>0.93,说明甘毕舒的物质基准不同批次间的差异较小,制备工艺稳定。
2.5 共有峰归属
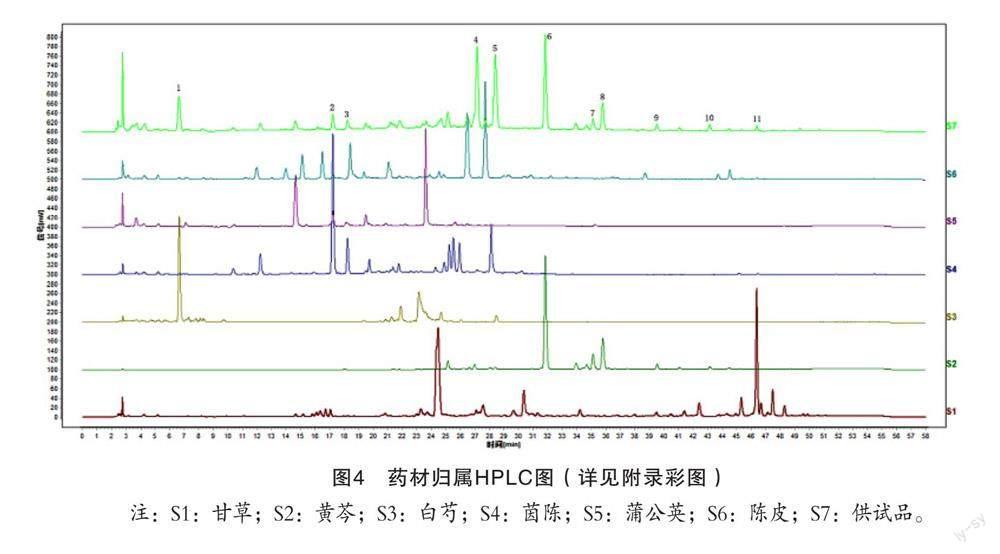
分别取“2.1.3”项下的药材溶液10 μL,进样分析,结果见图4。通过单味药材溶液和样品溶液的色谱峰相对保留时间和最大吸收波长对比,将11个共有峰进行药味归属。由图4可知,各单味药材贡献的谱峰分别为甘草1个(11号峰)、黄芩5个(6、7、8、9、10号峰)、白芍2个(1和5号峰)、茵陈2个(2和3号峰)、蒲公英2个(2和3号峰)、陈皮1个(4号峰);其中1号峰(没食子酸)、5号峰(芍药苷)为白芍药材的特有成分;2号峰(绿原酸)、3号峰(新绿原酸)为茵陈、蒲公英药材的共有成分;4号峰(柚皮苷)为陈皮药材的特有成分;6号峰(黄芩苷)、7号峰(未知)、8号峰(汉黄芩苷)、9号峰(黄芩素)、10号峰(汉黄芩素)为黄芩药材的特有成分;11号峰(甘草酸)为甘草药材的特有成分。
3 讨论
3.1 色谱条件优化
通过全波长扫描发现当波长为 283 nm 时,供试品没食子酸、柚皮苷、芍药苷、黄芩苷、汉黄芩苷图谱峰形较好,黄芩药材的特征图谱文献中检测波长采用280 nm[5-6],陈皮药材的高效液相色谱文献中检测波长采用283 nm[7];327 nm时,绿原酸、新绿原酸图谱峰形和分离度较好,这与文献中绿原酸和新绿原酸特征图谱的检测波长相似[8-9]。254 nm波长下,甘草酸、黄芩素、汉黄芩素图谱峰峰形较好,与文献报道相符[10],能够较全面获得甘毕舒的物质基准中成分信息,为此采用变波长检测方法。
3.2 相似度评价
本研究通过HPLC建立的3批甘毕舒的特征图谱能够全面、综合地反映口服液及各单味药材所含化学组方。不同批次样品间相似度均高于0.93,体现了在甘毕舒制剂工艺过程中对各中药材所含的化学组分影响较小,制剂组分整体稳定。3.3 共有峰归属
本研究中采用共有峰归属特征图谱手段对甘毕舒开展研究,对口服液中色谱光谱可视化成分进行了来源辨析和归属,为制剂进一步合理化综合质量控制和保证产品的临床疗效奠定基础。
本研究中建立了甘毕舒的特征图谱,峰数目、保留时间及共有峰等评价良好,可整体反映甘毕舒的物质相关特性,同时结合甘毕舒和单味药材特征谱图共有峰归属研究,初步明确了甘毕舒组分的来源归属,质控结果更加合理化。
参考文献:
[1] 王欢,李彩虹,赵新茹,等.甘毕舒中盐酸小檗碱薄层鉴别方法的改进研究[J].中国动物保健,2022,24(09):96-97.
[2] Xie P, Leung A Y. Understanding the traditional aspect of Chinese medicine in order to achieve meaningful quality control of Chinese materia medica[J].Journal of chromatography A, 2009,1216(11):1933-1940.
[3] 姚令文,刘燕,郑笑为,等. 指纹图谱、特征图谱技术在中药材和中成药中的应用[J].中国新药杂志,2018,27(08):934-939.
[4] Gu M, Ouyang F, Su Z.Comparison of high-speed counter-current chromatography and high-performance liquid chromatography on fingerprinting of Chinese traditional medicine[J]. Journal of chromatography A, 2004,1022(1):139-144.
[5] 張振巍, 张娜娜, 石磊, 等. 黄芩药材指纹图谱研究[J].中国药师,2013,16(10):1449-1451.
[6] Kovács G, Kuzovkina I N, Szoke É, et al. HPLC determination of flavonoids in hairy-root cultures of Scutellaria baicalensis Georgi[J]. Chromatographia, 2004,60(1):S81-S85.
[7] 许润娟,张芳红. 新会柑皮HPLC指纹图谱的研究[J].中药材, 2005(07):596-599.
[8] 廖彦,谌攀,白杨,等. 绵茵陈高效液相色谱指纹图谱研究[J].中南药学,2019,17(08):1224-1228.
[9] 浦香兰,张云天.茵陈配方颗粒HPLC特征图谱研究[J].中国现代应用药学,2014,31(10):1195-1197.
[10] 赵丽娟,王信,潘新波,等.金茵利胆口服液高效液相色谱指纹图谱及多成分含量同时测定研究[J].中国药业,2022,31(02):74-79.
HPLC Specific Chromatograms and Peak Attribution Research
for Ganbishu
WANG Huan1, LI Caihong1, DAI Long2, SONG Jing2, LIU Chaoyang1, LIU Yadong1
(1. Shijiazhuang Jiuzhou Veterinary Medicine Co.,LTD, Shijiazhuang 050000, China;
2. Binzhou Medical University, Binzhou 256600, China)
Abstract: HPLC was performed using a mobile phase consisting of methanol solution (A) and 0.1% phosphoric acid solution (B) through gradient elution. The detection was carried out at variable wavelengths with a flow rate of 1.0 mL/min. The column temperature was maintained at 30°C. A sample size of 10 μL was used. The results showed that there were 11 common peaks which 10 of them were identified in the characteristic spectrum of 3 batches of Gambishu samples. The similarity between the three batches of Ganbishu was found to be greater than 0.93. In addition to gallic acid, naringin, paeoniflorin, baicalin, wogonoside, chlorogenic acid, neochlorogenic acid, baicalein, wogonin and glycyrrhizic acid, peak No. 7 was from the unknown component peak of Scutellaria baicalensis Georgi. In conclusion, the method with good repeatability, accuracy and stability can be used for the quality control of Gambishu.
Keywords: Ganbishu; HPLC specific chromatograms; Veterinary traditional chinese medicine