不同氨氮浓度和基质条件对沉水植物的影响
林超 陈煜 周珺 许明峰 华楠 韩翠敏

摘要 在室外静态模拟条件下,通过测定黑藻、刺苦草、穗花狐尾藻的相对生长速率、分枝数、最大株高、叶绿素a、超氧化物歧化酶、过氧化物酶、过氧化氢酶的指标变化,研究沉水植物在基底和氨氮条件双因素变化下的响应情况。结果表明,黑藻、刺苦草、穗花狐尾藻的最大氨氮耐受浓度分别为2.69、4.69、2.69 mg/L。基于各沉水植物的生长速率变化情况,除黑藻在中浓度氨氮条件下生长速率不及淤泥组外,黄土组沉水植物适应氨氮胁迫的能力都更強。不同基质下同种植物在不同氨氮浓度水体中的叶绿素a含量整体呈现先升高后下降的趋势,且同一浓度下不同基质组无明显差异。同种基质条件下,黑藻和穗花狐尾藻在中浓度氨氮条件以下,SOD指标变化不显著,刺苦草呈现先上升后下降的趋势。淤泥和黄土环境下,不同氨氮浓度对黑藻CAT指标都无显著影响。
关键词 沉水植物;氨氮;基质;相对生长速率;生理指标
中图分类号 X 173文献标识码 A文章编号 0517-6611(2023)15-0063-05
doi:10.3969/j.issn.0517-6611.2023.15.015
Effects of Different Ammonia Nitrogen Concentrations and Substrate Conditions on Submerged Plants
LIN Chao1, CHEN Yu1, ZHOU Jun2 et al
(1.The Ecological Environmental Technology Co.,Ltd.,Wuxi, Jiangsu 214000;2.Wuxi River and Lake Management and Water Resources Management Center, Wuxi, Jiangsu 214000)
Abstract Under outdoor static simulation conditions, by measuring the relative growth rate, branch number, maximum plant height, chlorophyll a, superoxide dismutase, peroxidase and catalase of Hydrilla verticillata, Vallisneria spinulosa and Myriophyllum spicatum, we study the response of submerged plants to the changes of substrate and ammonia nitrogen conditions. The results showed that the maximum ammonia nitrogen tolerance concentrations of Hydrilla verticillata, Vallisneria spinulosa and Myriophyllum spicatum were 2.69 mg/L, 4.69 mg/L and 2.69 mg/L respectively. Based on the growth rate changes of submerged plants, except that the growth rate of Hydrilla verticillata is lower than that of silt group under the condition of medium concentration of ammonia nitrogen, the submerged plants in loess group have stronger ability to adapt to ammonia nitrogen stress. The chlorophyll a content of the same plant in water with different ammonia nitrogen concentrations under different substrates showed an overall trend of increasing first and then decreasing, and there was no significant difference between different substrate groups under the same concentration. Under the same substrate environment, under the medium concentration of ammonia nitrogen, the SOD index of Hydrilla verticillata and Myriophyllum spicatum did not change significantly, while the thorn bittergrass showed a trend of rising first and then declining. In silt and loess environment, different ammonia nitrogen concentrations have no significant effect on the CAT index of Hydrilla verticillata.
Key words Submerged plant;Ammonia-nitrogen;Stroma;Relative growth rate;Physiological index
沉水植物作为完全生长于水下的大型水生植物,是水生态系统维持稳定的重要生态类群,但其沉水性特点也决定了其对水质变化的敏感性[1]。虽然沉水植物的茎、叶等各部位对营养物质具有一定的吸收富集能力,但这种能力需要水质在一定的营养程度范围内才能保持稳定[2]。研究表明,水体长期氨氮超标会显著抑制沉水植物的生长,被认为是引起沉水植物衰退的重要原因之一[3]。也有学者认为,氨氮污染并不会直接导致沉水植物消亡,氨氮污染引起的藻类(包括附生藻类)暴发导致的低光照条件和次生代谢产物(藻毒素等)才是引起沉水植被消亡的直接原因[4]。
目前,沉水植物对氨氮的胁迫响应研究多集中于不同浓度条件下各植物的生长变化[5-7],然而沉水植物所处的水生生境具有复杂多变的特点,单一因素的研究已经无法准确分析沉水植物恢复的受限条件。该研究重点探究沉水植物在不同基底条件和不同水体条件2种因素变化下的响应情况,探明沉水植物对氨氮的响应是否会受到其所在底质条件的影响:即在底质营养高的条件下,沉水植物能否更耐受高氨氮胁迫(产生更多的抗逆性酶和其他代谢产物),以期了解基质类型对沉水植物耐受性的影响,同时指导水生态治理过程中不同河道对沉水植物品种以及基底条件改善措施的选择和应用,最终保证沉水植物群落构建的稳定性。
1 材料与方法
1.1 试验材料
针对河道中2种常见的基质条件,从河道中取底泥、硬质黄土分别作为试验基质材料,然后分别栽种3种本土沉水植物:黑藻(Hydrilla verticillata)、刺苦草(Vallisneria spinulosa)、穗花狐尾藻(Myriophyllum spicatum),植物材料采集自无锡市新吴区河道,供试植株生物量接近,不同种等数量种植。
1.2 试验设计
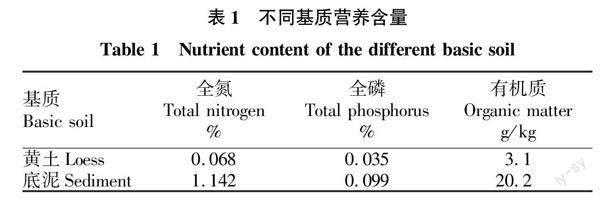
试验开展时间为2021年5月15—6月9日,为期25 d,该时间段是试验植物生长的旺盛期[8-9]。试验采用双因素设计,处理因素分别为不同氨氮浓度和基质类型,其中氨氮处理为空白对照和氨氮富增(1.69 mg/L,2.69 mg/L,4.69 mg/L;氨氮来源为NH4Cl)。用于培养的基质分别为河道内底泥和近岸黄土,基质的各项指标见表1。试验水体均为无锡市新吴区某治理后的河道水(氨氮0.69 mg/L、总磷 0.12 mg/L、COD 11.5 mg/L)。
试验基质和植物材料分别置于90 L塑料桶中,每种基质材料分别对应4种处理模式(空白组,1.69 mg/L,2.69 mg/L,4.69 mg/L),每個处理均重复3次。试验统一安排在室外自然光照和温度条件下进行,不同氨氮处理的水样每周监测1次,并按需添加NH4Cl以保证所设定的水体氨氮指标前后保持统一。另外,过程中排除藻类暴发对沉水植物生长的影响。
1.3 测定方法
植物各项指标的测定需等沉水植被群落完全占满整个水体空间(25 d)后进行。首先是从植物材料中取少量植株体用于生理指标的测定,包括叶绿素、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT),具体测定方法参照金相灿等[10-11]的方法。后进行植物生长相关指标的测定,收获后先将各物种分离,测定植株的最大株高、分枝数,最后将植株洗净烘干进行相对生长速率的计算。相对生长速率(RGR)的计算公式如下:
RGR=(lnW2-lnW1)/t
式中:W1和W2分别代表植物试验前后的生物干质量;t代表试验总天数d。
1.4 数据处理
数据采用Excel进行记录统计,数据经过SPSS Statistics软件进行差异显著性分析,数据最终通过Orgin8.0进行作图处理。
2 结果与分析
2.1 不同基质条件和氨氮浓度对供试植物相对生长速率及生物量的影响
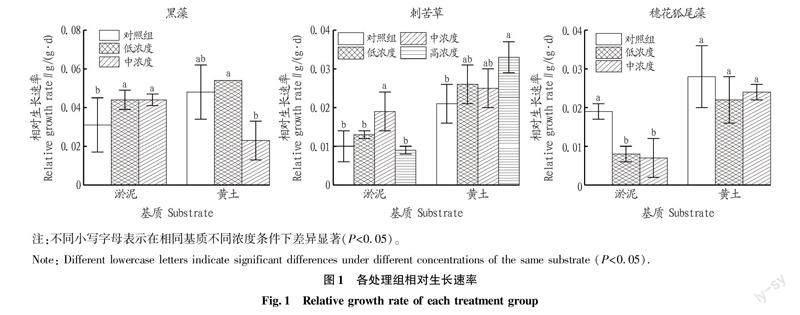
试验周期结束后,高浓度组只有刺苦草存活,黑藻和穗花狐尾藻都已经死亡。单从氨氮耐受性角度进行比较,刺苦草>黑藻>穗花狐尾藻。从图1可以看出,从淤泥条件下植物相对生长速率的变化趋势来看,除穗花狐尾藻对氨氮浓度反应较为敏感外,其他2种植物在适当的氨氮浓度条件下(低浓度和中浓度),生长速率较对照组都有一定的提升。
通过对氨氮和基质双因素分析发现,黄土组沉水植物适应氨氮胁迫的能力都有所提升,除黑藻在中浓度氨氮条件下生长速率不及淤泥组外,刺苦草和穗花狐尾藻在低浓度、中浓度氨氮条件下,黄土组植物的生长速率均优于淤泥组试验植物,其中刺苦草的效果最佳,即使在高浓度氨氮条件下,黄土组刺苦草的生长速率依然维持在较高的水平,是淤泥组高浓度氨氮条件下刺苦草生长速率的3.8倍。
从图2可以看出,黑藻在低浓度和中浓度氨氮条件下,分枝数多于对照组,且黄土环境下生长的黑藻在低浓度氨氮条件下分枝数最多,达到30枝,说明黄土基质能够促进黑藻在低浓度氨氮条件的营养生长。刺苦草在不同氨氮浓度下的分枝数,总体上也是多于对照组,且黄土环境下的刺苦草在高浓度氨氮条件依然生长旺盛,达到14枝,是淤泥环境高氨氮组的1.4倍。穗花狐尾藻相较于其他2种植物,分枝数在一定氨氮浓度条件下(低浓度和中浓度)有所下降,但不显著,这说明穗花狐尾藻对氨氮具有敏感性,且黄土环境也无法显著改善穗花狐尾藻不耐氨氮的特性。
从图3可以看出,中、低浓度氨氮条件下水体在不同基质条件下对黑藻、刺苦草、穗花狐尾藻的最大株高都没有显著影响。而高浓度条件下,虽然刺苦草在株高指标上依然表现出相较于其他2种植物更强的耐受性,但高浓度氨氮对刺苦草株高的反向影响依然很显著,说明高浓度氨氮会显著抑制刺苦草的纵向生长,从而转向横向生长。黄土环境下,黑藻和刺苦草的最大株高普遍高于淤泥组(同等浓度对比),说明黄土基质一定程度会促进黑藻和刺苦草纵向的营养生长。
2.2 不同基质条件和氨氮浓度对供试植物生理指标的影响
从图4可以看出,不同基质下同种植物在不同氨氮浓度水体中的叶绿素a含量趋势整体一致。低浓度和中浓度水体中黑藻和穗花狐尾藻叶绿素a含量均高于对照组,表明二者在中、低浓度氨氮条件下,叶绿素a指标不受影响,高浓度条件下光合作用则受到破坏;刺苦草叶片叶绿素a含量随氨
氮浓度升高逐渐下降,且在高浓度时,差异显著(P<0.05),表明其在高浓度条件下光合作用开始受到抑制;穗花狐尾藻
在低氨氮浓度水体中叶绿素a含量最高,表明穗花狐尾藻在低浓度氨氮条件下叶绿素a含量不受影响,中浓度条件下光合作用开始受到抑制。
从图5中SOD指标可知,不同基质同种氨氮浓度处理下,黑藻、刺苦草、穗花狐尾藻各处理组间SOD无明显差异。同种基质条件下,黑藻和穗花狐尾藻在低浓度氨氮条件下,SOD指标与对照组差异不显著;刺苦草则呈现先上升后下降的趋势,说明其在氨氮浓度提升的过程中作出应激反应。
从POD指标可知,淤泥环境下黑藻、刺苦草、穗花狐尾藻POD指标衰减相较于黄土环境更早,说明相较于淤泥环境,黄土基质条件下沉水植物表现出的过氧化物酶(POD)活性更高,这有利于保护植物免受逆境胁迫的伤害。
从CAT指标可知,淤泥和黄土环境下,不同氨氮浓度对黑藻CAT指标都无显著影响,但刺苦草和穗花狐尾藻各处理组差异较大,且刺苦草在淤泥和黄土条件下,趋势不一致,黄土环境下,刺苦草的CAT活性在中浓度和高浓度条件下明显高于淤泥环境;穗花狐尾藻整体表现为下降趋势,都随着氨氮浓度增加而下降,且与对照组差异显著(P<0.05),同种浓度条件下,黄土环境生长的穗花狐尾藻CAT值普遍低于淤泥组。
3 讨论与结论
沉水植物对富营养水体的应激反应原理一直存在争议,一种观点是沉水植物在水中的生长主要取决于水体透明度,
透明度下降(水色浑浊或藻类泛滥)会导致植物光合作用受到影响,而水体中的氮、磷含量不是影响沉水植物生长最关键因素,一定浓度的营养元素反而会帮助植物更好地进行营养生长[12]。另一种观点认为,水体中氮、磷元素超标对沉水植物是一种逆境胁迫,与陆生植物的盐胁迫性质类似,当水中的氮磷超过沉水植物能够吸收的正常范围,植物会慢慢退化直至消亡[13]。综合沉水植物生长指标数据变化,可以看出氨氮是沉水植物生长的限制因子之一,研究中的供试植物黑藻、刺苦草、穗花狐尾藻最大氨氮耐受浓度分别为2.69、4.69、2.69 mg/L,这与徐景涛等[14-15]对苦草和黑藻的研究结果基本一致,其内容表明苦草和黑藻氨氮分别在4和2 mg/L時,胁迫对植物影响可逆,而超过相应指标后,对植物的伤害则不可逆。当然,沉水植物的生长对水体氨氮浓度的要求也并非越低越好,一定浓度氨氮反而更有利于植物的营养生长,且不同植物所表现出的浓度最适性也有所差异,该研究中刺苦草最适宜的氨氮浓度明显要高于黑藻和穗花狐尾藻。
根据不同基质条件下植物生长状况对比发现,植物在淤泥和黄土2种不同基质条件下的生长情况存在差异,黄土环境下黑藻、刺苦草、穗花狐尾藻的相对生长速率、分枝数、最大株高大多数情况下都要优于淤泥组,这可能与淤泥自身已经具备满足甚至超过植物吸收所需的氮素需求有关[16]。该结论与陈开宁等[17]的研究结果并不一致,这可能与2种试验所用基质理化性质差异有关。
前人的研究指出,沉水植物的根系具有重要的吸收功能,所需磷素、氮素和微量元素可以通过根系从底质中进行吸收,基质中营养水平直接影响沉水植物对氨氮的耐受浓度[18-19]。因此,淤泥环境下过高的水体氨氮只会加重沉水植物吸收代谢这些养分的负担,最终对植物生长产生负面影响。另外,底泥中有机质含量高,底泥成为还原性腐泥时,也会对植物造成胁迫作用[20]。在沉水植物恢复工程实践中,对于富营养化水体的河道或者湿地类项目,需要根据沉水植物适应基质的差异性来构建沉水植物群落,针对不良的底质条件进行适当疏浚,从而创造合适的生境来减轻水体富营养对沉水植物造成的负面影响。
过量的氨氮对沉水植物生理胁迫的原因有很多,包括减少碳水化合物的形成、叶绿素含量降低、酶活性降低、抑制呼吸等[21-22]。该研究中,不同沉水植物在自身最大氨氮耐受浓度范围内,一些生理指标的变化存在差异性。就叶绿素a而言,刺苦草作为氨氮耐受性较好的植物,其叶绿素a指标在高浓度氨氮条件下最终呈现最低值,说明高浓度氨氮也影响到了刺苦草植物体内叶绿素的合成,这会进一步影响植物的光合作用和叶片吸收合成氮素的能力[23]。就酶活性而言,王斌等[24]研究表明,在相对高浓度氨氮处理下,沉水植物仍具有抗逆能力,但长期胁迫将使植物生长受到抑制,酶活性逐渐下降或消失,这可能是因为植物体内的碳水化合物已逐渐消耗殆尽,因而无法维持酶的响应活力。该研究中,黑藻、穗花狐尾藻在氨氮胁迫过程中,POD和CAT对于氨氮的响应相较于SOD更敏感,而刺苦草在氨氮胁迫过程中,SOD、POD、CAT都会随氨氮浓度的升高而产生变化,高浓度下各指标基本高于对照组。但也有持续下降的情况,如穗花狐尾藻CAT指标的变化,这可能与氨氮设置的浓度梯度不够有关。
通过以上研究可以得出:①高氨氮环境对沉水植物生长有着强烈的抑制作用。3种沉水植物中,刺苦草最耐高氨氮,其他2种植物在高浓度氨氮处理下均死亡,单从氨氮耐受性角度进行比较,刺苦草>黑藻>穗花狐尾藻。②黄土组沉水植物适应氨氮胁迫的能力都有所提升,除黑藻在中浓度氨氮条件下生长状况不及淤泥组外,刺苦草和穗花狐尾藻在低浓度、中浓度氨氮条件下,黄土组植物的生长状态都要优于淤泥组试验植物,其中刺苦草的效果最佳。该研究主要是在静态模拟的环境下进行,由于沉水植物实际所处的自然环境非常复杂,包括底泥条件、水流速度、光照条件、水质状况、水体透明度等,这些都会对植物长势造成综合影响,因此该研究在模拟条件下的研究结论还不足以全方位解释限制沉水植物生长的因素机理,但仍可为富营养化水体中沉水植物的退化机理和沉水植被的恢复重建提供科学依据。
参考文献
[1] 高奇英,朱文君,刘晓波,等.不同浓度氨氮对5种沉水植物生长的影响[J].水生态学杂志,2019,40(6):67-72.
[2] SERNA M D,BORRAS R,LEGAZ F,et al.The influence of nitrogen concentration and ammonium/nitrate ratio on N-uptake,mineral composition and yield of citrus[J].Plant & soil,1992,147(1):13-23.
[3] 刘燕.氮对沉水植物狐尾藻的生理特征及与沉积物氮行为的影响[D].北京:首都师范大学,2009.
[4] 庄凯.沉水植物轮叶黑藻(Hydrilla verticillata(L.f.)Royle)对氨氮胁迫的响应机理[D].南京:南京农业大学,2016.
[5] 章伟,王和云,赵以军.3种沉水植物碳氮代谢对水体氮源形态组成的响应[J].水生态学杂志,2017,38(2):51-56.
[6] 陈书琴,孙慧群,储昭升.氨胁迫下沉水植物抗氧化酶系统研究进展[J].环境科学与技术,2016,39(11):42-46.
[7] 尹传宝,张翠英,张敏,等.三种营养物质急性胁迫下菹草的生理生化特性[J].湿地科学,2015,13(1):129-134.
[8] 闵奋力,左进城,刘碧云,等.穗状狐尾藻与不同生长期苦草种间竞争研究[J].植物科学学报,2016,34(1):47-55.
[9] 丁桂珍,艾桃山,喻运珍,等.不同营养盐对轮叶黑藻生长的影响[J].水生态学杂志,2014,35(3):66-69.
[10] 金相灿,郭俊秀,许秋瑾,等.不同质量浓度氨氮对轮叶黑藻和穗花狐尾藻抗氧化酶系统的影响[J].生态环境,2008,17(1):1-5.
[11] 朱伟,张俊,赵联芳.底质中氨氮对沉水植物生长的影响[J].生态环境,2006,15(5):914-920.
[12] 丁玲,李巍,施蓓,等.透明度胁迫对菹草(Potamogeton crispus)生长的定量影响及其生长动力学模型[J].生态学报,2009,29(1):92-96.
[13] 卢姣姣,张萌,全水清,等.低氧、高铵和低光对沉水植物苦草(Vallisneria natans)生长与C-N代谢生理指标的影响特征[J].湖泊科学,2018,30(4):1064-1074.
[14] 徐景涛.典型湿地植物对氨氮、有机污染物的耐受性及其机理研究[D].济南:山东大学,2012.
[15] 颜昌宙,曾阿妍,金相灿,等.不同浓度氨氮对轮叶黑藻的生理影响[J].生态学报,2007,27(3):1050-1055.
[16] 叶春,于海婵,宋祥甫,等.底泥对沉水植物生长和群落结构的影响[J].环境科学研究,2008,21(5):178-183.
[17] 陈开宁,陈小峰,陈伟民,等.不同基质对四种沉水植物生长的影响[J].应用生态学报,2006,17(8):1511-1516.
[18] 周金波,金树权,包薇红,等.不同浓度氨氮对4种沉水植物的生长影响比较研究[J].农业资源与环境学报,2018,35(1):74-81.
[19] RATTRAY M R,HOWARD-WILLIAMS C,BROWN J M A.Sediment and water as sources of nitrogen and phosphorus for submerged rooted aquatic macrophytes[J].Aquatic botany,1991,40(3):225-237.
[20] 李芸,段如雁,刘昌闳,等.氨态氮对湖泊沉水植物的影响及应对策略[J].环保科技,2020,26(1):56-60.
[21] CRONIN G,LODGE D M.Effects of light and nutrient availability on the growth,allocation,carbon/nitrogen balance,phenolic chemistry,and resistance to herbivory of two freshwater macrophytes[J].Oecologia,2003,137(1):32-41.
[22] 王哲.沉水植物狐尾藻(Myriophyllum verticillatum L.)對水体铵态氮胁迫响应的研究[D].上海:上海师范大学,2019.
[23] MUTHUI S W.氨氮对沉水植物光合作用和呼吸作用的影响:以光叶眼子菜,微齿眼子菜和穗状狐尾藻为例[D].武汉:中国科学院大学(中国科学院武汉植物园),2021.
[24] 王斌,李伟.不同N、P浓度条件下竹叶眼子菜的生理反应[J].生态学报,2002,22(10):1616-1621.
基金项目 无锡市水利局太湖入湖河道水污染与蓝藻水华治理技术研究(JSXXCG2022-007)。
作者简介 林超(1988—),女,江苏无锡人,硕士,从事水生态工程研究。
*通信作者,硕士,从事水域生态规划研究。
收稿日期 2022-07-12;修回日期 2022-09-09
——以武汉紫阳湖为例

