卡西霉素生物合成途径中抗性基因calT的功能
苟丽霞?解子晗?张文丽?宋子涵?汪志军?韩铁生


摘要:目的 研究卡西霉素产生菌教酒链霉菌NRRL 3882中编码MmpL家族同源蛋白的抗性基因calT的功能。方法 利用λ-RED同源重组方法构建calT基因敲除质粒,通过接合转移和同源重组的方法得到双交换的calT基因敲除的突变株。通过HPLC分析突变株的代谢产物,并对突变株及野生菌株的细胞内及细胞外卡西霉素的分布进行分析。结果 突变株GLX30(ΔcalT)中卡西霉素的产量与野生菌株相比显著降低,且胞内卡西霉素的占比与野生菌株相比增加约3倍,说明calT与卡西霉素的转运功能相关。结论 CalT为转运蛋白,负责将卡西霉素转运至胞外以实现教酒链霉菌对卡西霉素的抗性。
关键词:卡西霉素;calT;MmpL家族;生物合成
中图分类号:Q933文献标志码:A
The function of the resistance gene calT in the biosynthetic pathway of calcimycin
Gou Li-Xia1, Xie Zi-han1, Zhang Wen-li2, Song Zi-han2, Wang Zhi-jun3, and Han Tie-sheng2
(1 School of Life Sciences, North China University of Science and Technology, Tangshan 063210; 2 Hebei Province Key Laboratory
of Occupational Health and Safety for Coal Industry, School of Public Health, North China University of Science and Technology, Tangshan 063210; 3 State Key Laboratory of Microbial Metabolism, School of Life Sciences and Biotechnology,
Shanghai Jiao Tong University, Shanghai 200240)
Abstract Objective To study the function of the resistance gene calT encoding MmpL family homologous protein in Streptomyces chartreusis NRRL 3882. Methods The calT gene knockout plasmid was constructed by λ-RED homologous recombination method, and the double-crossover calT gene knockout mutant was obtained by the methods of conjugation and homologous recombination. The metabolites of the mutant strains were analyzed by HPLC, and the distribution of intracellular and extracellular calcimycin in the mutant and wild strains was analyzed. Results Compared with the wild strain, the production of calcimycin in the mutant GLX30 (ΔcalT) was significantly lower than that in the wild strain, and the proportion of intracellular calcimycin increased by about 3 times compared with the wild strain, indicating that calT and the wild strain related to the transport function of the hormone. Conclusion CalT is a transporter protein, which is responsible for transporting calcimycin to the outside of the cell to achieve the resistance of Streptomyces oleifera to calcimycin.
Key words Calcimycin; calT; MmpL family; Biosynthesis
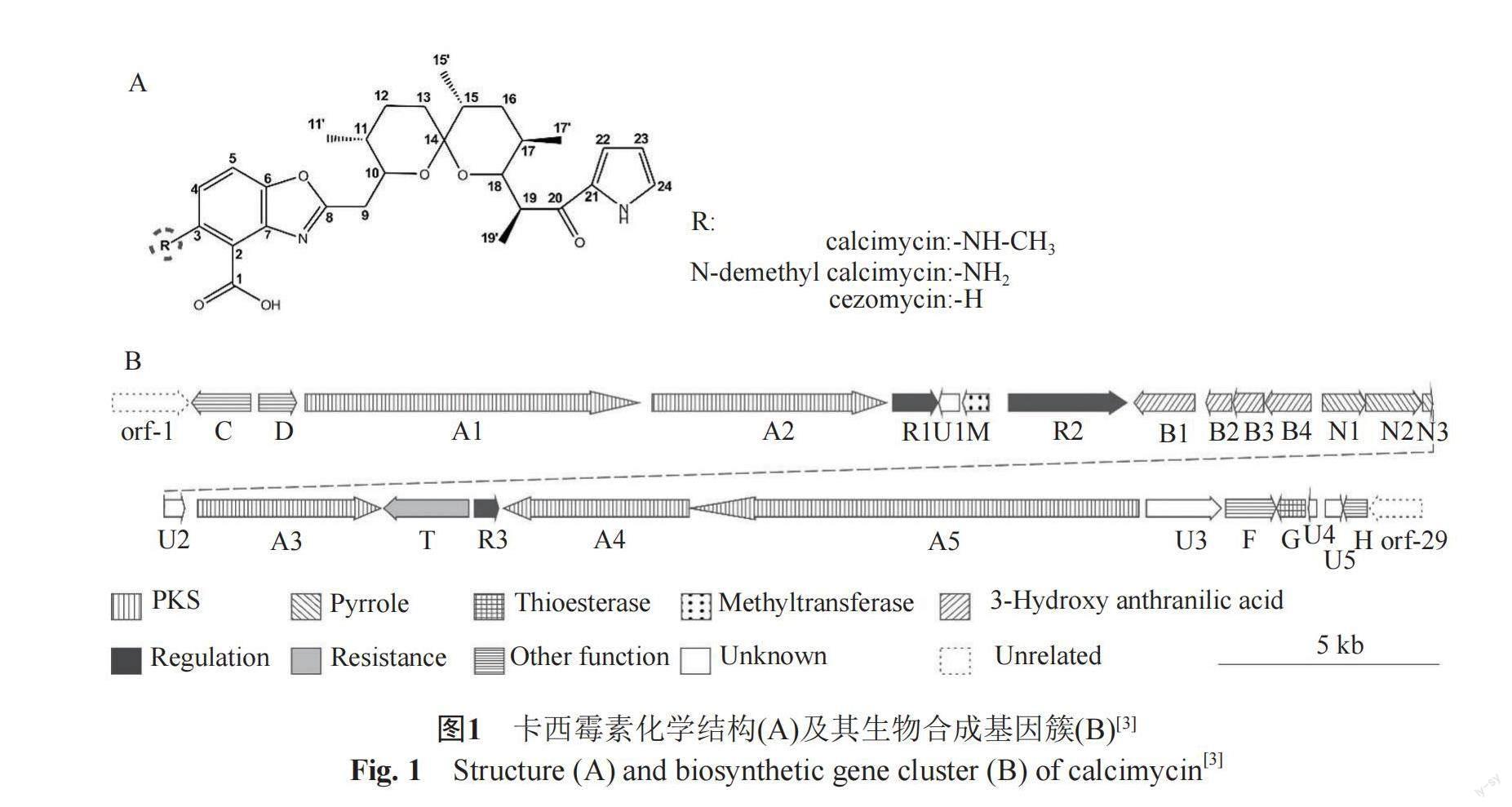
卡西霉素(calcimycin)又名A23187,是由教酒鏈霉菌(Streptomyces chartreusis)NRRL 3882产生的一种吡咯聚醚类抗生素,化学结构由吡咯环、螺旋酮环及含3位取代基团的苯并噁唑环组成[1](图1A)。卡西霉素是重要的离子载体,能与生理上重要的阳离子如钙离子、镁离子等结合形成二聚体复合物,具有抗菌、抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡[2-5]等功能,此外,卡西霉素具有诱导哺乳动物精子顶体反应、激活卵母细胞等功能[6-7],被广泛应用于辅助生殖的临床实践中。
2011年,吴秋林等[1]根据吡咯环的合成途径,设计特异性引物从教酒链霉菌NRRL 3882的总DNA中克隆到卡西霉素的生物合成基因簇(图1B)。其中,calA1-A5为5个聚酮合酶(polyketide synthase, PKS)基因,负责卡西霉素的螺旋环的合成;calB1-B4负责苯并恶唑环的前体3-羟基邻氨基苯甲酸(3-HAA)的合成;calN1-N3负责卡西霉素的吡咯环合成;calM为甲基转移酶,负责3位氨基的甲基化;calU1-calU5为未知功能基因;calR1-R3为3个途径特异性转录调控因子。前期研究中,通过对calR3基因体内敲除实验及体外酶学实验证实CalR3是一个负调控蛋白,通过finger-printing方法证实CalR3结合于calR3与calT基因之间的双向启动子位置,抑制自身及calT基因的转录。在calR3基因敲除的突变株中,calT基因的表达量明显上升,且突变株中卡西霉素的产量大幅度提升[8]。生物信息学分析显示calT是一个抗性基因,编码MmpL超家族的跨膜转运蛋白。关于MmpL家族蛋白的研究,目前主要集中在结核分枝杆菌中,探讨其对抗生素的抗性机制,在其他细菌中的研究比较少。因此本研究以calT基因为研究对象,通过PCR-targeting的方法,构建calT基因中断的突变株,通过HPLC方法对calT基因敲除突变菌株及野生菌株的代谢产物进行比较分析,并对野生菌株及calT基因敲除突变株的细胞内及细胞外代谢产物进行分析,揭示了calT基因在卡西霉素生物合成及转运中的作用,为MmpL家族同源蛋白在链霉菌次级代谢产物合成中的作用机制提供参考,并为今后利用分子生物学策略从基因水平上提高卡西霉素产量提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
本实验中所用到的全部菌种和质粒见表1,其中Escherichia coli BW25113/pIJ790用于PCR-targeting 敲除目的基因,ET12567/pUZ8002用作大肠埃希菌与链霉菌两亲本接合转移。本研究用到的引物由生工生物工程(上海)股份有限公司合成,详见表2。
1.1.2 培养基、主要试剂和仪器
实验所需LB培养基、LA培养基、SFM固/液体培养基、TSBY液体培养基。LB培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠5.0 g/L,pH7.0; LA培养基:将琼脂粉加入LB培养基中,最终浓度为1.5%。LB、LA培养基培养大肠埃希菌;SFM固体培养基用作教酒链霉菌NRRL 3882的孢子收集和结合转移;SFM液体培养基用作发酵教酒链霉菌NRRL 3882;TSBY培养基(10.3%蔗糖)[9]用于链霉菌菌丝体的生长及总DNA的提取。rTaq DNA聚合酶、KOD plus高保真DNA聚合酶,TOYOBO公司;限制性内切酶和DNA连接酶,Fermentas公司;DNA胶回收试剂盒、实验所用抗生素购自天根生化科技有限公司;甲醇、乙醇、乙酸乙酯购自河北艾锦科技有限公司。本实验所用抗生素的终浓度为:卡那霉素(Kan)50 μg/mL、氨苄霉素(Amp) 100 μg/mL、氯霉素(Cml) 25 μg/mL、阿泊拉霉素(Apr) 30 μg/mL。HPLC1200及色谱柱ZORBAX SB-C18(2.1 mm×150 mm,3.5 μm)购自安捷伦科技有限公司。
1.2 方法
1.2.1 CalT的生物信息学分析
CalT(GenBank: AEH42475.1)的蛋白质结构域分析由在线NCBI的CDD工具完成[11] (ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。
1.2.2 calT基因敲除突變株的构建
本研究应用REDIRECT Technology的方法[12]对calT基因进行敲除,通过EcoR I和 Hind III酶切pIJ773,回收获得具有阿泊拉霉素抗性基因(aac(3)IV)及oriT的片段(约1.4 kb),以其为模板,设计引物T-F1和T-F2,PCR扩增aac(3)IV-oriT cassette片段用于中断calT基因, 回收aac(3)IV-oriT cassette片段,并电转入E.coli BW25113/pKD46/p16F9感受态细胞中,利用E. coli BW25113/pKD46的同源重组系统将p16F9上的calT基因与aac(3)IV-oriT PCR cassette片段进行同源臂交换,构建calT基因中断的重组质粒pJTU3796。在辅助质粒pUZ8002的协助下,将重组质粒pJTU3796通过接合转移导入到野生型教酒链霉菌NRRL 3882孢子中,30℃、培养12~16 h 后用阿泊拉霉素(30 μg/mL)及萘啶酮酸(40 μg/mL)覆盖,继续培养3~4 d后挑选阿泊拉霉素抗性平板上的接合子划线扩培,扩培3 d后提取每个接合子的基因组DNA,以其为模板,使用验证引物T-F3和T-F4进行PCR验证。
1.2.3 突变菌株及野生菌株代谢物萃取及分析
将野生菌株及突变菌株GLX30(ΔcalT)的孢子按1:1000的比例接种于TSBY培养基中,30℃、220 r/min培养3 d,之后将种子液按2%的接种量转接于100 mL液体SFM培养基中,30℃、220 r/min发酵培养5~7 d。用两倍体积的乙酸乙酯对野生菌株及突变株的发酵液进行萃取,分析菌株总的代谢产物,接着对野生菌株及突变株发酵液进行离心,对发酵液离心后的菌体(胞内代谢物检测)和上清(胞外代谢物检测)做分别萃取,分析细胞内外的代谢产物。将萃取液分别进行旋转蒸发,之后用1 mL甲醇溶解旋蒸后的沉淀,有机滤膜过滤后用HPLC进行检测分析,计算其胞内外卡西霉素比值(胞内/胞外),通过峰面积计算卡西霉素含量。使用Agilent 1200 HPLC及ZORBAX SB-C18反向柱对样品进行检测,检测波长为280 nm,流动相A为含有0.1%的三氟乙酸(TFA)的水溶液,B相为甲醇(80%~100%),流速为0.3 mL/min。
2 结果
2.1 CalT的生物信息学分析
通过NCBI的CDD工具对CalT进行功能预测,显示CalT属于MmpL家族同源蛋白(图2)。MmpL(mycobacterial membrane protein large)即分枝杆菌膜蛋白,属于RND(抵抗-结瘤-细胞分裂)转运蛋白家族的一个亚类,参与跨细胞膜的底物特异性的内源性亲脂性成分的输出[4]。目前关于MmpL家族蛋白的研究主要集中在结核分枝杆菌中,现有研究表明,MmpL3介导分枝杆菌中脂质海藻糖单菌酸(TMM)的转运[5],MmpL5介导分枝杆菌的药物外排作用[13] ,MmpL7介导分枝杆菌聚酮化合物硫青霉烯二肌酸酯的转运等[14]。因此,CalT可能作为一个抗生素外排蛋白,通过将卡西霉素向胞外转运,实现宿主自身对卡西霉素的抗性。
2.2 calT基因中断的突变株的构建
为了探索calT基因的功能,通过PCR-targeting体系的λ-RED同源重组技术,对教酒链霉菌NRRL 3882基因组上的calT基因进行中断,通过同源重组构建aac(3)IV抗性基因置换calT基因的重组质粒pJTU3796,见图3A。在辅助质粒pUZ8002的协助下,将重组质粒pJTU3796通过接合转移导入教酒链霉菌NRRL 3882孢子中,筛选到calT基因中断的变菌株GLX30,见图3B。以野生菌株及GLX30突变株的基因组DNA为模板, PCR扩增验证,结果显示野生菌株对应的PCR片段大小为1024 bp,突变株GLX30(ΔcalT)对应的片段为1820 bp,说明GLX30是calT基因中断的双交换突变株。
2.3 野生菌株和突变菌株GLX30的代谢产物分析
将野生菌株与突变菌株GLX30(ΔcalT)进行液体发酵,30℃培养7 d,发酵产物经HPLC检测分析。以卡西霉素标准品为阳性对照,HPLC结果显示(图4),突变株GLX30 (ΔcalT)中卡西霉素的产量比野生菌株的产量大幅度降低(图4),这与我们前期研究结果相吻合,即当敲除calR3基因,卡西霉素的产量提高,calT的基因表达量明显上升[8]。
为了进一步研究calT基因,作为MmpL家族同源蛋白在卡西霉素跨膜转运中的作用,对突变菌株GLX30(ΔcalT)及野生菌株发酵7 d的细胞内(intracellular)及细胞外(extracellular)代谢产物分别进行HPLC检测分析,计算其胞内外卡西霉素比值(胞内/胞外),通过峰面积进行比较。结果显示,野生菌株及突变株GLX30 (ΔcalT)突变株的细胞外的卡西霉素的量均高于细胞内卡西霉素的量(图5),经计算WT胞外(WT-extracellular)与WT胞内(WT-intracellular)卡西霉素的比值约为88.97(图5A) ,突变株胞外(ΔcalT -extracellular)与突变株胞内(ΔcalT -intracellular)卡西霉素的比值约为26.67(图5B),说明calT与卡西霉素的胞外转运功能相关。
3讨论与结论
MmpL家族,是一种重要的多底物外排泵,根据其典型的拓扑结构被归属于RND(resistance-nodulation-division)超家族[15],其主要作用是将复杂的、与毒力相关的包膜脂质和铁载体穿过质膜转移到细胞外[16]。结核分枝杆菌的基因组编码有13个MmpL蛋白,目前只有MmpL3蛋白的转运活性通过体外生物化学实验的到证实[17]。RND超家族的外排泵蛋白参与的物质外排,被认为是结核分枝杆菌耐药的重要机制,RND超家族蛋白除了参与结核分枝杆菌的物质转运,还与革兰阴性细菌的抗生素耐药性及应激反应相关,目前研究较清楚的是大肠埃希菌中的RND超家族同源蛋白AcrB,作为药物外排泵,能将底物通过周质挤压到细胞外,其表达受负调控因子AcrR的调控[18-19]。生物信息学分析表明CalT与RND超家族的MmpL家族蛋白有较高同源性。本研究成功构建calT基因敲除的突变株,HPLC结果显示ΔcalT突变株中卡西霉素的产量大幅度减少,且细胞内卡西霉素的占比增加约3倍,说明calT与卡西霉素的胞外转运功能相关。同时,敲除calT后,胞外的卡西霉素浓度仍高于胞内,说明教酒链霉菌中仍有其他外排泵或非特异性外排系统将卡西霉素转运出胞外,以降低其体内毒性。
本研究中,calT基因的转录受到CalR3蛋白的调控。CalR3蛋白属于TetR家族的轉录调控因子,一般为诱导变构型DNA结合蛋白,其天然构型蛋白往往结合在一个双向启动子位置,阻遏自身及偶联基因的表达,构成负反馈调控结构;当细胞内诱导物的浓度增加,其与该调控因子结合使其构象改变,从而降低与DNA的结合强度,造成自身及偶联基因的转录水平上升。在本研究中,目标产物卡西霉素即为诱导物,实验研究表明其可以在体外结合CalR3蛋白,降低其DNA结合活性[8]。因此calR3与calT构成一个“自动开关”,当胞内卡西霉素浓度低时,CalR3抑制自身基因及calT的转录;当卡西霉素浓度升高,calR3及calT基因的转录水平上升,CalT将卡西霉素排出胞外,因此始终将胞内的卡西霉素浓度维持在一个较低的水平。此种转录调控模式为TetR家族蛋白的典型调控模式,其偶联的基因多种多样,一般为其调控因子诱导物的效应蛋白。其中偶联药物外排泵基因的模式比较常见,除了本研究的CalT,大肠埃希菌中药物外排泵蛋白AcrB(RND超家族同源蛋白)也受到TetR家族蛋白AcrR的负调控。结核分枝杆菌中MmpL4转运蛋白也反向偶联一个TetR家族调控因子Rv0452(尚未经实验验证)。
前期研究中,对卡西霉素基因簇上的负调控基因calR3敲除后,突变株中卡西霉素的产量提高约7倍,RT-PCR数据显示突变株中calT基因的表达量大幅度上升,体外酶学实验证实CalR3结合于calR3与calT基因之间的双向启动子位置,抑制自身及calT基因的转录[8],属于典型的TetR家族转录因子的调控机制。
综上,本研究通过基因敲除回补、HPLC代谢产物分析等手段证明了CalT是一个卡西霉素转运蛋白,通过将自身生成的卡西霉素外排,实现自身对卡西霉素的抗性。本研究将为MmpL家族蛋白的转运机制研究提供新的研究对象。
参 考 文 献
Wu Q, Liang J, Lin S, et al. Characterization of the biosynthesis gene cluster for the pyrrole polyether antibiotic calcimycin (A23187) in Streptomyces chartreusis NRRL 3882[J]. Antimicrob Agents Chemother, 2011, 55(3): 974-982.
Kajitani N, Kobuchi H, Fujita H, et al. Mechanism of A23187-induced apoptosis in HL-60 cells: Dependency on mitochondrial permeability transition but not on NADPH oxidase[J]. Biosci Biotechnol Biochem, 2007, 71(11): 2701-2711.
盖婧璇, 韩铁生, 刘文秀, 等. 卡西霉素生物合成调控基因calR2的功能[J]. 微生物学通报, 2018, 45(7): 9.
Viljoen A, Dubois V, Girard-Misguich F, et al. The diverse family of MmpL transporters in mycobacteria: From regulation to antimicrobial developments[J]. Mol Microbiol, 2017, 104(6): 889-904.
Su C C, Klenotic P A, Cui M, et al. Structures of the mycobacterial membrane protein MmpL3 reveal its mechanism of lipid transport[J]. PLoS Biol, 2021, 19(8): e3001370.
Xu Z, Yao G, Niu W, et al. Calcium Ionophore (A23187) rescues the activation of unfertilized oocytes after intracytoplasmic sperm injection and chromosome analysis of blastocyst after activation[J]. Front Endocrinol (Lausanne), 2021, 12: 692082.
Sampaio B, Ortiz I, Resende H, et al. Factors affecting intracellular calcium influx in response to calcium ionophore A23187 in equine sperm[J]. Andrology, 2021, 9(5): 1631-1651.
Gou L, Han T, Wang X, et al. A novel TetR family transcriptional regulator, CalR3, negatively controls calcimycin biosynthesis in Streptomyces chartreusis NRRL 3882[J]. Front Microbiol, 2017, 8: 2371.
Wu Q, Gou L, Lin S, et al. Characterization of the N-methyltransferase CalM involved in calcimycin biosynthesis by Streptomyces chartreusis NRRL 3882[J]. Biochimie, 2013, 95(7): 1487-1493.
Kieser T, Bibb M J, Buttner M J, et al. Practical Streptomyces genetics[M]. The John Innes Foundation, Norwich, United Kingdom, 2000: 25.
Marchler-Bauer A, Derbyshire M K, Gonzales N R, et al. CDD: NCBI's conserved domain database[J]. Nucleic acids research, 2015, 43(Database issue): D222-226.
Gust B, Kieser T, Chater K. PCR targeting system in Streptomyces coelicolor A3 (2)[J]. John Innes Centre, 2002, 3(2): 1-39.
Briffotaux J, Huang W, Wang X, et al. MmpS5/MmpL5 as an efflux pump in Mycobacterium species[J]. Tuberculosis (Edinb), 2017, 107: 13-19.
Jain M, Cox J S. Interaction between polyketide synthase and transporter suggests coupled synthesis and export of virulence lipid in M. tuberculosis[J]. PLoS Pathog, 2005, 1(1): e2.
Domenech P, Reed M B, Barry C E, 3rd. Contribution of the Mycobacterium tuberculosis MmpL protein family to virulence and drug resistance[J]. Infect Immun, 2005, 73(6): 3492-3501.
Szekely R, Cole S T. Mechanistic insight into mycobacterial MmpL protein function[J]. Mol Microbiol, 2016, 99(5): 831-834.
Xu Z, Meshcheryakov V A, Poce G, et al. MmpL3 is the flippase for mycolic acids in mycobacteria[J]. Proc Natl Acad Sci U S A, 2017, 114(30): 7993-7998.
Okusu H, Ma D, Nikaido H. AcrAB efflux pump plays a major role in the antibiotic resistance phenotype of Escherichia coli multiple-antibiotic-resistance (Mar) mutants[J]. J Bacteriol, 1996, 178(1): 306-308.
Ruzin A, Keeney D, Bradford P A. AcrAB efflux pump plays a role in decreased susceptibility to tigecycline in Morganella morganii[J]. Antimicrob Agents Chemother, 2005, 49(2): 791-793.

