水位深度对工厂化流水养殖大菱鲆生长的影响
李纪元, 郭 腾, 徐世宏, 吴乐乐, 于佳辰, 王彦丰, 李 军
水位深度对工厂化流水养殖大菱鲆生长的影响
李纪元1, 2, 3, 4, 郭 腾5, 徐世宏1, 2, 3, 吴乐乐6, 于佳辰7, 王彦丰1, 2, 3, 李 军1, 2, 3
(1. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237; 3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071; 4. 中国科学院大学, 北京 100049; 5. 青岛农业大学 生命科学学院, 山东 青岛 266109; 6. 中国海洋大学 水产学院, 山东 青岛 266003; 7. 江苏海洋大学 海洋科学与水产学院 江苏 连云港 222005)
为探讨水深对工厂化流水养殖水环境的影响, 本实验将9 000尾初始体质量为141.62±24.47 g的大菱鲆()按照低水深(20 cm)、中水深(40 cm)、高水深(60 cm)条件分为3个不同养殖水深组, 实验周期为80 d。实验期间, 跟踪检测长期和特定时期(投喂后8 h内)不同养殖水深水体中总氨氮(TAN)、亚硝酸盐(NO2–-N)、固体悬浮物(SS)、化学需氧量(COD)等参数, 并在实验结束时对大菱鲆成活率、体质量、饲料系数水平进行测量。研究表明, 水池内水流速度与水深呈负相关, 但各组间无显著性差异。高水深组的固体悬浮物含量显著(<0.05)低于其他两组, 低水深组的化学需氧量显著(<0.05)低于其他两组, 各水深组中氨氮、亚硝酸盐都在大菱鲆幼鱼安全浓度范围内, 且无显著性差异。在投喂后, 固体悬浮物含量在各水深组中呈先升高后降低趋势, 其中低水深组波动最大。氨氮含量在投喂后3 h开始上升, 其中低水深组涨幅最大。各水深组中化学需氧量随着投喂时间延长而逐渐积累, 而亚硝酸盐含量基本保持不变。实验结束, 低水深组中大菱鲆增质量率、特定生长率、体质量变异系数均显著(<0.05)高于高水深组, 而存活率、肥满度、饲料系数在各组之间没有显著差异。研究结果显示, 增加水深有利于提高养殖水环境水质恶化的缓冲能力。在保证养殖系统水质指标安全的前提下, 低水深在大菱鲆工厂化流水养殖中是一个可行的方案。
大菱鲆(); 生长; 水质; 水深; 工厂化流水养殖
水深作为水产养殖生态系统的因素之一, 与鱼类摄食模式、生长习性息息相关。ZHANG等[1]研究养殖水深对中华鲟()生长影响的结果表明, 在0.6 m深度, 中华鲟的特定生长率、增质量率、血清谷胱甘肽过氧化物酶、碱性磷酸酶、溶菌酶活性显著低于1和1.4 m水深。JIANG等[2]研究了不同水深(20、50、100、150、200 cm)对红刺参()生长和体色的影响, 其结果表明150 cm水深养殖的红刺参体质量最大, 200 cm水深养殖的红刺参成活率最高, 但悬浮在较深层的红刺参红色变浅。KAPUTE等[3]研究发现罗非鱼()在较深的池塘可以产生更好的养殖效果。养殖池水深通常由建造成本和养殖生物栖息偏好决定, 大菱鲆属于底栖鱼类, 水体养殖深度普遍在0.4~0.6 m。在实际养殖生产过程中, 高水深会使养殖成本提高, 造成水资源浪费, 低水深会使水体缓冲能力变差, 导致水体水质剧烈波动, 而水质是由温度、盐度、pH、溶解氧、氨氮、亚硝酸盐、固体悬浮物、化学需氧量等变量决定, 在很大程度上影响鱼类的生长。因此, 了解水深如何影响水质, 并确定适宜的养殖水深对大菱鲆的工厂化养殖至关重要。
大菱鲆(), 中文音译名“多宝鱼”, 隶属于硬骨鱼纲(Osteichthyes)、鲽形目(Pleuronectiformes)、菱鲆科(Scophthalmidae)、菱鲆属(), 原产于欧洲地区[4-5]。1992年雷霁霖院士首次将大菱鲆引入国内, 随后大菱鲆人工繁殖、苗种培养、成鱼养殖等问题被相继攻克, 迅速在山东、辽宁、江苏等地推广, 成为近年来中国最具有发展前景的养殖品种之一[6]。目前, 大菱鲆养殖模式多种多样, 包括循环水养殖、池塘养殖、工厂化流水养殖、网箱养殖等[7]。就实际情况而言, 工厂化流水养殖模式是主要形式, 占据主导地位[8]。目前已经有很多关于流水养殖的研究, 仇登高等[9]研究发现, 1次/天或1次/2天的投喂频率更适合流水模式下鞍带石斑鱼()的生长; 宋志飞等[10]研究发现, 在流水养殖系统中, 低密度组中俄罗斯鲟鱼()幼鱼增质量率、体长增长率、特定生长率、饲料转化率显著高于高密度组, 较高密度会对流水养殖系统中俄罗斯鲟鱼幼鱼的生长造成负面影响; ZHENG等[11]研究发现在流水系统中日本对虾()触角破损率与放养密度呈正相关趋势。目前尚未见到有关水深对工厂化流水养殖水质的影响。本研究通过探讨不同水深对大菱鲆工厂化流水养殖水质的影响, 为工厂化流水养殖中选择大菱鲆适宜养殖深度及水环境调控工作提供基础和依据。
1 材料与方法
1.1 实验材料
实验用大菱鲆购于威海圣航水产科技有限公司, 挑选健康活跃、无创伤的大菱鲆幼鱼9 000尾, 平均体质量141.62±24.47 g。
1.2 实验方法
1.2.1 养殖条件
采用工厂化流水养殖系统, 养殖池为八角形水泥池(5 m×5 m×0.8 m), 实验设计3组不同水深环境(20、40和60 cm), 每组3个重复, 每池养殖大菱鲆1 000尾, 养殖密度为40尾/m2(6 kg/m2), 实验周期80 d。实验期间每天投喂2次(6: 00; 17: 00), 日投喂率为1%, 对每个水池投喂量进行记录。各养殖池日进出水量相同, 进水口离水面15 cm, 水流与水面呈45°进入池内, 进出水速度相同(2.08 m3/h), 保持连续充气, 每天早、中、晚用LSH10-1M微型多普勒流速仪, 随机选取离养殖池中心4~5 m处6个固定点测量水流速度。水温控制为17.3±0.5 ℃, 盐度为30±1, pH为6.95±0.14, 养殖池内溶解氧含量为6.65±0.37 mg/L。
1.2.2 水质监测
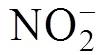
总氨氮检测采用纳氏试剂分光光度法[12], 亚硝酸盐检测采用萘乙二胺分光光度法[13], 固体悬浮物检测采用重量法[14], 化学需氧量检测采用碱性高锰酸钾法[15]。
1.2.3 生长检测
实验开始和结束时, 停食1 d, 各池随机选取300尾大菱鲆, 测量体长和体重, 按以下公式计算生长指标。
增质量率(Weight gain rate,WG)=(2–1)/1×100%
特定生长率(Special growth rate,SG)=(ln2–ln1)/×100%
饲料系数(Feed conversion ratio,FC)=W/(2×2–1×1)
存活率(Survival rate,S)=终末尾数/初始尾数×100%
肥满度(Condition factor,C)=2/3×100%
体重变异系数(weight coefficient of variation,WV)=(SD/2)×100%
式中,为终期平均体长(cm),1为初始平均体质量(g),2为终期平均体质量(g),2为终期大菱鲆尾数,1为初始大菱鲆尾数,为实验周期(d),W为总饲料摄入量(g), SD为体质量标准差。
1.2.4 数据处理
实验结果以“平均值±标准差”表示, 并用Excel 2016和SPSS 19. 0软件进行处理。采用单因素方差分析对各组数据进行显著性分析, 采用邓肯多重极差检验(DunCan)和最小显著差异检验(LSD)进行统计学处理,<0.05表示差异显著。
1)危害症状。桃小幼虫蛀果后,在果面上留有针尖状蛀孔,孔口有白色果胶,数日后干成白色蜡粉。幼虫蛀入果实后纵横串食,最终到达果心,蛀食种子。受害苹果果实生长受阻,果面凹凸不平,俗称“猴头果”。幼虫在果内一边蛀食,一边将粪便排于虫道内,被害果成为“豆沙馅”,失去食用价值。后期幼虫老熟后向外咬出香头大的“脱果孔”,脱离果实。
2 结果
2.1 不同水深对水流速度的影响
水池内水流速度与水深呈负相关关系: 在低水深时, 水流速度为0.11 m/s; 在中水深时, 水流速度为0.10 m/s; 在高水深时, 水流速度为0.08 m/s。水深越深, 水流速度越慢, 各水深组中水流速度无显著性差异(图1)。
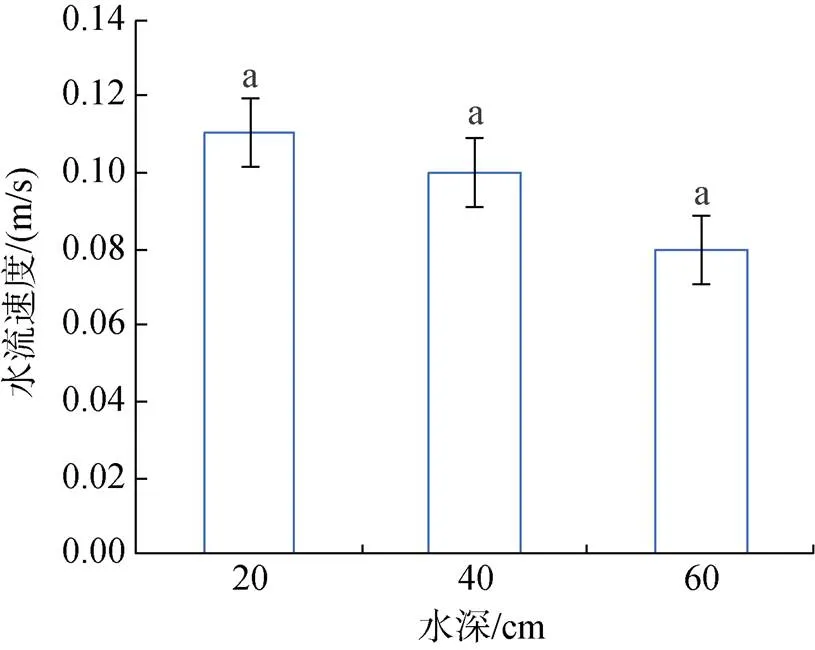
图1 水深对水流速度的影响
相同字母表示组间差异不显著(>0.05)
2.2 不同水深对水质的影响
在本实验中, 高水深组的固体悬浮物含量显著(<0.05)低于其长两组, 氨氮含量也是3组中最低(0.49 mg/L)。化学需氧量随着水深的增加而增高, 在高水深组最高, 达到1.51 mg/L, 高水深组和中水深组的化学需氧量显著(<0.05)高于低水深组。亚硝酸盐在低、中、高水深组的质量浓度分别为0.027、0.025、0.027 mg/L, 无显著性差异(图2)。
2.3 不同水深投喂后水质的变化规律
2.3.1 不同水深投喂后固体悬浮物的变化规律
由图3可见, 各处理组固体悬浮物浓度在投喂后1.5 h, 开始出现上升趋势。在投喂后2 h, 高水深组固体悬浮物浓度达到最高(190 mg/L)。在投喂后3 h, 中水深组固体悬浮物浓度达到最高(250 mg/L), 随后1 h大幅度下降。在投喂后3~4 h, 低水深组固体悬浮物大幅度上升并达到最高浓度(310 mg/L)。在2、3、8 h时, 高水深组水体固体悬浮物浓度高于低水深组。
2.3.2 不同水深投喂后氨氮的变化规律
由图4可见, 各水深组氨氮浓度在投喂后3 h内处于稳定状态, 在投喂后3 h开始呈上升趋势。低水深组氨氮质量浓度在投喂后5 h出现波峰并达到最大值(1.11 mg/L), 中水深组氨氮浓度在投喂后6 h出现波峰并达到最大值(1.08 mg/L), 高水深组氨氮浓度相对比较稳定, 在投喂后1 h出现最大值(0.65 mg/L)。
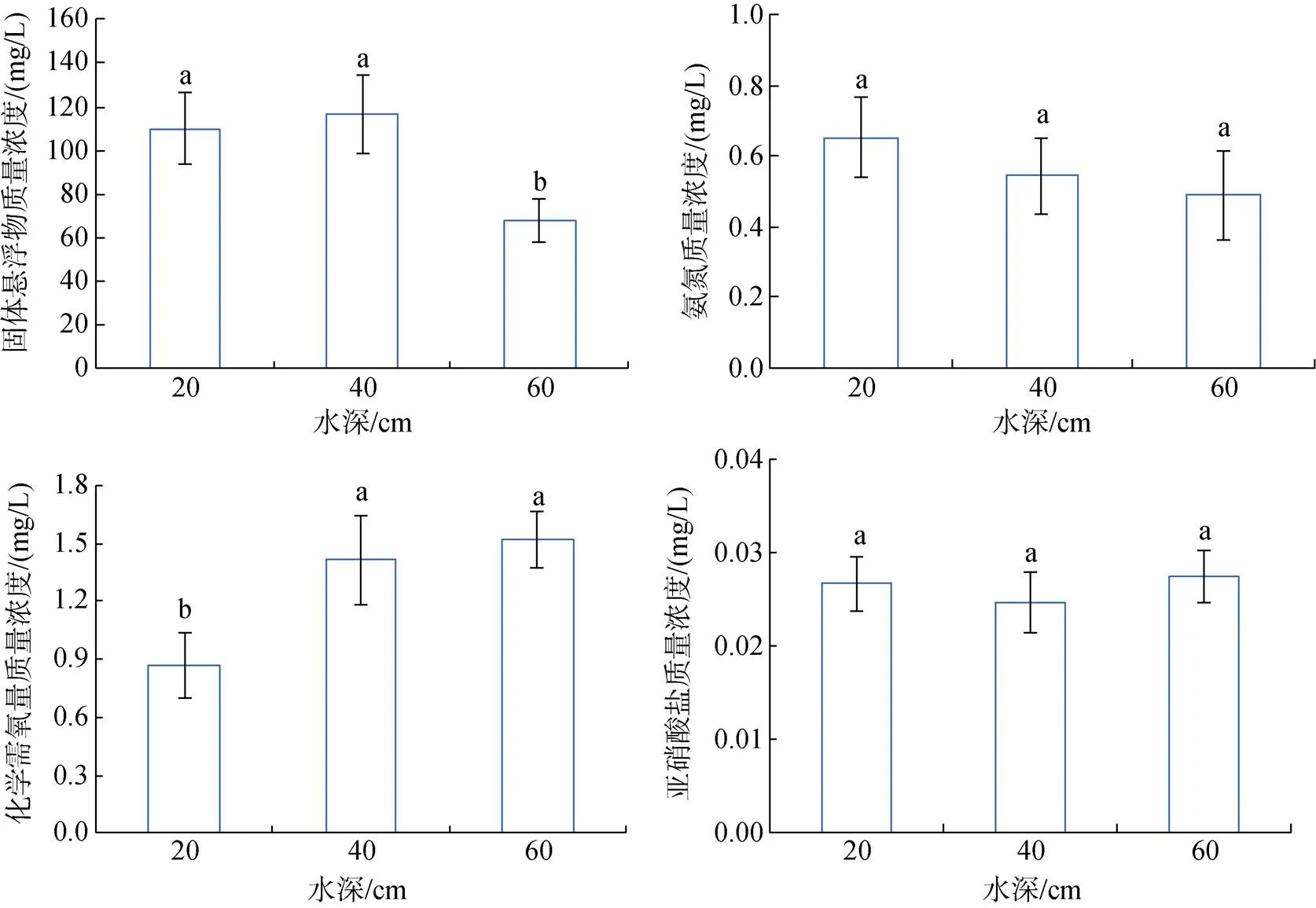
图2 水深对水质的影响
注: 相同字母表示组间差异不显著(>0.05), 不同字母表示组间差异显著(0.05), 图7、图8同
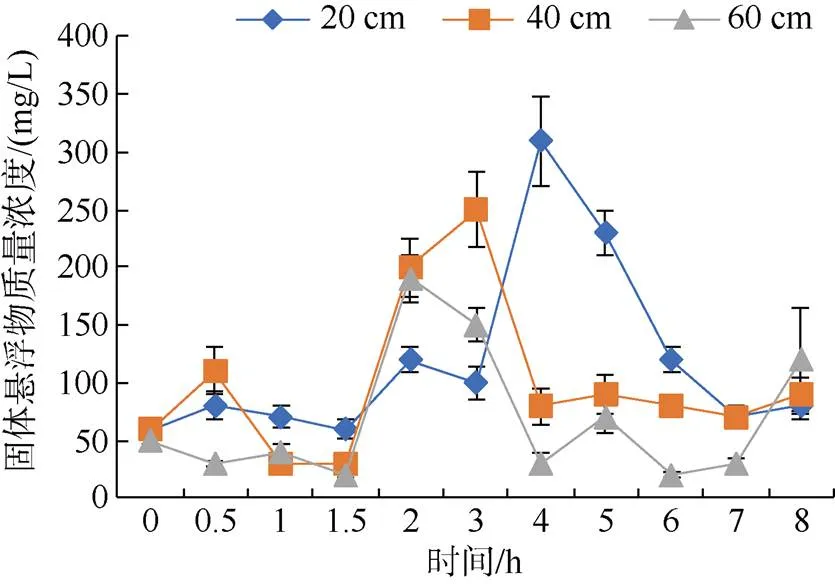
图3 不同水深投喂后固体悬浮物的变化规律
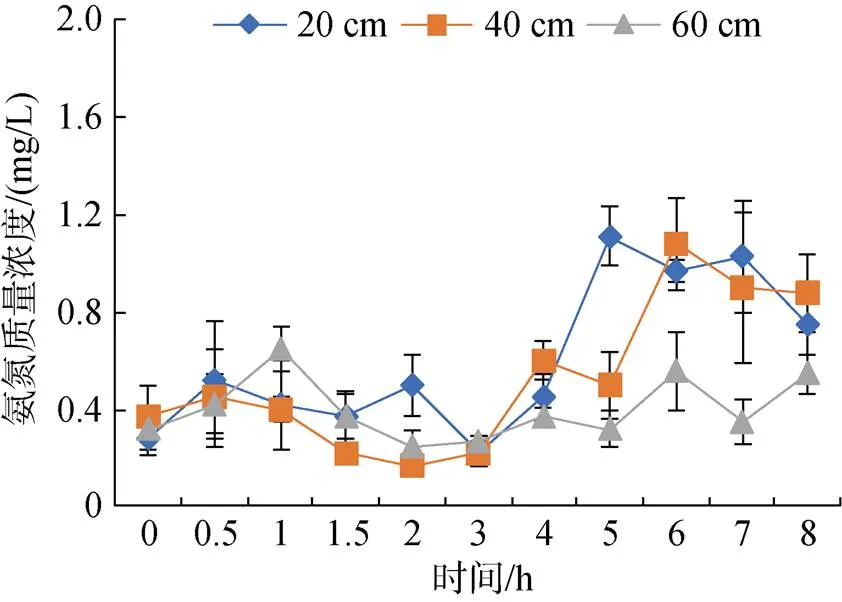
图4 不同水深投喂后氨氮的变化规律
2.3.3 不同水深投喂后亚硝酸盐的变化规律
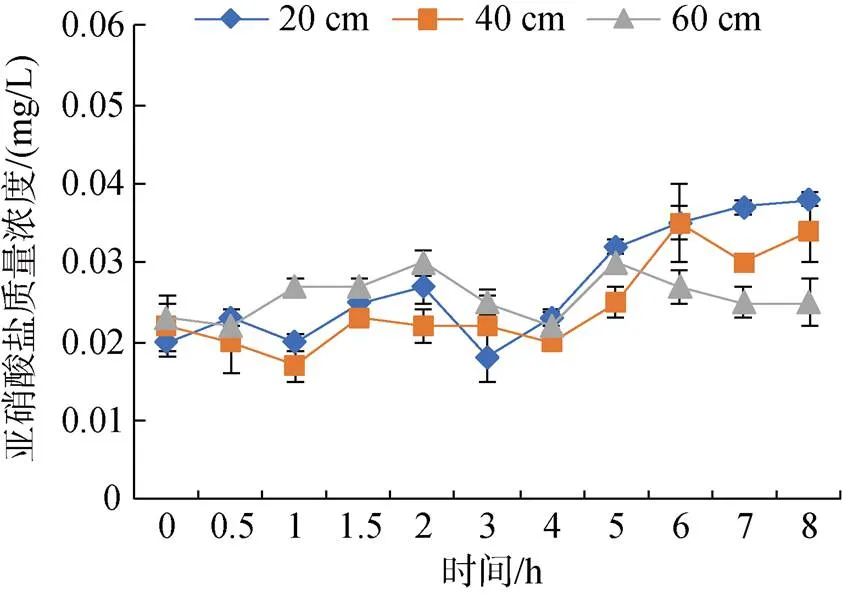
图5 不同水深投喂后亚硝酸盐的变化规律
2.3.4 不同水深投喂后COD的变化规律
由图6可见, 各水深处理组COD浓度变化具有相似的规律, 在投喂3 h内比较稳定。高水深组COD浓度在投喂后3 h开始大幅度上升, 而低水深组和中水深组在投喂后4 h开始大幅度上升。高水深组在8 h时COD最大(3.020 mg/L)。中、低水深组分别在7 h和6 h达到波峰, 在波峰处COD达到最大, 分别为3.636 mg/L和3.180 mg/L。

图6 不同水深投喂后COD的变化规律
2.4 不同水深对大菱鲆幼鱼生长的影响
大菱鲆幼鱼存活率随水深的增加而增加, 在高水深组存活率最高达到95.34%±0.73%, 但3组间存活率差异不显著。饲料系数在3个水深处理组之间没有显著性差异, 但在低水深时饲料系数最低。特定生长率和增质量率在低水深组最高, 分别为0.56%± 0.02%和56.68%±2.32%, 显著(<0.05)高于中水深组和高水深组。肥满度在中水深组最大, 其次是低水深组和高水深组。低水深组体重变异系数最大, 与中水深组没有显著性差异, 但显著(<0.05)高于高水深组(图7、图8)。
3 讨论
3.1 不同水深对水环境的影响
在实际生产过程中, 通常采用水面喷射法促进水池内水流循环, 水池内水流速度与进出水量、进出水速度、水池半径、水深、进水口离水面的距离等有关[16]。本研究控制其他变量相同, 发现水池内水流速度与水深呈负相关, 水深越深, 水流速度越慢, 这可能因为水体越深, 水的阻力越大, 不利于水体的流动和交换。CRIPPS[17]研究表明水体动力性能与水深有关, 随着水深的减少, 养殖水体利用效率提高。BURLEY[18]研究表明水深的变化导致了水箱内水体流动和混合的改变。但本实验中3个水深组之间水流速没有显著性差异, 说明在正常的养殖生产中, 水深对水流速度影响较小。大菱鲆属于底栖鱼类, 相比于游泳性鱼类, 大部分在摄食后迅速下潜到水底, 喜欢缓慢流速的环境。LI等[19]研究表明在0.06、0.18、0.36 m/s 3种水流速下, 养殖在0.18 m/s水流速下的大菱鲆幼鱼生长最好。在本研究中低水深组, 水流速为0.11 m/s最接近0.18 m/s, 而且在该处理组中, 大菱鲆增质量率和特定生长率最高, 这与LI等[19]研究成果一致。
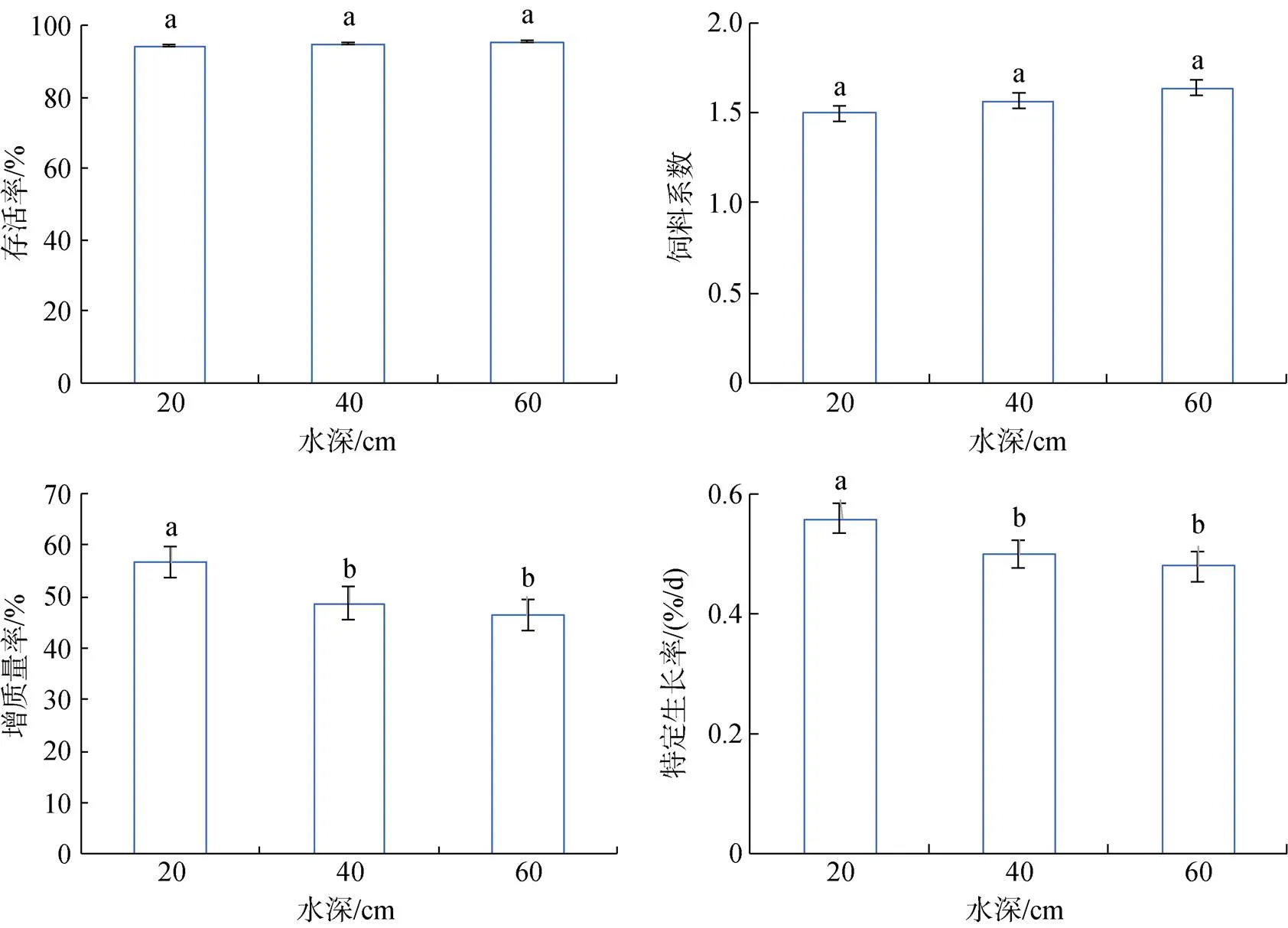
图7 不同水深大菱鲆生长状态
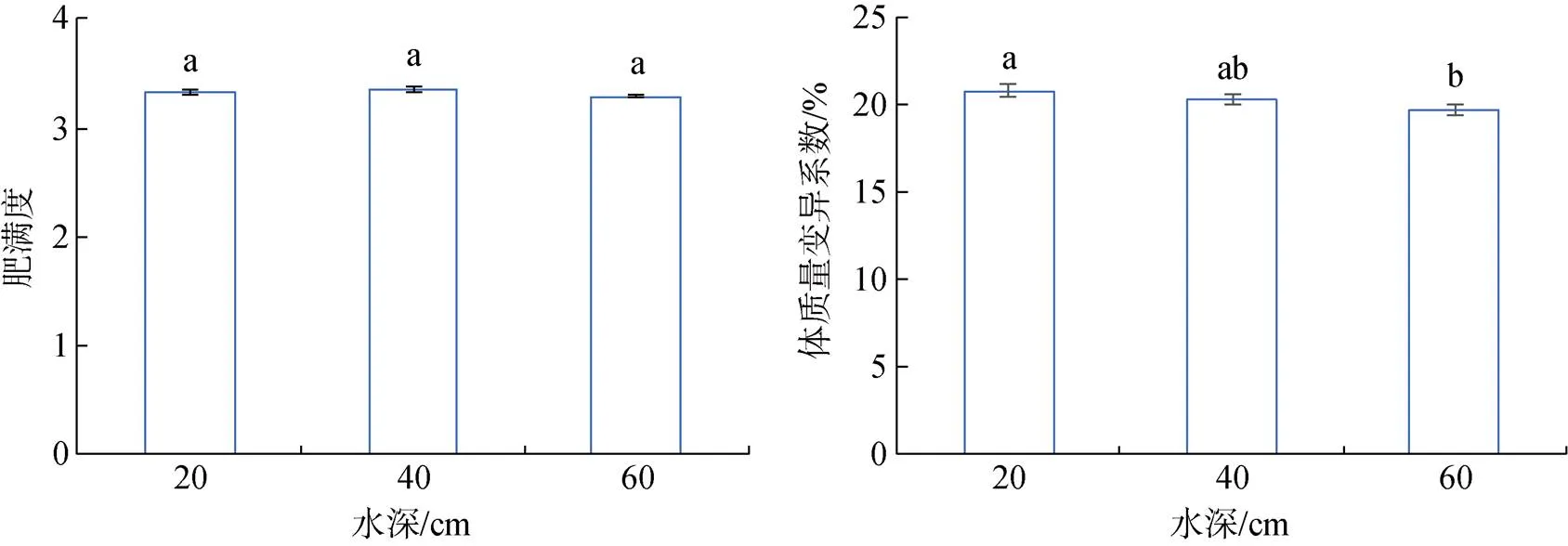
图8 不同水深大菱鲆生长表现
本研究中, 氨氮质量浓度在不同水深组中最高为0.65 mg/L, 低于大菱鲆幼鱼的安全浓度[20], 对大菱鲆幼鱼几乎没有影响。曲克明等[21]报道, 在正常溶氧条件下, 亚硝酸盐对大菱鲆的48 h LC50值和96 h LC50值分别为181.07和130.66 mg/L, 采用96 h LC50值乘以安全系数0.1作为安全浓度, 可以得到亚硝酸盐对大菱鲆的安全质量浓度为13.07 mg/L。本研究中, 3个水深组水体中亚硝酸盐浓度远低于安全浓度, 不是限制大菱鲆幼鱼生长的主要环境因素。高水深组的固体悬浮物含量显著(<0.05)低于其他两组, 说明增加水深有利于提高养殖水环境水质恶化的缓冲能力。但随着水深升高, 每日循环水量减少, 使得水体中粪便、残饵、黏液等有机质停留时间变长, 导致高水深组COD最高(1.51 mg/L)。
3.2 不同水深投喂后水质的变化规律
大菱鲆在摄食后会将代谢废物排放到水中, 导致水中的可溶性营养盐、固体悬浮物、COD等发生一些变化。养殖池中的固体悬浮物主要来源于残饵和粪便, 这些固体悬浮物既可以通过直接损害鱼鳃, 也可以通过矿化产生有害物质来影响鱼类生长[22]。本实验中, 在投喂1.5 h后, 固体悬浮物开始出现上升, 可能是养殖生物开始进行排泄。方志山[23]研究发现水体中固体悬浮物主要受到养殖对象的摄食与排泄的影响。低水深组中固体悬浮物波动最大, 可能因为较小蓄水水体缓冲能力较弱, 随着集中排泄和水体交换的进行, 出现大幅度升降。氨氮是摄食后排泄的主要含氮化合物[24], 当养殖环境中氨氮浓度较高, 会导致鱼类肠道消化吸收性能下降[25]、先天性免疫受抑制[26]、组织器官损伤[27]等症状。在本实验过程中, 3种水深处理组大菱鲆在投喂结束后, 氨氮排泄在3~8 h出现峰值, 这与唐贤明等[28]报道的3~9 h以及FANG等[29]对鳜鱼()研究结果4~8 h相近。鱼的代谢具有较大的波动性, 受到很多环境因子的影响比如水硬度、水流速、温度等[30-32]。在本实验中, 低水深组氨氮排泄较高, 可能在低水深处理组中大菱鲆代谢率比较高。亚硝酸盐含量在投喂后基本保持稳定, 亚硝酸盐是细菌硝化作用的中间产物, 亚硝化细菌首先在有氧的条件下将氨氮氧化成亚硝酸盐, 亚硝酸盐再被硝化细菌利用变成硝酸盐[33]。在投喂后, 氨氮还未转化成亚硝酸盐就随水流排出, 水体中亚硝酸盐含量基本取决于原水。高浓度的亚硝酸盐会对生物体产生危害[34], 因此在流水系统中良好的水源是非常有必要的。COD作为一个重要的水质指标, 可根据其含量来衡量水体中有机物的浓度。有机物本身对养殖生物并无影响, 但它既可以滋养大量的生物病菌, 又可以通过分解消耗氧气并产生有害气体, 对养殖生物造成不利的影响[35]。不同深度组水体中COD浓度变化具有相同的趋势, 即随着投喂后时间的增加, 水体中COD浓度逐渐升高, 说明在大菱鲆集中排泄后, COD会出现短暂的积累。张延青等[36]研究发现, 不同规格皱纹盘鲍()在摄食后, 各规格组COD都会随着时间延长而不断升高, 这与本研究结果一致。
3.3 不同水深对大菱鲆生长的影响
在养殖生产过程中, 养殖生物的生长性能是衡量养殖成功与否的重要依据, 而饲料利用率低、生长慢是大菱鲆实际生产过程中常见的问题。在不同水深组中, 大菱鲆的存活率、肥满度、饲料系数相似, 水深对这些参数没有显著的影响。但低水深组中大菱鲆体质量变异系数显著(<0.05)高于高水深组, 这表明在大生产环境条件下, 水深的变化不会影响大菱鲆的摄食, 但会影响大菱鲆的摄食模式。这可能是由于水深过浅, 导致饵料下沉时间短, 大菱鲆抢食造成的摄食不均匀。在低水深组中, 大菱鲆特定生长率和增质量率最高, 且显著高于中、高水深组。这可能是因为低水深可以使大菱鲆更直观地定位饲料, 降低了饲料损失量。其次, 高水深组由于水体交换量少, 导致悬浮物和有机质在养殖水体中停留时间过长, 造成COD积累过高。我们推测, 较高的COD也会影响大菱鲆的生长。ABDEL-HAY等[37]研究表明在0.5 m池塘养殖的非洲鲶鱼()比在1.5 m池塘养殖的鱼生长得更快。KRUMMENAUER等[38]研究表明在生物絮团技术(biofloc technology, BFT)系统中将南美白对虾()池水深减少到0.4 m可以提高生产率, 降低用水量, 这与本研究结果一致。然而, 有很多研究认为过低的水位对大多数鱼类来说是一个公认的压力源[39-40]。GUN等[41]研究表明将螃蟹()放在水面下70 cm深的地方比放置在水面下30 cm或者水表面生长得更快。HARIANTO[42]等研究发现1.50~3.72 cm水深对双色鳗鲡()生产性能参数无显著影响, 就水利用效率而言, 低水位更加适合双色鳗鲡养殖。因此, 在养殖生产过程中, 水深与养殖物种、养殖密度、养殖设施有关, 需要根据实际养殖情况进行养殖条件优化。
4 结论
在工厂化流水养殖中, 高水深条件下水质缓冲能力明显优于中、低水深组。特别是在投喂后水质快速变化期内尤其明显。而在长期监测过程中, 各组水体中氨氮、亚硝酸盐在大菱鲆幼鱼安全浓度范围内, 无明显差异。高水深虽然对水质浓度缓冲能力大, 但其交换量少, 导致悬浮物和有机质在养殖水体中停留时间长, 造成COD积累。低水深组大菱鲆的特定生长率、增质量率、体质量变异系数显著高于高水深组, 而存活率、肥满度、饲料系数在各组之间没有显著差异。综上所述, 原水水质稳定条件下, 大菱鲆工厂化流水养殖采用低水深养殖可随着日循环水量的增加, 长期稳定养殖水环境, 促使大菱鲆生长加快, 获得更大的养殖生物量。
[1] ZHANG H G, JIANG N, ZHANG Y L, et al. Effects of tank diameter and water depth on growth performance, antioxidant capacity and immune response of Chinese sturgeonin recirculating aquaculture system[J]. Journal of Applied Ichthyology, 2021, 38(1): 84-92.
[2] JIANG S H, DONG S L, GAO Q F, et al. Effects of water depth and substrate color on the growth and body color of the red sea cucumber,[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(3): 616-623.
[3] KAPUTE F. Growth performance of three tilapia fish species raised at varied pond sizes and water depths[J]. International Journal of Fisheries and Aquaculture, 2016, 8(8): 81-86.
[4] 米娜莎, 王栋. 中国大菱鲆产业现状及发展趋势分析[J]. 海洋科学, 2011, 35(6): 96-99. MI Nasha, WANG Dong. Status of turbot industry and its development trend in China[J]. Marine Sciences, 2011, 35(6): 96-99.
[5] 王卓铎, 张海涛, 孙广文, 等. 大菱鲆对蛋白质与氨基酸的需求研究进展[J]. 广东饲料, 2021, 30(1): 38-44.WANG Zhuoduo, ZHANG Haitao, SUN Guangwen, et al. Research progress on protein and amino acid requirements of turbot[J]. Guangdong Feed, 2021, 30(1): 38-44.
[6] 关长涛, 杨正勇, 王启要, 等. 大菱鲆产业发展报告[J]. 中国水产, 2021, 1: 22-35. GUAN Changtao, YANG Zhengyong, WANG Qiyao, et al. Turbot industry development report[J]. China Fisheries, 2021, 1: 22-35.
[7] 牛化欣, 常杰, 贾玉东, 等. 大菱鲆养殖成本控制技术[J]. 水产科技情报, 2015, 42(2): 81-83, 87. NIU Huaxin, CHANG Jie, JIA Yudong, et al. Cost control technology for turbot farming[J]. Fisheries Science & Technology Information, 2015, 42(2): 81-83, 87.
[8] 张宝龙, 赵子续, 曲木, 等. 工厂化水产养殖现状分析[J]. 养殖与饲料, 2020, 1: 31-34. ZHANG Baolong, ZHAO Zixu, QU Mu, et al. Analysis of the current situation of factory aquaculture[J]. Animals Breeding and Feed, 2020, 1: 31-34.
[9] 仇登高, 郑乐云, 黄种持, 等. 投喂频率对流水养殖鞍带石斑鱼生长、摄食及免疫酶活力的影响[J]. 西南大学学报(自然科学版), 2018, 40(7): 51-57. QIU Denggao, ZHENG Leyun, HUANG Zhongchi, et al. The effect of feeding frequency on growth performance, food intake and immune enzyme activities ofin flowing water cultivation[J]. Journal of Southwest University (Natural Science Edition), 2018, 40(7): 51-57.
[10] 宋志飞, 温海深, 李吉方, 等. 养殖密度对流水养殖系统中俄罗斯鲟幼鱼生长的影响[J]. 水产学报, 2014, 38(6): 835-842. SONG Zhifei, WEN Haishen, LI Jifang, et al. The influence of stocking density on the growth performance of juvenile Russian sturgeon () in flowing water cultivation[J]. Journal of Fisheries of China, 2014, 38(6): 835-842.
[11] ZHENG J B, MAO Y, SU Y Q, et al. Effects of stocking density on the survival, growth and physical injury ofjuveniles in a flowing water aquaculture system[J]. Aquaculture Research, 2020, 51(4): 1500-1506.
[12] 闫修花, 王桂珍, 陈迪军. 纳氏试剂比色法直接测定海水中的氨氮[J]. 中国环境监测, 2003, 6: 8-10.YAN Xiuhua, WANG Guizhen, CHEN Dijun. To determine NH4+-N directly in sea-water using nessler 's reagent-colorimetry[J]. Environmental Monitoring in China, 2003, 6: 8-10.
[13] GB 17378.4-2007, 海洋监测规范第4部分: 海水分析[S]. 中国: 中华人民共和国国家质量监督检验检疫总局, 2007: 113-114. GB 17378.4-2007, The specification for marine monitoring. Part 4: Seawater analysis[S]. China: General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, 2007: 113-114.
[14] GB/T 11901-1989, 水质悬浮物的测定重量法[S]. 中国: 国家技术监督局, 1989: 1-4. GB/T 11901-1989, Water quality--Determination of suspended substance--Gravimetric method[S]. China: The State Bureau of Quality and Technical Supervision, 1989: 1-4.
[15] 孙西艳, 付龙文, 刘永亮, 等. 海水化学需氧量的分析方法与监测技术[J]. 中国科学: 化学, 2022, 52(1): 71-88.SUN Xiyan, FU Longwen, LIU Yongliang, et al. Analysis method and monitoring technology for chemical oxygen demand in seawater[J]. Scientia Sinica (Chimica), 2022, 52(1): 71-88.
[16] OCA J, MASALO I. Flow pattern in aquaculture circular tanks: Influence of flow rate, water depth, and water inlet & outlet features[J]. Aquacultural Engineering, 2013, 52: 65-72.
[17] CRIPPS S J, POXTON M G. A method for the quantification and optimization of hydrodynamics in culture tanks[J]. Aquaculture International, 1994, 1(1): 55-71.
[18] BURLEY R, KLAPSIS A. Flow distribution studies in fish rearing tanks. Part 2-Analysis of hydraulic performance of 1 m square tanks[J]. Aquacultural Engineering, 1985, 4: 113-134.
[19] LI X, JI L Q, WU L L, et al. Effect of flow velocity on the growth, stress and immune responses of turbot () in recirculating aquaculture systems[J]. Fish and Shellfish Immunology, 2018, 86(C): 1169-1176.
[20] 孟振, 张鸿丽, 刘新富, 等. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应[J]. 渔业科学进展, 2020, 41(2): 51-60.MENG Zhen, ZHANG Hongli, LIU Xinfu, et al. Toxic effects of acute ammonia stress on young turbot[J]. Progress in Fishery Sciences, 2020, 41(2): 51-60.
[21] 曲克明, 徐勇, 马绍赛, 等. 不同溶解氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应[J]. 海洋水产研究, 2007, 4: 83-88. QU Keming, XU Yong, MA Shaosai, et al. Acute toxic effects of nitrite and non ion ammonia on turbot () at different DO levels[J]. Progress in Fishery Sciences, 2007, 4: 83-88.
[22] 段姗杉, 杨晨, 宋协法, 等. 循环水养殖系统微细悬浮颗粒的分布规律研究[J]. 渔业现代化, 2021, 48(2): 22-28. DUAN Shanshan, YANG Chen, SONG Xiefa, et al. Distribution of suspended fine particles in recirculating aquaculture system[J]. Fishery Modernization, 2021, 48(2): 22-28.
[23] 方志山. 综合水产养殖池悬浮颗粒物的动态变化研究[J]. 厦门大学学报(自然科学版), 2007, 1: 131-134. FANG Zhishan. Dynamic variation of total particular matter in poly-culture pond[J]. Journal of Xiamen University (Natural Science), 2007, 1: 131-134.
[24] 麻艳群, 曲照球, 司楠, 等. 温度对斑点叉尾鮰幼鱼耗氧率和氨氮排泄率的影响[J]. 水产养殖, 2021, 42(4): 31-35.MA Yanqun, QU Zhaoqiu, SI Nan, et al. Effect of temperature onoxygen consumption rate and ammonia excretion rate of juvenile[J]. Journal of Aquaculture, 2021, 42(4): 31-35.
[25] CAO S P, ZHAO D F, HUANG R, et al. The influence of acute ammonia stress on intestinal oxidative stress, histology, digestive enzymatic activities and PepT1 activity of grass carp ()[J]. Aquaculture Reports, 2021, 20: 100722.
[26] GUO H H, CHEN S Q, OUYANG K, et al. Evaluation of ammonia nitrogen exposure in immune defenses present on spleen and head-kidney of Wuchang Bream ()[J]. International Journal of Molecular Sciences, 2022, 23(6): 3129-3129.
[27] 吴利敏, 徐瑜凤, 李永婧, 等. 急性氨氮胁迫对淇河鲫幼鱼脑、鳃、肝、肾组织结构的影响[J]. 中国水产科学, 2020, 27(7): 789-800. WU Limin, XU Yufeng, LI Yongjing, et al. Effects of acute ammonia nitrogen exposure on brain, gill, liver, and kidney histology of Qi River crucian carp ()[J]. Journal of Fishery Sciences of China, 2020, 27(7): 789-800.
[28] 唐贤明, 田景波, 潘鲁青, 等. 大菱鲆正常代谢水平及节律性的研究[J]. 海洋水产研究, 2003, 4: 7-12. TANG Xianming, TIAN Jingbo, PAN Luqing, et al. Study on daily metabolic level and rhythm of turbot[J]. Progress in Fishery Sciences, 2003, 4: 7-12.
[29] FANG L, BAI X L, LIANG X F, et al. Ammonia nitrogen excretion in Mandarin Fish (and Grass Carp () fed practical diets: the effects of water temperature[J]. Aquaculture Research, 2017, 48(3): 836-843.
[30] ROMANO N, EGNEW N, QUINTERO H, et al. The effects of water hardness on the growth, metabolic indicators and stress resistance of largemouth bass[J]. Aquaculture, 2020, 527(C): 735469.
[31] 王晓晨, 孙国祥, 李勇, 等. 循环水养殖条件下水温对大菱鲆氨氮排泄、转氨酶及免疫因子的影响[J]. 渔业现代化, 2014, 41(6): 1-7. WANG Xiaochen, SUN Guoxiang, LI Yong, et al. Effects of water temperature on the nitrogenous excretion, transaminase and immune factors of turbot () in recirculating aquaculture system[J]. Fishery Modernization, 2014, 41(6): 1-7.
[32] LI X M, ZHANG Y G, LI X J, et al. Sustained exercise- trained juvenile black carp () at a moderate water velocity exhibit improved aerobic swimming performance and increased postprandial metabolic responses[J]. Biology Open, 2018, 7(2): bio032425.
[33] CIJI A, AKHTAR M S. Nitrite implications and its management strategies in aquaculture: a review[J]. Reviews in Aquaculture, 2020, 12(2): 878-908.
[34] 薛静怡, 宗雅丽, 侯玉, 等. 水产养殖中亚硝酸盐毒性影响及处理的研究进展[J]. 渔业研究, 2017, 39(4): 320-324.XUE Jingyi, ZONG Yali, HOU Yu, et al. Research progress on toxicity and treatment of nitrite in aquaculture[J]. Journal of Fisheries Research, 2017, 39(4): 320- 324.
[35] 刘慧玲, 黄翔鹄, 李长玲, 等. 不同浓度的枯草芽孢杆菌对罗非鱼鱼苗的养殖水体水质及其抗病力的影响[J]. 水产养殖, 2009, 30(10): 5-9.LIU Huiling, HUANG Xianghu, LI Changling, et al. Effect of different concentrations ofon water quality and disease resistence of Tilapia fry[J]. Journal of Aquaculture, 2009, 30(10): 5-9.
[36] 张延青, 李文亚, 高霄龙, 等. 皱纹盘鲍排氨率变化特征及代谢产物对水质的影响研究[J]. 海洋科学, 2017, 41(7): 23-30. ZHANG Yanqing, LI Wenya, GAO Xiaolong, et al. Ammonia excretion rate ofand effects of metabolite on water quality[J]. Marine Sciences, 2017, 41(7): 23-30.
[37] ABDEL‐HAY A H M, EMAM W, OMAR A A, et al. The effects of rearing water depths and feed types on the growth performance of African catfish ()[J]. Aquaculture Research, 2020, 51(2): 616-622.
[38] KRUMMENAUER D, POERSCH L H, FÓES G, et al. Survival and growth ofreared in Bft System under different water depths[J]. Aquaculture, 2016, 465: 94-99.
[39] FRISCH A J, ANDERSON T A. The response of coral trout () to capture, handling and transport and shallow water stress[J]. Fish Physiology and Biochemistry, 2000, 23(1): 23-24.
[40] EINARSDÓTTIR I E, NILSSEN K J. Stress responses of Atlantic salmon (L.) elicited by water level reduction in rearing tanks[J]. Fish Physiology and Biochemistry, 1996, 15(5): 395-400.
[41] GUN G, SULAEMAN S, HERLINAH H. The effect of limb-removing and placement-depth on the growth rate of mud crab juvenile,[J]. IOP Conference Series: Earth and Environmental Science, 2020, 521(1): 012027.
[42] HARIANTO E, SUPRIYONO E, BUDIARDI T, et al. The effect of water level in vertical aquaculture systems on production performance, biochemistry, hematology, and histology of[J]. Scientific Reports, 2021, 11(1): 1-13.
Effect of water depth on the growth of turbot () in factory flow-through aquaculture
LI Ji-yuan1, 2, 3, 4, GUO Teng5, XU Shi-hong1, 2, 3, WU Le-le6, YU Jia-chen7, WANG Yan-feng1, 2, 3, LI Jun1, 2, 3
(1. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao Laboratory for Marine Biology and Biotechnology, Qingdao 266237, China; 3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China; 5. College of Life Sciences, Qingdao Agricultural University, Qingdao 266109, China; 6. Fisheries College, Ocean University of China, Qingdao 266003, China; 7. School of Marine Science and Fisheries, Jiangsu Ocean University, Lianyungang 222005, China)
To explore the effect of water depth on the water environment of factory flow-through aquaculture, 9 000 turbot with an initial collective body mass of 141.62±24.47 g were divided into three different culture depth groups according to the low (20 cm), medium (40 cm), and high (60 cm) water depths. The three water depth groups of turbot were subjected to an 80-day experiment involving periodic tracking and detection of total ammonia nitrogen (TAN), nitrite (NO2–-N), suspended solids (SS), and chemical oxygen demand (COD). The substances in the aquaculture pool were measured for a long period and a specific period (within 8 h after feeding); the survival rate, body weight, and feed conversion ratio level of the turbot were also measured, but only once, which was at the end of the experiment. The study showed that the water flow rate in the pool was negatively correlated with water depth, but the difference between the groups was insignificant. The high water depth group had significantly (0.05) lower solids in suspension than the other two groups, while the low water depth group had significantly (0.05) lower COD than the other two groups. There was no significant difference in the levels of TAN and NO2–-N in all water depth groups, which were within the safe concentration range for turbot juveniles. After the feeding time, the suspended solid contents in each water depth group showed a tendency to rise first and then decrease, with the greatest fluctuation seen in the low water depth group. The TAN content started to increase 3 h after feeding the turbot, with the greatest increase also recorded in the low water depth group. With the prolongation of feeding time, COD gradually accumulated in each water depth group while the NO2–-N content remained unchanged. At the end of the experiment, the weight gain rate, specific growth rate, and coefficient of variation of body weight of turbot in the low water depth group were found to be significantly (0.05) higher than those in the high water depth group while the survival rate, condition factor, and feed conversion ratio were not significantly different among the groups. The results of the study showed that increasing the water depth was beneficial to improving the buffering capacity of water quality deterioration in the aquaculture environment. Under the premise of ensuring the safety of water quality indexes in the culture system, low water depth is a feasible solution in turbot factory flow-through aquaculture.
; growth; water quality; water depth; factory flow-through aquaculture
Oct. 23, 2022
S967
A
1000-3096(2023)6-0060-10
10.11759/hykx20221023002
2022-10-23;
2022-12-19
中国农业科研系统项目(CARS-47-G21); 山东省重大科技创新工程项目(2019JZZY020710)
[China Agriculture Research System, No. CARS-47-G21; Shandong Province Major Science and Technology Innovation Project, No. 2019JZZY020710]
李纪元(1999—), 男, 湖北钟祥人, 硕士研究生, 主要从事海水鱼养殖水环境调控研究, E-mail: lijiyuan991230@163.com; 李军(1964—),通信作者, 男, 山东青岛人, 博士, 主要从事鱼类繁殖与发育调控技术, E-mail: junli@qdio.ac.cn; 王彦丰(1983—), 通信作者, 男, 山东莱阳人, 博士, 主要从事养殖水环境调控研究, E-mail: yanfengwang@ qdio.ac.cn
(本文编辑: 谭雪静)

