多尺度蛋白质-多糖基益生菌递送体系研究进展
余帅朋,崔 玥,王 琳,2,李 达,蒲晓璐,
(1.河北科技大学食品与生物学院,河北石家庄 050018;2.君乐宝乳业集团,河北石家庄 050221)
益生菌(probiotics)是一类对宿主有益的活性微生物。当达到足够数量时,益生菌可以通过调节宿主黏膜与系统免疫功能或调节肠道内菌群平衡,对宿主发挥健康作用[1]。常用于食品中的益生菌主要从发酵食品或粪便微生物菌群中分离筛选而来[2],包括了双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、乳球菌属(Lactococcus)、芽孢杆菌属(Bacillus)、酵母菌属(Saccharomyces)等(图1)。益生菌必须能够顺利到达肠道内且有足够活菌量(通常应达到至少106CFU/g 以上)才能达到有效递送效果,发挥其益生作用[3]。然而,大多数益生菌对加工和储存过程中酸、氧气、热、光照、水分活度等外部环境条件[4-5],以及对人体消化道环境中的胃酸、消化酶和胆盐[6]抵抗力差,致使活菌量大幅度降低,益生作用失效[7]。
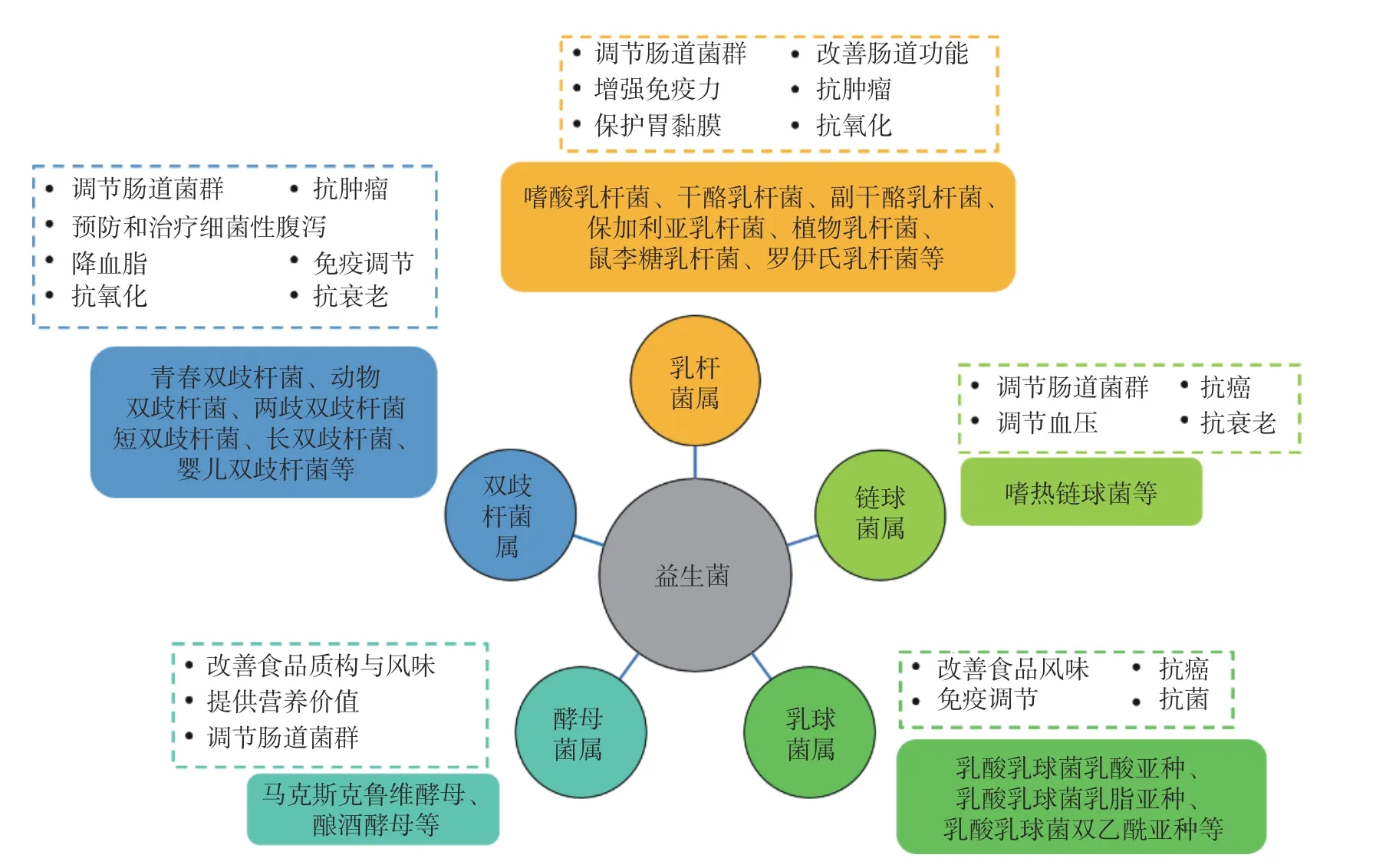
图1 食品中常用的益生菌种类及其益生作用[8-9]Fig.1 Probiotics species widely used in food and their health benefits[8-9]
为了提高益生菌对不良环境的抵抗力和存活率,建立有效的活性益生菌递送体系是最为有效的方法之一。蛋白质和多糖是具有健康、安全、生物兼容性、生物可降解性等特性,常用于制备食品递送体系的天然生物聚合物。在特定的加工技术条件下,利用蛋白质和多糖之间的相互作用可以组装形成多尺度结构的蛋白质-多糖基益生菌递送体系,并设计出实现靶向传输目的的功能性食品,其原因主要有三:第一,蛋白质-多糖的结合使用可以协同形成更稳定、更致密、更高机械强度的凝胶网状结构[10],并互补单一生物聚合物的缺点,比如蛋白质颗粒易聚集、多糖通常乳化性较差等[11],从而提高递送体系对酸、离子强度、热等加工过程和贮存环境因素的稳定性,避免其失稳分解并释放出被包埋的益生菌;第二,复合材料的双重消化优势得以发挥,例如,蛋白质在消化过程中起到缓冲作用,阻隔了酶对益生菌的损害,而多糖为益生菌提供了物理屏障,保护它们免受酸和胆汁的侵害[12],且蛋白酶对蛋白质的水解位点可因蛋白质-多糖相互作用而大量降低[13],保证了益生菌能抵抗胃肠消化环境;第三,复合运载体系可被设计成在胃和小肠的强酸性或弱酸性条件下释放受到抑制、在结肠的弱碱性条件下释放受到促进的pH 敏感性运载体系,或通过结肠内微生物分泌出的酶(还原酶、糖苷酶等)使其降解[14],从而实现在结肠中控制和持续释放益生菌的目的。本文主要对蛋白质-多糖基活性益生菌递送体系的形成机制、常见多尺度结构及在食品中的最新研究应用进展进行论述。
1 蛋白质-多糖复合体系的形成机制
蛋白质-多糖复合体系的构建是基于这两种生物聚合物的相互作用形成的。不同来源的蛋白质和多糖可以通过静电相互作用、疏水作用、氢键、范德华力等物理方式形成非共价结合,也可以通过美拉德反应、酶促交联、化学交联等化学方式形成共价结合(图2)[15]。
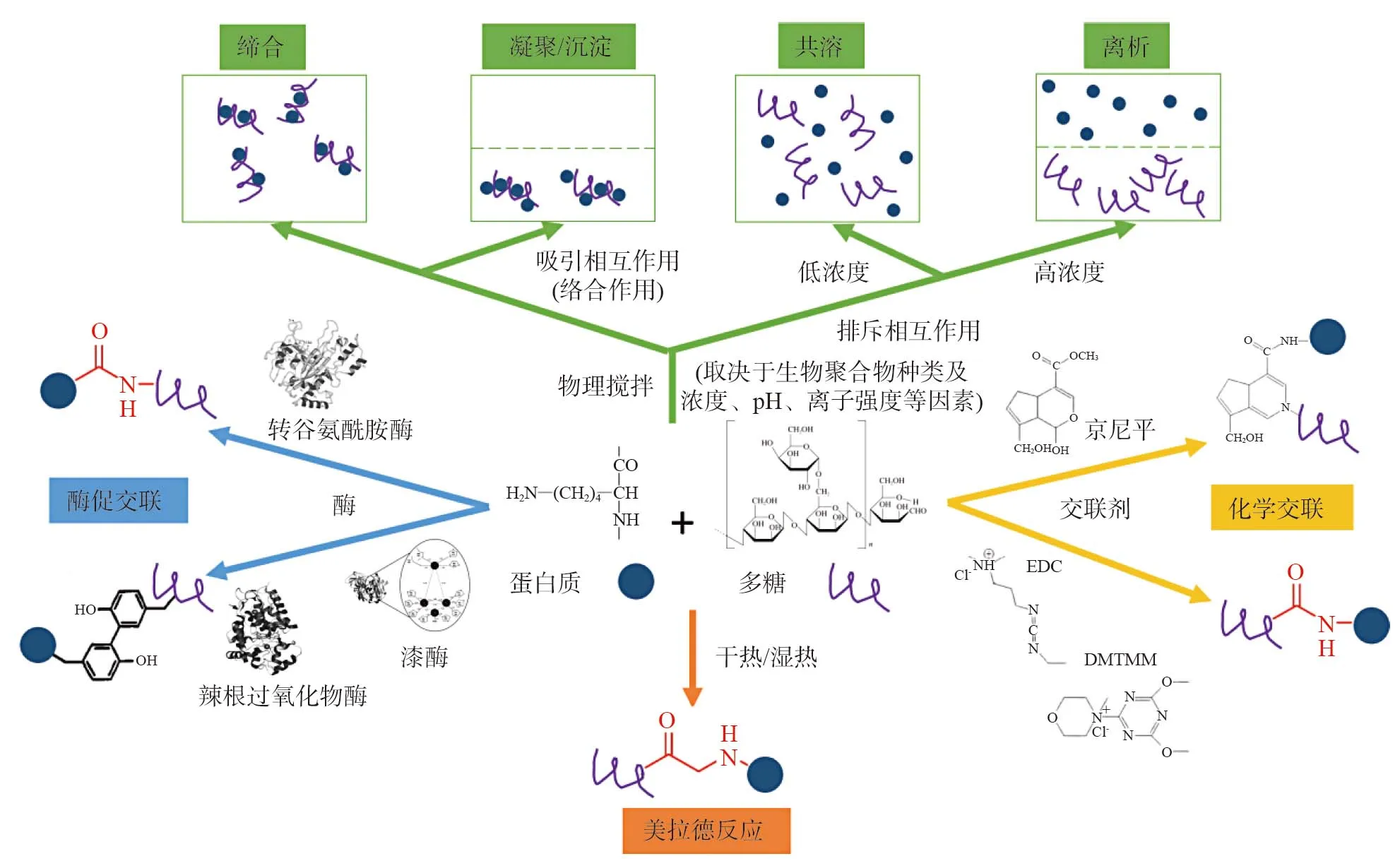
图2 蛋白质-多糖相互作用示意图[15]Fig.2 Schematical illustration of protein-polysaccharide interaction[15]
1.1 非共价结合
由于蛋白质和带负电荷的多糖溶液主要以带电形式存在,蛋白-多糖非共价的结合作用主要由静电相互作用引起[11-16]:a. 反应体系pH 小于蛋白质等电点时,带正电的蛋白质分子会与带负电的多糖分子发生强烈的静电吸附作用,从而产生强静电复合物并形成均相;但随着体系自由能的降低,静电复合物可进一步聚集,导致出现相分离、凝聚、或沉淀;b. 当反应体系pH 大于等电点时,带负电的蛋白质分子会与带负电的多糖分子发生弱相互作用,产生弱可逆复合物,导致形成两相溶液,或在足够低的浓度下,蛋白质和多糖以单个分子存在形成单相溶液,最终表现为共溶状态(图2)。其他非共价相互作用,包括氢键、范德华力、疏水相互作用等物理方式,在一定条件下有助于蛋白质与多糖形成更强的络合[17]:比如当反应体系pH 大于等电点时,蛋白质和多糖具有相似的电荷,可能会发生氢键结合;而范德华力可能发生在相近粒子彼此适当靠近,出现引力增大;加热可以使蛋白质和多糖的构象发生改变,疏水结构暴露并接触形成相互作用[18]。
1.2 共价结合
美拉德反应是制备蛋白质-多糖共价结合物的常用化学反应[19],是蛋白质分子中氨基酸侧链的氨基与多糖还原性末端的羰基之间缩合形成Schiff 碱化合物、共价键交联的过程[20](图2)。该反应能实现蛋白质和带中性电荷多糖(比如葡聚糖和淀粉)的共价交联[21-22]。相对于单一天然生物聚合物和蛋白质-多糖静电复合物,通过美拉德反应形成的蛋白质-多糖共价复合物的多种功能性均得到提高,包括乳化性、起泡性、溶解性和热稳定性等[23-25],同时蛋白质-多糖基乳液的功能性质也得到改善,比如形成更小的分散液滴粒径、更大的净ζ 电位、更好的稳定性[26]及在较低pH 和热处理条件下的稳定性[27]。但在反应时间、反应温度等条件控制不好的情况下,美拉德反应产生的具有诱变性、致癌性和细胞毒性的化合物会导致潜在的安全问题[28]。通过控制相对温和的反应条件、添加抗氧化剂等方式可为形成安全、健康的美拉德反应蛋白质-多糖产物提供更好的途径[29]。
蛋白质-多糖酶促交联反应主要通过转谷氨酰胺酶、过氧化物酶(比如辣根过氧化物酶)、多酚氧化酶(比如漆酶)等实现[30]。转谷氨酰胺酶通过催化蛋白质多肽链中的酰基供体和氨基糖上的伯氨基发生酰基转移反应,从而将具有伯胺基的糖分子导入到蛋白质分子中形成糖基化蛋白,而过氧化物酶和多酚氧化酶可以催化多糖中的阿魏酰残基与蛋白质的酪氨酸残基交联[17](图2)。酶促交联蛋白质-多糖复合物不仅比单一天然生物聚合物具有更高的乳化性和对盐、低pH、加热和冻融处理等环境应力的抵抗力[31],而且相比美拉德反应或静电结合物,其制备的乳液对酸性条件具有更高的抵抗力[32]。
蛋白质-多糖的化学交联主要通过戊二醛、京尼平、1-乙基-3-(3-二甲胺丙基)碳二亚胺(EDC)、4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐(DMTMM)等交联剂形成[33]。其中植物基天然来源、无毒、易溶于水的京尼平是对蛋白质氨基和多糖氨基进行交联[34],而EDC 和DMTMM 可促进蛋白质氨基和多糖羧基结合形成酰胺键,且自身不会成为交联物的一部分,转化为小分子副产物后能通过渗析等方法去除[35](图2)。但经研究表明,交联位点对蛋白-多糖共价结合物的界面性能有较大影响,基于蛋白质氨基与多糖羰基结合的美拉德交联结合物的乳化性优于蛋白质氨基与多糖氨基结合的京尼平化学交联结合物[36]。
2 用于益生菌递送的多尺度蛋白质-多糖基体系
蛋白质-多糖复合体系的常用制备方法主要包括自上而下和自下而上两种策略[37-38]:自上而下策略的本质是利用外部机械破坏力将大结构材料的尺寸减小为小颗粒,包括研磨、喷雾/冷冻干燥、挤出、乳化(高压均质、高速剪切、超声、微流控、膜乳化)等技术,适用于生产微米级或毫米级的蛋白质-多糖复合体系;自下而上策略主要是通过控制环境条件,比如生物聚合物的类型和浓度、pH、温度、离子强度等,通过分子自组装或自组织来实现较大颗粒的形成,比如包体络合、复合凝聚、液体抗溶剂沉淀、逐层沉积、静电纺丝或静电喷涂等方法,可用于制造纳米级或微米级的蛋白质-多糖复合体系。用于递送益生菌的蛋白质-多糖复合体系尺度主要包括宏观级(>1000 μm)、微米级(1~1000 μm)和纳米级(<1 μm)(表1)。
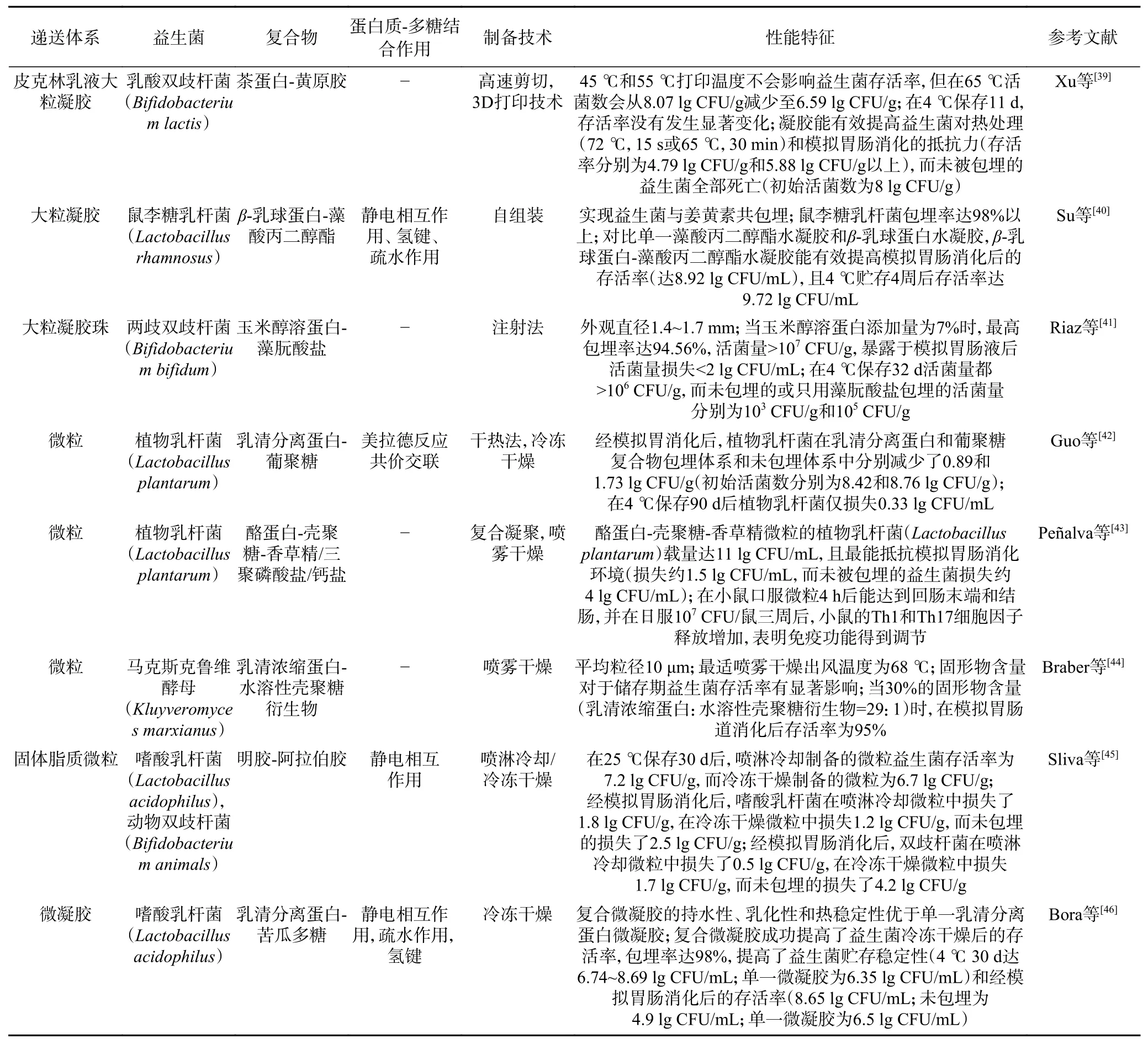
表1 蛋白质-多糖基活性益生菌递送体系结构及性能特征Table 1 Structure and property characteristics of protein-polysaccharide based viable probiotics delivery system
2.1 宏观级
2.1.1 大粒凝胶/大粒凝胶珠 水凝胶(hydrogel)是通过pH、加热、冷却、盐离子、酶促交联、高压、3D 打印等方式诱导形成、可保持大量水不溶解的生物聚合物分子三维交联网络体系[18,38,54]。其网络结构特征限制了外部环境因子(比如酶、氧气、盐等)与益生菌的接触,进而降低不良环境对益生菌的损耗。根据其粒径大小,水凝胶又可以分为大粒凝胶(macrogels)、微凝胶(microgels)、纳米凝胶(nanogels)。其中大粒凝胶已被广泛用于包埋递送益生菌[55](表1)。Yan 等[56]发现经模拟胃肠消化后,副干酪乳杆菌(Lactobacillus paracasei)在所有大豆分离蛋白-甜菜果胶酶促交联大粒凝胶中的损失仅约为1 lg CFU/mL,而未被包埋的副干酪乳杆菌全部死亡,展现出结肠靶向递送副干酪乳杆菌的效果;但副干酪乳杆菌的加入降低了水凝胶的硬度、提高了膨胀率并轻微扰乱了水凝胶的有序微观结构。
凝胶珠(hydrogel beads)是一种外观尺寸在微米级或毫米级的球形体系[57],根据尺寸又可分为大粒凝胶珠和微凝胶珠。凝胶珠可通过简单的注射法制得,比如将藻朊酸盐注入含二价阳离子(如Ca2+、Cu2+、Ba2+、Co2+)的水溶液,或将琼脂糖倒入冷水中等[58]。而蛋白质可通过非共价或共价作用与多糖进一步结合,从而改善凝胶珠的总体功效[59-60]。Ni 等[61]发现相对于单一藻朊酸盐凝胶珠,基于静电和氢键结合的藻朊酸盐-明胶基大粒凝胶珠对植物乳杆菌(Lactobacillusplantarum)的耐热性(50 ℃ 5 min)和贮存稳定性(4 ℃,6 d)分别提高了8%和15%,且可以提高植物乳杆菌对胃酸的抵抗力,并在小肠中因失去分子间氢键作用而逐渐溶解,从而达到小肠靶向释放的目的;但植物乳杆菌的负电与藻朊酸盐-明胶复合物形成的静电排斥力降低了凝胶珠的强度和硬度(图3)。
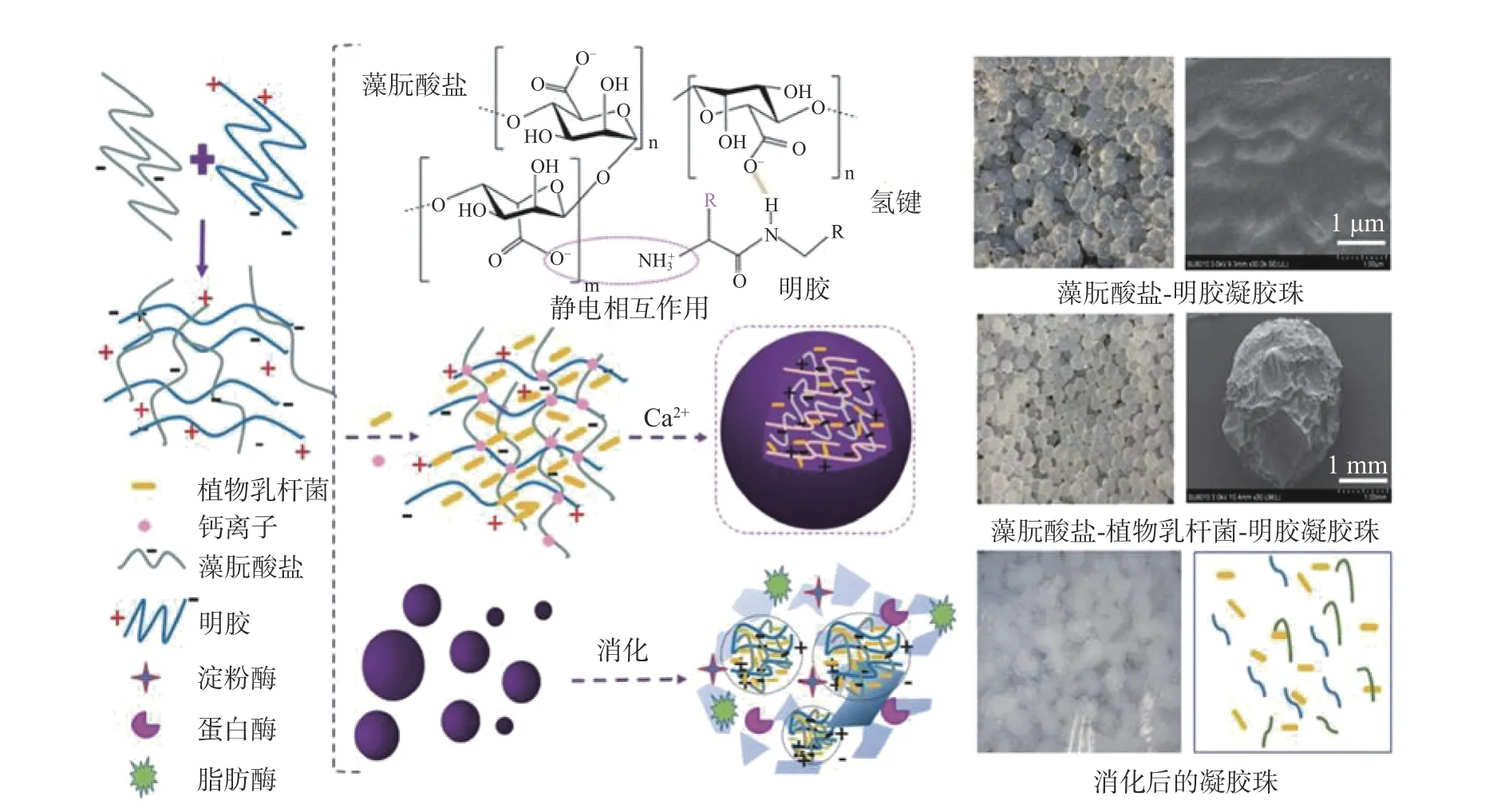
图3 基于静电和氢键相互作用介导的藻朊酸盐-明胶凝胶珠的制备及植物乳杆菌添加和消化前后结构变化[61]Fig.3 Production of electrostatically interacted and hydrogen bonding induced alginate-gelatin gel beads and the structure changes after the addition of Lactobacillus plantarum and gastrointestinal digestion[61]
综上,虽然不同结构特性的蛋白质-多糖基大粒凝胶/大粒凝胶珠通过简单的方法即可制得,且展现出优异的益生菌包封率和对环境应力的抵抗力,但尚存在一些实际应用限制:一方面益生菌的添加会对其凝胶结构和稳定性产生一定的破坏作用,另一方面通常需要通过冷冻干燥等方法以提高其稳定性、延长货架期,而益生菌在冷冻干燥过程中的存活率会下降。故更多关于蛋白质-多糖基大粒凝胶体系稳态化技术与材料的开发及其与益生菌活性保持的相关性仍有待进一步研究。
2.2 微米级
常见的微米级蛋白质-多糖基益生菌递送体系包括微粒(microparticles)、微凝胶/微凝胶珠、微乳(microemulsions)、微胶囊(microcapsules)等[37](表1,图4)。除了蛋白质-多糖复合材料自身的靶向递送特征,微粒、微乳和微胶囊壳-核结构的物理屏障作用和微凝胶网络结构的限制作用(2.1)进一步有助于实现益生菌的肠道定植。
2.2.1 微粒 相对于纳米粒子,直径为1~1000 μm的微粒具有足够空间来包埋益生菌的优势[62]。通过调节pH、温度等条件,蛋白质和多糖可通过非共价或共价结合形成具有不同结构特性的微粒。Mao 等发现美拉德反应制备的大豆分离蛋白和I-卡拉胶复合物[63]比复合凝聚法制备的复合物[64]更能提高长双歧杆菌(Bifidobacterium longum)对不利环境的抵抗力:经贮存(4 ℃,30 d)、巴氏杀菌(85 ℃,30 min)和模拟胃肠消化后,前者分别损失0.4、2.05 和3.12 lg CFU/mL,而后者分别损失1.62、2.71 和4.16 lg CFU/mL。这可能是因为益生菌在通过复合凝聚法制备微粒的酸性条件中容易受到损耗。Ma 等[65]利用复合凝聚法和化学交联法制备大豆蛋白-阿拉伯胶微粒能提高植物乳杆菌(Lactobacillus plantarum)在贮存过程(25 ℃,28 d)和模拟胃液中的存活率(分别达88%和98%以上)及模拟肠液中释放的活菌量(4 h 后达6.52 CFU/g)。但不同共价交联方式对蛋白质-多糖基微粒益生菌递送的影响及其消化特性的作用机制还需继续深入研究。
2.2.2 微凝胶/微凝胶珠 与单一生物聚合物微凝胶相比,蛋白质-多糖复合微凝胶可形成更紧密的互穿双网络结构,进而表现出更好的机械性能、持水能力、耐热性[66]。通过调节混合比例、pH、离子强度等条件,带相反电荷的蛋白质和多糖可以通过静电相互作用复合凝聚形成微凝胶/微凝胶珠。Etchepare 等[67]发现,相比于未包埋、藻朊酸盐单层包埋、藻朊酸盐-乳清浓缩蛋白-藻朊酸盐三层包埋和藻朊酸盐-乳清浓缩蛋白-藻朊酸盐-乳清浓缩蛋白四层包埋(图4),藻朊酸盐-乳清浓缩蛋白双层包埋的嗜酸乳杆菌(Lactobacillus acidophilu)微凝胶珠经模拟胃肠道消化后有最高的存活率,达9.19 lg CFU/g(初始活菌量约为12 lg CFU/g)。但与大粒凝胶相似(2.1.1),微凝胶/微凝胶珠的长期稳定性问题仍待进一步研究。
2.2.3 微乳 蛋白质-多糖复合物通常作为亲水性乳化剂用于稳定水包油(o/w)型或水包油包水(w/o/w)型微乳(图4)[16,68-69]。微乳不仅是递送益生菌的有效工具[70],而且其组成成分也可能对肠道菌群产生积极或消极的影响[71]。Kan 等[72]采用第二种途径制备了乳清分离蛋白-阿拉伯胶美拉德反应共轭物稳定的o/w 微乳,发现该微乳可显著调节人体粪便中肠道菌群的组成和丰度,以及丰富碳水化合物代谢和胆汁酸生物合成的途径。这可能归功于美拉德偶联物的消化率较低,使得大多数肠道菌群可发酵的碳水化合物和蛋白质底物能进入结肠,进而被肠道菌群代谢、并影响宿主的健康[73]。因此,通过美拉德反应制备的蛋白质-多糖复合物具有促进人体肠道菌群健康变化的潜力,这对设计使用蛋白质-多糖复合物作为乳化剂的微乳具有重要意义。
w/o/w 双重微乳不仅具有减脂、减糖、减盐、共包埋亲水和亲油性生物活性物质的优点[74],而且相比于其他微乳体系(比如o/w,油包水w/o,水包水w/w 等类型),其结构更能有效保护益生菌[62]:不同于o/w 微乳,益生菌可以包埋在双重微乳内层水相中,而大多数益生菌在水中的溶解性更好;另外w/o/w双重微乳包含一层油相和两层水相,故双重微乳的油相和外层水相都能保护在内层水相包埋的益生菌(图4)。Qin 等[75]开发了一种在酸性条件呈水凝胶状态、在中性pH 条件呈溶液状态的pH 响应性w/o/w双重微乳,能有效提高植物乳杆菌(Lactobacillus plantarum)经模拟胃肠消化后的活菌数(从7.79×107CFU/mL 降至7.36×107CFU/mL,而未被包埋的益生菌从7.81×107CFU/mL 降至0.14×107CFU/mL)。虽然双重微乳具有提高益生菌稳定性、改善控释效果的应用前景,但双重微乳的实际应用仍存在一些问题,比如由于存在较多分散液滴及表面积,双重微乳的长期稳定性通常比较欠缺[76]。另外,PGPR 存在安全食用限量(ADI 25 mg/kg)、异味及消费者对人工合成添加剂抵触等缺点[77],对双重乳液的可食用性也存在影响,故找到替代甚至超越PGPR 乳化性的天然亲油性乳化剂[78]仍是双重微乳递送体系急需解决的问题。
2.2.4 微胶囊 微胶囊是一种利用天然或合成的大分子聚合物作为壳/覆盖层,包覆固体、液体或气体等核心物质,利用物理(喷雾干燥、冷冻干燥、挤出技术、分子微囊化技术等)或化学方法(复合凝聚、复合沉淀、原位聚合等)制成的微型胶囊或微粒。2.2.1 中介绍的仅以蛋白质-多糖复合物为材料的微粒也属于一种微胶囊,故在此介绍以乳液为基础制备的蛋白质-多糖复合微胶囊。以o/w 乳液为基础(图4)是最常见制备微胶囊的方式之一[79]。若将天然或合成的固体脂质用作o/w 乳液中的油相,再采用固化手段去除水分即可制成固体脂质微粒(solid lipid microparticle)。Tasch Holkem 等[80]发现添加了5%肉桂提取物的乳球浓缩蛋白-阿拉伯胶静电复合固体脂质微粒具有最高的动物双歧杆菌(Bifidobacterium animalis)包埋率(98.59%),并在7 ℃贮存120 d 后获得最高存活率(9.3 lg CFU/g)。虽然含油微胶囊具有长期稳定性高、不良环境抵抗力强等特点,但以o/w 乳液为基础制备微胶囊的方式更适用于疏水性强的益生菌,而对强亲水性益生菌的包埋难以达到理想效果[80]。而以w/o/w 乳液为基础制备的w/o 微胶囊内层水相适用于包埋大部分益生菌(图4)[81]。但在喷雾干燥、冷冻干燥等过程中w/o/w 乳液结构容易受到破坏、难以获得理想的颗粒形貌[82],进而影响w/o 微胶囊的递送效果。除此之外,食品工业中制备微胶囊也通常采用传统干燥方法,而这些干燥脱水过程通常对益生菌有较大的损伤[83]。
2.3 纳米级
近年来,纳米级递送体系的构建与应用前景一直是研究的热点与焦点[37]。虽然纳米颗粒(nanoparticles)、纳米凝胶、纳米纤维(nano-fibers)、纳米乳液(nano-emulsions)、纳米胶囊(nano-capsules)等纳米级体系已被证实是递送益生菌的优势载体[84-85],但目前纳米级益生菌递送体系的研究开发仍面临一定的困难与挑战[62,86-87]:一方面难以找到合适的可用于制备纳米颗粒的生物聚合物材料(包括蛋白质-多糖复合物),另一方面益生菌的尺寸普遍较大(通常在1~10 μm)且形状各异,常难以较好地匹配纳米级递送体系。下面主要介绍可用蛋白质-多糖复合物制备的纳米纤维、纳米颗粒和纳米乳液。
2.3.1 纳米纤维 利用电流体动力学加工技术(包括静电纺丝和静电喷涂),在高压静电场下将表面带电的生物聚合物溶液通过喷嘴喷出即可形成负载生物活性物质的纳米纤维[88]。其中制备纳米 纤维的聚合物材料溶液是最关键的因素之一。蛋白质因其静电、疏水和亲水本质可用作疏水 袋保护益生菌免受不利环境的影响[89],但溶解在水中的蛋白质因其α-螺旋、β-片二级结构、 三级结构和球状结构等三维结构在电场作用下难以拉伸和缠绕[90]。多糖的加入可以改善蛋 白质在电流体动力学加工技术中的应用限制,包括具有潜在益生元特性[91]的普鲁兰多糖[92]、藻朊酸盐[93]等。Akkurt 等[94]发现在静电纺丝加工后,酪蛋白酸钙-普鲁兰多糖纳米纤维和酪 蛋白酸钠-普鲁兰多糖纳米纤维中鼠李糖乳杆菌(Lactobacillus rhamnosus)活菌数分别达9.5 和9.6 lg CFU/mL(分别负载9.3 和9 lg CFU/mL);经扫描电镜观察发现鼠李糖乳杆菌分布 在纳米纤维内(图5)。但更多适应于电流体动力学加工技术的蛋白质-多糖复合材料及其在 益生菌靶向递送的实际应用还有待进一步探索。

图5 鼠李糖乳杆菌电纺纤维垫扫描电镜图[94]Fig.5 Scanning electron microscopy images of electrospun Lactobacillus rhamnosus GG (LGG) incorporated in fibrous mats[94]
2.3.2 纳米颗粒 利用蛋白质-多糖复合材料制备益生菌包封纳米颗粒的途径主要有两种:第一种是用抗溶剂共沉淀法[95]、纳米沉淀法[96]等方式制备天然生物聚合物纳米颗粒,但由于起步较晚,蛋白质-多糖基纳米颗粒包封益生菌的研究报道较少[85];第二种是以磷脂或胆固醇制备包封益生菌的脂质纳米颗粒,再将蛋白质和多糖进一步吸附在脂质纳米颗粒表面。Hosseini 等[97]发现经模拟胃液和肠液消化后,明胶-壳聚糖-卵磷脂基脂质纳米颗粒中的鼠李糖乳杆菌(Lactobacillus rhamnosus)分别损失了1.2 和1.6 lg CFU/mL,而卵磷脂基脂质纳米颗粒分别损失了1.7 和3.28 lg CFU/mL,未被包埋的益生菌分别损失了4.5 和5.5 lg CFU/mL。故利用蛋白质和多糖复合材料制备纳米颗粒对于提高益生菌结肠靶向递送具有重要意义。
2.3.3 纳米乳液 纳米乳液是一种热力学稳定、能有效包埋生物活性物质并提高其生物利用率的递送体系,通常在粒径50~200 nm 时呈现透明,在粒径大于500 nm 时呈现乳白色外观[98-99]。纳米乳液可以更容易地穿过细胞壁、进入目标细胞,具有较强的肠黏膜黏附能力和与其他代谢因子相互作用的能力,且纳米乳液液滴可以保护被包埋益生菌免受不良环境的影响,提高益生菌活性[86]。Vaishanavi 等[100]发现在27 ℃贮存40 d 后,大豆分离蛋白-阿拉伯胶基o/w纳米乳液中的德尔布鲁氏乳杆菌(Lactobacillus delbrueckiisubsp. bulgaricus)活菌数达9.8×107CFU/mL和8.8×108CFU/mL(初始活菌数分别为5.4×107CFU/mL 和4.3×108CFU/mL)。
3 蛋白质-多糖基益生菌递送体系在食品中的应用
3.1 酸奶
酸奶是益生菌的理想载体。酸奶为益生菌的生存提供了良好的介质,且口感好,营养价值高,可以常规地纳入日常饮食中。然而,在酸奶的储存、运输和配送过程中,益生菌仍能在较低环境温度下利用残留的乳糖缓慢发酵、产生乳酸,导致酸奶酸度继续上升,并对其感官属性产生不利影响[8]。此外,如果酸奶在储存过程中pH 下降过多,益生菌的活性也会降低。益生菌酸奶在储存期间的过度酸化问题可以通过不同尺度结构的蛋白质-多糖基益生菌递送体系得以改善,比如微凝胶珠[101]和微胶囊[102]均能降低酸奶的过酸化程度,且能提高益生菌在贮存过程中的存活率,并改善酸奶品质;w/o/w 双重乳液具有分离发酵益生菌的作用,以避免对发酵过程干扰,同时不会对酸奶的理化性质产生影响,并提高益生菌经贮存和胃肠消化后的存活率[103]。
3.2 奶酪
因其具有相对较高的pH、脂肪含量、固体稠度和高缓冲能力,奶酪亦被认为是一种优秀的益生菌输送工具[104]。另外,益生菌也可以在奶酪成熟过程中产生蛋白酶、脂肪酶、乳糖酶、胞外多糖和/或抗菌物质,帮助产品质量属性、安全性和保质期的提高。但奶酪加工环境、长期贮存及食用消化过程都会极大影响益生菌的活菌量,而通过蛋白质-多糖复合材料进行包埋,并在奶酪中应用能提高益生菌在不良环境中的生存能力。例如,水凝胶能提高益生菌在奶酪贮存过程中的稳定性,还能限制蛋白质水解和可滴定酸度变化[105];微粒能提高益生菌在奶酪贮存和模拟胃肠消化环境中的存活率[106];微胶囊能提高益生菌在低pH、高盐离子浓度等奶酪加工环境因素和数月贮存过程中的存活率[79]。
3.3 饮料
因为令人满意的风味和营养特性,众多乳、茶、果蔬、植物蛋白等饮料都是提供益生菌的理想食品。此外,饮料中的许多营养物质均对益生菌生长起着积极作用,包括维生素、矿物质、膳食纤维和抗氧化剂等[107]。利用蛋白质-多糖基体系包埋益生菌能改善益生菌在杀菌、干燥等饮料加工工艺、数周或数月的贮存及食用消化过程中大量失活的问题,但蛋白质-多糖复合材料的筛选及益生菌递送体系尺度结构的构建十分关键,不仅决定了益生菌是否能实现结肠靶向传递,而且决定了益生菌是否发酵并对饮料的品质性能产生影响[108]:相对于多糖基水凝胶[109],蛋白质-多糖基水凝胶不仅能进一步提高益生菌在发酵、贮存及胃肠消化后的存活率[47,61],而且因蛋白质载体具有较高的孔隙率,益生菌可从蛋白质-多糖基水凝胶中持续释放到饮料主体中并繁殖增长,进而产生更高的益生菌代谢活性而获得更高滴定酸度的饮料,同时因为蛋白质的缓冲作用,加入蛋白质-多糖基水凝胶的饮料pH 更高[110];蛋白质-多糖基微粒可以分离益生菌以避免后酸化过程,进而避免对饮料pH、可滴定酸度和还原糖含量等性能的影响[111];在蛋白质-多糖基微胶囊中,由于喷雾干燥过程中蛋白质变性而导致微胶囊孔隙度和表面活性变化,饮料中营养物质在微胶囊中扩散减慢,进而减缓了益生菌的生长及饮料pH 的降低,同时能提高饮料在贮存和模拟胃肠消化后的存活率[112]。
除以上食品外,蛋白质-多糖基益生菌递送体系还能在肉制品[113]、可食用膜[114]等领域中应用,并在益生菌活性保持和产品品质改善等方面发挥了重要作用。
4 结论
综上所述,利用蛋白质和多糖之间的非共价或共价作用可以组装形成多尺度结构的蛋白-多糖基递送体系,其中水凝胶、微粒、纳米颗粒等体系均已展现出优异的靶向传输功效。但目前不同尺度结构的递送体系仍存在不同的缺陷,比如水凝胶的长期稳定性差、货架期短,益生菌在o/w 型微乳的油相里溶解性差,w/o/w 型双重微乳长期稳定性和亲油性乳化剂方面仍存在待改善的问题,微胶囊利用传统干燥方法制备的过程中对益生菌有很大的损耗,纳米纤维、纳米颗粒、纳米乳液等体系的材料开发和在食品中的实际应用还有待继续深入探究。蛋白质-多糖基益生菌递送体系已在酸奶、奶酪、饮料等食品中展现出优异的功能性,其尺度结构决定了益生菌的靶向传递效果及发酵程度对产品品质的影响。未来,蛋白质-多糖基益生菌递送系统的研究工作可在如下方面进一步探索:a. 结合纳米纤维、纳米颗粒、纳米乳液等纳米体系的结构特征,开发高效传输益生菌的纳米级递送体系;b. 开展益生菌与其他生物活性物质共包埋的蛋白质-多糖复合递送体系的构建机制及性能研究,开发多功能的新型食品;c. 利用蛋白质-多糖复合体系的天然性、生物相容性、生物可降解性、食用安全性及特有的营养和功能特性等优点,设计含活性益生菌的食品包装材料和低脂食物、肉类替代物等对人体健康的新型食品。

