老年脑梗死后血管性痴呆病人血清AGEs、RAGE水平与病情严重程度的关系
刘丽娟 江曼 成勇 毛高峰 方煌
血管性痴呆(vascular dementia, VD)是脑梗死(cerebral infarction, CI)病人常见并发症,多发于老年群体,临床主要表现为记忆、认知、行为等功能障碍,严重影响病人的生活质量[1]。临床研究表明,脑梗死后血管性痴呆(CI-VD)是由脑血管病变引起脑组织损害,进而出现的认知功能障碍综合征,病人病情呈阶梯样发展,严重者可导致病人丧失生活自理能力[2]。研究发现,VD病情具有可逆性,早期积极干预有助于病情转归或延缓病情进展[3]。因此,明确CI-VD病人病情进展的因素,对于指导临床治疗,改善预后具有重要意义。
当前,临床主要根据病理学检查、影像学诊断以及认知障碍量表评分诊断病人病情,临床应用时操作繁琐,对医师水平要求较高,且具有一定的主观性[4]。有研究报道,脑神经病变病人部分生理指标变化早于病情变化,临床检测这些生理指标能够预测病情变化,便于及时给予针对性治疗[5]。其中,晚期糖基化终末产物(advanced glycation end products, AGEs)是过量的糖和蛋白质结合产物,与多种慢性退化型疾病的发生、发展有关[6]。此外,晚期糖基化终末产物受体(advanced glycation end products receptor, RAGE)能够与AGEs结合,形成受体-配体激活物,启动细胞信号转导通路,从而发挥生物学作用[7]。有研究报道,AGEs、RAGE与阿尔茨海默病的发生、发展密切相关[8]。然而,老年CI-VD病人血清AGEs、RAGE水平与病情严重程度的关系尚不清楚,鉴于此,本研究选取中国人民解放军中部战区总医院收治的96例老年CI-VD病人,探究血清AGEs、RAGE水平与病情严重程度的关系。
1 资料与方法
1.1 临床资料 选取2020年1月至2021年6月本院收治的96例老年CI-VD病人,其中,男52例,女44例,年龄60~82岁,平均(62.27±10.93)岁。另选取同期医院收治的84例单纯老年CI病人,其中,男45例,女39例,年龄60~83岁,平均(62.75±11.58)岁。2组性别、年龄差异无统计学意义,具有可比性(P>0.05)。本研究获得医院伦理委员会批准(20190516)。
纳入标准:(1)CI-VD组:符合《卒中后认知障碍管理专家共识》[9]中CI-VD诊断标准;年龄≥60岁;经影像学检查确诊;知情同意;(2)单纯CI组:年龄≥60岁;CI后未发生VD;知情同意。
排除标准:CI前认知障碍;帕金森病、脑积水等认知功能障碍疾病;精神疾病;血液系统疾病;心、肝、肾严重功能障碍;脑出血;颅脑手术史;神经功能损害史;恶性肿瘤;交流障碍。
1.2 方法
1.2.1 VD的严重程度分级:根据MMSE量表评估老年CI-VD病人的痴呆严重程度,MMSE评分>20分为轻度,10~20分为中度,<10分为重度[10]。
1.2.2 资料收集:收集病人性别、年龄,合并糖尿病、高血压、冠心病情况,吸烟史、饮酒史、受教育程度、病变位置等资料。
1.2.3 实验室指标检测:病人入院后清晨空腹采集静脉血5 mL,3500 r/min离心分离血清,采用酶联免疫吸附法测定血清AGEs、RAGE水平,试剂盒均购自上海佰晔生物科技有限公司。采用HF240-300型全自动生化分析仪(山东鑫煤矿山设备集团有限公司)测定LDL-C、HDL-C、TC、TG、FPG,酶联免疫吸附法(武汉伊艾博科技股份有限公司)测定神经元特异性烯醇化酶(neuron-specific enolase, NSE)、CRP、TNF-α,分光光度法(北京雷根生物技术有限公司)检测丙二醛水平。
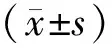
2 结果
2.1 CI-VD病人和单纯CI病人血清AGEs、RAGE水平比较 CI-VD病人血清AGEs、RAGE水平均高于单纯CI病人(P<0.01),见表1。
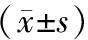
表1 2组病人血清AGEs、RAGE水平比较
2.2 CI-VD病人血清AGEs、RAGE水平与病情严重程度的相关性分析 96例老年CI-VD病人中按照痴呆严重度分为轻度25例、中度39例、重度32例。重度组病人血清AGEs、RAGE水平均高于轻度组和中度组(P<0.05),中度组病人血清AGEs、RAGE水平均高于轻度组(P<0.05),见表2。Spearman相关性分析显示,血清AGEs(r=0.446,P<0.001)、RAGE(r=0.469,P<0.001)水平与痴呆严重程度呈正相关。
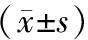
表2 血清AGEs、RAGE水平与病情严重程度的关系
2.3 单因素分析影响老年CI-VD病人重度痴呆的因素 重度组病人初中及以下受教育程度构成比及血清CRP、TNF-α、NSE、AGEs、RAGE水平均高于轻中度病人(P<0.05),见表3。
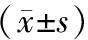
表3 单因素分析影响老年CI-VD病人重度病情的因素
2.4 Logistic回归分析影响老年CI-VD病人重度痴呆的独立相关因素 将受教育程度(高中及以上=0,初中及以下=1)、血清CRP、TNF-α、NSE、AGEs、RAGE水平作为自变量,以是否为重度痴呆(否=0,是=1)为因变量,进行Logistic多因素回归分析,结果显示受教育程度、血清NSE、AGEs、RAGE水平均是影响老年CI-VD病人重度痴呆的独立相关因素(P<0.05),见表4。
表4 Logistic回归分析影响老年CI-VD病人重度病情的相关因素
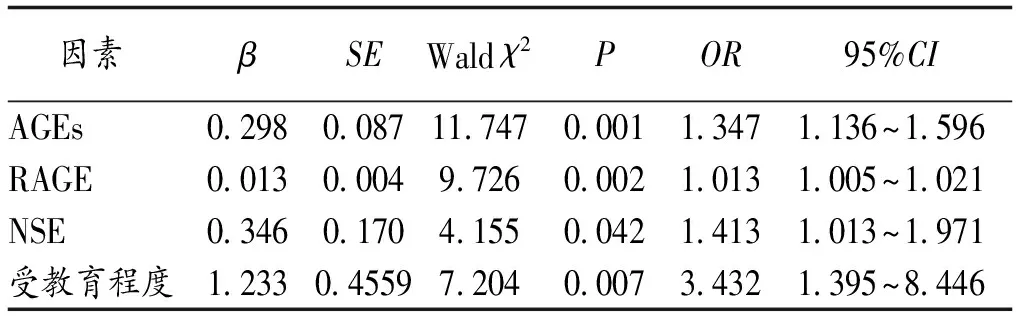
因素βSEWald χ2POR95%CIAGEs0.2980.08711.7470.0011.3471.136~1.596RAGE0.0130.0049.7260.0021.0131.005~1.021NSE0.3460.1704.1550.0421.4131.013~1.971受教育程度1.2330.45597.2040.0073.4321.395~8.446
2.5 老年CI-VD病人血清AGEs、RAGE水平预测重度病情的价值 ROC曲线分析显示,老年CI-VD病人血清AGEs、RAGE水平预测重度病情的最佳截断点分别为33.07μg/mL、550.31μg/mL,灵敏度分别为81.25%、75.00%,特异度分别为65.62%、84.37%,AUC分别为0.799、0.794,二者联合的特异度和AUC分别为95.31%和0.855,见表5和图1。
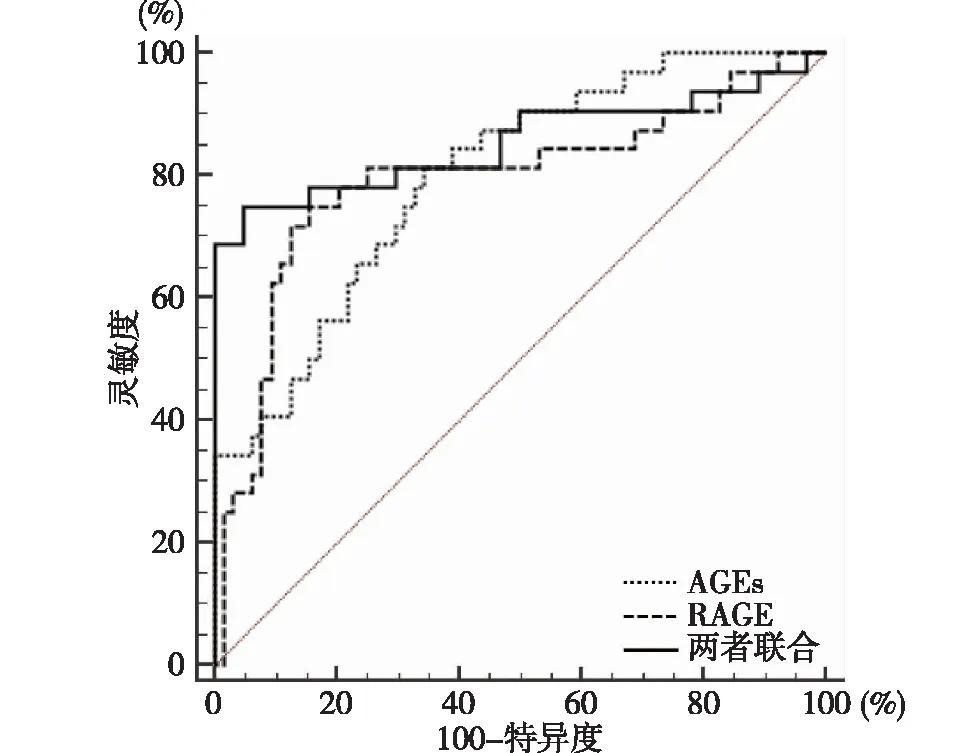
图1 老年CI-VD病人血清AGEs、RAGE水平预测重度病情的ROC曲线
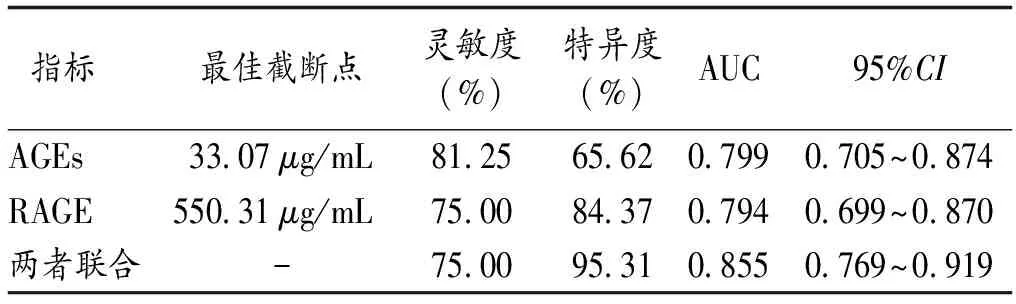
表5 老年CI-VD病人血清AGEs、RAGE水平预测重度痴呆的价值
3 讨论
CI病人脑损伤与认知损害密切相关,左侧大脑半球、丘脑、海马、额叶、内囊等部位损伤均可导致病人认知功能障碍。CI-VD的发病机制尚不明确,可能与多种复杂因素以及病理途径有关[11]。CI-VD病人大脑皮层高级功能呈进行性衰退,随着病人病情加重,病理范围逐渐扩大,病变加重,各种病理机制导致皮层、皮层下结构破坏,病人表现为不同程度认知功能障碍[12]。由于VD病理变化具有可逆性,早期积极干预能够有效遏制病情进展,甚至转归[13]。
本研究中,老年CI-VD病人血清AGEs、RAGE水平异常升高,且血清AGEs、RAGE水平与病情严重程度呈正相关。AGEs是蛋白质、核酸、脂质等大分子游离基与葡萄糖的羟基催化反应终末产物,作为信号分子参与衰老组织清除和结构重建,在病理状态下可导致细胞功能异常[14]。AGEs可以通过影响血管内皮功能、释放炎症因子、加速神经元坏死等影响血管通透性,进而导致VD的发生和进展。研究证实,AGEs能够损伤血管内皮,促进血栓形成,影响血脑屏障通透性[15]。有研究报道,AGEs存在于大脑神经中枢星形胶质细胞中,通过修饰微管相关蛋白tau和β淀粉样蛋白影响线粒体功能,进而引起氧化应激损伤,损伤血管内皮[16]。AGEs可以刺激血管内皮细胞生长因子产生,增加血管通透性,引起血管壁水肿,同时可以直接导致血管舒张功能障碍,与其受体RAGE相互作用,加速神经元变性坏死[17]。RAGE是细胞表面免疫球蛋白超家族多配体受体,能够与AGEs结合,激活NF-κB途径,共同参与脑血管疾病的发生、发展[18]。AGEs与RAGE结合能够启动受体信号转导途径,促进活性氧分子形成及蛋白激酶C活化,进而损伤神经元功能[19]。本研究多因素Logistic回归分析显示,受教育程度和血清NSE、AGEs、RAGE水平均是影响老年CI-VD病人痴呆严重程度的相关因素,进一步说明血清AGEs、RAGE水平变化在CI-VD病人病情发展中的作用。动物实验研究发现,阻断AGEs/RAGE通路能够缓解认知功能障碍小鼠临床症状。本研究ROC曲线分析显示,老年CI-VD病人血清AGEs、RAGE水平预测重度病情的最佳截断点分别为33.07μg/mL、550.31μg/mL,AUC分别为0.799、0.794,二者联合的特异度和AUC分别为95.31%和0.855,在不显著牺牲灵敏度的情况下,联合预测提高了特异度,进而提高了预测价值。
综上,老年CI-VD病人血清AGEs、RAGE水平与病情严重程度有关,其水平变化可作为预测病情变化的敏感指标。

