Copine7蛋白在牙、牙周组织发育与再生中的作用
杨 玥,赵溟昱,谢旭东,王 骏
1999年,Savino等[1]最早在散发性乳腺癌研究中发现Copine 7(CPNE7)蛋白。近年来研究发现,前成釉细胞条件培养基(preameloblast-conditioned medium,PACM)能诱导牙源性间充质干细胞分化,具有促进牙本质和牙骨质形成的作用[2-4]。2011年,Lee等[2]在PACM中检测到CPNE7蛋白,并发现CPNE7蛋白能显著促进成牙本质细胞分化标志物的表达,表明了CPNE7蛋白具有促进间充质细胞分化的潜能。基于此,学者们在牙本质再生、牙周组织再生、骨组织再生及肿瘤领域对CPNE7开展了众多研究[5]。
1 CPNE7介绍
CPNE蛋白家族是一个进化上高度保守的钙离子依赖性磷脂结合蛋白家族,其普遍特征为N端包含两个C2结构域,C端包含一个von Willebrand因子A型结构域[2, 6]。其中N端的两个C2结构域被认为与钙离子流入有关[7],von Willebrand结构域参与蛋白间相互作用[8]。目前CPNE蛋白家族包含9个成员(CPNE1~9)。在CPNE2、CPNE6和CPNE7蛋白中,第2个C2结构域负责蛋白质钙依赖性膜结合,均表现出高钙离子亲和力。CPNE7蛋白通过与成牙本质细胞表面的核仁素蛋白结合[9],介导细胞内吞作用,上调牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)和纤毛体成分的含量,促进牙周组织和牙本质的形成[10]。
2 CPNE7的时空表达
2.1 CPNE7在空间上的表达
有学者利用小鼠模型,分析了CPNE7蛋白在胚胎期和出生后的时空表达特征,动态观察了CPNE7在牙齿发育过程中的表达模式[10]。CPNE7蛋白在前成釉细胞分化为成釉细胞的过程中合成,并在合成后不久分泌至外胚层间充质中,促进间充质细胞先分化为前成牙本质细胞,再分化为成牙本质细胞(图1)。进一步分析发现,CPNE7蛋白和mRNA同时在牙乳头和牙源性上皮细胞上表达,证实了牙源性上皮细胞分泌的CPNE7通过上皮-间充质相互作用向间充质细胞转移,并促进其分化为成牙本质细胞(图2)。该研究发现,CPNE7在成牙本质细胞、牙本质和前期牙本质中分布均匀,而在成釉细胞中少量表达。

小鼠牙冠形成过程中,CPNE7蛋白在成釉细胞中合成并分泌至间充质,促进成牙本质细胞的分化。牙冠发育后期,牙本质矿物质沉积,CPNE7蛋白在成牙本质细胞中弱表达图1 CPNE7牙冠发育过程中的作用模式图Fig.1 Action pattern diagram of CPNE7′s role during odontogenesis
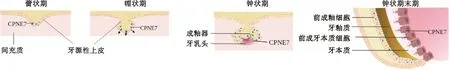
CPNE7蛋白最初在蕾状期的上皮细胞中表达,帽状期也可见于牙囊细胞。在钟状期,CPNE7蛋白见于整个成釉器中,同时在牙乳头也有少量表达。在钟状期末期,CPNE7蛋白在前成釉细胞和前成牙本质细胞中分泌图2 CPNE7在小鼠牙齿发育时期的表达Fig.2 Expression of CPNE7 during mouse tooth development
2.2 CPNE7在时间上的表达
Park等[11]通过免疫组化检测和原位杂交技术,确定了CPNE7在小鼠牙齿发育过程中的定位。在蕾状期,CPNE7蛋白在口腔上皮细胞中表达,而未在牙源性间充质中表达。在帽状期,CPNE7蛋白除在牙源性上皮细胞表达外,也有少量在牙囊中表达,但仍未在其他间充质结构中表达。在钟状期,CPNE7蛋白在整个成釉器中都有表达,同时在牙源性间充质中少量分泌。在钟状期末期,CPNE7蛋白同时在前成釉细胞和前成牙本质细胞中表达(图2)。
在出生后的牙冠形成时期,CPNE7蛋白定位于成牙本质细胞、牙本质和前期牙本质中,但在成熟成釉细胞和赫特维希上皮根鞘(Hertwig's epithelial root sheath,HERS)中弱表达[11](图2)。在此期间CPNE7蛋白的不连续表达可能有助于牙本质初始矿物沉积。在HERS和根部牙本质形成过程中,CPNE7蛋白在与上皮细胞基底膜接触的前成牙本质细胞中表达。总体来看,CPNE7蛋白的表达水平在成牙本质细胞分化早期上升,在晚期下降,显示其与早期牙齿发育有关。
3 CPNE7对牙本质、牙周组织修复与再生的影响
3.1 CPNE7可以促进牙本质的形成
3.1.1 诱导牙本质小管空间封闭
CPNE7蛋白可以促进牙本质小管内矿物沉积和牙本质小管空间封闭,进而促进第三期牙本质再生。Park等[12]将CPNE7蛋白应用于牙本质过敏症模型,并在之后观察第三期牙本质形成状况和牙本质小管封闭情况,损伤的牙本质在使用CPNE7蛋白处理后与对照组相比通透性明显降低。碱性磷酸酶(Alkaline phosphatase,ALP)是细胞矿化中的特征分子,成牙本质细胞在CPNE7处理后ALP启动子活性升高,此外,CPNE7处理犬牙间接盖髓模型后在电镜下观察到牙本质小管被矿物沉淀所阻断,表明CPNE7对牙本质小管内矿物沉积有促进作用[3]。
3.1.2 自噬诱导作用
CPNE7能通过自噬诱导促进成牙本质细胞分化和第三期牙本质的形成,且新形成的牙本质保留原发性牙本质特征。Lee等[2]发现,CPNE7不仅能通过调控纤毛细胞控制DSPP的表达,促进牙源性间充质干细胞分化成为成牙本质细胞,还能诱导非牙源性间充质干细胞分化后呈现成牙本质细胞特征,表明CPNE7在成牙本质细胞分化中发挥关键作用。Park等[12]将CPNE7蛋白应用于牙本质过敏症模型中,损伤的牙本质在使用CPNE7蛋白处理后有新的第三期牙本质形成,并检测到新生牙本质表达牙本质涎蛋白(dentin sialoprotein,DSP)和神经巢蛋白(NESTIN)。DSP和NESTIN是成牙本质细胞分化的重要标志物,表明CPNE7蛋白诱导产生的硬组织保留了原发性牙本质的特征[13-15]。在比格犬牙的活体间接盖髓术模型中,CPNE7组剩余牙本质下明显能观察到再生的牙本质小管结构[3]。尽管成熟的成牙本质细胞对外部刺激的反应能力较弱,但CPNE7可能会增强其细胞功能并导致管状牙本质再生。
为了进一步探究CPNE7促进第三期牙本质形成的机制,Choung等[3]将CPNE7重组蛋白(recombinant CPNE7,rCPNE7)应用于暴露的牙本质,以探究该蛋白在体内是否能渗透通过牙本质小管。结果表明,rCPNE7能很好地通过狭窄的牙本质小管快速渗透并扩散到牙本质液中。CPNE7蛋白可能通过刺激小管中的成牙本质细胞分化,从而促进第三期牙本质的形成。Park等[16]发现,细胞自噬标志物微管相关蛋白轻链3-Ⅱ(microtubule-associated protein light chain 3-Ⅱ,LC3-Ⅱ)在成牙本质细胞发育中表现出与CPNE7相似的表达模式,CPNE7处理增强了LC3-Ⅱ表达。进一步研究发现,CPNE7不但通过诱导自噬上调DSP和牙本质基质蛋白-1(dentin matrix protein-1,DMP-1)激活成熟牙本质细胞活性,还上调成牙本质细胞中表达的NESTIN和微管相关蛋白(microtubule-associated protein tau,TAU),并可能参与细胞重塑,刺激成牙本质细胞突伸长。此外,经过CPNE7蛋白处理的成牙本质细胞中脂褐质减少,表明CPNE7介导的自噬作用可能通过清除细胞有丝分裂产生的代谢产物,帮助恢复细胞功能。
3.2 CPNE7可以促进牙周组织的再生
多项研究表明,CPNE7在促进牙周组织再生方面有重要作用。Yu等[4]将比格犬前磨牙进行完全脱位和延迟再植处理,并彻底刮除其牙根表面的牙周膜和牙骨质以探究牙周组织缺损时,CPNE7蛋白在促进其再生方面的作用。实验设置CPNE7蛋白处理组、PACM培养基处理组、CPNE7蛋白灭活处理组,并设置牙周膜和牙骨质刮除的阴性和阳性对照。结果显示,CPNE7蛋白处理组与其他实验组相比,牙周膜纤维垂直于根面埋入牙槽嵴中,与天然牙类似,但其新生牙周膜的质量差异无统计学意义。在CPNE7蛋白灭活处理组中,牙骨质形成明显减少,但仍然高于阴性对照组,表明CPNE7蛋白虽与牙周膜再生无明显关系,但可能参与牙骨质再生,在牙周组织修复中有积极作用。Choung等[17]在体外评价CPNE7对牙囊细胞、牙周膜干细胞和牙髓细胞的影响,发现CPNE7可能通过调节牙周膜干细胞在骨质上的附着和促进牙周膜纤维垂直排列于新形成的牙骨质和牙槽骨,而在牙周再生中发挥功能性作用。
最新的研究证实,CPNE7促进牙周组织再生的机制可能与TAU蛋白有关。TAU能通过重组肌动蛋白-微管网络与微管的不稳定结构域结合,在细胞骨架的形成与稳定中发挥重要作用[18]。Bai等[18]在体外研究中发现,CPNE7在细胞中与TAU空间表达的定位相同,并能诱导TAU的表达。随后在小鼠和比格犬体内实验中证明,CPNE7能通过调节TAU与牙骨质附着蛋白,介导细胞骨架重组,影响牙周膜在牙槽骨上的附着,使错位的牙周膜纤维重排整齐,从而有助于牙周膜再生。
4 CPNE7的衍生物
4.1 CDP4
Lee等[19]根据CPNE7蛋白序列结构分析,从CPNE7蛋白序列C2结构域的C端到von Willebrand因子A型结构域选择出6条短肽CDP1~6,集中在CPNE7蛋白的321~360位。其中CDP4(氨基酸序列为VNPKYKQKRR,相对分子质量为1 315)表现出较低的细胞毒性、较好的细胞渗透性和成骨能力。有学者发现,CDP4能显著提高体外人牙髓干细胞成骨分化标志物pSmad/Smad蛋白、骨钙蛋白、碱性磷酸酶、RUNX2蛋白表达[15,20],且效果接近完整的CPNE7蛋白。茜素红染色结果显示,CDP4提高钙沉积水平效果甚至高于CPNE7蛋白。以上研究提示CDP4序列可能是CPNE7蛋白中与细胞渗透性和成骨分化有关的关键序列。体内外研究数据都支持,CDP4的促成骨作用与目前最有效的促成骨药物骨形成蛋白2(bone morphogene-tic protein 2,BMP-2)相近,有潜力作为BMP-2的替代药品应用于骨组织工程领域。
与完整蛋白相比,合成肽在再生治疗中能有效避免免疫原性、体内降解、致癌等不良反应,具有成骨效率高、选择性高、累积风险低和交叉反应性高等优势。此外,CDP4在工业生产中更易合成、优化和处理,具有更高的商业潜力。
4.2 CPNE7-DP
Lee等[21]设计并合成了一种稳定、成本低且易操纵的功能性肽CPNE7-DP(包含对应于CPNE7蛋白344~353位的一段合成肽,氨基酸序列为KYKQKRRSYK),可模仿CPNE7蛋白的功能。在Lee等设计的比格犬前磨牙牙本质暴露模型中,CPNE7-DP对不同程度的牙本质暴露都表现出促进修复性牙本质形成和牙本质小管封闭的作用,且新生的硬组织表现出原发性牙本质的特征,表明其不仅促进新生成牙本质细胞分化,还能重新激活休眠状态的成牙本质细胞,使其分泌牙本质基质。而在Bai等[18]的体外研究中发现,CPNE7-DP等能直接上调骨质附着蛋白的表达水平,并在犬类三壁骨缺损模型中修复牙周膜的结构与功能,在牙周组织的修复方面也表现出良好的应用前景。此外,CPNE7是通过核仁素介导的内吞作用进入细胞,而CPNE7-DP可以直接穿过细胞膜。CPNE7-DP在多种条件下保持稳定,是一种更为稳定的细胞穿透肽。
5 CPNE7及其衍生物的临床应用前景
多项研究证实CPNE7蛋白能显著降低牙本质通透性,在牙本质敏感症(dentin hypersensitivity,DHS)的治疗中显示出重要的应用潜能。DHS是暴露的牙本质对外界刺激产生的酸痛不适感,难以预防,且治疗过程痛苦[22]。基于液体动力学理论[23-24],目前临床上减轻DHS疼痛的主要方法是通过阻塞牙本质小管内液体流动,从而阻断各种刺激的侵入[25],但是传统的治疗方法并不理想[26]。在Park等[12]构建的牙本质暴露模型中,CPNE7蛋白能诱导第三期牙本质的再生,促进牙本质小管封闭并显著降低牙本质通透性,能有效减轻DSH的症状,显示了CPNE7蛋白在DSH的治疗中的重要潜力。对于牙本质小管封闭的原因,目前有两种可能的解释[3]:一种是成牙本质细胞在CPNE7蛋白的刺激下在牙本质小管内矿化;另一种是CPNE7蛋白因其高钙离子结合能力与牙本质液中的钙离子直接反应。
目前已有大量有关生物牙本质再生方面的研究,其中大部分研究表明:第三期牙本质表现出骨样牙本质特征,成牙本质细胞包埋于形成很快的间质中,细胞变性后在该处遗留一空隙[27]。骨样牙本质矿物密度低于管样牙本质,无法起稳固的支持保护作用[28]。此外,骨样牙本质中牙本质小管数目明显少于正常牙本质,而多项研究表明牙本质小管在牙齿防御机制中起重要作用[29-31]。CPNE7诱导产生的牙本质具有管样牙本质特征,新生牙本质中DSP和神经巢蛋白具有良好的生理活性。同时CPNE7蛋白能促进牙本质小管内的矿物沉积,降低牙本质通透性,在治疗牙本质缺失方面有重要的临床应用前景。
牙周组织再生是通过修复因牙周疾病或外伤受损的牙周组织,还原其原始状态,获得牙周组织结构和功能的重建[32]。体外研究证实CPNE7可通过调节牙周膜纤维的排列促进牙骨质形成,在牙周组织修复中具有一定的应用前景,但具体的作用机制仍有待进一步研究[4,16-17]。
除在牙、牙本质修复方面的作用外,最新的研究指出CPNE7可促进口腔鳞状细胞癌转移。间充质干细胞(mesenchymal stromal cells,MSCs)是肿瘤微环境的重要组成部分,MSCs与肿瘤实质细胞的相互作用在肿瘤转移中起到关键作用[33-34]。越来越多的研究证明,MSC通过分泌特定的细胞因子影响肿瘤的转移进程[35]。Ji等[36]通过实验证明,CPNE7可以与口腔鳞状细胞癌间充质细胞表面的核仁蛋白、Iκßα蛋白结合,激活NF-κB通路,促进p65的胞内转移和IκBa磷酸化,调节间充质细胞分泌CXCL8,促进口腔鳞癌细胞的转移。因此,间充质干细胞中的CPNE7可能成为口腔鳞癌的潜在治疗靶点。
6 总 结
综上所述,CPNE7蛋白在促进间充质细胞分化、成牙本质细胞形成、牙本质和牙骨质再生的过程中均发挥重要的作用,显示其在牙本质损伤和牙周缺损的临床治疗中可能的应用潜力。然而,CPNE7蛋白促进牙本质和牙骨质修复的具体作用机制尚未明确。
目前研究主要关注CPNE7蛋白对牙本质的作用及其机制,而关于其在牙周组织再生中的作用及机制的研究较少,有少量文献揭示其与口腔鳞癌转移的关系,但CPNE7的细胞毒性和致癌作用仍有待进一步的研究。另一方面,大多数研究仅仅对CPNE7蛋白的作用作出定性的探讨,未对其使用量、作用方式和作用时间做进一步的拓展。
由于CPNE7蛋白成本高昂、分子量较大等限制,具有易于合成、性能更佳优势的CPNE7蛋白衍生物更具有临床应用潜力。基于CPNE7蛋白衍生的功能肽因其各方面性能的不同,可能将满足多样化的临床促牙本质和牙周组织再生需求。

