应力刺激通过Wnt/β-catenin通路调控牙骨质细胞的矿化
王 涵,李天成,陈 硕,曾心怡,杨 宽,邹淑娟,段沛沛
错牙合畸形被世卫组织列为口腔三大疾病之一,在我国,因错牙合畸形而正在接受正畸治疗的患者逐年增加[1]。正畸治疗中,对牙齿施加轻力,牙槽骨发生吸收改建的同时,牙根表面发生的吸收陷窝将再矿化并修复;若对牙齿施加过大的矫治力,牙槽骨发生潜行性吸收的同时,牙根将产生大量吸收陷窝,这种不可逆性吸收会使牙根变短,也即发生正畸源性牙根吸收[2]。正畸源性牙根吸收(orthodontically induced root resorption,OIRR)是正畸治疗中最常见的并发症,其发病率大于90%,其中>4 mm的重症牙根吸收所占比例仍在逐年增加[3-4]。轻、中度OIRR直接导致牙根支持组织面积减小而影响牙齿的健康,重度OIRR增加了牙齿松动脱落的风险,极大危害了正畸患者的口腔及身心健康[4]。同时,OIRR的发生常导致治疗中断、治疗效果欠佳或治疗时间延长,进而可能诱发医患关系紧张及信任危机。OIRR不仅影响了患者对健康及美的追求,也极大阻碍了正畸学科的发展与进步[5]。因此,应力刺激下牙根再矿化并修复吸收陷窝的能力对防治OIRR至关重要,掌握该过程中潜在的分子机制及关键靶点是目前正畸研究领域的热点和难点。
牙骨质是覆盖在牙根表面的矿化结缔组织,通过牙周韧带将牙齿固定在牙槽骨上[6]。牙骨质作为牙根的保护屏障,能在感染、创伤或正畸应力等外界刺激下维持牙根矿化组织的稳态平衡,使牙根再矿化并修复吸收陷窝[7]。因此,牙骨质的生理活性与牙根的再矿化及自我修复息息相关。牙骨质细胞是组成牙骨质的唯一细胞,其细胞功能及生物学行为变化调控着牙骨质的再矿化及稳态平衡,是揭示牙根吸收潜在机制的关键环节。然而,由于解剖位置特殊及含量较少,牙骨质细胞分离难度极大,且周围组织连接紧密,细胞种类繁杂,分离后难以鉴定,因此一直以来缺乏稳定有效的体外细胞研究模型[6,8]。本课题组成员所在的美国Bonewald实验室于2016年成功建立了全球范围内首株新型小鼠永生化牙骨质细胞系IDG-CM6细胞,突破了牙骨质体外研究的技术壁垒,并进而对其生化特性展开了初步探究[6,9]。课题组前期研究表明,牙骨质细胞是牙骨质感受应力及应力转导的关键细胞,牙骨质细胞内相关信号通路的表达对牙骨质稳态有调控作用[1,9]。组织病理学切片观察到,牙根吸收后,吸收凹陷区域形成继发性牙骨质,牙骨质细胞在牙骨质修复的过程中是否发挥了作用?上述生物学反应的潜在分子机制尚不清楚,亟待相关细胞实验进行深入探究。
Wnt/β-catenin通路在牙骨质再生领域中研究广泛[10]。β-catenin是Wnt/β-catenin通路中的重要因子,它的活性和浓度水平对该通路调控牙骨质再生至关重要[10-11]。有研究表明,β-catenin能够上调成牙骨质细胞中Osterix的表达水平从而促进牙骨质再生[10];另有研究证实β-catenin是Gli1+祖细胞分化为成牙骨质细胞并进行牙骨质再生的关键调控因子[11]。此外,Han等[12]研究表明,Wnt/β-catenin通路的激活可诱导牙周炎大鼠的成牙骨质细胞活化及牙骨质再生。综上研究说明,Wnt/β-catenin通路在成牙骨质细胞激活、牙骨质修复过程中扮演了重要角色。
然而,成牙骨质细胞包埋入牙骨质基质并分化为牙骨质细胞后的进一步矿化才是牙骨质发挥牙根屏障作用的关键[6-8],而该领域由于此前缺乏有效的牙骨质细胞体外模型,故相关研究较为匮乏。本课题组前期利用IDG-CM6牙骨质细胞系对其矿化特性进行了初步探究,证明该细胞系能够模拟体内牙骨质细胞的矿化及生物学特性[13];同时,本课题组最新研究发现,IDG-CM6细胞内β-catenin能够响应机械刺激产生表达变化[9]。综上推测,轻力刺激可能通过调控Wnt/β-catenin通路活性进而影响牙骨质再矿化及稳态平衡。
本研究通过构建体外牙骨质细胞的压应力模型,探究应力下Wnt/β-catenin通路在牙骨质稳态及再矿化中的调控作用,并揭示轻力牙移动时牙根吸收修复中再矿化发生的潜在分子机制,为临床中防控OIRR提供理论基础。
1 材料与方法
1.1 实验材料
IDG-CM6细胞由美国Bonewald实验室惠赠;Ⅰ型鼠尾胶原(Sigma公司,美国);胎牛血清(Fetal bovine serum,FBS,Gibco公司,美国);α-MEM培养基(Hyclone公司,美国);抗坏血酸(ascorbic acid,AA)、β-甘油磷酸钠、茜素红(Sigma公司,美国);γ干扰素(interferon-γ,IFN-γ,Gibco公司,美国);Lipofectamine 2000(上海汉恒生物科技有限公司,中国);si-NC、si-β-catenin(上海汉恒生物科技有限公司,中国);RIPA蛋白裂解液、二辛可宁酸(bicinchoninic acid,BCA)试剂盒(上海研谨生物科技有限公司,中国);Trizol、逆转录试剂盒、荧光PCR定量试剂盒(Takara 公司,日本);小规格不锈钢珠(0.25 g/颗,成都宝科生物公司,中国);DAPI(Sigma公司,美国);Cy3、鬼笔环肽、0.5% Triton X-100(上海碧云天生物技术公司,中国)。
1.2 方法
1.2.1 细胞培养及矿化诱导 在33 ℃孵箱内扩增细胞(培养瓶:带有Ⅰ型胶原表面的培养瓶;培养基:10%FBS、100 U/mL青霉素G、100 mg/mL链霉素、α-MEM;增殖诱导剂:IFN-γ),在37 ℃孵箱内诱导矿化(接种密度:4×104个/cm2;矿化诱导液:AA及β-甘油磷酸钠),矿化诱导至21 d收集细胞以备分析(此时最接近体内牙骨质细胞生理学特点,图1)[9]。
图1 IDG-CM6细胞矿化诱导至21 d培养镜下形态Fig.1 Microscopic morphology of IDG-CM6 cells subjected to osteogenic-induced medium for 21 days
1.2.2 体外细胞静压力系统的建立 加力方法参考文献[14]。取矿化诱导21 d后的IDG-CM6(IDG-CM621 d,下同)细胞置于孔板,将事先备好的磁珠称重,根据实际孔板的底面积进行计算,以保证最终压应力大小为0.5 g/cm2;精确计重后的磁珠置于离心管盖并轻轻放入孔板,施加6 h压应力后[15]收样以进行后续实验(压应力施加超过6 h后 IDG-CM621 d细胞会出现大面积脱落、死亡)。
1.2.3 高通量测序(RNA-seq) 选取6个样品(对照组及应力组各3个)寄往北京诺禾致源生物信息科技有限公司进行基因测序;测序流程大致为样品检测、rRNA 去除、双链cDNA 合成、加测序接头、降解cDNA 第二链、富集及文库质检、测序。
1.2.4 差异表达mRNA筛选 使用Illumina Hiseq 2500平台进行RNA测序分析。使用Trinity软件完成转录组组装。用RSEM软件将每个待测样品数据与对照序列进行对标。采用Corset软件富集转录组。用DESeq软件对基因表达水平进行标准化。当P<0.05时,认为该基因表达具有统计学差异(DEGs)。DEG热图采用k-means聚类,用Java TreeView软件进行观察。
1.2.5 细胞转染和分组 取IDG-CM621 d细胞,实验设置对照组(IDG-CM621 d细胞)、应力组(加载0.5 g/cm2静压力的IDG-CM621 d细胞)、si-NC组(转染si-NC的IDG-CM621 d细胞)以及si-β-catenin组(转染si-β-catenin的IDG-CM621 d细胞)。转染组均按照Lipofectamine 2000 试剂盒说明进行。
1.2.6 实时荧光定量聚合酶链反应(real-timequantitative polymerase chain reaction,RT-qPCR) 提取IDG-CM621 d的细胞总RNA,逆转录为cDNA,按试剂盒说明进行聚合酶链反应(polymerase chain reaction,PCR),检测各组Ctnnb1(β-catenin)水平以验证转染效果;同时检测成骨因子Runx2及Sp7的mRNA表达水平。引物由上海生工生物工程公司合成。
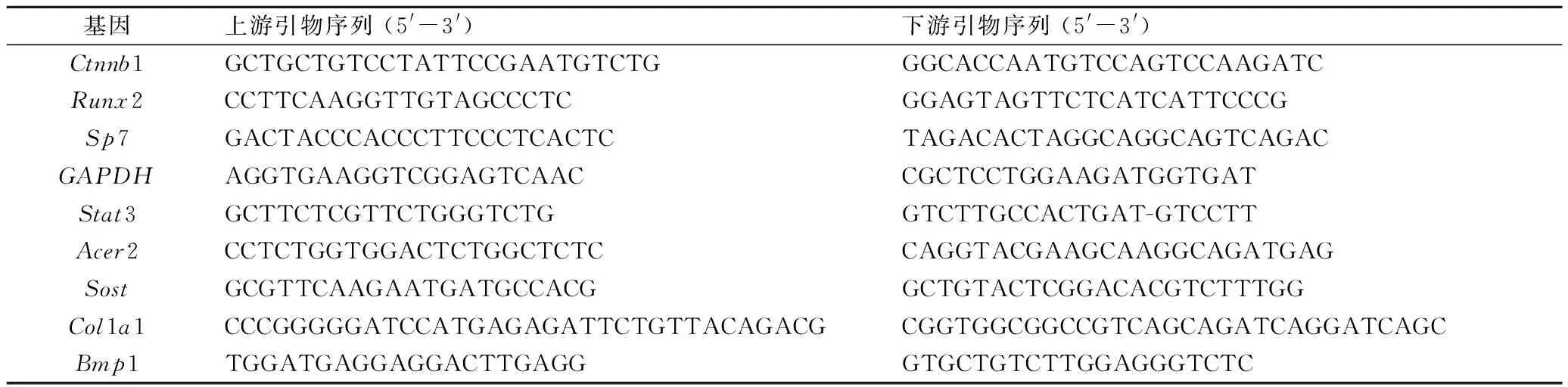
表1 qRT-PCR检测中所需引物序列Tab.1 Sequences of primers used in qRT-PCR
1.2.7 蛋白印迹(Western blot)法检测蛋白表达 提取各组细胞总蛋白,用BCA试剂盒进行定量。各组蛋白上样量为60 μg,随后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE),然后转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF),用5%牛血清BSA室温封闭,完成后用TBST(Tris-HCl缓冲盐+Tween溶液)洗涤3次,加入一抗4 ℃孵育过夜,TBST洗涤3次,加入二抗室温孵育1 h,TBST洗涤3次,暗室中曝光显影,定影,用Image J软件检测各组蛋白条带灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.2.8 茜素红染色 细胞在4%多聚甲醛缓冲液中固定10 min,然后用浓度为2%的茜素红染色10 min,随后吸净染液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,以去除未结合染料,并收集图像。为了定量分析钙沉积量,每次再加入1 mL 10%氯化十六烷基溶液直到去除所有染料。取200 μL溶液至96孔板中,使用紫外分光光度计在570 nm处测量,用10%氯化十六烷基溶液作为空白对照。
1.2.9 免疫荧光染色 对于免疫荧光染色,首先在室温下用4% PFA固定IDG-CM621 d细胞15 min,随后用PBS洗涤2次。固定后,用0.5% Triton X-100进行细胞打孔10 min后用5% BSA封闭1 h。随后PBS洗涤3次,在培养皿中加入一抗,4 ℃孵育过夜。随后用结合Cy3的二抗孵育样品2 h。DAPI和鬼笔环肽分别用于细胞核和细胞骨架的染色。最后用共聚焦激光扫描显微镜观察细胞。
1.3 统计学分析
采用SPSS 22.0 统计学软件对所有实验数据进行分析,计量资料以均值±标准差表示且所有资料均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05即认为差异具有统计学意义。
2 结 果
2.1 压应力刺激对牙骨质细胞的矿化及成骨相关因子表达水平的影响
与对照组比较,应力组IDG-CM621 d细胞茜素红着色的矿化结节显著增多,表明IDG-CM621 d细胞矿化活跃(图2A);同时,成骨矿化相关因子Runx2及Osterix的mRNA及蛋白表达水平均较对照组显著升高(图2B、C)。此外,免疫荧光染色结果显示,应力刺激下Runx2荧光信号较对照组显著上调,且在亚细胞定位层面,应力组Runx2受激活发生显著的核内转移(图2D)。
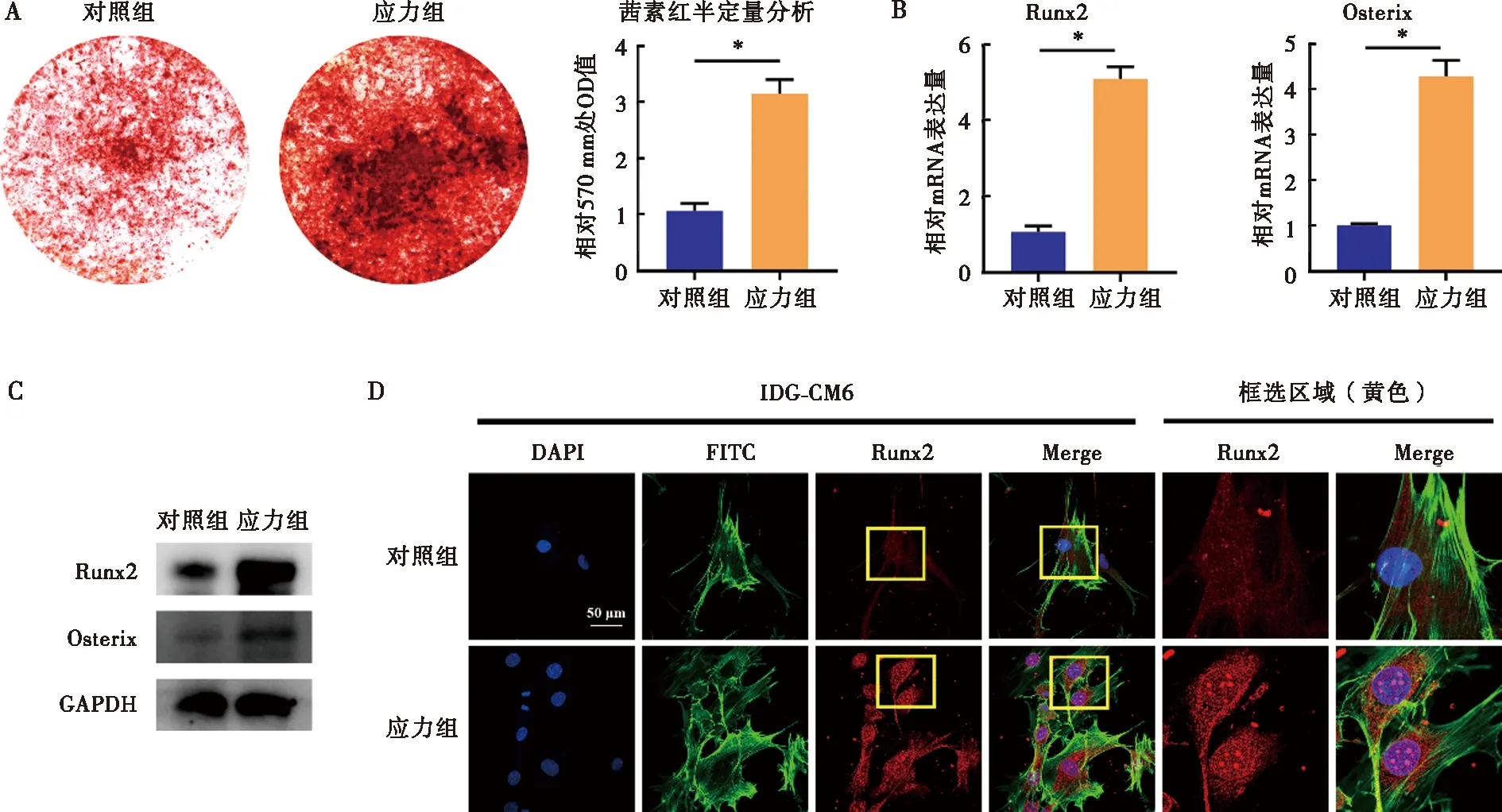
A:茜素红染色及半定量分析检测应力刺激对IDG-CM621 d细胞矿化程度的影响;B:qRT-PCR检测应力刺激对IDG-CM621 d细胞内Runx2、Sp7的mRNA表达水平的影响;C:Western blot检测应力刺激对IDG-CM621 d细胞内Runx2、Osterix蛋白表达的影响;D:免疫荧光检测应力刺激对IDG-CM621 d细胞内Runx2表达的影响;*:P<0.05图2 应力刺激对IDG-CM621 d细胞矿化相关因子Runx2、Osterix的影响Fig.2 The effects of mechanical stress on the mineralization and osteogenic factors, Runx2 and Osterix of IDG-CM6 cells subjected to osteogenic-induced medium for 21 days
2.2 压应力刺激下IDG-CM621 d细胞中β-catenin的表达变化
高通量测序结果显示,应力组相比对照组有16个成骨矿化相关基因表达上调,15个成骨矿化相关基因表达下调(图3A);将差异表达基因以热图形式呈现(图3B)并从中筛选出差异表达最显著的7条基因进行PCR检测。PCR结果与热图预测结果一致,应力组较对照组成骨矿化相关因子表达水平显著升高(图3C)。其中,Ctnnb1(β-catenin)表达水平变化最为显著,因此将其作为研究应力下牙骨质细胞矿化增加这一生物学过程的潜在靶点基因。Western blot、PCR及免疫荧光结果表明,应力下IDG-CM621 d细胞中β-catenin表达显著增加(图3D、E)。
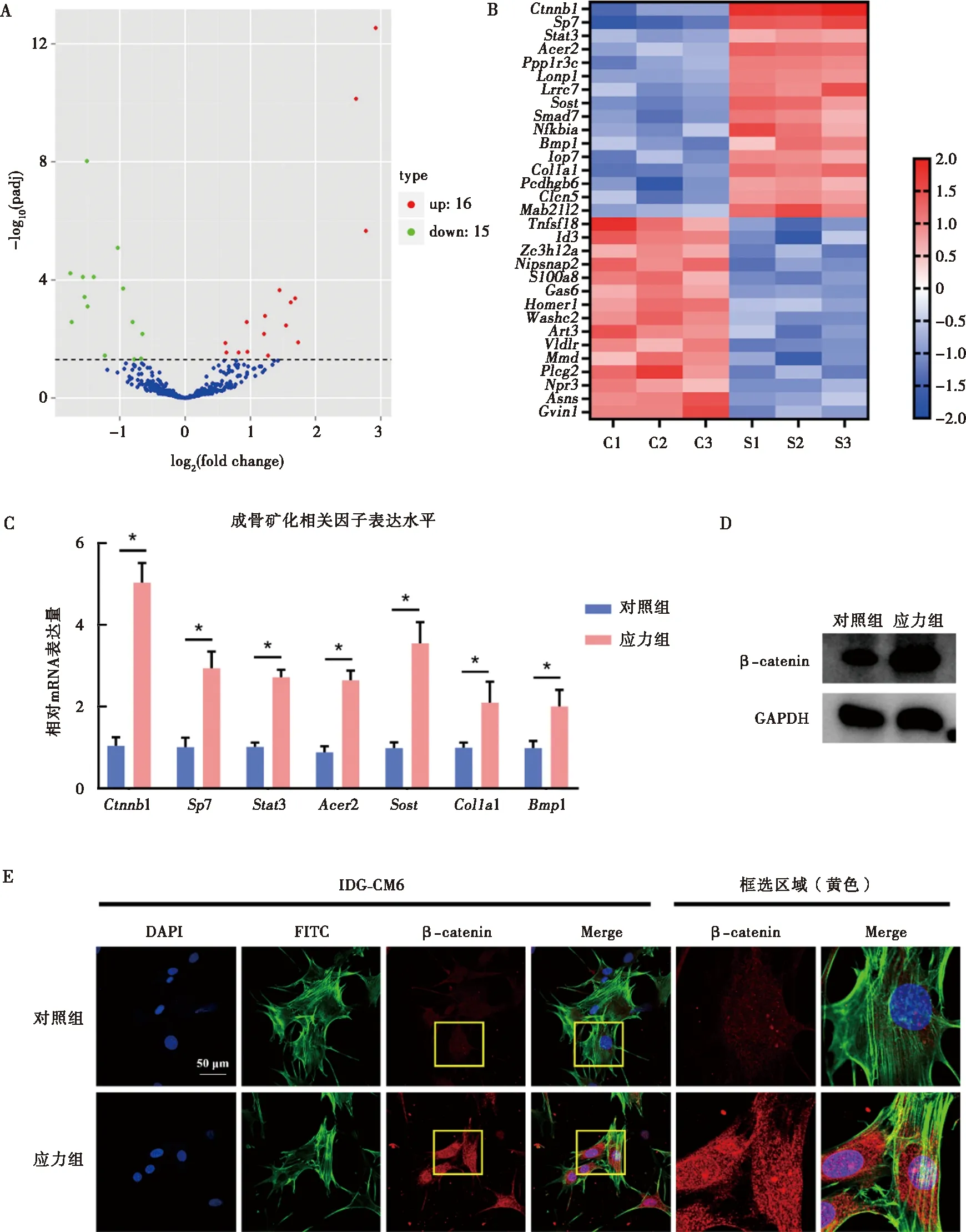
A:应力与对照组相比差异表达基因的火山图;B:差异表达基因的热图;C:筛选并采用qRT-PCR检测矿化相关因子的mRNA表达水平;D:Western blot检测应力对β-catenin的蛋白表达水平的影响;E:免疫荧光检测应力刺激对IDG-CM621 d细胞内β-catenin表达的影响;*:P<0.05图3 应力刺激下IDG-CM621 d细胞内差异表达基因的筛选及应力对IDG-CM621 d细胞内β-catenin的影响Fig.3 The differentially expressed genes of IDG-CM6 cells under mechanical stress and the effects of mechanical stress on expression of β-catenin in IDG-CM6 cells subjected to osteogenic-induced medium for 21 days
2.3 压应力刺激通过β-catenin调控牙骨质细胞矿化的潜在机制
与对照组相比,si-β-catenin组IDG-CM621 d细胞内β-catenin的基因及蛋白表达显著下调(图4)。相较对照组,IDG-CM621 d细胞内矿化程度降低,成骨相关因子Runx2及Osterix的蛋白及mRNA水平均显著减少,Runx2荧光信号强度亦减弱(图5)。当施加压应力后,IDG-CM621 d细胞矿化程度增加,Runx2及Osterix表达亦显著上升(图5)。在压应力刺激下通过si-β-catenin抑制β-catenin表达后,IDG-CM621 d细胞矿化受到抑制,Runx2及Osterix表达水平亦显著降低(图5)。
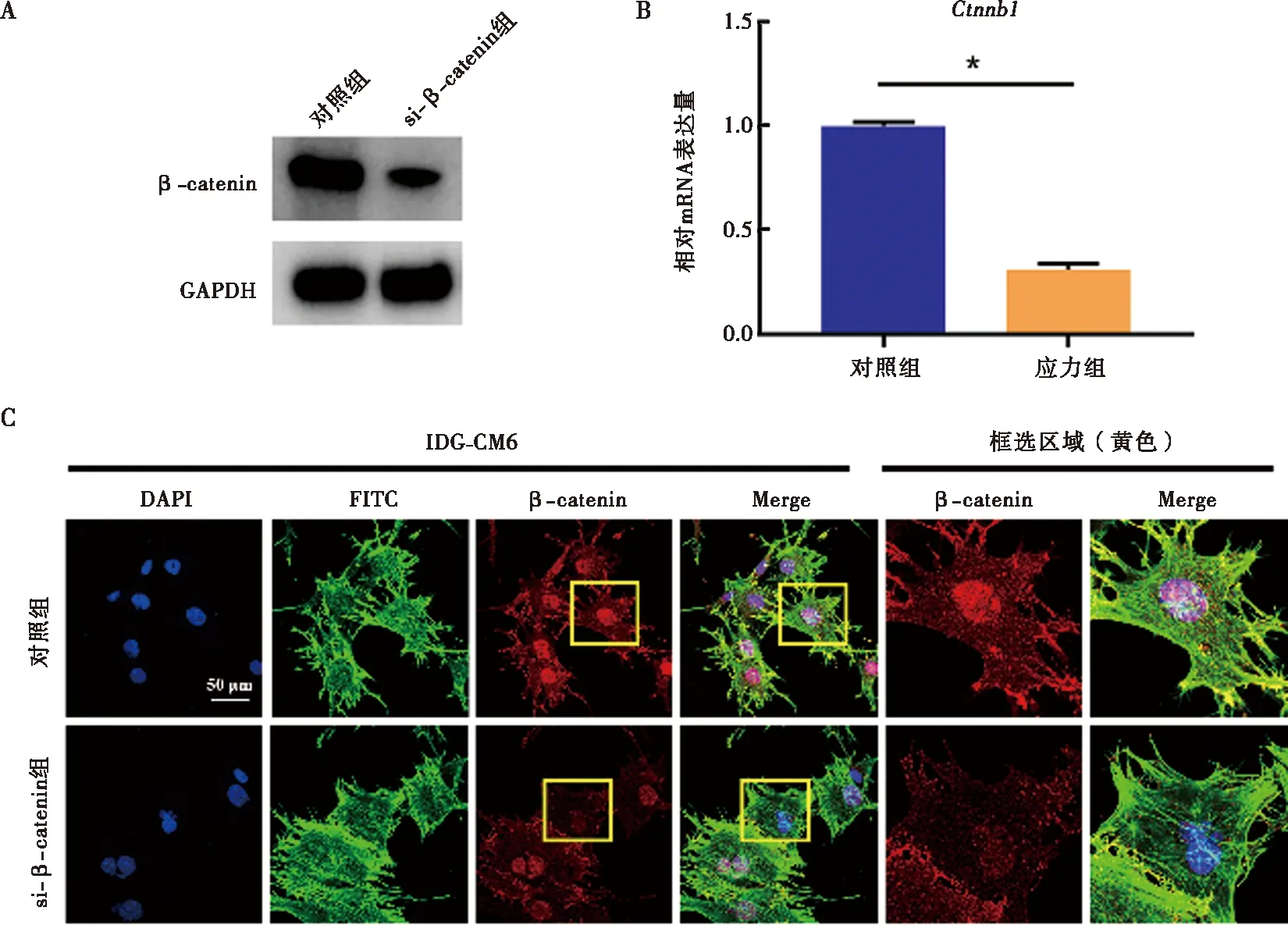
A~B:利用siRNA成功敲除β-catenin的Western blot及qRT-PCR检测;C:利用siRNA成功敲除β-catenin的免疫荧光检测;*:P<0.05图4 利用siRNA技术成功敲除IDG-CM621 d细胞内的β-catenin表达水平Fig.4 Successful knockdown of β-catenin in IDG-CM6 cells subjected to osteogenic-induced medium for 21 days using the siRNA technology
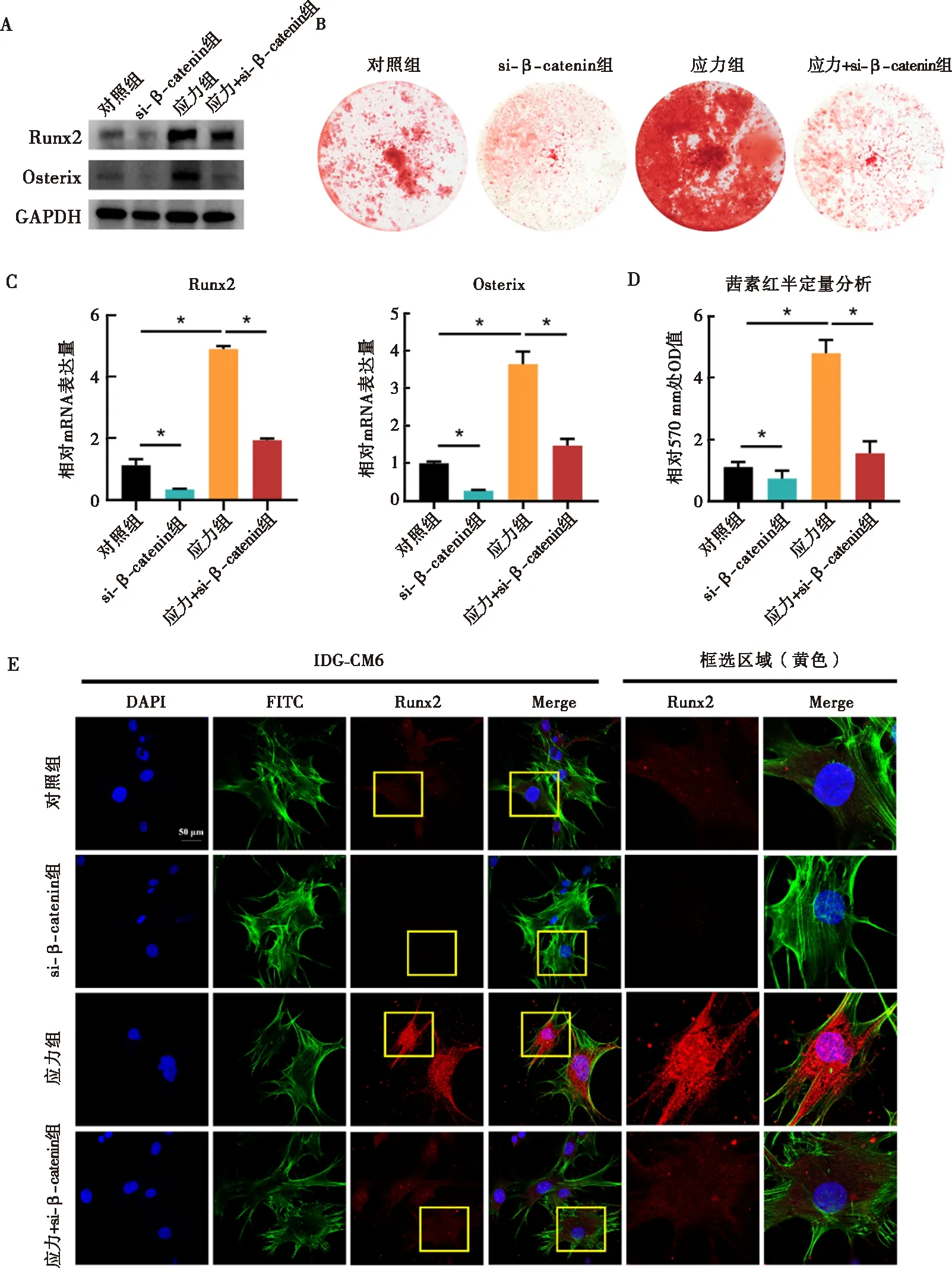
A~D:Western blot、qRT-PCR及茜素红染色检测下调β-catenin对应力下IDG-CM621 d细胞矿化以及其内Runx2、Osterix蛋白、mRNA表达的影响;E:免疫荧光检测下调β-catenin对应力下IDG-CM621 d细胞内Runx2表达的影响;*:P<0.05图5 应力刺激通过Wnt/β-catenin通路调控IDG-CM621 d细胞矿化相关因子表达水平的潜在机制Fig.5 The role of mechanical stress in regulating mineralization and osteogenic factors of IDG-CM6 cells subjected to osteogenic-induced medium for 21 days via Wnt/β-catenin signaling pathway
3 讨 论
生理情况下,牙骨质较固有牙槽骨具有更强的抗吸收能力,在牙根表面发生小范围的病理性吸收时,新生含细胞牙骨质(继发性牙骨质)的产生填补吸收凹陷区,迄今为止,此修复过程发生的机制仍不明确。此领域研究的壁垒之一是缺乏牙骨质细胞的体外研究模型。牙骨质细胞直接参与了牙骨质再矿化的生理过程,但因体外分离培养困难,所以目前有关OIRR牙骨质再矿化的细胞生物学研究较为缺乏。本课题组于美国Bonewald实验室参与并成功建立了一种新型小鼠永生化牙骨质细胞系IDG-CM6细胞。实验对矿化21 d的牙骨质细胞进行加力。前期研究表明,矿化21 d的牙骨质细胞稳定表达骨硬化蛋白(SOST),这与体内牙骨质组织中表达骨硬化蛋白一致,是其可作为牙骨质体外研究模型的重要特征之一[9,13]。因此,本实验在第21天施加压应力,以模拟体内牙骨质修复的状态。而探究轻力而非重力刺激下的牙骨质矿化机制,直接为临床中常规加力后牙根吸收的修复提供理论依据。
长期以来,细胞应力转导的机制是口腔生物力学研究领域的焦点[16]。许多应力敏感型细胞如骨细胞等,均能在感知应力刺激后引导其内各信号通路活性改变,进而产生增殖、分化、迁移、凋亡等细胞生物学行为的变化[17-18]。牙骨质细胞与骨细胞在结构及功能上均具有高度相似性,二者同样具备复杂的树突网络及微管腔隙,外界信号如机械刺激等能通过该结构向细胞内传递,并激活应力敏感型通路发生构象变化,进而调控细胞生物学反应及稳态平衡[6,8]。本课题组近期研究证实,牙骨质细胞能够转导应力信号为生化信号,激活下游PGE2及COX2等应力转导相关因子的表达,而这些因子在骨矿化再生及骨改建过程中亦发挥重要作用[1,9,19-20]。上述结论提示,应力刺激下,在牙骨质细胞将力学信号转导为生物学信号后,很可能继续参与下游牙骨质细胞的矿化及稳态平衡的调控,以发挥牙骨质细胞在OIRR再矿化进程中的作用。因此,本实验采用静压力系统对牙骨质细胞进行应力加载,该加力方式最能模拟人体内实际正畸应力微环境[21],并且方法传统有效,广泛应用于各种细胞应力转导的研究中[14,21-22]。本研究结果表明,应力组牙骨质细胞矿化程度增加,且成骨矿化相关因子表达水平亦显著升高,说明应力刺激可能促进牙骨质细胞矿化,增强其合成代谢活动。
为进一步探究正畸应力促进牙骨质细胞矿化的潜在分子调控机制,本课题组采用新兴的高通量测序技术手段,对应力刺激后的牙骨质细胞差异表达的基因进行筛选及预测。结果显示,在应力加载下,牙骨质细胞中成骨矿化相关基因显著变化。随后,本课题组进一步深入分析,筛选出差异表达最为显著的7条基因并进行PCR检测,结果表明Ctnnb1 (β-catenin)的mRNA水平增加最为显著,很可能是压应力刺激下牙骨质细胞矿化增加的关键调控因子。β-catenin是Wnt/β-catenin通路中的重要因子,其活性及表达水平影响着该通路在骨代谢平衡中的调控作用[23-24]。体内研究表明,大鼠β-catenin基因敲除后,骨小梁的骨量及密度均显著减少[25];此外,本课题组新近研究证实,β-catenin在牙骨质细胞矿化过程中发挥重要调控作用,其正向/逆向调控作用依赖于自身浓度水平范围[26]。综上提示,β-catenin活跃参与了骨及牙骨质等矿化组织稳态平衡的调控过程。本课题组研究结果显示β-catenin的蛋白及荧光水平较对照组显著增加,呈现与mRNA相同的变化趋势;同时,在亚细胞定位层面,β-catenin受应力刺激后发生显著的核内转移,核内定位的β-catenin表达较对照组显著上调。上述表明,应力刺激能够促进牙骨质细胞中β-catenin的表达并激活其入核,进而可能对下游成骨矿化相关靶基因发挥调控作用。
在此前实验结果基础上,本课题组通过敲降牙骨质细胞系IDG-CM6细胞内的β-catenin,深入探究了β-catenin在应力促进的牙骨质细胞矿化过程中所发挥的调控功能。结果表明,应力激活的牙骨质细胞矿化增加能够被si-β-catenin所逆转,结合此前实验结果可得,应力刺激可能是通过调控β-catenin的水平进而影响牙骨质细胞的矿化及稳态平衡。这与骨细胞在应力刺激下发生β-catenin上调并调控骨稳态的结论一致[27]。
综上所述,应力刺激能够促进牙骨质细胞矿化,成骨相关因子表达水平升高;β-catenin在该过程中发挥了重要调控作用,应力刺激可能是通过上调牙骨质细胞内β-catenin的表达水平进而调控牙骨质细胞矿化,并最终调控牙骨质稳态及牙根吸收的再矿化。此研究为正畸临床OIRR的再矿化修复提供了新的理论依据,丰富了牙骨质修复机制的研究。

