介孔生物活性玻璃/聚己内酯短纤维骨组织工程支架体外抑炎功能研究
冯泽华,邱 爽,徐萱雯,郑 凯,徐 艳
牙周炎是目前全球成人失牙的主要原因,多表现为牙龈红肿出血、牙齿松动、牙周软硬组织缺损[1]。目前恢复牙周组织缺损的主要方法为引导性组织再生(guided tissue regeneration,GTR),有时还需要配合骨组织支架以维持其空间及形态[2]。骨组织工程支架可模拟细胞外基质(extracellular matrix,ECM),形成适合细胞接种和培养的结构与环境,促进干细胞的成骨向分化,从而促进牙周骨再生[3]。
植入物移植后往往会导致局部异物反应(foreign body response,FBR),局部过度炎症反应可能导致植入失败。髓系细胞(包括巨噬细胞、中性粒细胞和单核细胞),尤其是巨噬细胞,在生物材料的FBR和降解中起着关键作用[4]。同时巨噬细胞还可通过分泌细胞因子影响骨再生微环境,如M1型(促炎型)巨噬细胞释放TNF-α和IL-1β,不仅抑制成骨细胞合成分泌碱性磷酸酶(alkaline phosphatase,ALP),还对细胞外骨基质的分泌和钙化产生负面影响,而M2型(抑炎型)巨噬细胞则可促进组织修复[5]。因此,目前合成制备能够发挥免疫调节作用的植入支架材料已成为组织再生工程的研究热点。
1 材料与方法
1.1 试剂和仪器
PCL(Mn 80000)、明胶、羧甲基壳聚糖(carboxymethyl chitosan,CMCS)、乙酸(纯度99%)、甲酸(纯度99%)、来自牙龈卟啉单胞菌的细菌脂多糖(lipopolysaccharide,LPS)(Sigma,美国),叔丁醇、十六烷基三甲基溴化铵(cetrimonium bromide,CTAB)、乙酸乙酯(ethyl acetate,EA)、饱和氨水、正硅酸四乙酯(tetraethyl orthosilicate,TEOS)、无水乙醇、二水合氯化钙(麦克林,中国),RAW 264.7细胞系(中国科学院,中国),CCK-8试剂盒、Calcein/PI细胞活性与细胞毒性检测试剂盒(碧云天,中国),鼠抗F4/80 Percp-cy5.5、鼠抗CD86(B7-2)FITC、鼠抗CD206 PE(Abcam,英国),PBS-牛血清白蛋白溶液(0.1%BSA,源叶,中国),小鼠 Fc 受体阻断剂(爱必信,中国),通用内参抗体鸡尾酒套装(Abbkine,中国),流式染色缓冲液(Biosharp,中国),逆转录试剂盒(Takara,日本),SYBR Green PCR matter mix(诺唯赞,中国)。
桌面型静电纺丝机(纳仪仪器,中国),高速均质机(基铭仪器,中国),离子溅射镀膜仪(Emitech,英国),热场发射扫描电子显微镜及X射线能谱仪(energy dispersive spectrometer,EDS)(FEI,美国),全波长酶标仪(MD,美国),数码相机(佳能,日本),CO2细胞培养箱(Heraeus,美国),超净工作台(Baker,美国),流式细胞仪(BD,美国),体视显微镜(Nikon,日本),倒置荧光显微镜(Leica,德国),扫描电子显微镜(scanning electron microscopy,SEM)(Philips,荷兰),荧光定量PCR仪(ABI,美国),离心机、超微量紫外分光光度计、细胞计数仪(赛默飞,美国),喷金设备(Quorum,英国)。
1.2 支架制备
所有制备过程都在室温和50%~60%的相对湿度条件下进行。
1.2.1 静电纺丝 将PCL(Mn 80000)溶解在乙酸和甲酸(体积比1∶1)中配制成质量分数为15%的PCL溶液,在室温下磁力搅拌6 h直至充分溶解。将该溶液加入到10 mL注射器,连接21G针头(内径为0.51 mm),用注射泵控制溶液流速为0.4 mL/h。一块铝箔被固定在接地的滚筒收集器上,与针尖距离为15 cm,收集器转速为400 r/min。高压电源通过一金属夹加载于针头上,施加的电压固定为14 kV。稳定纺丝6 h后收集铝箔表面的电纺膜。
1.2.2 PCL纳米纤维的制备 将PCL电纺膜切割成约1 cm×1 cm的纤维膜,分散在75%乙醇中,使用带有11.5 mm直径刀头的FSH-2A高速均质机粉碎成纳米纤维悬浊液。均质机在2 min内匀速加速到20 000 r/min,高速工作5 min后,使用1 mm孔径的过滤网过滤悬浊液,滤网上的剩余物质被反复均质和过滤。之后,纳米纤维悬浊液经历离心和48 h的冷冻干燥,获得PCL纳米短纤维。
1.2.3 PCL海绵的制备 称量30 mg PCL纳米短纤维,转移到含2 mL 20%(体积分数)叔丁醇的5 mL烧杯中。充分混合后,再加入750 μL去离子水,静置20 min,等待PCL纳米短纤维浮起。然后沿瓶壁缓慢加入750 μL 0.1 g/mL明胶溶液,静置20 min,48 ℃水浴5 min,获得PCL海绵。去离子水清洗海绵3次,去除多余的明胶,37 ℃烘干24 h。
对坡脚进行垂直切坡处理后,斜马道宽度拓展为4.85 m,即上坝道路初期坝下游坝面段实际宽度达到4.85 m,增强了道路的安全通行条件。
1.2.4 MBGN的合成 MBGN采用基于微乳化的溶胶-凝胶法合成。2.8 g的十六烷基三甲基溴化铵溶解在132 mL的去离子水中。在35 ℃下持续磁力搅拌直至溶液澄清透明后,加入40 mL乙酸乙酯,25 ℃水浴磁力搅拌30 min,加入28 mL 1 mol/L氨水溶液,搅拌15 min后向上述混合物中加入144 mL正硅酸四乙酯,搅拌30 min后再加入4.06 g CaCl2·2H2O,搅拌4 h。离心收集形成的白色沉淀,用去离子水和无水乙醇各清洗1次,在60 ℃下干燥过夜,然后以2 ℃/min的加热速度在700 ℃下煅烧3 h。
1.2.5 PCL@MBGN的合成 去离子水配制质量分数为5%的CMCS溶液。根据加入MBGN相对于CMCS的质量分数(0%、100%、150%),这些溶液分别被命名为0%MBGN、100%MBGN、150%MBGN。分别将250 μL上述溶液均匀地滴在PCL海绵的表面,37 ℃烘干2 d,得到的支架分别被命名为PCL@0MBGN,PCL@100MBGN,PCL@150MBGN。
1.3 MBGN、PCL电纺膜和PCL@MBGN支架的表征
用SEM观察MBGN、PCL电纺膜的形态和PCL@MBGN的横截面,同时采用EDS检测其元素组成。在用SEM观察之前,试样通过喷金设备喷金。
1.4 体外细胞毒性
1.4.1 细胞培养 RAW264.7细胞系在DMEM完全培养基(含100U/mL青霉素、100 mg/mL链霉素和10%胎牛血清)中传代,5%CO2、37 ℃培养箱内培养,传至3~4代后开始使用。
1.4.2 细胞毒性 根据试剂盒说明书,使用CCK-8法进行PCL@0MBGN、PCL@100MBGN、PCL@150MBGN的细胞毒性检测。将支架在DMEM培养液中浸泡24 h,支架DMEM浸提液的终浓度为1 g/L,用0.22 μm的过滤器过滤浸提液。将RAW 264.7以每孔3 000个细胞接种在96孔板中,贴壁培养12 h后,将细胞培养基换成条件培养基(PCL@MBGN浸提液、100 U/mL青霉素、100 mg/mL链霉素和10%胎牛血清),空白对照组使用DMEM完全培养基换液。培养24、48 h后,分别在96孔培养板中加入CCK-8试剂,并在37 ℃下培养2 h,酶标仪检测获得各孔在450 nm处的吸光度。活死细胞染色也同时按Calcein/PI细胞活性与细胞毒性检测试剂盒说明书进行,在24、48 h使用倒置荧光显微镜下观察并拍照。
1.5 体外抗炎能力
1.5.1 细胞处理 调整RAW 264.7细胞悬液密度为5×105个/mL,流式细胞术检测所用接种于培养皿中,qRT-PCR所用细胞接种于6孔板中,贴壁培养12 h后,除空白对照组外均加入100 ng/mL LPS刺激细胞12 h,诱导炎症反应后,PCL@MBGN处理组予以浸提液处理48 h。
1.5.2 流式细胞术检测极化水平 浸提液刺激结束后,消化、收集细胞,4 ℃条件下650×g离心4 min,于100 μL染色缓冲液(1% PBS-BSA)中重悬,加入2 μL FcR阻断剂,4 ℃避光孵育10 min,涡旋混匀。加入相应流式抗体(F4/80、10 μL CD86,40 μL CD206)和100 μL antibody cocktail进行表面染色,4 ℃避光孵育60 min,700 μL染色缓冲液洗涤2次,离心,300 μL染色缓冲液重悬细胞,上机检测。
1.5.3 qRT-PCR检测相关基因转录水平 Trizol法提取细胞总RNA,取1 μg RNA反转录成cDNA。引物由上海生工生物工程有限公司合成,序列见表1。按照SYBR Green PCR matter mix说明书进行real-time PCR检测,反应条件为95 ℃,30 s预变性;5 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。重复3次,数据按2-ΔΔCt的方法分析炎性相关细胞因子肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素1β(interleukin-1 beta,IL-1β)、白细胞介素4(interleukin-4,IL-4)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOs)的mRNA相对浓度。
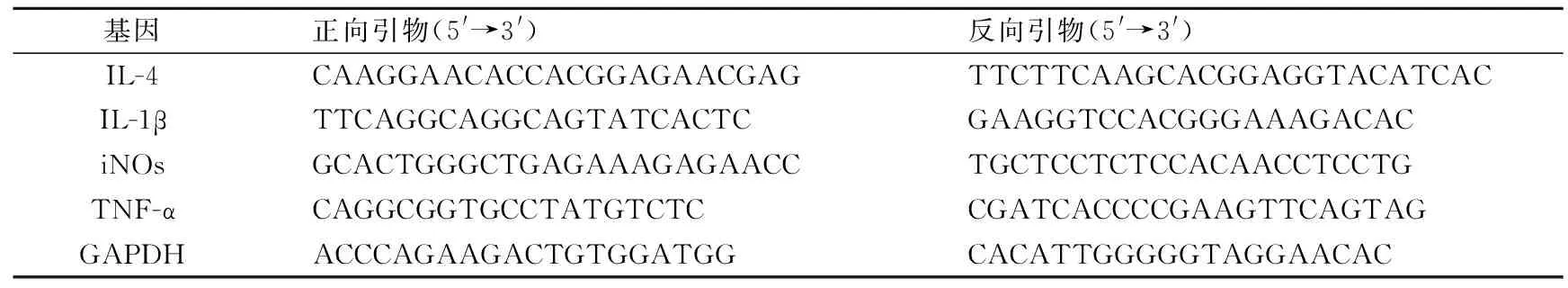
表1 引物设计Tab.1 Primer designs
1.6 统计学分析

2 结 果
2.1 支架制备与形貌
本研究选用“良性溶剂”甲酸和乙酸作为PCL的溶剂,通过静电纺丝获得了质量分数为15%的PCL静电纺丝膜。在SEM下观察,静电纺丝纤维分布均匀、无明显液滴,纤维的平均直径为(261±76)nm(图1E)。通过分散、均质化、筛选和冻干可以获得PCL纳米短纤维(图1B),再利用明胶的热自组装和烘干,合成PCL纳米纤维海绵。PCL纳米纤维海绵呈白色,表面疏松多孔。

A:PCL静电纺丝纤维膜数码照片图;B:PCL短纤维数码照片图;C:PCL@MBGN在吊兰叶片上数码照片图;D:MBGN与PCL@150MBGN的EDS结果;E:PCL电纺纤维膜SEM图;F:MBGN的SEM图;G:PCL@0MBGN的横截面SEM图;H:PCL@100MBGN的横截面SEM图;I:PCL@150MBGN的横截面SEM图图1 PCL@MBGN支架材料的制备与性能Fig.1 Preparation and morphology of PCL@MBGN scaffolds
通过溶胶-凝胶法合成的MBGN,SEM下呈均匀的球形颗粒,粒径在100~200 nm(图1F)。CMCS具有黏性作为粘接介质,可以将MBGN粘接于PCL纳米纤维表面(图1H、I)。将含有不同浓度MBGN的CMCS溶液滴加于PCL海绵上,利用重力和海绵的吸水性使其分布于海绵表面及内部,再烘干以获得MBGN增强的PCL海绵(PCL@MBGN),此时的PCL@MBGN由于CMCS的添加呈淡黄色(图1C),各组间的宏观形貌无明显差异。同时观察到PCL@MBGN可静置于吊兰叶片尖端。
PCL@MBGN横截面SEM结果可见PCL@0MBGN组的纤维直径不规则增加,表面可见凝胶涂层(图1G)。添加MBGN组纤维表面可见颗粒状MBGN附着在纤维表面(图1H、I),且随MBGN添加量增加而纤维表面颗粒含量增加。
EDS结果(图1D)显示MBGN的主要组成元素为O、Si、Ca,其中Si的质量分数为19.4%,Ca的质量分数为2.9%。PCL@150MBGN的主要组成元素为C、O、Si,其中Si的质量分数为2.6%,Ca质量分数为0.1%,与MBGN中Ca添加量较低有关。
2.2 体外细胞毒性
RAW 264.7细胞在浸提液中培养24 h和48 h后均表现为良好的增殖活性。PCL@MBGN各组在浸提液中培养24 h后,较空白对照组均表现为高于110%的增殖活性,PCL@0MBGN(P<0.01)、PCL@150MBGN组(P<0.05)明显增高,其中PCL@0MBGN组增殖活性最高,但PCL@MBGN各组间无明显差异(P>0.1)。在浸提液中培养48 h后,PCL@MBGN组仍表现为高于空白对照组的增殖活性,且随MBGN添加量增加,增殖活性越强(图2)。以上结果表明PCL@MBGN对RAW 264.7细胞无毒性,且MBGN的添加可能促进细胞的增殖。
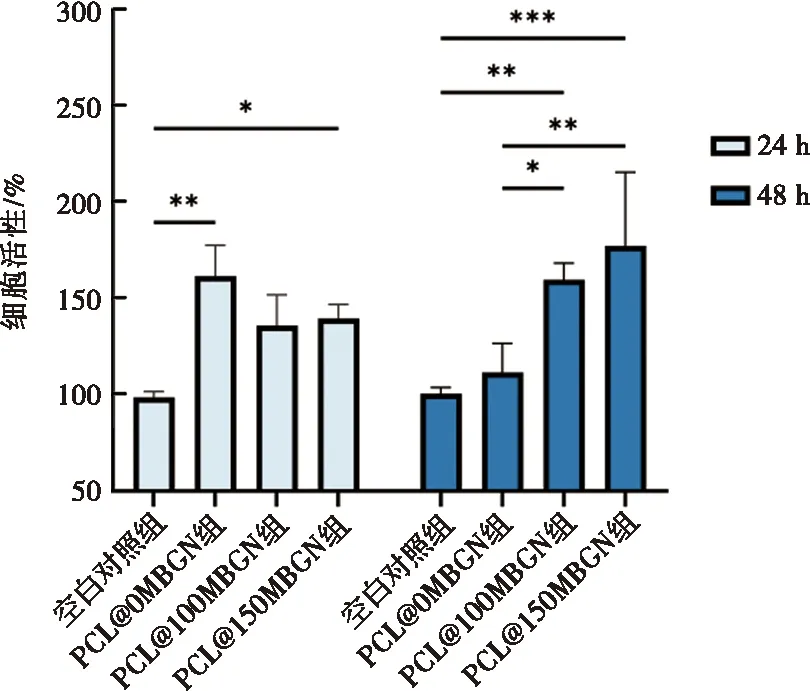
*:P<0.05,**:P<0.01,***:P<0.001图2 RAW264.7细胞在PCL@MBGN浸提液中培养24 h和48 h后的细胞活性Fig.2 RAW264.7 cells viability after 24 and 48 hours of cultivation in PCL@MBGN extract
活死细胞染色显示,各组均未见大量红色荧光指示的死细胞,验证PCL@MBGN无细胞毒性(图3)。
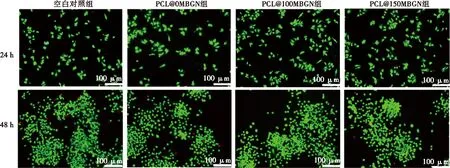
绿色荧光指示活细胞,红色荧光指示死细胞图3 RAW264.7细胞在PCL@MBGN浸提液中培养24 h和48 h后活死细胞染色结果Fig.3 RAW264.7 cells viability after 24 and 48 hours of cultivation in PCL@MBGN extract
2.3 体外免疫调节能力
流式细胞术结果显示,LPS作用后,CD86阳性率较空白对照组有明显提高(P<0.05),PCL@MBGN浸提液处理48 h后,CD86+M1型巨噬细胞比例随MBGN添加量增加而减少;CD206+M2型巨噬细胞比例增加,虽然增加量较少,但增长倍数明显提高(P<0.05)。未添加MBGN的PCL@0MBGN组也较LPS处理组CD86+M1型巨噬细胞比例降低,CD206+M2型巨噬细胞比例增加(P<0.05)(图4、表2)。

A:空白对照组;B:添加100 ng/mL LPS的DMEM完全培养基培养12 h;C:LPS+PCL@0MGBN组;D:LPS+PCL@100MGBN组;E:LPS+PCL@150MGBN组图4 PCL@MBGN浸提液对RAW 264.7细胞极化水平影响 Fig.4 The effect of PCL@MBGN extracts on the polarization level of RAW 264.7 cells
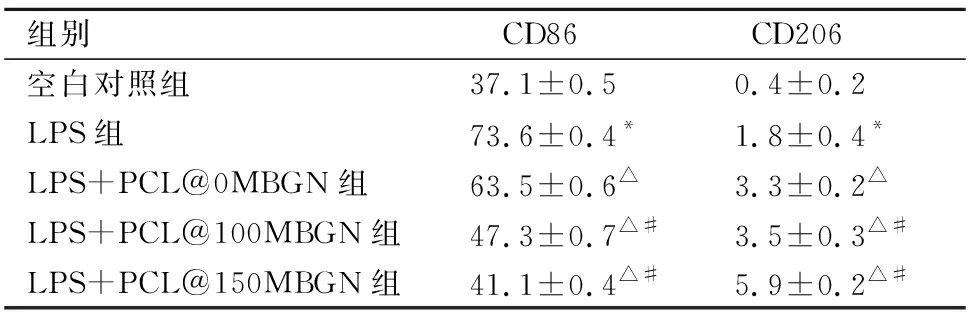
表2 PCL@MBGN浸提液对RAW 264.7细胞极化水平影响Tab.2 The effect of PCL@MBGN extracts on the polarization level of RAW 264.7 cells %
qRT-PCR检测IL-4、IL-1β、TNF-α、iNOs等免疫相关基因转录水平如表3所示。在LPS刺激下,炎性相关的IL-1β、TNF-α、iNOs的转录水平较空白对照组显著上调,而抑炎相关因子IL-4下调,表明本研究成功诱导RAW 264.7细胞炎性反应。与LPS组相比,PCL@MBGN各组中IL-4转录水平均明显提高(P<0.001),且MBGN添加量越多,IL-4转录水平越高(P<0.000 1);IL-1β、TNF-α、iNOs转录水平明显下降(P<0.05);LPS+PCL@150MBGN IL-1β、iNOs、TNF-α表达最低,IL-4表达最高,抑炎效果最好。
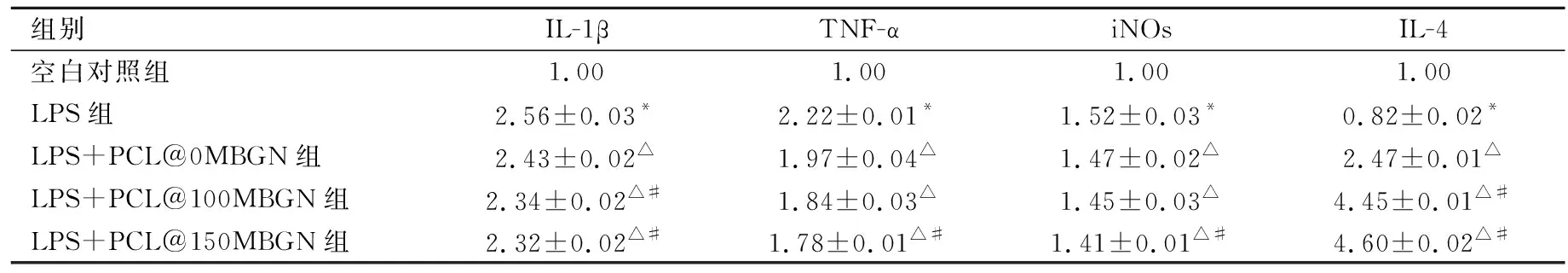
表3 PCL@MBGN浸提液对炎症相关细胞因子基因转录水平影响Tab.3 The effect of PCL@MBGN extract on the transcription level of inflammatory related cytokine genes
3 讨 论
目前使用CMCS进行静电纺丝纤维表面改性并粘接MBGN,合成PCL/MBGN复合3D支架材料用于骨组织工程尚未见相关报道。本研究结合利用静电纺丝、均质化、明胶热自组装、CMCS表面改性等技术将溶胶-凝胶法合成的MBGN粘接于纳米纤维表面,成功合成了3D结构的纳米纤维支架PCL@MBGN。


巨噬细胞极化与机体功能和疾病发生发展密切相关[16]。在骨再生过程中,M1型巨噬细胞释放大量促炎细胞因子(如TNF-α、IL-1β和IL-6),抑制骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)和成骨细胞的增殖和成骨分化[17],促进成骨细胞凋亡,并激活破骨细胞[18-19],对成骨产生抑制作用[20-23]。TNF-α刺激成骨细胞分泌NF-κB配体的受体激活剂,与单核细胞膜受体结合,通过激活NF-κB途径促进单核细胞向破骨细胞分化[24]。在这个过程中,活性氧(reactive oxygen species,ROS)增加[25],进一步放大了炎症级联反应,且ROS可以抑制BMSCs的成骨分化[26],加速成骨细胞的衰老和功能障碍[27]。因此通过抑制巨噬细胞的M1型分化,并抑制促炎因子分泌将有利于BMSCs的成骨向分化,创建一个有利于成骨的免疫微环境。该复合支架免疫调节功能与促进骨再生之间的内在机制还有待进一步探究。
4 结 论
综上,本研究成功制备了由PCL和MBGN组成的具有3D结构的复合骨组织工程支架,该支架在体外发挥了抑炎作用,抑制了小鼠RAW264.7巨噬细胞系向M1型极化,并在一定程度上促进其向M2型极化,并抑制促炎因子转录,这可能是其促进骨再生的一个潜在机制。PCL@MBGN在骨再生应用,尤其是炎症环境下的骨缺损修复具有很大的潜力。

