淡水环境及水产品中酰胺类除草剂残留现状研究进展
曾斯丽,高磊,王鹏,陈中祥,黄晓丽,覃东立*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海201306;3.农业农村部渔业环境及水产品质量监督检验测试中心(哈尔滨) 150070,4.东北林业大学,黑龙江 哈尔滨 150040)
酰胺类除草剂是农业生产中应用较为广泛的一类除草剂,主要包括甲草胺、乙草胺、丙草胺、丁草胺和异丙甲草胺等,其适用于玉米、花生、大豆、棉花、水稻等主要农作物防除杂草,生产中应用面积大,目前已成为世界上应用最广、使用量最大的除草剂种类之一[1]。酰胺类除草剂在保证粮食丰收的同时,其在环境中的残留,也带来了潜在的风险。酰胺类除草剂的土壤吸附常数较低,水溶性较强,施用在农田里的酰胺类除草剂经雨水冲刷、地表径流等方式进入到养殖水体中,导致渔业生态环境污染。有研究表明,在河流、湖泊、水库、池塘等水环境中都存在酰胺类除草剂的残留[2-4]。进入渔业生态环境的酰胺类除草剂,首先会对鱼类等水生动物产生不良影响[5]。更引人关注的是,在水生生态中,鱼类处于食物链的顶端,表现出高度的除草剂生物蓄积性[6]。通过食物链的传递,该类除草剂可能对人类健康产生危害。
现有研究表明,酰胺类除草剂及其在环境中的代谢物对人和动物具有较强的毒性效应[6-7],鉴于其毒性危害,美国环境保护署(Environmental protection agency, EPA)于1994年将乙草胺列为B-2类致癌物[8]。欧盟于1998年规定了地表水中每种氯乙酰胺类除草剂最大允许浓度为1.0 μg/L,饮用水中最大允许浓度为0.1 μg/L[9]。甲草胺等5种酰胺类除草剂在欧盟被禁止使用(表1)。日本针对6种酰胺类除草剂规定了其在水产品中的最大残留限量(表1)。中国现已制定生活饮用水中甲草胺的最大残留限量[10]和大豆、玉米、糙米等农作物中乙草胺等4种酰胺类除草剂的最大残留限量,但暂未制定水产品中酰胺类除草剂的限量标准。
目前,国内尚没有关于酰胺类除草剂在水产品中检测方法的标准,有关酰胺类除草剂在水产品中的残留动态研究缺乏,导致针对该类除草剂对水产品质量安全的影响评估面临诸多困难。为解决上述问题,本研究在总结酰胺类除草剂的性质及检测技术现状的基础上,概述了其在淡水渔业环境及水产品中的残留现状,旨在为进一步开发渔业环境及水产品中酰胺类除草剂的检测技术和开展水产品中酰胺类除草剂残留风险评估以及稻渔综合种养模式下酰胺类除草剂在水产品中的污染特征、归趋和富集效应研究提供参考。同时,为科学制定水产品中酰胺类除草剂污染防控措施和保障水产品质量安全、保障消费者健康提供参考。
1 酰胺类除草剂概述
1.1 物理及化学性质
酰胺类除草剂是具有—CONH结构的除草剂,其种类繁多,按照化学结构可将其分为两类,一类是氯乙酰胺类,主要包括甲草胺、乙草胺、丙草胺、丁草胺和异丙甲草胺;另一类是芳酰胺类,主要包括苯噻酰草胺和敌稗。常见的酰胺类除草剂品种及其英文名称、CAS号、分子式、分子量、沸点等信息见表1。
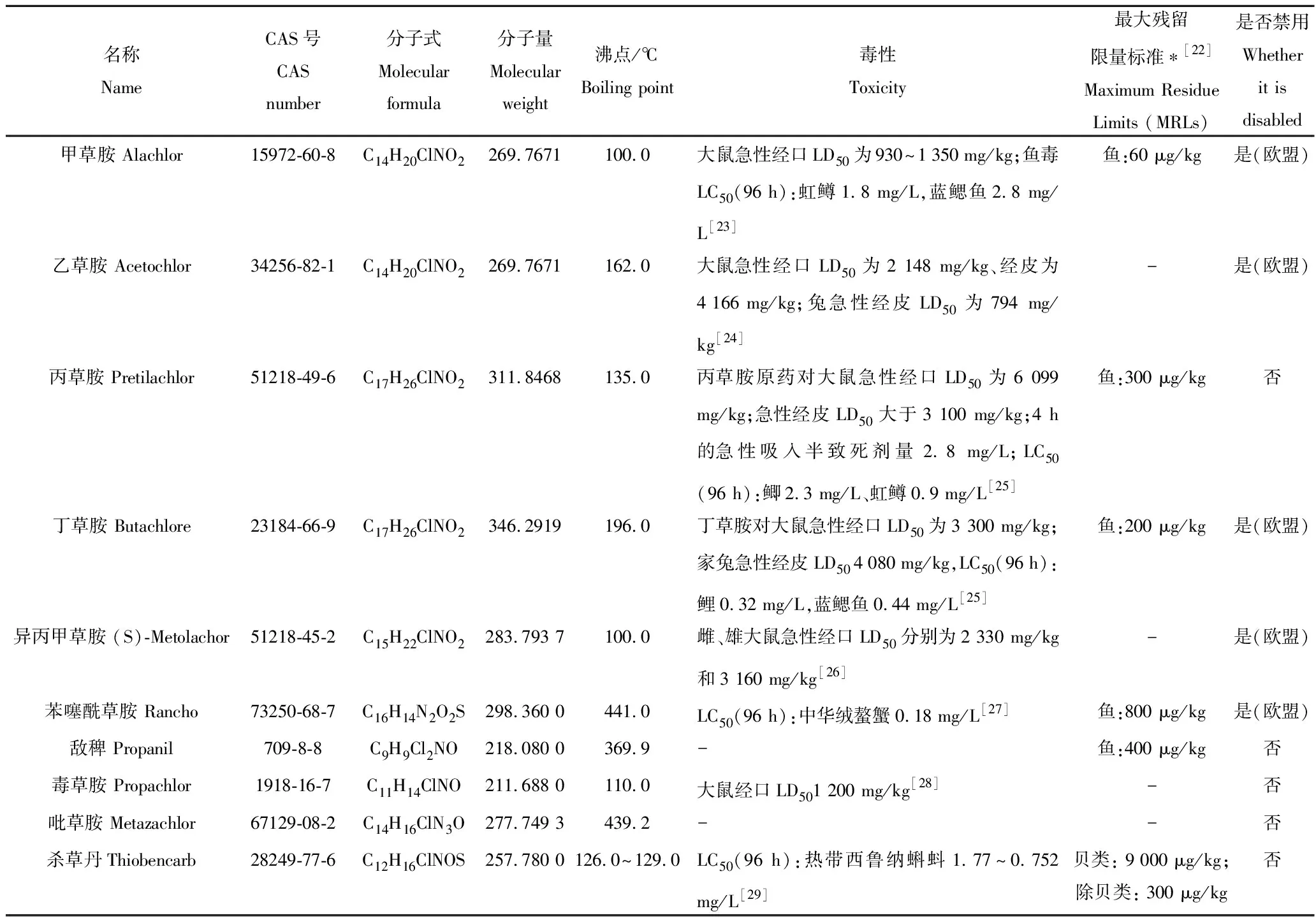
表1 酰胺类除草剂基本信息Tab.1 Basic information of amide herbicides
1.2 毒理学性质
酰胺类除草剂原药多属于低毒类农药,其对人、牲畜表现出较低毒性(酰胺类除草剂的毒理学数据见表1)。但酰胺类除草剂代谢或降解的中间产物毒性较高,其在环境中易转化为二烷基苯醌亚胺,该物质对人和动物有致癌风险[7]。乙草胺在自然环境中可以降解成为乙基磺酸类产物,其对水生动物及两栖类有较强的毒性效应[11]。与哺乳类动物相比,酰胺类除草剂对鱼类生物的毒性较强。研究表明,酰胺类除草剂对水生动物具有遗传毒性、免疫毒性和生殖毒性[12]。甲草胺、乙草胺能够抑制斑马鱼(Daniorerio)胚胎孵化,导致斑马鱼发育畸形[13],出现细胞凋亡、内分泌系统紊乱等症状[14]。乙草胺和丙草胺会降低斑马鱼胚胎及幼虫阶段与先天免疫相关的基因转录,抑制先天免疫系统发挥作用[14]。丁草胺胁迫下导致虹鳟(Oncorhynchusmykiss)出现血浆睾酮水平降低,参与减数分裂的基因表达下调,减数分裂过程和精子发生进程受抑制生殖毒性表现[15]。
1.3 迁移转化规律
酰胺类除草剂在土壤中的迁移规律分为两个方向:水平方向和垂直方向[16]。水平方向主要是通过水土流失、地表径流等,使除草剂横向流动;垂直方向是通过渗透作用或者大气沉降的方式进入到土壤中,从土壤表层向下移动,最终进入到地下水中。研究表明,乙草胺在不同土壤中的半衰期为:华北褐土(4.2 d)<湖南红土(6.5 d)<东北黑土(10.7 d),偏碱性土壤的降解速率大于偏酸性的土壤[17]。
酰胺类除草剂的降解途径包括非生物降解(直接光解和间接光解)和生物降解。季节和水质对降解速率影响较大[18],冬季河水中的半衰期为:丁草胺(159 d)<异丙甲草胺(206 d)<乙草胺(410 d);夏季河水中的半衰期为:丁草胺(7 d)<乙草胺(27 d)<异丙甲草胺(32 d)。微生物降解机制主要为矿化作用和共代谢作用[16]。罗玮等[19]分离出以乙草胺为唯一氮源的菌株,对乙草胺的降解率达到了80.2%。酰胺类除草剂也能够被植物吸收利用[20],黄晓丽等[21]研究发现空心菜(Ipomoeaaquaticaforssk)可以加速水溶液中丙草胺和丁草胺的降解,空心菜水培组与无植物组相比丁草胺与丙草胺的平均去除率分别提高了65.19%和70.49%。
2 检测技术研究进展
目前,酰胺类除草剂残留的检测及相关研究主要涉及水体、土壤、大豆、玉米等多种基质[6],关于淡水水产品中残留现状也有研究,但相对较少。酰胺类除草剂样品的检测一般包括样品前处理和仪器分析两个环节。本研究主要从养殖环境及水产品中酰胺类除草剂样品的前处理方法和仪器分析方法两个方面进行简要综述,以期为该类除草剂的残留检测技术研发奠定基础。
2.1 样品前处理技术
样品前处理包括提取、分离、浓缩和净化等步骤,是农药残留分析的关键和重要环节。农药检测分析的误差约50%来源于样品的前处理过程,且多数样品前处理的工作量超过全部分析过程的70%。
针对不同的样品基质,所采用的样品前处理方法也不同。目前,针对环境水质样品中酰胺类除草剂的前处理方法主要有固相萃取(Solid-phase extraction,SPE)[30-32]、液液萃取(Liquid-liquid extraction,LLE)[33]和分散液液微萃取(Dispersive liquid-liquid microextraction, DLLME)[34]等;针对环境底质样品中酰胺类除草剂的前处理方法主要有固液提取结合层析柱净化[35-36]、分散固相萃取(Dispersive solid-phase extraction,DSPE)[37-38]、加速溶剂萃取(Accelerated solvent extraction, ASE)[39]等;针对水产品样品中酰胺类除草剂的前处理方法主要有SPE[40]、QuEChERS技术[41]、凝胶渗透色谱(Gel permeation chromatography, GPC)[42]等。
随着检验检测技术的不断发展,样品前处理技术也向着高效、快捷、环保、自动化和微型化等方向发展。一方面,现有的样品前处理技术进一步优化和完善。Gao等[8]开发了一种薄层超声提取结合SPE技术,将其应用到鲤(Cyprinuscarpio)鱼肉中7种酰胺类除草剂的检测中,结果显示该方法的萃取效率得到了较大的提高。朱富强等[43]利用乙腈提取水产品中25种磺酰脲类及磺酰胺类除草剂,采用SHIMSEN QVet-NM +固相萃取柱净化,结果表明方法简便快速。另一方面,相关文献报道的其他农药或基质所使用的前处理方法也会陆续应用到水产养殖环境和水产品中酰胺类除草剂的检测,如基质固相分散萃取技术[44]、顶空固相微萃取[45]、分子印迹技术[46]等。此外,磁性固相萃取技术(Magnetic solid-phase extraction, MSPE)是一种将磁性材料(四氧化三铁、磁性碳纳米管和聚乙二醇等)加入到待提取液中,待吸附完成后,外加磁场将固液分离,再进行洗脱后得到目标化合物。与传统SPE相比MSPE具有简单快速、高效等优点[47]。随着样品前处理技术不断发展,该技术将会被逐步应用到酰胺类除草剂的检测中[7]。
2.2 仪器分析技术
针对酰胺类除草剂的仪器分析方法主要包括气相色谱法(Gas chromatography, GC)[48]、液相色谱法(Liquid chromatography, LC)[49]、气相色谱-质谱法(Gas chromatography-mass spectrometry, GC-MS)[50]、气相色谱-串联质谱法(Gas chromatography-tandem mass spectrometry, GC-MS/MS)[51]和液相色谱-串联质谱法(Liquid chromatography-tandem mass spectrometry, LC-MS/MS)[52]等。其中GC和LC分析方法在连接非质谱检测器时,只能通过保留时间来定性,若非目标化合物的峰谱出现在目标化合物的保留时间段时,会造成假阳性结果,并且存在检测灵敏度低等问题[53];GC-MS法在分析分子量小或沸点高的农药时易受到基质干扰,导致检测结果的准度度和灵敏度降低等问题;GC-MS/MS和LC-MS/MS可以最大限度的屏蔽基质干扰、提升农药组分定性结果的准确度和检测结果的灵敏度,在农药检测分析中优势明显。气相色谱适宜分离热稳定性好、分子量小且易挥发的物质,液相色谱适宜分离挥发性低、热稳定性差且相对分子质量较大的有机化合物,酰胺类除草剂更适合使用液相分离。因此,GC-MS/MS和LC-MS/MS相比,LC-MS/MS更适合酰胺类除草剂的检测。随着检测技术的不断进步,一些新兴的仪器分析手段也逐步被应用到酰胺类除草剂的检测之中。
2.2.1 毛细管电泳法
毛细管电泳法(Capillary electrophoresis, CE)是以毛细管为分离通道,以高压直流电场为驱动力,依据样品各组分之间淌度和分配的差异而实现分离的电泳分离分析方法。该方法具有分析时间短、样品用量少等优点。赵艳霞等[54]建立了多抗霉素和丙草胺的毛细管电泳-电化学发光检测法,结果表明,在检测电位为1.18 V,检测池中缓冲溶液为35.00 mmol/L磷酸盐和6.00 mmol/L二氯三联吡啶钌(pH=8.00)的条件下,两种目标物的线性范围为0.50~1 000.00 μg/L,定量限范围为0.05~0.20 μg/L,检出限为0.01~0.05 μg/L。毛细管电泳所使用的设备简单、分析效率高,未来也可通过与质谱技术结合使用提高检测灵敏度,扩大其应用范围。
2.2.2 气相色谱-飞行时间质谱法
气相色谱-四极杆-飞行时间质谱(Gas chromatography-quadrupole time-of-flight mass spectrometry, GC-QTOF)具有分析速度快、分辨率高、数据库采集方便和精确质量数全谱采集等优点。罗铭等[55]利用GC-QTOF建立了土壤中包括乙草胺和丁草胺在内的190种农药和16种多环芳烃的检测方法,对土壤样品在0.10 mg/L加标水平下,大部分农药和多环芳烃的回收率在70%~120%之间,相对标准偏差RSD小于15%。GC结合飞行时间质谱(TOF)可以提取精确的质量数,有效抵抗干扰,对组分定性的准确度高。
2.2.3 液相色谱-飞行时间质谱法
液相色谱-四极杆-飞行时间质谱(Liquid chromatography-quadrupole time-of-flight mass spectrometry, LC-QTOF-MS)同样具有分析速度快、灵敏度高、质量范围宽、分辨率高、质量测量精度高等优点,在有机化合物的定性方面具有优势。高磊等[56]利用LC-QTOF-MS建立了渔业水体中酰胺类除草剂的检测方法,结果表明水样中的酰胺类除草剂的检测限(LOD)为0.05~0.20 ng/L。由于LC-QTOF-MS具有更高的分辨率,能够测量被测组分的准确质荷比,可用于未来的非靶向检测技术研究。
3 酰胺类除草剂在淡水渔业环境中残留现状
在农业生产过程中,大量不能被充分利用的酰胺类除草剂会通过迁移转化进入到渔业环境中,对水产品造成危害。因此本研究总结了不同淡水渔业环境(养殖池塘、水库湖泊、河流、稻鱼综合种养系统)及其水产品中酰胺类除草剂的残留现状,详情见表2。
3.1 养殖池塘
养殖环境的污染会影响养殖产品的健康[57],而养殖池塘面积通常比湖泊小,水体交换有限,水源一般来自附近的地表水或者地下水,酰胺类除草剂进入到养殖池塘中后会在池塘环境中积聚,并在养殖生物链的各个层级上残留,放大和富集,影响栖息在池塘中的水生生物[58]。研究发现哈尔滨地区养殖池塘水体、底泥以及周边土壤中乙草胺、丙草胺和丁草胺的残留规律表现为:池塘周边土壤>池塘表层底泥>池塘表层水体[59]。养殖池塘大多与农田相邻,喷洒在农田中的除草剂,一部分被土壤吸附而残留,另一部分会随着地表水进入养殖池塘中,而池塘水体相对封闭,除草剂通过吸附在固体颗粒表面逐渐沉降到底泥中,导致池塘底泥相比于水体中的残留量高。
3.2 湖泊水库
水库一般指在山沟或河流的狭口处建造拦河坝形成的人工湖泊,水体相对静止。薛南冬等[60]在北京官厅水库9个采样点采集了底泥以及水样,以GC-MS法进行样品检测发现,底泥、表面水体以及孔隙水中乙草胺的的含量为0.01~0.19 ng/L、ND~1.50 ng/L、ND~26.50 ng/L,检出率为100%;东南地区饮用水源中乙草胺的检出频率为100%[61];太湖流域烯酰吗啉的残留量为203.48 ng/L,检出率达98%[2]。国外研究学者报道在希腊北部的湖泊中异丙甲草胺的残留量为3.65 μg/L,检出率达到29%[62];对比了2006—2012年间葡萄牙南部水库中酰胺类除草剂的残留状况,发现2011—2012年酰胺类除草剂的残留量(91.99 ng/L)比2006—2007年的残留量(39.04 ng/L)高[63]。通过国内外不同研究发现,湖泊水库中残留的酰胺类除草剂不会立刻降解,并且随着时间的推移表现出一定的蓄积性。
3.3 河流
酰胺类除草剂在农业生产中施用后,一部分通过地表径流的方式进入到河流中,对河流中的水生生物造成污染。研究发现,中国多地河流环境中均存在酰胺类除草剂,松辽、长江、黄淮海及珠江四大流域中,淮河以及松花江流域酰胺类除草剂的残留量较多。珠江流域酰胺类除草剂的残留量为1.93~122.66 μg/L[64]。2009—2010年间,松花江流域雨季前后沉积物中乙草胺的残留量从0.47 μg/kg上升到11.76 μg/kg,河岸土壤中的残留量从0.03 μg/kg上升至709.37 μg/kg,2009年雨水高流量期间,沉积物中乙草胺的平均浓度为4.79 μg/kg,河岸土壤中为0.75 μg/kg,2010年雨水平均流量期间,乙草胺的平均浓度为2.35 μg/kg,河岸土壤为61.36 μg/kg,雨季前后酰胺类除草剂增加可能是由于大流量期水土流失严重所导致的[65]。酰胺类除草剂虽然具有一定的降解性,但是在不同基质中降解能力不同,因此在相同流域的不同区域残留量状况也不同,表现为河岸土壤中乙草胺的残留量要远高于沉积物。
国外学者研究了酰胺类除草剂在河流中的残留情况。西班牙埃布罗河流域2001—2004年异丙甲草胺的残留量为200 ng/L;2004—2006年丙草胺的残留量为93 ng/L,甲草胺为272 ng/L;2011年,乙草胺的残留量为314 ng/L[66-67]。1994—1998年间,在美国中西部147条小溪中乙草胺的残留量从0.05 μg/L上升到了0.72 μg/L[68]。自1994年,乙草胺在美国登记允许使用以后,其在溪水中的检出率从17%上升到了35%[69]。随着时间的增加,酰胺类除草剂在不同流域的残留量在不断增加,不能降解的除草剂会蓄积到水体、土壤、以及水产品中,对水生环境造成严重威胁。
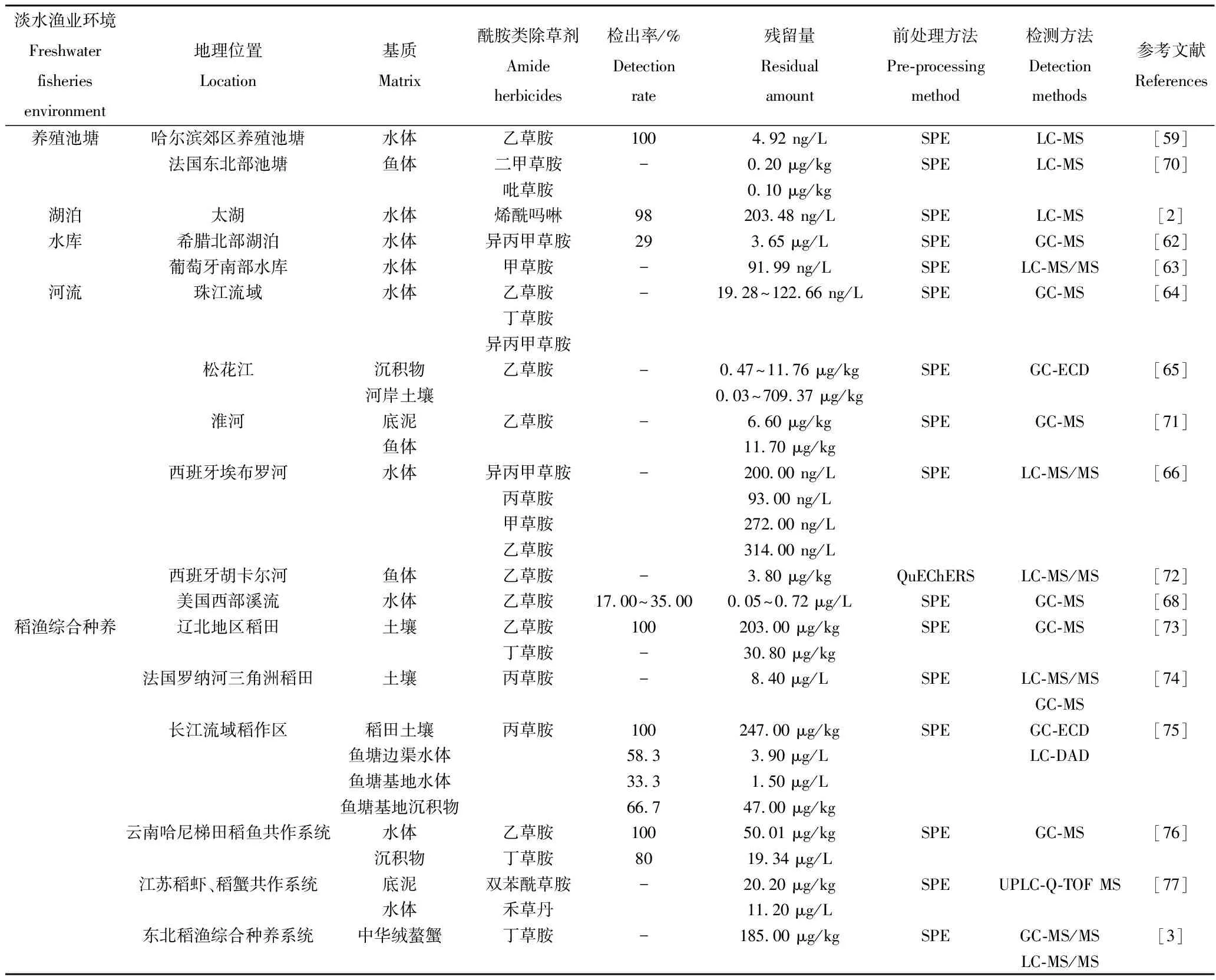
表2 淡水养殖环境中酰胺类除草剂残留情况Tab.2 Residual condition of amide herbicides in freshwater aquaculture environment
3.4 稻渔综合种养系统
稻渔综合种养模式中稻和渔是一个相互依存、循环利用的生物链,即为稻田空间与水产养殖共享,水稻种植与水产品生产相互结合起来,形成新型生态系统。丁草胺和丙草胺是广泛应用于稻田中的酰胺类除草剂[57],在进行田间施药时,部分除草剂会直接沉降到水中并沉积至底部。长江流域稻作区稻田土壤中丙草胺的残留量为247.00 μg/kg,检出率为100.00%,鱼塘边渠中丙草胺的残留量为3.90 μg/L,检出率为58.30%,是鱼塘基底(1.50 μg/L)的2.6倍,同时在稻田、鱼塘基底、鱼塘边渠等区域的沉积物中,发现丙草胺的检出率为66.70%[75];残留规律为:稻田土壤>鱼塘边渠>鱼塘基底,根据离稻田的距离由远到近逐渐增多。云南哈尼梯田稻渔共作系统中水样和底泥中乙草胺的检出率分别为100.00%、80.00%,残留量分别为19.34、50.01 μg/kg[76]。江苏稻虾、稻蟹共作系统中,双苯酰草胺和禾草丹的残留量分别为20.20、11.20 μg/L,残留规律表现为稻田底泥>水体>虾蟹[77]。
综上所述,在稻渔综合种养模式下,酰胺类除草剂在进行田间喷洒时,不可避免的残留到稻田水体中并迁移到生长在稻田中的水产动物体内,影响了稻渔综合种养模式下水产品的质量安全。
4 展望
本研究对酰胺类除草剂的理化性质、毒性、迁移转化规律、检测方法以及残留现状进行综述,总结了渔业环境及水产品中酰胺类除草剂的检测方法,针对不同水生环境中酰胺类除草剂的残留现状进行了详细的探讨。酰胺类除草剂容易渗透,在环境中容易发生蓄积,残留于土壤、水环境、水产品等物质中,对水生植物、水产品等产生危害,且有可能对人类造成威胁。针对目前酰胺类除草剂在水产品中的前处理技术、现场快速检测技术、食用安全性评价以及代谢规律等提出了展望。
4.1 构建快速、高效的样品前处理技术
目前,针对渔业环境及水产品中酰胺类除草剂的前处理方法主要包括SPE、QuEChERS、ASE、GPC等。以后的研究中,样品前处理技术总体向着简单、快捷、高效、环保、通用等方向发展。分子印迹技术因分子印迹聚合物结构的特殊性决定了其对目标化合物及其类似物的高选择性,磁性分离技术能够避免前处理过程中繁琐复杂的步骤。磁性材料与分子印迹聚合物的结合,兼顾了两种材料的优势,显著提高了对目标化合物的选择性。因此,可设计一种适用于酰胺类除草剂的磁性分子印迹方法,以缩短前处理时间,提高实际样品测定的准确性。
4.2 建立水产品中酰胺类除草剂快速检测技术
传统的检测技术大都存在前处理过程复杂,检测周期长的问题,而常用的检测手段往往是靶向检测,一些非靶向物质无法检出。为了解决这一问题,可利用不同的机理设计出相应的试剂盒,比如通过纳米材料合成类过氧化物酶、类氧化酶,将其制备成快速检测试剂盒,应用于活体水产品现场快速检测。开发出更快速,更高灵敏度的现场快检技术,不需要复杂的仪器,将会是水产品质量安全检测技术未来的发展趋势。酰胺类除草剂检测技术的快速发展,将会在食品安全评估、环境污染检测工作方面发挥重要作用,将会为完善此类除草剂的限量标准以及加强环境监测和食品安全监测提供技术支持。
4.3 开展酰胺类除草剂在水产品中残留的食用安全性评价
中国目前已制定玉米、花生、大豆、小麦及糙米等农产品中酰胺类除草剂的最大残留限量,但未制定水产品中酰胺类除草剂的最大残留限量。日本于2006年制定了水产品中酰胺类除草剂的最大限量值。鉴于酰胺类除草剂的毒性危害以及在国内水产品中普遍检出的客观事实,有必要在全国开展水产品中酰胺类除草剂的风险监测与评估,评价水产品中酰胺类除草剂残留及其代谢物对食用者健康影响的安全风险,为中国制定水产品中酰胺类除草剂的安全标准提供数据支撑。
4.4 研究酰胺类除草剂在水产品中的代谢规律
酰胺类除草剂在种植业中广泛使用,不可避免的会进入水产养殖环境中。针对这一问题,一方面需要开展自然环境状态下酰胺类除草剂在水产品中富集和代谢规律研究;另一方面,通过室内药浴模拟实验对不同药浴时间下的水产品进行酰胺类除草剂的残留测定,进一步深入研究酰胺类除草剂在水产品中的残留及代谢特征、迁移转化规律及富集效应。明确酰胺类除草剂在水产品不同部位中的代谢规律和不同受药时间的残留动态,为制定水产品中酰胺类除草剂的污染防控措施提供科学依据。
4.5 建立稻渔综合种养模式下酰胺类除草剂残留控制技术规范
酰胺类除草剂(如丙草胺、丁草胺、苯噻酰草胺、敌稗等)在水稻种植中被广泛应用,对稻渔综合种养的水产品质量安全存在一定的隐患。合理使用酰胺类除草剂对实现稻渔综合种养的可持续发展和提升水产品质量安全具有积极作用。可以在室内药浴模拟实验的研究基础上,通过研究室外稻渔综合种养条件下酰胺类除草剂在稻田水体、底泥及水产品中的残留特征,揭示其迁移转化规律,梳理关键风险控制点,从而研制稻渔综合种养模式下酰胺类除草剂在水产品中的残留控制技术。
正确评估酰胺类除草剂在水稻中的应用对养殖水产品安全性的影响,有助于解决水稻种植和共生水产品养殖之间的矛盾问题,科学发展稻渔综合种养模式,有力推动稻渔综合种养等新型绿色养殖模式发展。构建稻渔综合种养模式下水产品中酰胺类除草剂的残留控制技术规范,对完善与推广稻田综合种养技术、预防酰胺类除草剂对养殖经济水产品的危害、保障水产品消费安全具有重要意义。

