缩窄性心包炎超声特征的logistic回归分析
李国英,徐明,刘玲玲,黄泳淇
缩窄性心包炎(constrictivepericarditis,CP)是由心包增厚、疤痕、无弹性以及不规则钙化等原因导致的心室舒张期充盈受限的一类疾病,起病隐匿,临床症状缺乏一定的特异性,易被漏诊或误诊,故对该疾病早期诊断及时治疗仍存在一定的挑战。超声心动图因其操作简便、使用 方便、无辐射等优点广泛应用于临床,仍是目前诊断CP首选影像学检查方法[1-2]。本研究基于临床及超声心动图指标建立logistic回归模型,旨在为临床快速早期诊断提供依据。
材料与方法
1.临床资料
回顾性分析2012年1月-2022年4月因疑似CP在我院就诊的116例患者的病例资料。其中,男80例,女36例,年龄14~93岁,平均(55.54±17.53)岁。主要临床表现为不明原因的胸闷、气促、咳嗽、双下肢水肿和腹胀等。CP组均行心包切除术,术前行超声心动图检查;非CP组(对照组)均行经胸超声心动图检查,同时行CT、MRI和/或PET等影像学检查,并结合心导管或病理活检排除CP。
CP组78例,其病因包括结核60例(77%)、手术后6例(7.7%)和特发12例(15.4%);非CP组38例,其中限制型心肌病9例,心律失常14例(左束支传导阻滞8例,起搏异常6例),右心功能不全12例,严重三尖瓣反流3例。CP组中,男59例(7%),女19例(23%),年龄17~88岁,平均(56.27±16.78)岁;非CP组中,男21例(55%),女17例(45%),年龄14~93岁,平均(54.05±19.11)岁。
2.检查方法
使用 Philips IE33、Philips IE Elite或Philips EPIQ 7C彩色多普勒超声诊断仪,心脏探头频率为2.5~5.0 MHz。所有测量和评估均由不知道诊断结果的≥2位超声医师(诊断经验>5年)一致确认。
诊断CP的主要超声心动图征象[3]:①心包增厚(>3 mm)、钙化伴回声增强。结合经胸超声心动图及高频超声检查,主要观察右室前壁、心尖及左室后壁的心包是否增厚,房室环部位有无回声增强、钙化。②双房增大,双心室大小正常或偏小。重点参照2016年《中国成年人超声心动图检查测量指南》所公布的各心腔正常参考值范围以及结合心尖四腔心切面观察四腔比例进行综合判断。③室间隔抖动征。主要利用M型记录室间隔运动情况,重点观察有无舒张早期室间隔的异常抖动。④二尖瓣(mitral valve,MV)舒张早期峰值血流速度(E)与舒张晚期峰值血流速度(A)的比值(E/A)>2。⑤二尖瓣舒张早期E峰在吸气时较平静呼吸时减小率△Emv[△Emv=(E-E吸)/E]>25%。⑥测量MV环隔室间隔侧及外侧壁舒张期组织位移速度(记为隔e'和侧e'),隔e'>8 cm/s或隔e'>侧e'。⑦心室形变,心室出现“束腰状”或“管状”狭窄。
患者取左侧卧位和平卧位,经胸骨旁、心尖和剑突下三个声窗进行二维成像。经常规左心室长轴切面、左室短轴切面、心尖四腔心切面进行探查,结合M型、脉冲多普勒超声和组织多普勒成像(tissue doppler imaging,TDI)技术进行观察和测量。重点观察舒张期室间隔与左室壁的运动情况,记录左心室射血分数(ejection fraction,EF)和每搏输出量(stroke volume,SV);心尖四腔心切面观察内容:四腔比例是否正常,心室有无扭曲、形变;结合PWI,测量二尖瓣舒张早期峰值血流速度(E)与舒张晚期峰值血流速度(A)速度及吸气后第一次心跳时舒张早期峰值血流速度E吸;结合TDI,测量MV环隔e'和侧e'。
3.统计学方法
使用SPSS 22.0统计学软件对数据进行统计分析。计量资料服从正态分布者采用均数±标准差表示,组间比较采用t检验;不服从正态分布者采用中位数M(Q25~Q75)表示,组间比较采用Wilcoxon符号秩和检验;计数资料的组间比较采用Pearson χ2检验。多因素分析和回归模型的建立采用二元logistic逐步回归分析,以P<0.05作为进入模型的标准。
结 果
1.单因素分析
CP组和非CP组之间临床和超声表现的比较结果见表1。两组间年龄的差异无统计学意义(P>0.05),性别构成的差异有统计学意义(P<0.05),CP组中男性患者更多见。
CP组与非CP组之间EF和SV值的差异无统计学意义(P>0.05);双房增大(双室大小正常或偏小)和E/A>2的出现率在两组间的差异无统计学意义(P>0.05);心包增厚、室间隔抖动征、心室变形和吸气后△Emv>25%、隔e'>8 cm/s以及隔e'>侧e'这6个变量在CP组中的出现率均显著高于非CP组(P<0.01)。其中,有8例房颤患者二尖瓣血流速度变化无法观测,故无法评估其△Emv是否大于25%。
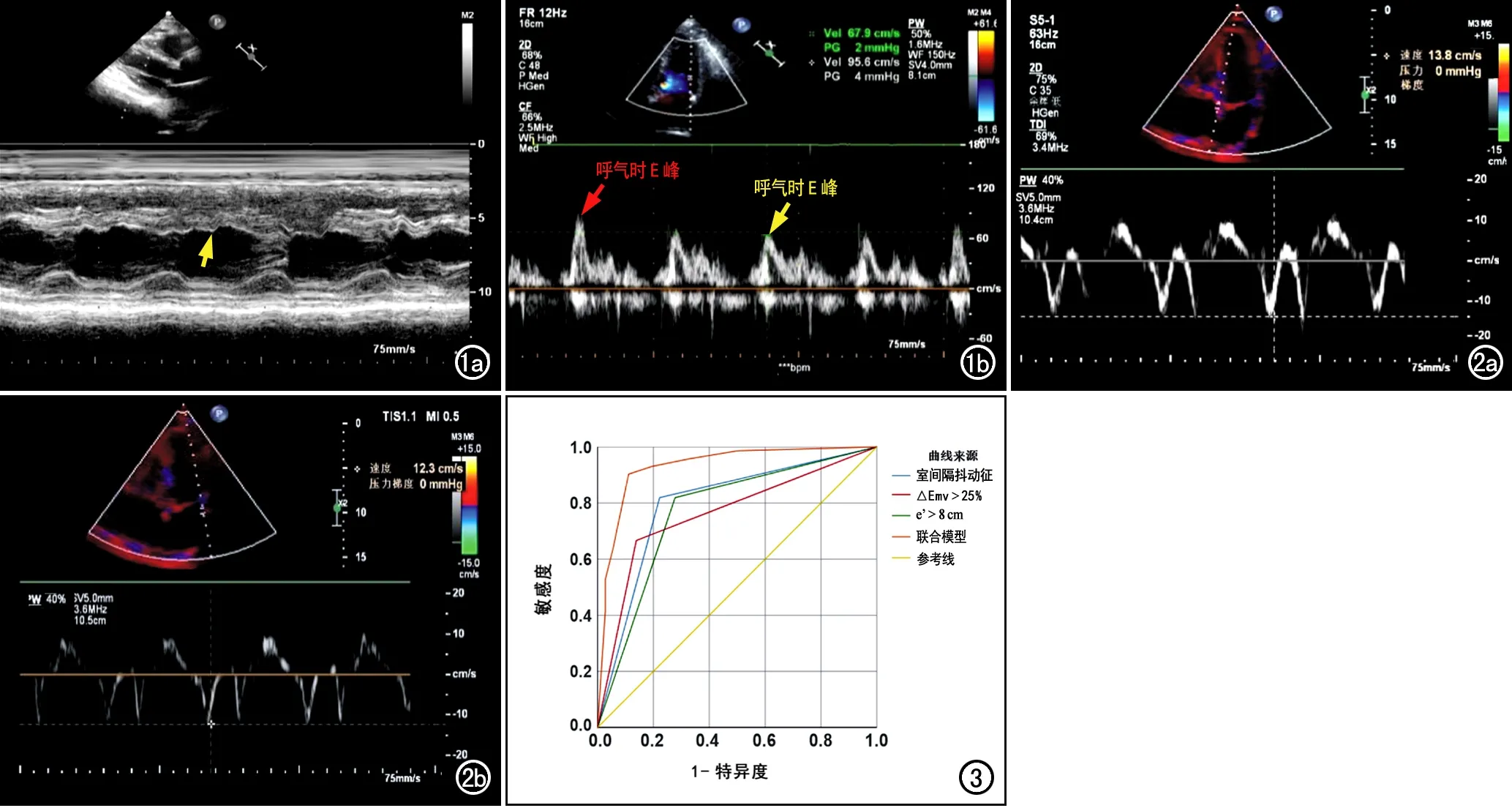
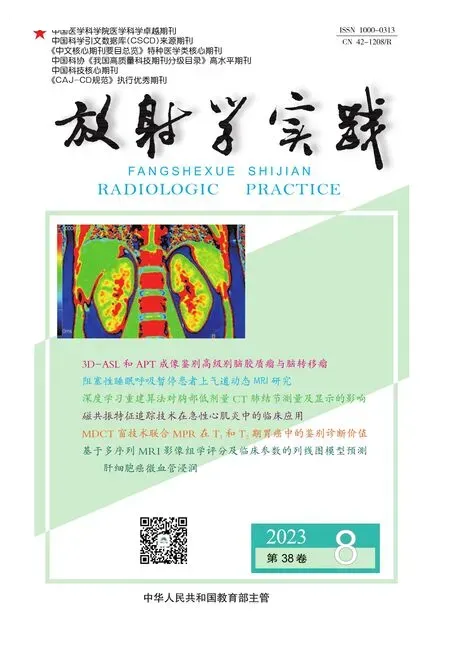
图1 CP患者,男,48岁。a)胸骨旁长轴切面超声M型图,显示室间隔舒张早期出现切迹征象,即室间隔抖动征(箭);b)PWI显示二尖瓣血流频谱,测量呼气时E峰(红箭)及吸气后E峰(黄箭)的峰值,计算吸气后E峰峰值较呼气E峰峰值的变化率(△Emv)。 图2 CP患者,男,57岁,TDI显示二尖瓣环周围组织随心动周期的变化情况。a)室间隔侧组织位移速度e'>8cm/s;b)侧壁组织位移速度e'>8cm/s。 图3 联合模型和3个变量诊断CP的ROC曲线。室间隔抖动征、吸气△Emv>25%、隔e'>8cm/s和联合模型诊断CP的AUC分别为0.799、0.764、0.771和0.931。
2.多因素分析
根据单因素分析结果,CP组与非CP组比较,P<0.05的变量有心包增厚、室间隔抖动征、心室变形、吸气后△Emv>25%、隔e'>8 cm/s和隔e'>侧e'。以CP为因变量,将这6个变量作为自变量,进行逻辑回归分析,结果显示室间隔抖动征、深吸气后△Emv>25%和e'>8 cm/s是CP的独立影响因素(P<0.05),详见表2。因吸气后△Emv>25%这一指标在房颤患者(n=8)中无法获取,故参与多因素分析的总样本量为108例(CP组72例,非CP组36例)。
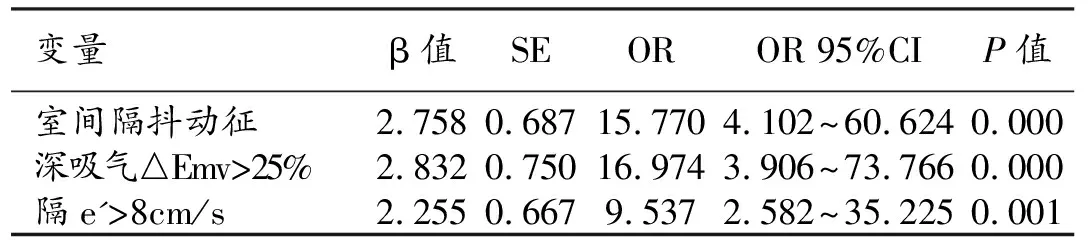
表2 超声特征预测CP的多因素分析结果
3.Logistic回归模型
以是否为CP为因变量,将CP的独立影响因素进行logistic逐步回归,建立CP的诊断模型:Logit(P)=-3.166+2.758X1+2.832X2+2.255X3。对其进行霍斯默检验,自由度=5,P=0.664。其中,X1为室间隔抖动征(0:无;1:有),X2为深吸气后△Emv(0:≤25%;1:>25%),X3为隔e'(0:≤8;1:>8)。
应用此回归模型诊断CP,当Logit(P)>0.5则评估为CP,Logit(P)≤0.5则评估为非CP,最终此模型在本组样本中诊断CP符合率为89.8%(96/108);单独诊断时,ROC曲线下室间隔抖动征、深吸气△Emv>25%、隔e'>8 cm/s AUC分别为0.799、0.771、0.764,室间隔抖动征的诊断效能略优于其他两者。以此回归模型诊断CP在ROC曲线下AUC为0.931(表3和图4),优于前面三者单独诊断,表明该诊断模型诊断效能良好。
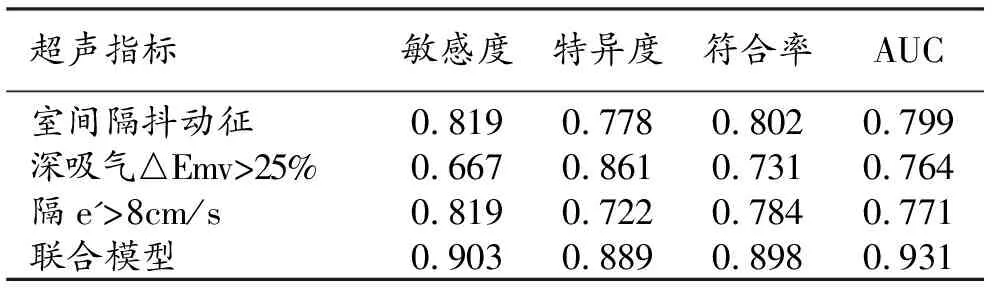
表3 各超声指标与联合应用的诊断效能
讨 论
近年来,随着超声成像质量的提高和超声医师对缩窄性心包炎认识的深入,超声检查可更早诊断CP。国外已有学者采用现有的超声诊断标准对心衰患者进行CP诊断[4],而目前国内尚未看到类似的研究。在欧美国家本病的主要病因为特发性和病毒性心肌炎(占42%~49%)以及心脏手术(11%~37%),结核或化脓性心包炎仅占3%~6%[5];而在其他国家,结核仍是最常见的病因[6]。不同病因可能导致患者的影像学表现存在一定差异,本研究主要针对结核性心包炎的超声心动图指标,其该模型更能体现结核性心包炎的特点。
本研究中多因素回归分析结果表明,室间隔抖动征是诊断CP的影响因素。由于心包增厚和纤维化,胸内和心内压力分离以及固定空间内室间隔依赖,从而产生了室间隔舒张早期的来回摆动。观察室间隔及左室壁运动情况是所有超声心动图检查中的常规观察项目,所以室间隔抖动征通常是诊断缩窄性心包炎的第一线索,且本研究中其诊断敏感度高达81.9%,特异度约为78.8%,这与既往研究结果基本一致[7]。因室间隔抖动征在CP中很常见,但左束支传导阻滞、起搏异常或右室功能障碍时也会出现[8],本研究中非CP组也因有9例患者出现上述3种情况之一,术前超声疑似为CP,故不能将此征象视为CP的特异性征象。
本研究中,深吸气后△Emv>25%诊断CP的敏感度较低,仅66.7%,但其特异度达86.1%,可能因为部分患者左室充盈压升高使得呼吸导致的左心室压力变化较小而不能被显示,或者心包严重钙化包裹心脏,使得胸腔压力的改变无法对心室充盈产生明显影响,此时这一指标诊断CP的敏感性不高,但是其特异性很好。另外,CP患者舒张早期血流速度加快,即E峰增高,而舒张晚期血流速度较慢,即A峰较低,E/A比值显著增大[9],但在本研究中单因素分析结果显示E/A>2诊断CP的价值不高(P<0.05)。
此外,本研究结果显示TDI检测的二尖瓣环运动速度e'>8 cm/s是诊断CP的独立影响因素。对这一指标进行分析,是参考了Choi等[10]的研究结果,他们认为室间隔侧e'>8 cm/s可用于诊断CP。本研究中其中的CP的敏感性达81.9%,但特异度较低,仅72.2%。e'值是超声心动图检查中用于无创性评估心肌舒张功能的常用指标,e'值减小一般与心肌疾病导致的心力衰竭相关,通常不会出现在CP患者中。CP患者的心室在舒张期横向扩张受限,使得其纵向运动代偿性增加,所以其e'值常表现为正常或增高。而另一项超声特征“瓣环逆转”即隔e'>侧e',在本次研究中虽然单因素分析中有其统计学差异(P<0.01),但在多因素分析中该因素分析结果P>0.05而被排除。
心包增厚是诊断CP的直接征象,但是经胸超声心动图对心包增厚或钙化的检出率较低[11-12],这可能由于肺与心脏的强反射界面,导致对心包增厚和钙化的识别存在明显的局限性;另外,心包增厚的不规则性分布,也将导致对心包的识别存在局限性。部分经验不足的医师可能将患者心包脂肪垫与增厚的心包相混淆,而出现误诊或漏诊。本研究中只选取了经胸超声心动图对心包的观察结果,未将经食道超声对心包增厚的检出情况纳入分析。在CP组中发现心包钙化率(9%)低,与相关文献报道一致[11]。综上所述,经胸超声心动图对心包增厚和心包钙化的检测能力有限。
本研究中经多因素logistic回归分析建立预测模型,其诊断CP的AUC为0.931,符合率为89.8%,诊断效能好,诊断价值高。与临床实际诊断过程相比,将众多超声指标精简和量化,更容易被超声医师学习和掌握,可以为临床快速、早期诊断和及时治疗CP提供依据。
本研究存在的局限性:目前临床上CP属于较少见的心血管疾病,国内多为病例报道或小样本研究,本研究样本量相对较多,但总的来说样本量还是较小,尤其是非CP组,使得结果可能存在一定的偏倚;其次,本研究是在单一机构中进行的回顾性研究,不同诊断水平的医师对CP的超声特征的认识水平存在差异,在留取图像时可能存在主观偏差;第三,本研究中选取的超声征象和测量指标是临床实践中广泛采用的,所选用的阈值未经外部验证,可能会导致对诊断准确性的高估。