不同重建算法与辐射剂量对定量CT骨密度测量的影响:体模研究
童小雨,刘义军,方鑫,李贝贝,王旭,陈安良
近年来对骨质疏松的流行病学调查显示50岁以上人群中骨质疏松症的患病率高达19.2%[1],骨密度是骨质疏松和骨折患者的终身重要监测指标,骨量减少和骨质疏松的检出尤为重要,骨密度的机会性筛查是预防骨质疏松的关键[2-4]。双能X射线吸收测量法(dual energy X-ray absorptiometry,DXA)和定量CT(quantitative computed tomography,QCT)均能无创性检测骨密度[5-7]。QCT技术对骨松质的变化更为敏感,同时可三维观察椎体形态学改变,临床应用价值高,但患者接受的辐射剂量较大。如何降低辐射剂量并保证骨密度测量的准确性是当前QCT研究的热点之一。选用合适的重建算法是间接降低患者辐射剂量的方式之一,继传统的滤波反投影算法(filtered back projection,FBP)之后,又相继开发了迭代重建算法(iterative reconstruction,IR)和深度学习(deep lear-ning,DL)重建算法,较大程度地提高了降低辐射剂量的潜能[8]。但目前对于在不同辐射剂量下不同重建算法对骨密度测量的准确性有无影响的相关研究较少。本研究基于拟人化仿真欧洲脊柱体模,探究不同辐射剂量下不同重建算法及其不同等级对骨密度测量准确性的影响。
材料与方法
1.研究对象
采用拟人化仿真欧洲脊柱体模(European Spine Phantom,ESP;编号145,德国QRM公司)进行测量和分析。ESP由一定的环氧树脂、羟基磷灰石(Hydroxyapatite,HAP)等成分组成,主要用于骨密度测量仪器的标准化和相互校准,其X射线的衰减等于水与HAP的混合物。ESP包含3个不同骨密度值的椎体,从上至下标记为第一(L1)、第二(L2)和第三腰椎(L3),对应的真实骨密度值(标定值)分别为50、100和200 mg/cm3。
2.扫描方法
使用联影uCT760 CT机进行扫描。首先对QCT校准体模进行扫描,并按照规定对工作站进行校准,再采用2种辐射剂量对ESP体模进行扫描,每种剂量的扫描均重复10次。管电流采用剂量调制技术,常规辐射剂量组(normal dose,ND)选用剂量调制等级3,低辐射剂量组(low dose,LD)选用剂量调制等级1;两组的其它扫描参数均相同:120 kV,螺距0.9875,转速0.5 s/r,扫描层厚5 mm,矩阵512×512,视野500 mm×500 mm,床高以ESP体模中心为准。
重建参数:两组均分别采用FBP、等级5、7、9的迭代重建算法Karl(keep artifact really low,Karl)以及等级1~4的DL算法进行图像重建,共获得16组图像,重建层厚及层间距均为1 mm,软组织(B-SOFT-B)算法。
3.测量和分析
骨密度测量:将扫描数据上传至骨密度测量工作站(Model 4 QCT pro v6.1,Mindways)进行分析处理,由一位骨肌组诊断医师在各组图像上分别测量各椎体松质骨的骨密度(bone mineral density,BMD)。在横轴面图像上选取各椎体骨松质区域勾画ROI,大小约为椎体骨松质面积的2/3,然后在冠状面/矢状面图像上设定高度为9 mm,尽量选取椎体的中间层面,软件即可自动生成容积ROI(VOI)并计算出其BMD值,每一椎体骨密度值均测量3次,计算均值作为该椎体的骨密度值(图1)。采用相对误差(relative error,RE)评价测量的准确性:
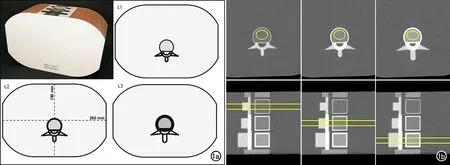
图1 ESP测量示意图。a)ESP外观及L1~L3椎体CT简图;b)QCT骨密度测量ROI示意图,在体模的L1~L3椎体中心层面的横轴面图像上,在松质骨内勾画ROI,在矢状面定位像上确定测量的范围,软件即可自动生成每个椎体的三维容积感兴趣区,并获得其骨密度值。
RE=|测量值-标定值|/标定值×100%
(1)
椎体图像质量评估:由同一位诊断医师使用uCT760后处理工作站,在各椎体中心层面放置ROI,大小约为整个椎体面积的2/3[9],测量CT值及其SD值;以腹前方区域作为背景组织,测量其CT值及其SD值;按照公式(2)计算椎体的对比噪声比(contrast noise ratio,CNR):
(2)
4.辐射剂量
扫描结束后记录ND组及LD组的平均毫安秒(milliampere seconds,mAs)、容积CT剂量指数(CT dose index volume,CTDIvol)、剂量长度乘积(dose length product,DLP)。
5.统计学分析
应用SPSS24.0和MedCalc20.022统计软件包对数据进行处理,计量资料以均数±标准差表示,采用独立样本t检验分析各组BMD测量值与真实值的差异,采用配对样本t检验分析不同辐射剂量之间管电流(mAs)、CTDIvol、DLP和BMD的差异,采用单因素方差分析比较相同辐射剂量不同重建算法椎体BMD和CNR的差异,进一步组间两两比较采用LSD法,采用配对样本t检验比较低辐射剂量组结合不同等级算法与ND-FBP组各椎体CNR值之间的差异。
结 果
1.辐射剂量
LD组的管电流、CTDIvol和DLP分别为(38.60±0.843)mAs、(3.171±0.02)mGy和(65.55±0.05)mGy·cm,相较于ND组分别降低了78.41%、78.25%和78.28%,各指标在两组间的差异均有统计学意义(t=158.692~1699.766,P均<0.001)。
2.组间及组内BMD的差异性分析
各椎体(L1~L3)在相同重建算法不同辐射剂量下所测得BMD值的差异均无统计学意义(t=-2.006~1.472,P>0.05)。ND组及LD组中,各算法之间所测得的L1~L3的BMD值的差异均无统计学意义(F=0.485~1.954,P>0.05),详见表1。

表1 不同辐射剂量和重建算法测得的3个椎体的BMD值及比较 /mg/cm3
16组图像上中所测得BMD值与ESP标定值之间的差异均有统计学意义(t=-114.091~-17.114,P<0.05)。各椎体BMD测量值的RE范围为2.17%~7.44%;对16个组总体情况进行分析,L2的RE最大,平均值为7.16%±0.58%,L3的RE最小,平均值为2.23%±0.20%,各组RE详见表2。

表2 不同辐射剂量和重建算法测得的3个椎体BMD值的RE及比较 /%
3.不同辐射剂量下各椎体CNR值的比较
不同算法之间各椎体CNR的差异均有统计学意义(F=47.883~153.983,P<0.05),Karl算法和DL算法随着各自算法等级的提高,图像噪声逐渐降低,CNR逐渐升高(图2)。

图2 各椎体不同算法之间CNR值比较的柱状图。a)L1椎体;b)L2椎体;c)L3椎体。* 与ND-FBP比较,P<0.05;** 与ND-FBP比较,P<0.001。
讨 论
算法的发展使低剂量扫描成为可能,目前临床常用的算法可分为3种:滤波反投影算法、迭代算法和深度学习重建算法。不同图像重建算法对图像质量及辐射剂量的影响不同:FBP算法为传统CT图像算法,图像受辐射剂量影响较大;Karl算法是一种基于投影域的迭代降噪技术,能在降低图像整体噪声水平的同时,保持图像的组织结构特征[10];DL算法是基于人工智能在图像重建方面的突破,采用了先进的深度卷积神经网络(deep neural network,DNN)技术,在降低噪声的同时能使得图像保持较高的空间分辨率,在一定程度上为辐射剂量的降低提供了技术保证[11-12]。不同算法对于图像信号的处理方式也有明显不同,算法改变对于骨密度测量准确性的影响尚不清楚,因此本研究基于带有标定值的欧洲脊柱仿真体模,同时为了更好地模拟临床扫描环境,采用剂量调制技术进行常规剂量(调制等级3,为常规腹部扫描等级)和低剂量(调制等级1)扫描,该技术能够根据扫描定位像中的衰减信息,确定扫描部位所需的剂量曲线,同时能基于人体组织结构的差异而智能调节管电流的大小,从而可提供更均匀的剂量分布。
本研究中LD组相较于ND组,管电流(mAs)、CTDIvol和DLP分别降低了78.41%、78.25和78.28%,辐射剂量降低程度与蒋耀军等[9]和吴巧玲等[13]学者的研究结果基本一致,且所获得的图像均可用于骨密度测量,表明采用深度学习重建算法可满足临床诊断需求,在降低辐射剂量方面有巨大潜力。本研究结果显示不同辐射剂量下相同算法重建图像上所测得的BMD值的差异无统计学意义(P>0.05),这与高冰等[14]采用低管电流方式行腰椎低剂量QCT的研究结果一致,王勇朋等[15]采用管电流80 mA的低剂量扫描条件行胸部CT扫描及QCT骨密度测量的一站式研究结果也印证了这一点。上述结果均表明管电流不会影响BMD值的测量,可作为QCT低剂量扫描的有效方法。同时本研究中发现不同重建算法(FBP、Karl和DL)以及不同重建等级(Karl和DL算法)之间所测得的BMD值的差异均无统计学意义(P>0.05)。笔者认为导致这一结果出现的原因是QCT是利用常规CT的扫描数据,通过将带有椎体X线衰减信息的图像经过QCT质控分析系统进行校正,与专业的QCT羟基磷灰石体模进行等效密度的转化,从而获得椎体骨质含量的信息,是目前最精准的骨密度测量方法[16]。本研究中采用剂量调制技术来降低辐射剂量,使用不同算法来提升图像质量,总体上均未影响到椎体对X射线的衰减信息,所以不同辐射剂量及不同等级和类型的重建算法在骨密度值的测量上均表现出较好的一致性,组间差异均无统计学意义。
本研究结果显示,不同辐射剂量、重建算法和等级得到的16组图像上所测得的BMD值相较于ESP体模的标定值,差异均有统计学意义。笔者认为,扫描设备不同、部分容积效应、CT值漂移、线性回归的阈值水平不同等因素均会使CT测量值出现一定的差异,使得BMD测量值出现一定的误差[17],可接受的准确度误差范围为5%~15%。本研究中采用RE来进行各组图像BMD测量值的准确性评价,最终测量值的RE范围为2.17%~7.44%,在允许的偏差范围之内。其中,针对16个组总体情况进行分析,L2的RE最大,平均值约为7.16%±0.58%,L3的RE最小,平均值约为2.23%±0.20%。
本研究中在显著降低辐射剂量后,LD-Karl9图像上测得椎体的CNR值虽与ND-FBP之间的差异无统计学意义,但既往有研究结果表明,高等级Karl算法的重建图像上解剖结构显示过于平滑,有很强的塑料感。DL算法有四个等级可供选择,本研究结果显示LD-DL2图像上上测得椎体的CNR值与ND-FBP之间的差异无统计学意义;相较于Karl算法,DL算法拥有更好的降噪性能,且相较于ND-FBP,LD-DL3和LD-DL4图像椎体的CNR值均有显著提高,LD-DL3组中L1、L2、L3的CNR较ND-FBP分别提高了30.58%、17.81%和14.73%,LD-DL4组中L1、L2、L3的CNR分别较ND-FBP提高了53.72%、32.48%和26.06%。上述结果显示出深度学习算法在椎体的显示上有很好的应用前景,应根据扫描条件选择适当的重建算法。
本研究存在的局限性:ESP虽然模拟的是人体真实的骨密度值,但其组成成分依旧与人体之间存在一定的差异;ESP中模拟的椎体结构周围均为水,不含人体其它脏器组织,所以本研究中仅针对椎体的CNR进行分析,未进行图像的主观评分。
综上所述,不同重建算法、相同算法不同等级在不同辐射剂量水平下对骨密度的测量准确性均无显著影响;选择恰当的DL重建算法等级可在保证图像质量的同时有效降低患者的辐射剂量,有利于临床随访观察。