阻塞性睡眠呼吸暂停综合征大鼠认知障碍与海马区小胶质细胞的关系
刘仁帅 罗悯 殷梅
(昆明医科大学第二附属医院神经内科,云南 昆明 650101)
阻塞性睡眠呼吸暂停综合征(OSAS)是一种与睡眠相关的常见呼吸障碍〔1〕。作为 OSAS的常见并发症,认知障碍近年来备受关注〔2〕。OSAS对认知功能的影响包括注意力和警觉性降低、记忆力和学习能力受损、精神运动功能失衡、情绪调节紊乱和执行功能下降等〔3〕。小胶质细胞是中枢神经系统血管化、炎症和神经保护的关键因素〔4〕,激活的小胶质细胞与OSAS患者神经炎症的发展和维持有关。小胶质细胞特别容易因脑损伤和炎症或免疫刺激而被激活,并在激活后发生显著的形态学改变,从静止的分枝小胶质细胞变成激活的似变形虫的小胶质细胞。在这个激活过程中,它们的表面分子(如补体受体、细胞因子、趋化因子等)将上调,同时,具有促炎性和潜在细胞毒性的多种可溶性因子,释放激活的小胶质细胞〔5~7〕通过受损的线粒体、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶和产生过量一氧化氮来诱导强大的氧化应激反应〔8〕,从而加重慢性间歇性缺氧(CIH)损伤,导致认知障碍。作为OSAS最重要的病理生理过程,CIH会导致中枢神经系统的结构性神经元损伤和功能障碍,这很可能与海马体有关〔9〕,但具体机制尚不完全清楚。本研究建立OSAS大鼠动物模型,观察海马CA1区病理变化及小胶质细胞激活情况,寻找OSAS认知障碍可能的机制。
1 材料与方法
1.1主要仪器和试剂 多参数神经监护仪(上海诺诚医疗器械公司);Morris水迷宫(成都盟泰科技有限公司);组织脱水机(阔海科技 KH-TK);石蜡包埋机(Leica EG1160,德国);石蜡切片机(Leica RM2135,德国);冰冻切片机(Leica CM 1900,德国);数码成像及分析系统(CellSens Standard);10 mg/ml玻璃酸透明质酸钠凝胶(上海其胜生物制剂公司);磷酸盐缓冲液(PBS,北京中杉 ZLI-9061);Tween 20(Sigma-vetec);聚乙二醇辛基苯基醚(TritonX-100,Vetec V900502);柠檬酸盐修复液(北京中杉金桥);苏木素(Sigma H3136);伊红(Sigma 230251);石蜡(Leica H22149);二氨基联苯胺(DBA)显色试剂盒(北京中杉ZLI-9018);封闭用正常羊血清(北京中杉ZLI-9021);通用型二步法检测试剂盒(北京中杉金桥);离子钙接头蛋白抗原(IBA)-1(wako日本 rabbit)。
1.2实验动物 健康雄性SD大鼠60只,体质量280~300 g,购自昆明医科大学实验动物学部〔生产许可证:SCXK(滇)K2015-0002)〕,在昆明医科大学实验动物楼标准化饲养,保证实验大鼠正常生活习性。本实验得到昆明医科大学实验动物伦理委员会批准。
1.3实验动物及分组 适应性喂养后采用随机数字表法将60只大鼠随机分为对照组和实验组各30只。对照组采用正常饲养模式,实验组采用咽腔多点注射透明质酸钠凝胶制备OSAS模型。
1.4OSAS动物模型制作 根据周赵德等〔10〕方法,(1)SD大鼠均适应性饲养1 w后,使用多参数神经监护仪监测血氧饱和度并记录数据(具体方法为:按3 ml/kg的剂量配制10%水合氯醛,对大鼠进行腹腔注射麻醉;成功后,将血氧探头的红外线充分接鼠尾静脉,待仪器上参数稳定后记录每只大鼠的最低血氧饱和度和平均血氧饱和度)。(2)实验组模型制备方法为:麻醉方法同以上,于双侧舌腭弓、咽腭弓及舌根处多点少量注射医用透明质酸钠凝胶(约3 ml),整个过程注意观察大鼠呼吸情况。小心监测大鼠生命体征,直至大鼠麻醉完全清醒,避免窒息死亡。分别于术前1 w及术后4 w使用多参数神经监护仪监测最低血氧饱和度及平均血氧饱和度,并与术前数据进行统计学分析。(3)实验分组:30只模型组大鼠造模成功后,按继续饲养时间分为实验2、4、6 w组,每组10只,与对照组相对应。
1.5Morris水迷宫试验行为学评估 ①定位航行实验:第1~6天对大鼠进行水迷宫检测,第1天为适应性训练。实验开始时小平台放置于第三象限且在水面下1~2 cm。将两组大鼠分别在每个象限的中点面朝池壁置放入水槽,同时启动计算机跟踪程序,记录每组大鼠在水迷宫中找到水下平台所花费的时间、路程,超过90 s未找到平台时其潜伏期记为90 s,同时实验者用小棍指引大鼠寻找到平台,并允许其在小平台上停留10 s。取每只大鼠的平均成绩作为空间学习能力的指标,连续观测6 d。②空间探索实验:第7天将小平台撤去,分别在四个象限的固定点将大鼠放入水池,记录大鼠在目标象限的时间及穿过原平台所在位置的次数,将此作为空间记忆的检测指标。
1.6苏木素-伊红(HE)染色观察各组海马CA1区病理学改变 所有大鼠脱颈处死后,快速分离海马组织并制备石蜡切片,将切片在二甲苯中脱蜡10 min,然后在降序的乙醇(100%、95%、85%和70%)和蒸馏水中再水合5 min。切片用0.1% HE溶液染色,然后在95%和100%乙醇中逐渐脱水2次,每次5 min。处理脱水后,中性树胶封片,普通光学显微镜下观察显色结果并拍照。
1.7免疫组组织化学(IHC)检测小胶质细胞标记物IBA-1的阳性表达 将切片置于温度为65 ℃恒温烘箱中至少30 min,常规梯度乙醇脱蜡至水,0.01 mol/L PBS漂洗,将脑组织切片浸入3%过氧化氢(H2O2)溶液在室温下放置30 min以阻断内源性过氧化物酶活性。然后将组织切片置于柠檬酸盐缓冲液中在微波炉中进行抗原修复。在室温下再加入正常山羊血清1 h以阻断非特异性结合,加适当浓度一抗,4 ℃过夜。PBS洗涤20 min后,组织切片与二抗(PV9000试剂)37 ℃孵育30 min。然后去除多余的二抗,再用PV9000试剂25 ℃孵育1 h,PBS漂洗后用DAB染色5~10 min。显微镜下观察显色情况并记录显色时间,然后将组织切片用苏木素复染,烘干,二甲苯透明10 min,中性树胶封片,照片采集。
1.8统计学方法 采用SPSS23.0软件进行自身配对设计t检验、重复测量方差分析、单因素方差分析及Pearson相关分析。
2 结 果
2.1造模成功判断 造模后实验组出现活动减少、呼吸费力、呼吸频次增快、抬头呼吸、腹式呼吸加深,可闻及呼吸打鼾声等类似OSAS症状。对照组性情温顺、呼吸正常、活动及饮食正常。实验组造模后最低血氧饱和度及平均血氧饱和度均较造模前降低,差异均具有统计学意义(P<0.05),提示造模成功。见表1。
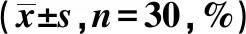
表1 实验组造模前后最低血氧饱和度和平均血氧饱和度
2.2Morris水迷宫行为学结果
2.2.1定位航线实验 实验组2、4、6 w平均潜伏期较对照组延长,差异有统计学意义(P<0.05),且随着实验组培养时间延长,潜伏期逐渐延长,差异有统计学意义(P<0.05),表明实验组学习能力明显受损。见表2。
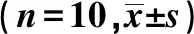
表2 两组不同培养时间平均潜伏时间及穿越平台次数比较
2.2.2空间探索实验结果 与对照组比较,实验组2、4、6 w穿越平台次数减少,差异有统计学意义(P<0.05)。且随着实验组饲养时间延长,其穿越平台次数逐渐减少,差异有统计学意义(P<0.05),提示实验组出现明显的空间定位记忆缺陷。见表2。
2.3各组海马HE染色结果 实验组2、4、6 w神经元变性坏死计数与对照组同期比较明显增加(均P<0.05)。见表3。对照组各时间点海马CA1区神经元细胞形态规则,大小形状正常,细胞核呈圆形或椭圆形,细胞轮廓及边界清晰,细胞排列致密、整齐,核仁明显且核质分明,有少量异染色质。对照组各期海马CA1区部分神经元细胞出现核固缩,细胞排列松散、紊乱,边界不清,细胞周围间隙增宽,形态不规则。随着OSAS时间延长,神经元数量减少,细胞变形、坏死细胞逐渐增多,细胞核模糊。亦可见细胞空泡化,胞质成分不明显。见图1。

图1 HE染色观察两组不同培养时间海马CA1区组织病理学(×40)
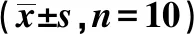
表3 各组不同培养时间海马CA1区神经元变性坏死计数及IBA-1表达比较
2.4免疫组化观察两组海马CA1区小胶质细胞标记物IBA-1表达 图2可知,对照组2、4、6 w可见静息期小胶质细胞,表现为:数量少,染色浅,细胞体小而长,可见有伸向各个方向的呈分枝状细长的突起。实验组2、4、6 w,可见激活后的小胶质细胞,表现为细胞突起增粗,细胞深染,细胞体变大、膨胀。实验组2、4、6 w IBA-1的IOD值与对照组同期比较明显增加(P均<0.05)。见表3。

图2 两组培养不同时间海马CA1区IBA-1表达[×200;小框所指为箭头处局部放大的IBA-1小胶质细胞(×400)]
2.5海马神经损伤与行为学、小胶质细胞活化的相关性 海马CA1区神经元变性坏死细胞数与Morris水迷宫实验第5天逃避潜伏期时间呈显著正相关(r=0.848,P<0.05),与Morris水迷宫实验第5天空间探索数据呈显著负相关(r=-0.820,P<0.05)。海马神经损伤与小胶质细胞活化:海马CA1区神经元变性坏死细胞数与海马CA1区IBA-1免疫组化染色结果呈显著正相关(r=0.774,P<0.05)。
3 讨 论
CIH是OSAS的主要病理特征,而间歇性缺氧和睡眠碎片化可以影响成人海马神经元,患有OSAS并发症的老年患者可能会加速脑萎缩、认知能力下降及痴呆的发生。有证据提示,OSAS动物模型中的CIH与空间学习受损有关,这与皮层和海马CA1区的细胞凋亡增加及神经细胞损伤有关〔11~13〕。OSAS致认知障碍的机制包括CIH、氧化应激、睡眠结构紊乱及神经炎症等,其中神经炎症的变化,与小胶质细胞密切相关〔9,14〕。已经有动物实验证实,CIH导致小鼠背侧海马体的轻度神经炎症,包括早期炎性细胞因子升高、后期小胶质细胞变化及对脂多糖炎症挑战的细胞因子反应改变。这些变化可能会导致CIH诱导的认知障碍和病理性脑老化〔15〕。已知在中枢神经系统中,巨噬细胞和小胶质细胞被细胞因子激活并分化为促炎(M1)或抗炎(M2)谱。细胞因子如白细胞介素(IL)-6、IL-5、肿瘤坏死因子(TNF)-α和γ-干扰素(IFN-γ)通常负责激活小胶质细胞进入促炎M1谱以清除病原体和受损组织,并激活凋亡途径。而IL-4、IL-10和IL-13细胞因子促使小胶质细胞分化为抗炎M2谱以促进细胞存活并抑制炎症通路。然后激活的小胶质细胞会释放与其特征一致的细胞因子,以进一步诱导额外的免疫反应。在稳态条件下,这些激活的细胞因子被平衡以维持细胞健康。然而,这些互补谱的失调可能由炎症系统的慢性激活引起〔16,17〕,这些可通过后续实验研究进一步探索。目前,对结构神经元损伤的机制及小胶质细胞在OSAS暴露于CIH期间所起的潜在作用知之甚少。CIH引发了诸如海马细胞凋亡和学习缺陷等病理。根据大量啮齿动物模型累积证据证实,CIH确实会诱导大脑中的异位损伤模式,特别是影响皮质、皮质下和海马区域,最终导致神经元凋亡和小胶质细胞激活〔18〕。氧化应激和神经炎症对小胶质细胞具有负面机制影响,导致其凋亡。受损的小胶质细胞会释放大量促炎细胞因子,进一步促进炎症的级联反应。一般来说,炎症的适度激活有利于神经保护,但过度时会导致神经毒性。因此,保护小胶质细胞免受炎症诱导的细胞凋亡是缓解神经炎症的一种策略〔19〕。近年来,越来越多的研究表明,线粒体自噬是一种内在的抗炎机制,可启动功能失调的线粒体的清除并限制过度的炎性细胞因子产生,最终抑制神经炎症〔20〕。已有研究证实,通过使用抗氧化及抗炎类药物,如芝麻酚等可降低海马体神经炎症细胞因子的表达,减轻CIH大鼠认知障碍〔21,22〕。
综上,OSAS模型大鼠致认知障碍可以导致海马CA1区神经细胞病理损害,同时引起小胶质细胞的激活,可能与神经炎症有关,表明神经炎症相关通路可能参与OSAS致认知障碍的过程中,抗神经炎症可能成为OSAS海马损伤的治疗方法之一。

