溃疡性结肠炎大鼠模型不同建立方式比较
王文豪 张欣 孙振民 孙佳 赵成龙 李玉莉 高志星
(潍坊医学院 1临床医学院,山东 潍坊 261053;2整形外科研究所;3附属医院消化内一科)
溃疡性结肠炎(UC)是一种病因及发病机制尚未明确的,特发性、慢性的结肠黏膜炎症性疾病。具有复杂的遗传背景,环境、心理、免疫,肠道微生态等多种因素共同作用。始于直肠,通常以连续的方式向近端延伸至部分或整个结肠,一些直肠炎或左侧结肠炎患者可能有盲肠内的炎性斑块〔1〕。临床进程不可预测,主要是因为发作期和缓解期交替出现。临床上溃疡性结肠炎患者通常表现为腹痛、腹泻和便血〔2〕。其他多种疾病也与UC有关,包括葡萄膜炎、硬膜炎、视神经炎、骨质疏松、牛皮癣、抑郁症、sweet综合征、口腔炎等。UC的年龄分布最有可能出现在生命的第2或第4个10年,没有特定的性别偏好〔3〕。我国流行病学资料显示我国大陆地区的UC发病率约为11.6/10 000,且尚有数据未被完全统计,存在被低估的可能〔4~6〕。不难看出UC在我国仍属少见病,但近20余年来其就诊人数呈快速上升趋势〔7〕。尽管涉及UC发病的病因仍不确定,但是各种动物模型的研究为揭示UC的发病和进展提供了新的见解。各种化学诱导型UC模型已在实验室广泛使用。这些模型紧密模仿人类UC的形态,组织病理学及临床症状特征。在化学诱导的结肠炎模型中,最广泛使用的是三硝基苯磺酸(TNBS)/乙醇联合诱导的结肠炎和右旋糖酐硫酸钠(DSS)诱导的结肠炎模型〔8〕。本研究对这两种UC大鼠建模方式进行对比。
1 材料与方法
1.1材料 8周龄,体质量180~220 g SPF级Wistar雄性大鼠18只,购自济南朋悦实验动物繁育有限公司,动物许可证号:SCXK(鲁)20190003。根据潍坊医学院动物保护和使用委员会批准的程序进行动物实验,以减轻疼痛和避免伤害。实验方案均严格按照中华人民共和国科学技术部制定的《实验动物的护理和使用指导建议》执行。尽一切努力使动物遭受的痛苦最小化。TNBS购自美国sigma,DSS购自美国MPBIO。
1.2分组 将18只SPF级Wistar雄性大鼠随机分为TNBS/乙醇组、DSS组及健康对照组各6只。动物饲养于潍坊医学院实验动物中心层流房内,室温(20±2)℃,相对湿度50%~60%,颗粒饲料喂养,自由饮水。
1.3TNBS/乙醇法建立大鼠UC模型 根据Morris 等〔9〕研究,采用TNBS/乙醇法诱导UC模型。适应性饲养1 w后,禁食、不禁水24 h,腹腔注射30 mg/ml戊巴比妥钠,麻醉成功后,采取头低脚高,将直径约2 mm橡胶管,自肛门缓慢插入直肠约8 cm,灌入TNBS原液100 mg/kg+50%乙醇0.25 ml,取头低尾高位,呈20~30 °角,持续30 s,放置笼中,建模结束,清醒后自由饮食。
1.4DSS溶液自由饮水法建立大鼠UC模型 根据Fichna等〔10〕研究,本实验采用4%DSS自由饮水法建立大鼠UC模型。适应性给喂养1 w后用4%DSS代替饮用水,连续7 d自由饮用进行诱导,DSS溶液每2 d换1次,以保持溶液质量,7 d后换回普通饮用水,建模结束。
1.5一般状况的观察 3组建模结束后观察大鼠有无活动减少、毛色异常,每日同一时间称取各组大鼠体质量,记录其大便性状及大便隐血或肉眼血便状况并且收集粪便。大便隐血检测运用便隐血检测试纸(联苯胺法):挑取少许粪便于滤纸上,加1%联苯胺冰醋酸溶液1~2滴,加3%过氧化氢溶液1~2滴。加试剂后2 min试纸反应区不显色为隐血试验阴性(-);加试剂10 s后,反应区显浅蓝色,渐变蓝色为隐血试验阳性(+);加入试剂后反应区初显浅蓝褐色,渐加深变明显褐色为隐血试验阳性();加入试剂后反应区立即显蓝褐色为隐血试验阳性()。按表1进行疾病活动指数(DAI)评价,DAI =(体质量下降分数+大便性状分数+便血分数)/3。

表1 DAI评分标准
1.6标本采集及处理 3组大鼠建模结束1 w后,剖杀取材后当天死亡,1只在建模结束后第2天死亡)。禁食不禁水24 h,过量30 mg/ml戊巴比妥钠腹腔注射。迅速剖开大鼠腹腔,游离脾脏称重,游离肛门至盲肠末端肠管,测量结直肠长度及重量,沿纵轴剖开,冰生理盐水冲洗肠管内表面,吸水纸拭干,平铺于滤纸上,以观察结肠组织大体形态,取各组大鼠结肠相同部位组织,依次进行固定、脱水、透明、浸蜡、包埋、切片、摊片、烤片、脱蜡、染色、脱水、透明、封片制作结肠病理组织切片进行苏木素-伊红(HE)染色,过碘酸雪夫(PAS)染色,将大鼠结肠中的黏液素染成紫红色,光镜下观察。
1.7统计学方法 采用SPSS17.0软件进行t检验。
2 结 果
2.1一般状况 建模后健康对照组体质量一直呈上升趋势,粪便颗粒状,粪便潜血阴性,无肉眼血便。TNBS/乙醇组建模后第1天出现肉眼血便,后血便明显,体质量不断下降,粪便呈稀便。DSS组建模后第1天出现肉眼血便,第3天肉眼血便消失,粪便隐血强阳性,体质量不断下降,粪便不成形。TNBS/乙醇组和DSS组 DAI评分〔(2.4±0.43),(2.25±0.34)分〕明显高于健康对照组〔(0.13±0.1)分,P<0.01〕。而TNBS/乙醇组和DSS组 DAI 评分差异无统计学意义(P>0.05)。TNBS/乙醇组大鼠1只在建模当天死亡,1只在建模结束后第2天死亡,DSS组和健康对照组正常生存。3组生存曲线见图1。
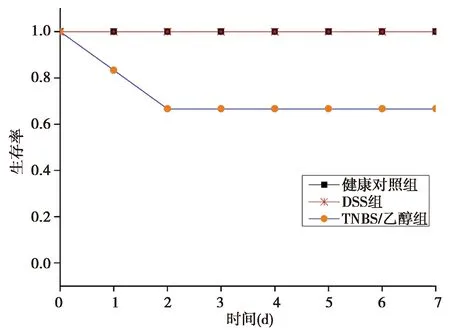
图1 3组生存曲线
2.2结肠损伤评价 TNBS/乙醇法建立的大鼠UC模型,受损肠壁坚硬,弹性差,在结肠距离肛门约8 cm处可见肉眼巨大溃疡面或肿块,伴有糜烂,充血。DSS组剖开肠管并未发现肉眼可见溃疡面,肠壁较柔软,肠壁可见小的出血点,健康对照组结肠表面未见明显异常。见图2。
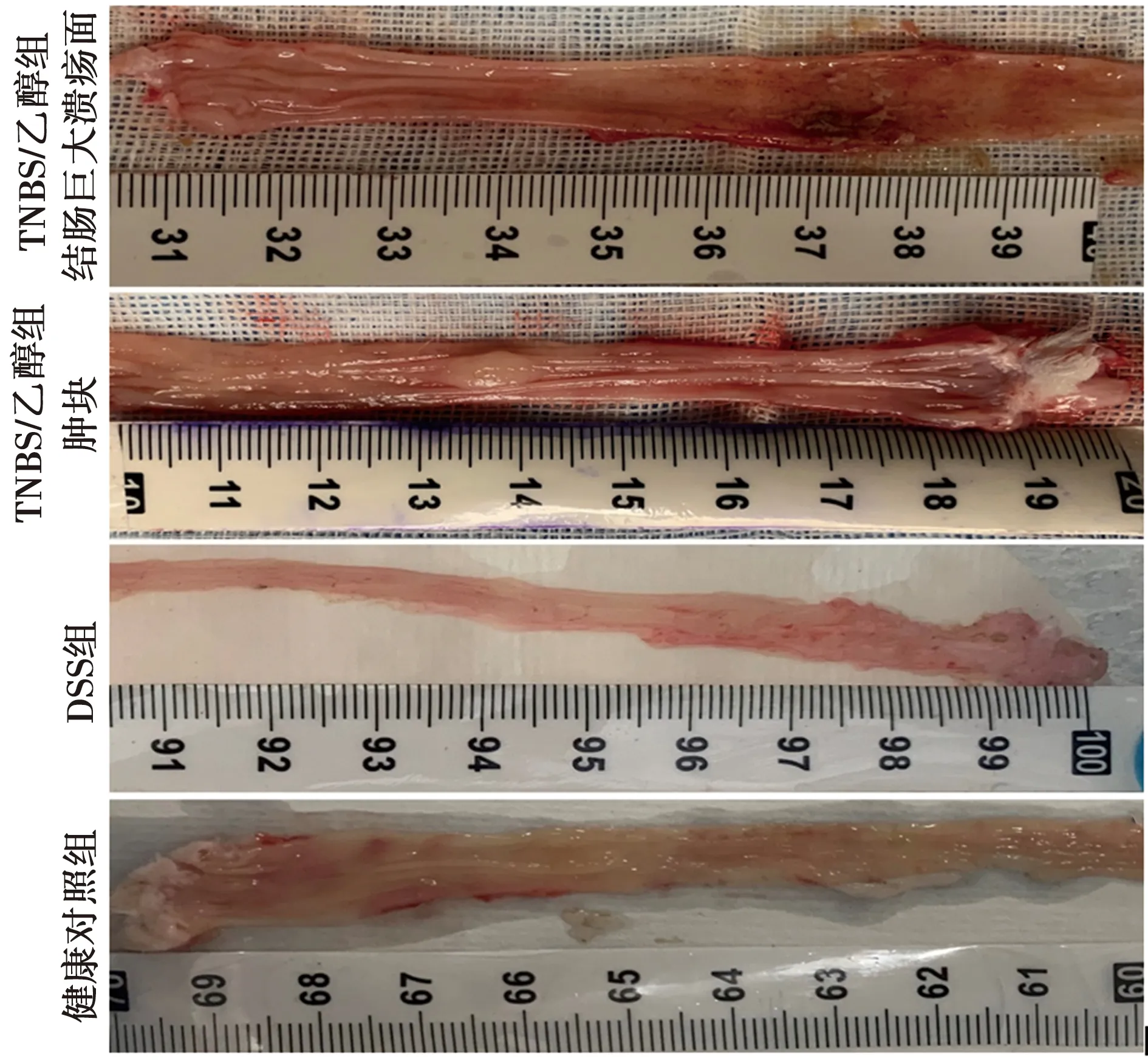
图2 各组结肠
2.3结肠组织病理学 HE染色可见,健康对照组正常黏膜,黏膜下层,肠隐窝和肌肉层的微观特征,结肠结构完整,无炎症,隐窝完整,杯状细胞丰富。TNBS/乙醇组结肠HE显示炎性细胞浸润黏膜及黏膜下层,甚至达肌层。有广泛弥漫性炎性细胞浸润,黏膜及黏膜下层可见糜烂和溃疡,隐窝结构改变,大小、形态不规则,腺体减少,可见隐窝脓肿等。DSS组固有膜内有弥漫性炎性细胞润,包括中性粒细胞、淋巴细胞、浆细胞、嗜酸性粒细胞等,尤其是上皮细胞间有中性粒细胞浸润(即隐窝炎)。隐窝结构改变,隐窝大小、形态不规则,分支、出芽,排列紊乱,杯状细胞减少等。PAS染色可见,健康对照组肠道腺体排列规整,呈管状,可见大量染色阳性的含黏液杯状细胞,腺腔表面亦可见染色阳性细胞。TNBS/乙醇组和DSS组黏液素较健康对照组明显减少。TNBS/乙醇组和DSS组未见明显差异。见图3。
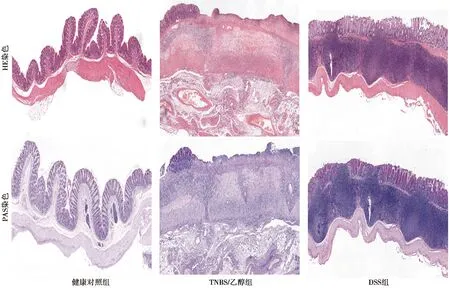
图3 3组结肠组织病理学(×40)
3 讨 论
TNBS/乙醇法诱导UC的过程中,乙醇起到破坏大鼠的肠壁黏膜屏障的作用,造成肠黏膜的损伤,TNBS作为半抗原能与赖氨酸的E-氨基共价结合,修饰细胞表面蛋白。引起 Th1 介导的免疫反应,表现为黏膜固有层 CD4+T细胞、中性粒细胞和巨噬细胞的浸润增多,产生炎症改变〔11,12〕。Grisham等〔13〕认为,由于抗坏血酸盐和TNBS之间的相互作用,TNBS可以(酶法和非酶法)代谢生成O2-和H2O2,提示TNBS诱导的结肠炎可能部分是由TNBS氧化代谢产生的细胞毒性活性氧代谢产物介导的。TNBS/乙醇诱导的大鼠UC,大鼠同样表现出腹泻、便血、体质量减轻等与人类UC相似的临床症状,方法简单,建模时间短暂,只需一次灌肠给药,且建模成本相对较低,大鼠间差异相对较小。但对于结肠壁损伤较大,溃疡面肉眼可见且出现假性息肉,甚至出现穿透性溃疡,模型死亡率较高,且溃疡面集中在距离肛门8 cm处,这与灌肠方法有着直接关系。因此该模型更适用于研究依赖于CD4+T 细胞免疫功能的肠道炎症反应。
DSS是一种具有抗凝作用的硫酸多醣,PerSe等〔14〕研究表明,DSS对结肠上皮屏障的完整性具有破坏性,可使肠黏膜通透性增加,导致多糖等大分子物质更易渗入肠黏膜组织中,进而引发一系列炎症反应,Okayasu等〔15,16〕发现,DSS引起肠道菌群的改变,特别是革兰阴性厌氧菌数量的增加,包括杆菌科,进而导致肠道内破坏和炎症改变。DSS诱导UC大鼠表现出腹泻、便血、体质量减轻等与人类UC相似的临床症状,病理表现也与人类UC临床相似,建模方式简单,成模率高,可重复性强,但建模成本较高,且周期相对较长,自由饮水无法控制每只大鼠饮水量,建模后大鼠间差异较大。因此DSS 模型更适用于肠黏膜损伤、肠道菌群改变在UC发生发展中作用的研究。
综上,TNBS/乙醇法建立的模型更适用于研究依赖于CD4+T 细胞免疫功能的肠道炎症反应,而DSS 模型更适用于肠黏膜损伤、肠道菌群改变在UC发生发展中的作用研究。

