基于网络药理学、分子对接及实验验证探讨霍山石斛治疗非酒精性脂肪肝的作用机制
邓光辉,叶梦娟,蔡 肖,马梦真,吕家慧,吴 静,张晓倩,邢丽花,彭代银, 3, 4,王妍妍*,俞年军, 3, 4*
基于网络药理学、分子对接及实验验证探讨霍山石斛治疗非酒精性脂肪肝的作用机制
邓光辉1, 2,叶梦娟1, 2,蔡 肖1, 2,马梦真1, 2,吕家慧1, 2,吴 静1, 2,张晓倩1, 2,邢丽花1, 2,彭代银1, 2, 3, 4,王妍妍1, 2*,俞年军1, 2, 3, 4*
1. 安徽中医药大学,安徽 合肥 230012 2. 安徽省中医药科学院 中药资源保护与开发研究所,安徽 合肥 230012 3. 省部共建安徽道地性中药材品质提升协同创新中心,安徽 合肥 230012 4. 中药研究与开发安徽省重点实验室,安徽 合肥 230012
基于网络药理学、分子对接及体内实验验证探讨霍山石斛对非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的疗效及作用机制。利用文献检索霍山石斛活性成分,采用SwissTargetPrediction数据库预测其潜在靶点,采用DisGeNET和GeneCards数据库筛选NAFLD靶点,并将药物靶点和疾病靶点取交集,构建蛋白质-蛋白质相互作用网络,借助DAVID数据库进行基因本体功能和京都基因与基因组百科全书通路富集分析,构建“活性成分-靶点-疾病-通路”网络,并采用AutoDock等软件对关键活性成分和核心靶点进行分子对接验证。采用高脂高糖饮食诱导NAFLD小鼠模型,设置对照组、模型组、吡格列酮(10 mg/kg)组和霍山石斛低、中、高剂量(200、400、600 mg/kg)组,连续给药8周。检测血清三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)及天冬氨酸氨基转移酶(aspartate aminotransferase,AST)的含量;ELISA检测肝脏中TC、TG、白细胞介素-6(interleukin-6,IL-6)、IL-1β及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;油红O染色和苏木素-伊红(HE)染色检测肝组织病理变化;Western blotting检测肝组织中胰岛素受体(insulin receptor,InsR)、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)蛋白表达。霍山石斛中筛选出石斛酚、铁皮石斛素A、4,4′-dihydroxy-3,5-dimethoxydihydrostilbene、柚皮素等38个活性成分,与NAFLD共同靶点有155个,作用于胰岛素、AKT1、白蛋白、TNF、IL-6、血管内皮生长因子A、过氧化物酶体增殖物激活受体γ、IL-1β等19个核心靶点,主要涉及癌症途径、PI3K/Akt通路、晚期糖基化终产物及其受体信号通路、缺氧诱导因子信号通路、TNF信号通路等,分子对接显示前5位核心成分与前5位核心靶点具有较好的接合能力。动物实验结果证实成功构建小鼠NAFLD模型,与模型组比较,霍山石斛组小鼠体质量、肝脏指数以及血清TG、TC、ALT、AST、LDL-C和肝脏TC、TG水平显著降低(<0.05、0.01),血清HDL-C水平显著升高(<0.01),改善肝脏脂肪蓄积和变性,肝脏InsR、PI3K、p-Akt/Akt蛋白表达水平显著增加(<0.05、0.01),p-GSK-3β/GSK-3β蛋白表达显著减少(<0.01)。霍山石斛对NAFLD具有保护作用,其机制可能与激活PI3K/Akt通路、改善胰岛素抵抗和减少炎症反应有关。
霍山石斛;非酒精性脂肪肝;网络药理学;芦丁;石斛酚;柚皮素;InsR/PI3K/Akt/GSK-3β通路;胰岛素抵抗;炎症
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是以三酰甘油(triglyceride,TG)为主的脂质在肝细胞内堆积的肝脏代谢性疾病,以肝脏脂肪变性为开始,可能发展成脂肪性肝炎[1]。全球NAFLD患病率为20%~30%,并随着肥胖人群的增加而不断上升[2]。目前,NAFLD尚无获批的有效药物,因此,迫切需要探索治疗NAFLD的靶点和药物[3]。
霍山石斛C. Z. Tang et S. J. Cheng是兰科石斛属多年生草本植物,作为一种传统名贵中药,在改善肝脏脂肪变性和炎症方面具有巨大潜力,拥有重大的医药开发价值和应用前景[4]。现代药理学研究发现,霍山石斛具有保护肝脏、降血糖、调血脂、抗氧化等多种功能活性,对NAFLD具有防治作用[5-6]。表明霍山石斛治疗NAFLD具有较好的前景,然而霍山石斛防治NAFLD的物质基础和作用机制仍不清楚,需深入研究。
网络药理学是利用生物网络中药物的药理机制解释药物成分、靶点和疾病之间的关系,关注的是多个活性成分与各种不同基因或蛋白相互作用,这与中药的“整体”研究思路相同[7]。因此,本研究利用网络药理学[8]及分子对接研究霍山石斛中活性成分治疗NAFLD的作用机制,并通过体内实验进行初步验证,为探索霍山石斛治疗NAFLD提供一定理论参考。
1 材料
1.1 药材
霍山石斛干条经安徽中医药大学生药系俞年军教授鉴定为兰科植物霍山石斛C. Z. Tang et S. J. Cheng的干燥茎,打粉过100目筛(粒径D90,115~120 μm)备用。称取适量霍山石斛细粉,加入一定量的蒸馏水,配成混悬液,含芦丁(56.7±2.9)mg/kg、石斛酚(11.9±1.6)mg/kg、柚皮素(78.7±2.4)mg/kg[9]。
1.2 动物
SPF级C57BL/6J雄性小鼠36只,体质量18~22 g,5周龄,购自杭州子源实验动物科技有限公司,许可证号SCXK(浙)2019-0004。所有动物均饲养在环境温度20~25 ℃,相对湿度40%~70%,昼夜循环每日12 h交替照明,自由摄取食物,喂养60%脂肪供能高脂纯化型饲料。动物实验符合动物实验伦理学要求,经安徽中医药大学动物伦理委员会审查后批准(批准号AHUCM-mouse-2022124)。
1.3 药品与试剂
吡格列酮(批号H20110048)购自江苏德源药业股份有限公司;果糖(批号D809612)购自麦克林生化科技有限公司;小鼠白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、小鼠IL-6 ELISA试剂盒(批号分别为JYM0531Mo、JYM0218Mo、JYM0012Mo)购自武汉基因美生物科技有限公司;组织胆固醇(total cholesterol,TC)酶法测定试剂盒、组织TG酶法测定试剂盒(批号分别为A111-1-1、A110-1-1)购自南京建成生物工程研究所;RIPA裂解液、BCA蛋白浓度测定试剂盒、磷酸酶抑制剂、蛋白上样缓冲液(批号分别为P0013B、P0012S、P1081、BL502B)购自上海碧云天生物技术有限公司;超敏ECL发光检测试剂(批号P10100)购自新赛美生物科技有限公司;丝氨酸蛋白酶抑制剂(批号EA0006)购自山东思科捷生物技术有限公司;胰岛素受体(insulin receptor,InsR)抗体(批号204331AP)购自美国Proteintech公司;磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)兔多克隆抗体(批号分别为YN5487、YT2082)购自Immunoway公司;蛋白激酶B(protein kinase B,Akt)兔多克隆抗体(批号380617)、β-肌动蛋白(β-actin)兔单克隆抗体(批号380624)购自成都正能生物有限公司;p-Akt、p-GSK-3β抗体(批号分别为CST4060T、CST5558T)购自美国CST公司;60%脂肪供能高脂纯化型饲料(批号XTHF60)购自江苏协同医药生物工程有限责任公司。
1.4 仪器
DW-25L262型低温台式离心机(合肥荣事达小家电有限公司);Chemray 240型全自动生化仪(深圳雷杜生命科学股份有限公司);Multiskan Spectrum多功能酶标仪(美国赛默飞公司);DYCZ-24KS型电泳仪、DYCZ-40K型转膜仪(北京六一生物科技有限公司);AMERSHAM IMAGER 600型凝胶成像系统(美国GE公司);YIB-510FL型光学显微镜(苏州越视精密仪器有限公司)。
2 方法
2.1 霍山石斛活性成分的查找与筛选
在Web of science(https://www.webofscience. com)、中国知网(https://www.cnki.net)、PubMed(https://pubmed.ncbi.nlm.nih.gov)等数据库中检索“霍山石斛”和“”获得霍山石斛化学成分。通过化源网(https://www. chemsrc.com)和PubChem(https://pubchem.ncbi.nlm. nih.gov)数据库补充化合物的名称及结构信息。Chem Draw 20软件绘制化合物的分子结构式,保存为sdf结构。在Swiss ADME(http://www.swissadme. ch)中导入化合物结构,通过药动学规则筛选。筛选标准:(1)Lipinski、Ghose、Veber、Egan、Muegge中2种及以上的类药性原则为“yes”,表明化合物具有良好的成药性;(2)肠胃吸收结果为“high”,表明化合物具有良好的生物利用度。同时满足上述2条标准的化合物为霍山石斛中有效的活性成分[10]。
将筛选的霍山石斛活性成分的结构导入SwissTargetPrediction数据库,每个活性成分取“probability”值不小于0.01的潜在作用靶点,汇总所有靶点信息,UniProt数据库(https://www.uniprot. org)校正化学成分靶点基因名称,使蛋白靶点信息标准化。
2.2 NAFLD靶点预测及药物-疾病共同靶点收集
分别在GeneCards数据库(https://www. genecards.org)和DisGeNET数据库(https://www. disgenet.org)中,以关键词“non-alcoholic fatty liver disease”收集NAFLD相关基因,去除重复基因后,结合UniProt数据库将靶点名标准化,确定NAFLD的潜在作用靶点。使用Venny 2.1.0将霍山石斛活性成分靶点与NAFLD疾病相关靶点取交集。
2.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建
将霍山石斛与NAFLD共同靶点导入STRING数据库进行分析,结果保存为*tsv格式文件并导入Cytoscape 3.7.2软件中,运用“Network Analyzer”的功能对PPI结果进行网络拓扑学分析,构建PPI网络,利用Cytoscape 3.7.2软件中的插件CytoNCA进行关键靶点的筛选[11]。
2.4 “药物-靶点-疾病”网络的构建
将“2.2”项下收集的霍山石斛与NAFLD的共同靶点导入Cytoscape 3.7.2构建“药物-靶点-疾病”网络。
2.5 基因本体(gene ontology,GO)生物功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
通过DAVID数据库对得到的交集靶点进行GO功能注释和KEGG通路分析,利用微生信(http://www.Bioinformatics.com.cn/)对GO和KEGG通路富集结果进行可视化分析[12]。
2.6 “活性成分-靶点-疾病-通路”网络构建
将霍山石斛活性成分、NAFLD、前20条KEGG通路及其涉及的靶点数据整合,导入Cytoscape 3.7.2软件中构建“活性成分-靶点-疾病-通路”网络。
2.7 分子对接
将“活性成分-靶点-疾病-通路”网络中度值排名前5位的有效活性成分与PPI网络中前5位的潜在靶点进行分子对接。在PubChem数据库中获取霍山石斛活性成分的SDF文件,作为配体文件。蛋白质受体文件从PDB数据库(http://www.rcsb.org/)中获取,通过AutoDock Tool软件对蛋白受体进行去水、加氢等操作。使用Autodock Vina进行分子对接并计算结果,受体-配体的结合程度可以通过分子对接结果中的结合能水平来判断。如果结合能小于−5 kJ/mol,说明目标物与化合物有一定的结合活性,结合能越低,对接效果越好,用PyMOL对结果进行可视化[13]。
2.8 体内实验验证
2.8.1 模型建立、分组与给药 C57BL/6J雄性小鼠随机分为对照组、模型组、吡格列酮(10 mg/kg)组和霍山石斛低、中、高剂量(200、400、600 mg/kg)组,每组6只。对照组喂养普通饲料,饮用普通饮用水,其余各组喂养高脂饲料,饮用10%果糖溶液,连续喂养12周,构建小鼠NAFLD模型[14-15]。在喂养4周后开始给药,1次/d,连续8周。
2.8.2 体质量、肝指数测定 每周称定小鼠质量。实验结束后对每只动物的肝脏组织进行称定,并计算肝脏指数。
2.8.3 血清和组织样本收集 给药8周后,所有小鼠禁食不禁水12 h,ip 10%水合氯醛麻醉,从腹主动脉抽取全血,室温静置2 h,4 ℃、2000 r/min离心20 min收集血清,将血清样品储存在−80 ℃。取血后迅速收集肝脏组织,用冷冻生理盐水冲洗,取各组小鼠相同部位少量肝组织,用4%的多聚甲醛溶液固定,用于后续形态学检测,剩余部分储存在−80 ℃冰箱中。
2.8.4 血清中TC、TG、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及肝脏中TC、TG含量检测 利用全自动生化分析以检测小鼠血清中TC、TG、ALT、AST、HDL-C、LDL-C的含量。取保存于−80 ℃冰箱中的肝脏组织,根据试剂盒说明书检测小鼠肝脏中TC、TG的含量。
2.8.5 肝组织病理学形态和油红O染色观察 将肝组织按常规石蜡包埋制备4 μm组织切片,按照苏木素-伊红(HE)、油红O染色后,于显微镜下观察并拍照。
2.8.6 肝脏炎症因子测定 取保存于−80 ℃的肝脏,按照ELISA试剂盒说明书检测小鼠肝脏中的IL-6、IL-1β和TNF-α的含量。
2.8.7 Western blotting检测InsR/PI3K/Akt/GSK-3β通路蛋白表达 取100 mg新鲜肝脏组织,液氮研磨后加入RIPA裂解液充分研磨,离心提取总蛋白后取上清,BCA法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入一抗,4 ℃孵育过夜。放入二抗(1∶10 000),室温孵育1 h,使用增强的化学发光试剂显影,采用Image Lab进行灰度分析。
3 结果
3.1 霍山石斛的活性成分
通过数据库收集霍山石斛的化学成分,发现38个活性成分符合要求,见表1。
3.2 霍山石斛活性成分与NAFLD的共同靶点
38个霍山石斛活性成分靶点汇总后并去除重复靶点得到613个靶点,在GeneCards数据库和DisGeNET数据库中收集NAFLD的潜在靶点,去重后得到1041个靶点。将霍山石斛活性成分靶点与NAFLD靶点取交集,共得到155个共同靶点,即为霍山石斛活性成分抗NAFLD的潜在靶点(图1)。
表1 霍山石斛的活性成分
Table 1 Active components of D. huoshanense
序号成分相对分子质量 DHP14,4′-dihydroxy-3,5-dimethoxy- dihydrostilbene274.31 DHP2山药素III244.28 DHP33-hydroxy-4′,5-dimethoxybibenzyl258.13 DHP43,4-二羟基-5-甲氧基苯甲醛168.15 DHP54-羟基苯甲酸138.12 DHP6香草醛152.15 DHP7天麻素286.28 DHP8(+)-丁香树脂酚418.40 DHP9柚皮素272.25 DHP10丁香酸198.17 DHP11氧化白藜芦醇244.24 DHP122,3,4,7-四甲氧基菲298.30 DHP13对反式香豆酰酪胺283.32 DHP14二氢白藜芦醇230.26 DHP15tristin260.28 DHP16毛兰素318.40 DHP17铁皮石斛素N436.15 DHP18(R)-3,4-dihydrox-5,4′,α-trimethoxy- bibenzyl304.34 DHP19chrisotoxene 314.34 DHP20dendrophenol274.31 DHP213,4′-二羟基-5,4′-二甲氧基联苄244.28 DHP223,4-二羟基-5,4′-二甲氧基联苄274.31 DHP23铁皮石斛素T498.53 DHP244,7-dihydroxy-2,3,6-dimethoxy-9,10-dihydrophenanthrene302.33 DHP25chrysotobibenzyl332.40 DHP26铁皮石斛素A304.34 DHP27石斛酚304.34 DHP28(7S,8S,8R)-4,4-dihydroxy-3,3,5,5-tetramethoxy-7,9-epoxylignan-9-ol-7-one434.44 DHP29黄芩苷446.40 DHP30橙皮苷302.28 DHP31石斛酮碱279.38 DHP32石斛碱263.38 DHP33棒节碱C281.35 DHP34反式石斛黄碱257.33 DHP35铁皮石斛素D304.34 DHP36铁皮石斛素B290.32 DHP37淫羊藿苷676.70 DHP38芦丁610.50
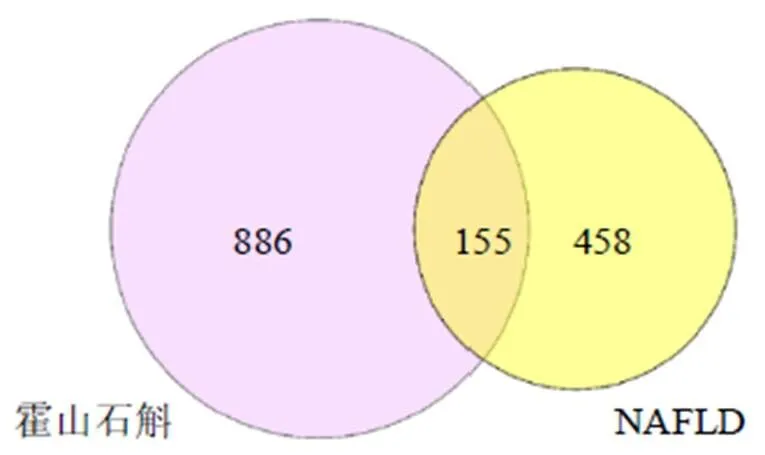
图1 药物-疾病共同靶点Venn图
3.3 PPI网络构建
将“3.2”项下的共同靶点导入STRING数据库得到PPI网路,共涉及155个节点和2213条边。采用Cytoscape软件构建PPI网络,度值越大,节点越大。运用CytoNCA插件和“Network Analyzer”的功能进行拓扑分析,计算度中心性(degree centrality,DC)、中介中心性(betweenness centrality,BC)、紧密中心性(closeness centrality,CC)的平均值,分别是28.55、148.41和0.52,DC和BC大于2倍均值的靶点共有19个,见图2和表2。
3.4 “药物-靶点-疾病”网络的构建
Cytoscape构建的“药物-靶点-疾病”网路,药物、活性成分和疾病均以节点表示,相互关系以边表示,见图3。
3.5 GO生物功能和KEGG通路富集分析
利用DAVID在线网站对交集靶点进行生物富集分析,得到具有统计学意义(<0.05)的GO功能富集条目1708条,其中生物过程(biological process,BP)1444条、分子功能(molecularfunction,MF)163条、细胞组分(cellular component,CC)101条,排名前10的条目见图4-A。
KEGG通路富集结果显示,155个交集靶点共涉及到1191条通路,利用值排序绘制排名前20的KEGG通路气泡图,见图4-B。富集结果显示霍山石斛活性成分对NAFLD的防治主要分布在癌症通路、PI3K/Akt通路、糖尿病并发症晚期糖基化终产物及其受体(advanced glycation end products-receptor for advanced glycation end products,AGE-RAGE)信号通路、缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号通路、胰岛素信号通路和TNF信号通路等,这些通路与脂质合成、胰岛素抵抗及炎症反应等存在密切关系。

图2 霍山石斛活性成分抗NAFLD作用的PPI网络(A) 和核心靶点(B)
表2 PPI网络拓扑分析关键靶点
Table 2 Key targets of PPI network topology analysis
序号基因DCBCCC序号基因DCBCCC 1INS10318390.7511STAT3763480.65 2AKT110114460.7412CASP3764540.66 3ALB9615240.7313HSP90AA1757380.65 4TNF969350.7214HIF1A723440.64 5IL69511890.7215ESR1717310.64 6VEGFA896750.7016MTOR672670.63 7PPARG8515260.6917MMP9662930.62 8IL1β814940.6718PTGS2653950.63 9MAPK3796130.7019CAT594540.61 10EGFR786770.67
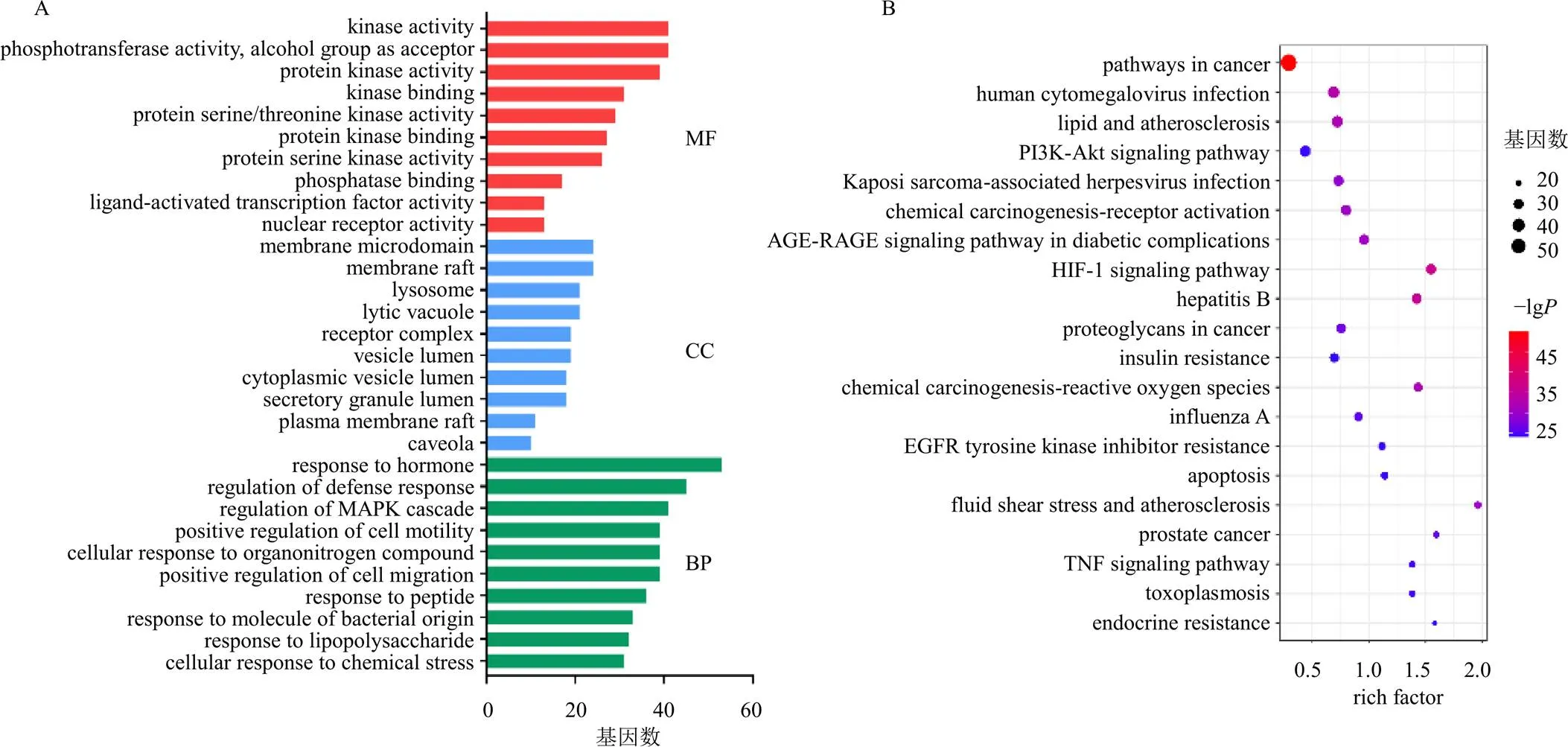
图4 GO功能(A) 和KEGG通路(B) 富集分析
3.6 “活性成分-靶点-疾病-通路”网络构建
利用Cytoscape软件,构建“活性成分-靶点-疾病-通路”网络,见图5。其中红色三角形节点为疾病名称,深绿色三角形形节点为霍山石斛;蓝色正方形节点为霍山石斛活性成分,紫色菱形节点为通路,黄色圆形节点为“活性成分-疾病-通路”共同靶点。度值越大,节点越大,表明节点在网络中更重要。

图5 霍山石斛治疗NAFLD的“活性成分-靶点-疾病-通路”网络
3.7 分子对接
运用分子对接对5个核心靶点(INS、AKT1、ALB、TNF-α、IL-6)和“活性成分-靶点-疾病-通路”网络中度值排名前5的有效活性成分(石斛酚、铁皮石斛素A、4,4′-dihydroxy-3,5-dimethoxydihydrostilbene、柚皮素、3,4-二羟基-5,4′-二甲氧基联苄)进行分析,结果见表3。霍山石斛5个活性成分和5个核心靶点的结合能均小于−5 kJ/mol,表明霍山石斛活性与核心靶点具有良好的结合能力,从而发挥抗NAFLD作用,利用PyMOL对部分对接结果进行可视化,见图6。
表3 分子对接
Table 3 Molecular docking
活性成分结合能/(kJ·mol−1) INSAKT1ALBTNFIL-6 石斛酚−18.13−19.33−18.42−22.02−22.89 铁皮石斛素A−19.72−18.75−22.36−20.25−16.83 4,4′-dihydroxy-3,5-dimethoxydihydrostilbene−21.88−16.78−21.88−18.99−21.01 柚皮素−28.95−24.24−28.71−29.43−28.28 3,4-二羟基-5,4′-二甲氧基联苄−24.77−19.72−20.05−23.28−19.91
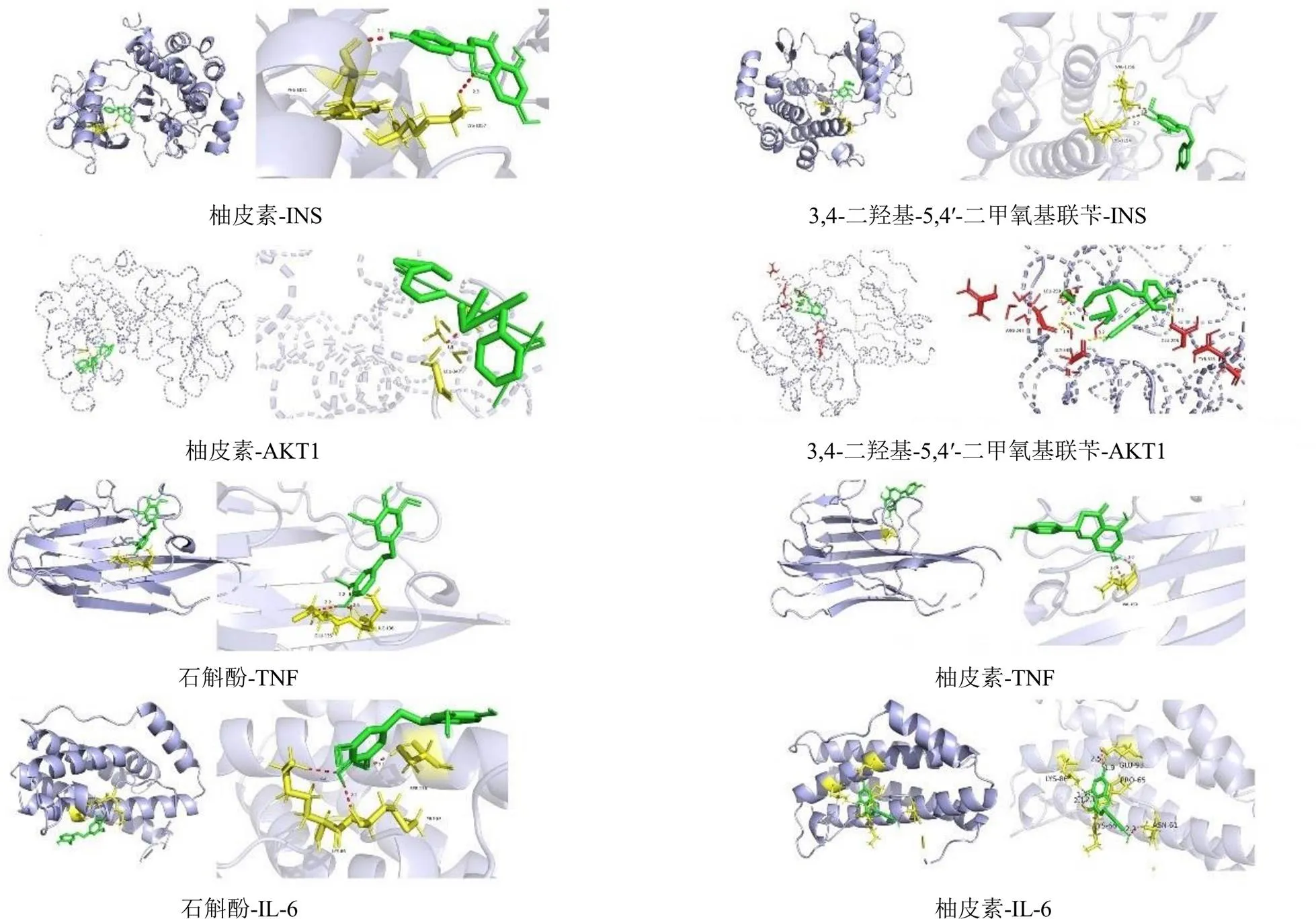
图6 霍山石斛活性成分与核心靶点的分子对接
3.8 体内实验验证
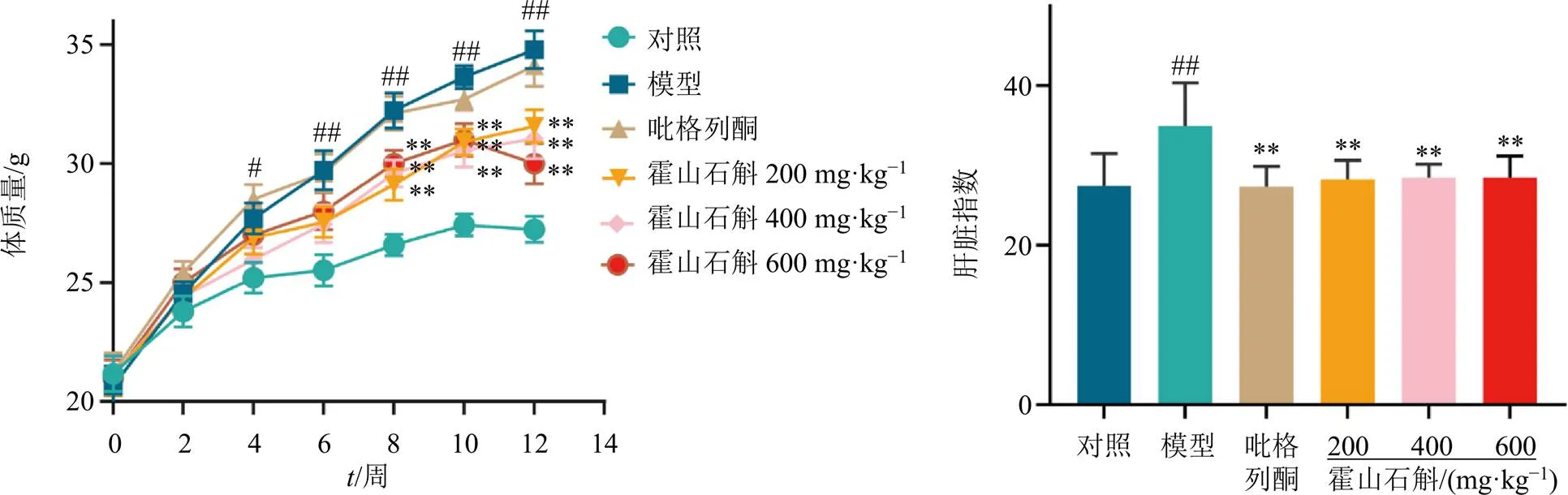
3.8.1 霍山石斛对NAFLD模型小鼠体质量和肝脏指数的影响 如图7所示,与对照组比较,模型组小鼠体质量和肝脏指数显著升高(<0.05、0.01);与模型组比较,霍山石斛各剂量组小鼠体质量均显著降低(<0.01),各给药组小鼠肝脏指数均显著降低(<0.01),表明霍山石斛抑制了高脂高糖饮食诱导的小鼠体质量和肝脏指数的增加。
3.8.2 霍山石斛对NAFLD模型小鼠血清TC、TG、ALT、AST、HDL-C、LDL-C及肝脏中TC、TG水平的影响 如图8所示,与对照组比较,模型组小鼠血清TG、TC、ALT、AST、LDL-C和肝脏TC、TG水平显著升高(<0.01),血清HDL-C显著降低(<0.01);与模型组比较,各给药组血清TG、TC、ALT、AST、LDL-C和肝脏TC、TG水平显著降低(<0.05、0.01),血清HDL-C水平显著升高(<0.01)。
与对照组相比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同

图8 霍山石斛对NAFLD小鼠血清TC、TG、ALT、AST、HDL-C、LDL-C及肝脏中TC、TG水平的影响(, n = 6)
3.8.3 霍山石斛对NAFLD小鼠肝脏脂肪堆积和肝组织病理变化的影响 对肝组织进行HE和油红O染色分析,如图9所示,对照组肝细胞形态正常,肝小叶结构清晰,无脂肪变性和炎细胞浸润;与对照组比较,模型组肝细胞形态紊乱,脂滴堆积和脂肪空泡变性严重,且伴有炎性细胞浸润。经霍山石斛干预后,与模型组比较,肝细胞形态结构明显改善,脂滴堆积和脂肪空泡显著降低,几乎不见炎细胞浸润。提示霍山石斛能有效抑制肝脏脂肪变性和堆积,改善高脂高糖所致的肝损伤。

图9 霍山石斛对NAFLD小鼠肝脏脂肪堆积和肝组织病理变化的影响(×200)
3.8.4 霍山石斛对NAFLD小鼠肝脏炎症水平的影响 如图10所示,与对照组比较,模型组小鼠肝脏IL-6、IL-1β、TNF-α水平显著升高(<0.01);与模型组比较,各给药组小鼠肝脏IL-6、TNF-α水平显著降低(<0.05、0.01),霍山石斛中、高剂量组和吡格列酮组肝脏IL-1β水平显著降低(<0.05、0.01),表明霍山石斛可以改善高脂高糖饮食诱导的肝脏炎症。
3.8.5 霍山石斛对NAFLD小鼠肝脏InsR/PI3K/ Akt/GSK-3β通路蛋白表达的影响 如图11所示,与对照组比较,模型组小鼠肝脏InsR、PI3K、p-Akt/Akt蛋白表达降低(<0.01),p-GSK-3β/GSK-3β蛋白表达显著升高(<0.01);与模型组比较,各给药组小鼠肝脏InsR、PI3K、p-Akt/Akt蛋白表达水平显著增加(<0.05、0.01),p-GSK-3β/GSK-3β蛋白表达显著减少(<0.01),表明霍山石斛可以调节InsR/PI3K/Akt/GSK-3β信号通路蛋白的表达,从而发挥抗NAFLD作用。
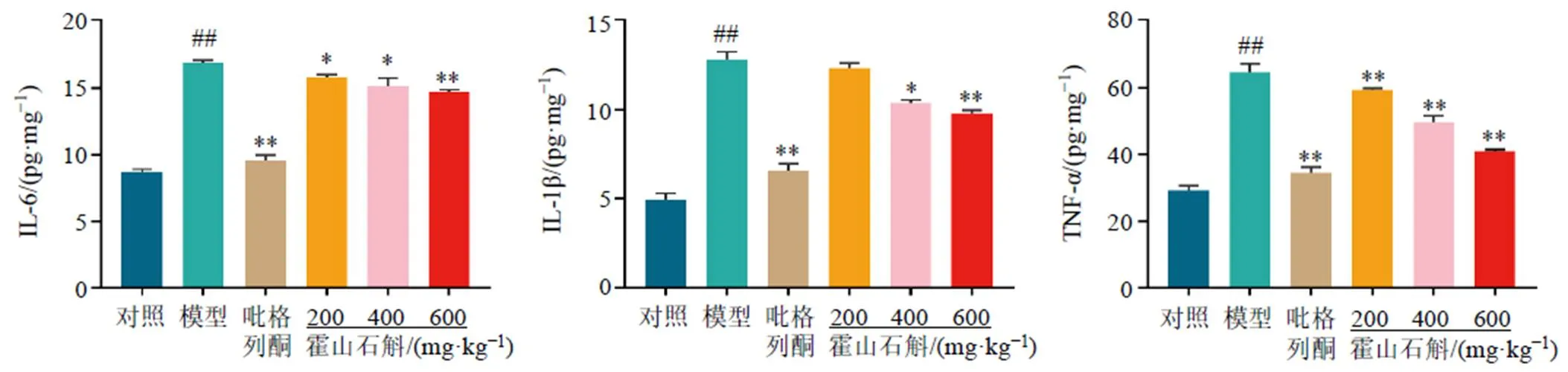
图10 霍山石斛对NAFLD小鼠肝脏IL-6、IL-1β、TNF-α含量的影响(, n = 6)
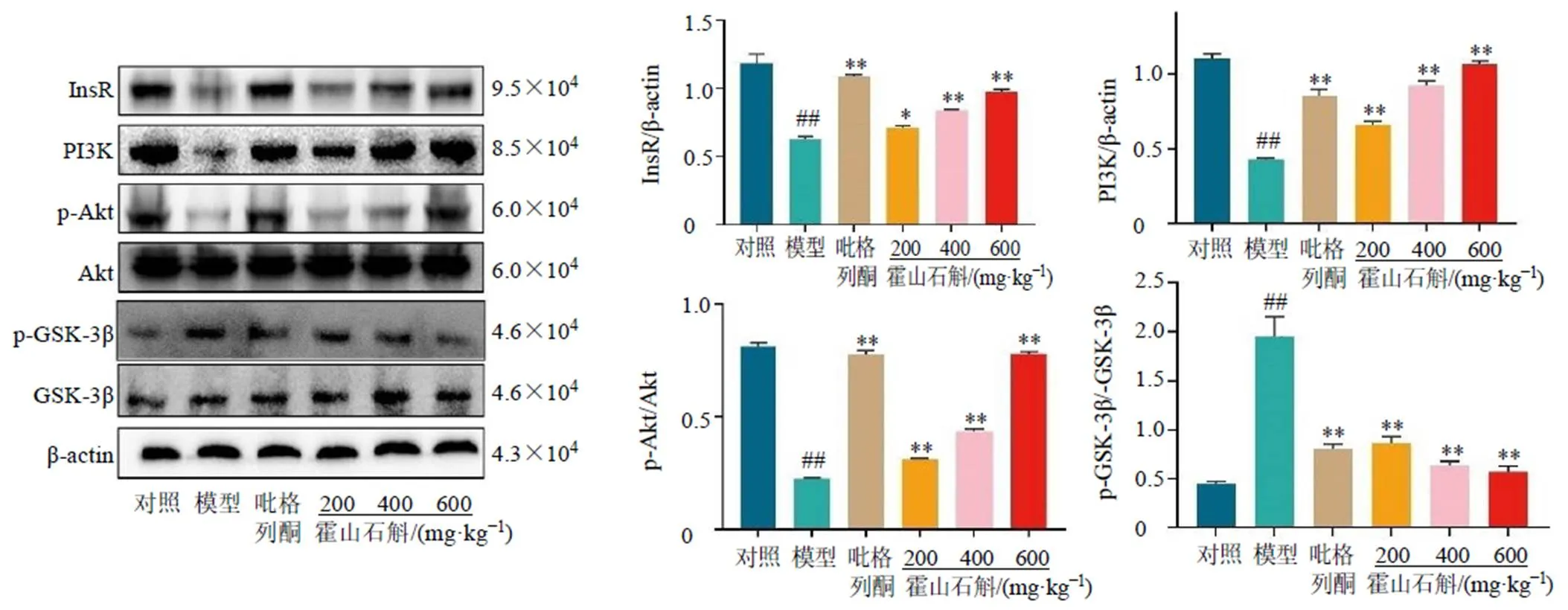
图11 霍山石斛对NAFLD小鼠肝脏中InsR/PI3K/Akt/GSK-3β通路蛋白表达的影响(, n = 3)
4 讨论
NAFLD是世界范围内最普遍的代谢性肝病,其复杂的发病机制限制了预防、诊断和治疗的进展。脂质蓄积、胰岛素抵抗、炎症、氧化应激和肠道菌群等均与NAFLD的发病机制息息相关,然而驱动疾病发展的机制尚不完全清楚[16-19]。中药在预防和治疗NAFLD中显示出独特的优势,金钗石斛可以通过增加肝脏中的牛磺结合胆汁酸水平,促进胆固醇的排泄,改善肝脏脂质异常发挥抗NAFLD作用[20]。铁皮石斛能够调节脂质代谢和糖代谢相关基因的表达,抑制NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)炎症小体的激活,调节线粒体功能、肠道菌群,抑制脂多糖/Toll样受体4(Toll-like receptor 4,TLR4)相关的炎症介质的激活,减轻小鼠肝脏损伤[21-24]。霍山石斛虽能有效改善四氯化碳所致肝损伤和酒精性肝损伤等肝脏疾病,然而对高脂高糖饮食诱导NAFLD的小鼠作用机制仍不清楚[25-26]。本研究基于网络药理学,通过霍山石斛抗NAFLD的核心作用靶点并结合霍山石斛的“活性成分-疾病-靶点-通路”网络、分子对接和体内实验验证,对霍山石斛防治NAFLD的潜在机制进行初步探究。
本研究采用网络药理学分析霍山石斛治疗NAFLD的潜在机制,发现霍山石斛共有石斛酚、铁皮石斛素A、4,4′-dihydroxy-3,5-dimethoxy-dihydrostilbene、柚皮素、3,4-dihydroxy-5,4′-dimethoxybibenzyl等38个活性成分,PPI网路分析后发现霍山石斛的关键靶点有胰岛素(insulin,INS)、AKT1、白蛋白(albumin,ALB)、TNF、IL-6、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARG)、IL-1β、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等,涉及1708条生物过程,1191条信号通路,其中与NAFLD密切相关的有PI3K/Akt信号通路、HIF-1信号通路、TNF-α信号通路,分子对接结果显示霍山石斛中5种活性成分与5个核心靶点均具有较好的结合能力,表明霍山石斛可能通过多靶点、多途径来改善NAFLD。
炎症是免疫系统对组织损伤或感染的生理反应,可导致细胞因子、趋化因子和类花生酸等炎症介质的释放,引导免疫系统修复受伤组织和抵抗外界病原体的入侵[27]。炎症活动会随着时间的持续导致慢性炎症变化,加重组织损伤,导致类风湿性关节炎、炎症性肠道疾病等疾病发生[28]。炎症在NAFLD中扮演着重要角色,是促使单纯性脂肪肝发展为脂肪性肝炎的重要驱动因素,损伤的肝细胞会促进促炎细胞因子的产生,进而导致NAFLD加重,甚至发展成NASH[29]。因此,抑制炎症对NAFLD的治疗具有重要意义。
本研究建立高脂高糖饮食诱导的NAFLD小鼠模型,探索霍山石斛对NAFLD的影响。结果表明,与对照组比较,模型组小鼠体质量、肝脏指数、血清及肝脏中TC、TG、ALT、AST、LDL-C含量显著升高,HDL-C水平显著下降,油红O和HE染色显示模型组小鼠肝脏中有大量脂质沉积和空泡样脂肪变性,说明高脂高糖饮食成功诱导NAFLD小鼠模型。霍山石斛治疗后能显著减少NAFLD小鼠体质量、肝脏指数、血清及肝脏中TC、TG、ALT、AST、LDL-C含量,提高HDL-C水平,同时减轻肝脏脂肪变性和脂质沉积。此外,霍山石斛能显著降低NAFLD小鼠肝脏中IL-6、IL-1β、TNF-α水平,表明霍山石斛可能通过调节肝脏炎症来改善NAFLD。以上结果表明霍山石斛能够有效减轻NAFLD小鼠的肝脏脂肪沉积、变性,对NAFLD有良好的防治作用。
通过KEGG富集分析,预测霍山石斛防治NAFLD的可能作用通路并结合文献报道,PI3K/Akt通路在防治NAFLD中发挥着重要作用。PI3K/Akt信号通路参与多种细胞功能的调节,如代谢、葡萄糖转运、增殖、细胞存活、生长和血管生成等[30],并且与胰岛素抵抗密切相关,胰岛素及其信号通路直接参与肝脏糖代谢的调节,包括加速肝糖原合成和葡萄糖摄取,抑制肝脏糖异生。PI3K及其下游因子Akt在胰岛素信号通路中发挥了关键作用[31]。胰岛素可以与细胞表面的受体InsR结合,激活胰岛素受体底物(insulin receptor substrate,IRS)磷酸化,随后PI3K被激活,一旦PI3K被激活并被吸收到细胞膜上,磷脂酰肌醇4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)在肌醇环的D3位点发生磷酸化,生成磷脂酰肌醇3,4,5-二磷酸(phosphatidylinositol-3,4,5-triphosphate,PIP3)。PIP3又与Akt的Pleckstrin同源性结构域结合,并转位到3-磷酸肌醇依赖性蛋白激酶1的PH结构域,激活丝氨酸-苏氨酸激酶Akt磷酸化[28]。PIP3依赖的Akt磷酸化激活启动了包括GSK-3β/人糖原合成酶2(glycogen synthase 2,GYS2)和叉头框蛋白O1(forkhead box protein O1,FoxO1)/磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)/葡萄糖-6-磷酸酶(glucose-6-phosphatase G-6-pase,G6Pase)在内的一系列信号级联,从而增强GYS2活性,降低PEPCK和G6Pase活性,最终促进肝糖原合成,抑制肝脏糖异生[32]。因此,PI3K/Akt通路在霍山石斛调节肝脏糖代谢中的作用不容忽视。为了研究霍山石斛对NAFLD的可能作用机制,对PI3K/Akt通路蛋白的表达进行研究。结果表明,霍山石斛能显著提高NAFLD小鼠肝脏InsR、PI3K、p-Akt/Akt表达,显著降低p-Gsk-3β/GSK-3β水平,表明霍山石斛可能通过激活InsR/PI3K/Akt/GSK-3β途径调节糖原合成和胰岛素抵抗,发挥对NAFLD的保护作用。
综上,本研究对霍山石斛治疗NAFLD的机制进行了初步研究,通过网络药理学和体内实验验证了霍山石斛可能通过PI3K/Akt信号通路和减少促炎症因子的表达,从而调节肝脏胰岛素抵抗和抑制炎症介质的释放,发挥防治NAFLD的作用。本研究结果为霍山石斛治疗NAFLD提供理论支持,为霍山石斛治疗NAFLD提供一定理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Abood S, Veisaga M L, López L A,. Dehydroleucodine inhibits mitotic clonal expansion during adipogenesis through cell cycle arrest [J]., 2018, 32(8): 1583-1592.
[2] Tarantino G, Citro V, Capone D. Nonalcoholic fatty liver disease: A challenge from mechanisms to therapy [J]., 2019, 9(1): 15.
[3] Zhi H J, Jin X, Zhu H Y,. Exploring the effective materials of flavonoids-enriched extract fromroots based on the metabolic activation in influenza A virus induced acute lung injury [J]., 2020, 177: 112876.
[4] 邓光辉, 俞年军, 王妍妍, 等. 霍山石斛活性成分对肝脏疾病作用及其机制研究进展[J]. 中草药, 2022, 53(21): 6959-6967.
[5] Zha X Q, Deng Y Y, Li X L,. The core structure of apolysaccharide required for the inhibition of human lens epithelial cell apoptosis [J]., 2017, 155: 252-260.
[6] Wang H Y, Li Q M, Yu N J,.polysaccharide regulates hepatic glucose homeostasis and pancreatic β-cell function in type 2 diabetic mice [J]., 2019, 211: 39-48.
[7] Yuan Z Z, Pan Y Y, Leng T,. Progress and prospects of research ideas and methods in the network pharmacology of traditional Chinese medicine [J]., 2022, 25: 218-226.
[8] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[9] 甘江华, 黄玙璠, 彭代银, 等. 3种石斛对脾阴虚型大鼠便秘的治疗作用及其机制初步研究 [J]. 中国中药杂志, 2019, 44(12): 2600-2606.
[10] Daina A, Michielin O, Zoete V. SwissADME: A free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules [J]., 2017, 7: 42717.
[11] Lei S S, Zhang N Y, Zhou F C,.regulates fatty acid metabolism to ameliorate liver lipid accumulation in NAFLD mice [J]., 2021, 2021: 1-12.
[12] Shannon P, Markiel A, Ozier O,. Cytoscape: A software environment for integrated models of biomolecular interaction networks [J]., 2003, 13(11): 2498-2504.
[13] Gaillard T. Evaluation of AutoDock and AutoDock vina on the CASF-2013 benchmark [J]., 2018, 58(8): 1697-1706.
[14] Cho J, Johnson B D, Watt K D,. Exercise training attenuates pulmonary inflammation in high-fat high-carbohydrate induced NAFLD [J]., 2022, 54(9S): 652.
[15] Feng Y B, Li H, Chen C,. Study on the hepatoprotection ofcaulis polysaccharides in nonalcoholic fatty liver disease in rats based on metabolomics [J]., 2021, 12: 727636.
[16] Musso G, Cassader M, Paschetta E,. Bioactive lipid species and metabolic pathways in progression and resolution of nonalcoholic steatohepatitis [J]., 2018, 155(2): 282-302.
[17] Neumann K, Schiller B, Tiegs G. NLRP3 inflammasome and IL-33: Novel players in sterile liver inflammation [J]., 2018, 19(9): 2732.
[18] Watt M J, Miotto P M, De Nardo W,. The liver as an endocrine organ-linking NAFLD and insulin resistance [J]., 2019, 40(5): 1367-1393.
[19] Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD) [J]., 2019, 76(8): 1541-1558.
[20] Huang S, Wu Q, Liu H,. Alkaloids ofLindl. Altered hepatic lipid homeostasis via regulation of bile acids [J]., 2019, 241: 111976.
[21] Lei S S, Li B, Chen Y H,., a traditional Chinese edible and officinal plant, accelerates liver recovery by regulating the gut-liver axis in NAFLD mice [J]., 2019, 61: 103458.
[22] Yin X Z, Chi W M, Zhang L,. Protective effects ofWall ex Lindl. on high-fat diet-induced liver damage in mice [J]., 2021, 45(4): e13687.
[23] Ji L S, Li Q, He Y,. Therapeutic potential of traditional Chinese medicine for the treatment of NAFLD: A promising drugBunge [J]., 2022, 12(9): 3529-3547.
[24] 王凤华, 韩吉春, 李德芳, 等. 霍山石斛水提取物通过介导NF-κB/p65和p38 MAPK减轻小鼠酒精性肝损伤 [J]. 天然产物研究与开发, 2017, 29(4): 569-574.
[25] Pan L H, Lu J, Luo J P,. Preventive effect of a galactoglucomannan (GGM) fromon selenium-induced liver injury and fibrosis in rats [J]., 2012, 64(7/8): 899-904.
[26] Coussens L M, Werb Z. Inflammation and cancer [J]., 2002, 420(6917): 860-867.
[27] Fullerton J N, Gilroy D W. Resolution of inflammation: A new therapeutic frontier [J]., 2016, 15(8): 551-567.
[28] Marra F, Gastaldelli A, Svegliati Baroni G,. Molecular basis and mechanisms of progression of non-alcoholic steatohepatitis [J]., 2008, 14(2): 72-81.
[29] 刘宏民, 吴洁洁, 陈欢, 等. 基于InsR/PI3K/Akt通路研究岩黄连总碱纠正高脂喂养小鼠糖代谢紊乱的作用机制[J]. 中草药, 2022, 53(12): 3687-3693.
[30] Hatting M, Tavares C D J, Sharabi K,. Insulin regulation of gluconeogenesis [J]., 2018, 1411(1): 21-35.
[31] Miao B C, Skidan I, Yang J S,. Small molecule inhibition of phosphatidylinositol-3,4,5-triphosphate (PIP3) binding to pleckstrin homology domains [J]., 2010, 107(46): 20126-20131.
[32] Liu T Y, Shi C X, Gao R,. Irisin inhibits hepatic gluconeogenesis and increases glycogen synthesis via the PI3K/Akt pathway in type 2 diabetic mice and hepatocytes [J]., 2015, 129(10): 839-850.
Mechanisms ofagainst non-alcoholic fatty liver disease by network pharmacology combined with molecular docking and experimental validation
DENG Guang-hui1, 2, YE Meng-juan1, 2, CAI Xiao1, 2, MA Meng-zhen1, 2, LYU Jia-hui1, 2, WU Jing1, 2, ZHANG Xiao-qian1, 2, XING Li-hua1, 2, PENG Dai-yin1, 2, 3, 4, WANG Yan-yan1, 2, YU Nian-jun1, 2, 3, 4
1. Anhui University of Chinese Medicine, Hefei 230012, China 2. Anhui Academy of Traditional Chinese Medicine & Institute of Conservation and Development of Traditional Chinese Medicine Resources, Hefei 230012, China 3. MOE-Anhui Joint Collaborative Innovation Center for Anhui Genuine Chinese Medicinal Materials, Hefei 230012, China 4. Key Laboratory of Traditional Chinese Medicine Research and Development of Anhui Province, Hefei 230012, China
To explore the therapeutic effect and mechanism ofon non-alcoholic fatty liver disease (NAFLD) based on network pharmacology, molecular docking andexperimental verification.The active components ofwere searched by literature, the potential targets were predicted by SwissTargetPrediction database, the targets of NAFLD were screened by DisGeNET and GeneCards databases, drug targets and disease targets were intersected to construct protein-protein interaction network. Gene ontology function and Kyoto encyclopedia of genes and genomes pathway enrichment analysis were carried out by DAVID database, and “active ingredient-target-disease-pathway” network was constructed, molecular docking verification of key active ingredients and core targets was carried out by AutoDock and other software. NAFLD mouse model was induced by high-fat and high-sugar diet, control group, model group, pioglitazone group (10 mg/kg) andlow-, medium-and high-dose (200, 400, 600 mg/kg) groups were set up, drugs were continuously given for eight weeks. Levels of triglyceride (TG), total cholesterol (TC), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol (HDL-C), alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum were detected; The levels of TC, TG, interleukin-6 (IL-6), IL-1β and tumor necrosis factor-α (TNF-α) in liver were detected by ELISA. The pathological changes of liver tissue were detected by oil red O staining and hematoxylin-eosin (HE) staining. Western blotting was used to detect the expressions of insulin receptor (InsR)/phosphatidylinositol-3-kinase (PI3K)/protein kinase B (Akt)/glycogen synthase kinase-3β (GSK-3β) pathway related proteins in liver tissue.A total of 38 active components were screened from, including moscatilin, dendrobixin A, 4,4′-dihydroxy-3,5-dimethohydroxystilbene, naringin, and 155 common targets with NAFLD, acting on 19 core targets such as insulin, protein kinase B1 (AKT1), albumin, tumor necrosis factor (TNF), interleukin-6 (IL-6), vascular endothelial growth factor A, peroxisome proliferator-activated receptor γ, IL-1β, mainly involving cancer pathway, PI3K/Akt pathway, advanced glycation end products-receptor for advanced glycation end products signaling pathway, hypoxia inducible factor signaling pathway and TNF signaling pathway. Molecular docking showed that the top five core components have good binding ability with the top five core targets. The animal experiment results confirmed that the mouse NAFLD model was successfully established. Compared with model group, body weight, liver index, levels of TG, TC, ALT, AST, LDL-C in serum and TC, TG in liver ofgroup were significantly decreased (< 0.05, 0.01), and HDL-C level in serum was significantly increased (< 0.01), improved the accumulation and degeneration of liver fat. And expression levels of InsR, PI3K and p-Akt/Akt proteins in liver were significantly increased (< 0.05, 0.01), while the expression of p-GSK-3β/GSK-3β protein was significantly decreased (< 0.01).has protective effect on NAFLD, and its mechanism may be related to activating PI3K/Akt pathway, improving insulin resistance and reducing inflammatory reaction.
C. Z. Tang et S. J. Cheng; non-alcoholic fatty liver disease; network pharmacology; rutin; moscatilin; naringenin; InsR/PI3K/Akt/GSK-3β pathway;insulin resistance; inflammation
R285.5
A
0253 - 2670(2023)16 - 5244 - 13
10.7501/j.issn.0253-2670.2023.16.013
2023-04-27
国家自然科学基金联合基金项目(U19A2009);省部共建安徽道地中药材品质提升协同创新中心项目(教科信厅函[2022]4号);安徽省教育厅项目(皖教秘科[2014]44号)
邓光辉(1997—),男,硕士研究生,研究方向为中药资源与中药质量。Tel: 17856419316 E-mail: 3111630539@qq.com
王妍妍,教授,研究方向为中药药理。Tel: (0551)68129180 E-mail: wangyanyan@ahtcm.edu.cn
俞年军,教授,研究方向为中药质量评价。Tel: (0551)68129173 E-mail: ynj2005288@sina.com
[责任编辑 李亚楠]

