基于网络药理学与动物实验探究桂花醇提物对慢性脑缺血神经损伤的保护作用及机制
程 芳,张 杰,胡加成,徐 欢,先劲燃,谢兴亮,盛艳梅
• 药理与临床 •
基于网络药理学与动物实验探究桂花醇提物对慢性脑缺血神经损伤的保护作用及机制
程 芳,张 杰,胡加成,徐 欢,先劲燃,谢兴亮*,盛艳梅*
成都医学院药学院,四川 成都 610500
基于磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路探究桂花醇提物抗慢性脑缺血性神经损伤的保护作用与机制。借助文献检索、TCMSP、BATMAN数据库筛选桂花活性成分及靶点;OMIM、GeneCards疾病数据库检索疾病靶点。取交集靶点构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络。借助DAVID数据库进行基因本体(gene ontology,GO)功能和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,并建立“成分-靶点-通路”网络。采用右侧颈总动脉结扎法建立慢性脑缺血小鼠模型,随机分为假手术组、模型组、脑络通(195 mg/kg)组和桂花醇提物低、高剂量(125、375 mg/kg)组。采用旷场实验评价各组小鼠自发能力及探索行为;检测各组小鼠海马组织胆碱乙酰化酶(choline acetylase,ChAC)和胆碱酯酶(cholinesterase,ChE)水平;采用苏木素-伊红(HE)和TUNEL染色观察脑组织病理结构变化及神经元凋亡情况;采用Western blotting检测海马组织PI3K/Akt信号通路及凋亡相关蛋白表达。网络药理学筛选得到12种桂花活性成分及潜在靶点289个,慢性脑缺血疾病靶点3014个,桂花与慢性脑缺血的交集靶点198个,其中AKT1、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)等为核心靶点。通过KEGG和GO分析进一步发现,PI3K/Akt信号转导通路可能是桂花发挥慢性脑缺血神经保护的重要途径。采用右侧颈总动脉结扎法复制慢性脑缺血小鼠模型,结果显示,桂花醇提物可显著升高脑组织ChAC水平(<0.001),降低ChE水平(<0.001),增强中枢胆碱系统功能;明显提高脑缺血小鼠站立次数及中央区域运动距离(<0.001),以改善认知等神经功能障碍,并抑制缺血区脑组织的神经元凋亡(<0.001)。其作用机制与调控PI3K/Akt信号通路,上调p-PI3K、p-Akt、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达(<0.05、0.01),同时下调促凋亡细胞色素C(cytoehrome C,Cyt-C)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、cleaved Caspase-3蛋白表达相关(<0.01)。桂花醇提物可有效抑制脑缺血性神经细胞损伤,改善神经功能障碍,其脑神经保护作用与调控PI3K/Akt通路、抑制细胞凋亡有关。
桂花醇提物;慢性脑缺血;网络药理学;毛蕊花糖苷;红景天苷;细胞凋亡;PI3K/Akt通路
慢性脑缺血是大脑灌注不足所引起的脑功能障碍疾病[1]。近年来,慢性脑缺血的患病率逐年攀升,其引发进展性的认知、学习、记忆能力下降使患者及家属的生命质量都受到巨大冲击[2]。然而,目前临床治疗慢性脑缺血尚缺乏理想药物。慢性脑缺血起病慢、防治时间长,及早识别和干预可以有效地阻止疾病的发展,提高患者生活质量。研究表明,慢性脑缺血的病理机制十分复杂,包括神经细胞凋亡、氧化应激、炎性损伤等[3]。长期脑组织血流量低灌注引发神经元死亡,细胞凋亡便是其中主要的死亡形式,而脑白质和海马CA1区的神经元凋亡又将引起认知、学习记忆功能障碍[4]。因此抑制或减少脑缺血后的神经元凋亡,对恢复缺血后神经功能至关重要。
桂花属药食同源类中药[5],目前对其资源开发主要集中在浸膏、精油和食材应用方面,而对于其药用价值还缺乏深入探讨[6]。传统医学研究发现,桂花性温,味辛、无毒,富含多种芳香成分,具芳香开窍药的特性[7]。芳香开窍药易通过血脑屏障、改善脑微循环、减轻脑水肿等途径抵抗脑缺血损伤,已成为治疗中枢神经系统疾病的常用药物[5,8]。已有研究报道桂花醇提物可有效改善半乳糖引起的小鼠记忆力减退现象,并抑制小鼠大脑中神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经营养因子-3(neurotrophin-3,NT-3)的产生,从而发挥神经损伤的保护作用[9]。Lee等[10]研究表明桂花醇提物可通过抗氧化作用保护大鼠皮层神经元免受6-羟多巴胺(6-hydroxydopamine,6-OHDA)和谷氨酸诱导的神经元损伤。此外,桂花醇提物中的苯乙醇苷也能有效抵抗氯化钴诱导的PC12神经细胞缺氧损伤[11]。目前关于桂花抗缺血损伤的机制尚未阐明,其药用价值的开发与应用受限。基于以上研究推测桂花醇提物或能成为改善慢性脑缺血神经损伤的潜力药物。网络药理学是一门从多层次、多角度分析药物与疾病关系,预测活性药物靶点、作用机制等问题的新兴学科[12]。本研究拟借助网络药理学方法探究桂花治疗慢性脑缺血的活性成分及作用靶点,并结合动物实验评价桂花醇提物对慢性脑缺血小鼠神经损伤的主要保护机制,为后期桂花相关产品的研发提供理论依据。
1 材料
1.1 数据库
TCMSP2.3数据库(http://tcmspw.com/tcmsp. php)、SwissTargetPrediction数据库(http:// swisstargetprediction.ch/)、BATMAN数据库(http://bionet.ncpsb.org.cn/batman-tcm/index.php)、OMIM数据库(https://www.omim.org)、GeneCards数据库(https://www.genecards.org)、VENNY2.1数据库(https://bioinfogp.cnb.csic.es/tools/venny)、STRING数据库(https://string-db.org)、DAVID数据库(https://david.ncifcrf.gov)。
1.2 动物
SPF级雄性KM小鼠60只,体质量18~25 g,购自成都达硕实验动物有限公司,许可证号SCXK(川)2020-030,饲养于成都医学院动物实验中心,适应性饲养7 d后进行实验。动物实验遵守成都医学院动物伦理委员会的伦理要求(批准号:成医动伦[2022]第015号)。
1.3 药品与试剂
桂花购自广西桂林,经成都医学院中药学教研室游元元教授鉴定为木犀科木犀属植物木犀(Thunb.) Lour.的花;脑络通胶囊(批号20210601)购自广东云方制药有限公司;RIPA裂解液(批号P0013B)、PMSF(100 mmol/L,批号ST506)、磷酸酶抑制剂(批号P1082)、一抗稀释液(批号P0023A)、二抗稀释液(批号P0023D)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)抗体(批号AF1150)购自上海碧云天生物科技有限公司;胆碱酯酶(cholinesterase,ChE)试剂盒(批号20211221)、胆碱乙酰化酶(choline acetylase,ChAC)试剂盒(批号2021220)购自上海酶联生物科技有限公司;TUNEL细胞凋亡检测试剂盒(批号C1088)购自上海碧云天生物科技有限公司;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体(批号20584-1-AP)、p-PI3K抗体(批号10176-2-AP)、蛋白激酶B(protein kinase B,Akt)抗体(批号60203-2-Ig)、p-Akt抗体(批号66444-1-lg)、细胞色素C(cytochrome-C,Cyt-C)抗体(批号10993-1-AP)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号26593-1-AP)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号60267-1-lg)、β-actin抗体(批号66009-1-Ig)购自武汉三鹰生物技术有限公司;HRP标记的山羊抗兔二抗(批号BA1054)、山羊抗鼠二抗(批号BA1050)购自武汉博士德生物工程有限公司;水合氯醛(批号190420)购自成都市科龙化工试剂厂;注射用青霉素钾(批号20190102)购自江西省科达动物药业有限公司。
1.4 仪器
OFT-100型大小鼠旷场活动实验系统(成都泰盟软件有限公司);Varioskan Flash酶标仪(美国Thermo Fisher Scientific公司);JW-2018H型离心机(安徽嘉文仪器装备有限公司);16030929型高通量快速匀浆器(美国MP Biomedicals公司);电泳仪、成像系统仪(美国Bio-Rad公司)。
2 方法
2.1 网络药理学分析
2.1.1 获取桂花活性成分及潜在靶点 通过TCMSP2.3数据库,选择以“Herb name”和“桂花”为检索词,将桂花活性成分筛选条件设为口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18,并将候选生物活性化合物2D结构的SDF文档导入SwissTargetPrediction数据库,以确定桂花活性成分的靶点。再利用BATMAN数据库,选择“Herb or Herb list”以“GUI HUA”为关键词,筛选条件设置为Score cutoff≥20、<0.05,筛得桂花的活性成分及作用靶点。通过文献检索补充已报道且有药理作用的桂花活性成分,进入化源网搜索得到其英文名,再进入PubChem输入其英文名得到相关SMILES号。打开SwissTargetPrediction数据库,将PubChem得到的SMILES号输入,点击预测即可得到化合物相关靶点。将上述数据库结果汇总、去重,建立桂花活性成分-靶点数据集。
2.1.2 获取慢性脑缺血疾病靶点 以“chronic cerebral ischemia”为关键词,检索疾病数据库(OMIM、GeneCards)中的疾病靶点,将2个数据库结果合并、去重,所得结果即为慢性脑缺血疾病靶点数据集。
2.1.3 获取桂花与慢性脑缺血交集靶点并构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络 将桂花和慢性脑缺血的潜在靶点导入VENNY2.1以获取交集靶点。将得到的交集靶点导入STRING数据库,选择交互作用阈值>0.4,构建PPI网络图。获得TSV格式文件,并将其导入Cytoscape软件进行网络拓朴分析。
2.1.4 桂花与慢性脑缺血交集靶点的基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 在线打开DAVID数据库,将核心靶点导入到数据库中,选择官方基因名称,物种限定为“Homo sapiens”,分析背景选择为“Homo sapiens”,分别进行GO富集分析和KEGG通路分析并整理所得数据。获得显著富集且与慢性脑缺血相关的通路及生物学过程,<0.05表示具有统计学意义,按基因数进行排序,筛选出具有显著差异的生物过程和可靠的靶点通路,在线打开微生信绘图网站绘制柱状图和气泡图,并将所得的通路构建“成分-靶点-通路”网络。
2.2 桂花醇提物对慢性脑缺血小鼠的保护作用及机制研究
2.2.1 桂花醇提物的制备 桂花醇提物由成都医学院国家中医药管理局中药药剂学二级实验室制备提供。称取200 g桂花,加入95%乙醇2400 mL,回流提取3 h,200目滤布滤过,提取液50 ℃减压浓缩至相对密度为1.05(50 ℃)的清膏,冷冻干燥得桂花乙醇提取物64.1 g(即1 g提取物相当于3.12 g桂花生药),采用高效液相色谱法测得其中毛蕊花糖苷、红景天苷质量分数分别为30.03%、5.21%。
2.2.2 慢性脑缺血模型复制、分组及给药 采用右侧颈总动脉结扎法制作慢性脑缺血小鼠模型[13],模型复制成功评判标准[14]:①结扎后小鼠右眼变为浅白色,自然苏醒后,右眼半闭且颜色转变成微红;②激光散斑血流检测小鼠右侧脑血流较左侧下降20%~30%,将造模符合标准的小鼠纳入研究。小鼠随机分为假手术组、模型组、脑络通(195 mg/kg)组和桂花醇提物低、高剂量(125、375 mg/kg)组,每组10只。脑络通胶囊成人给药剂量为1.5~3 g/d,取1.5 g/d;桂花取人用生药量3、9 g[15],成人体质量以70 kg计,依据人与小鼠体表面积换算系数得到小鼠桂花低、高剂量组生药量分别390、1170 mg/kg。并根据提取物得率(即1 g桂花相当于0.32 g提取物)换算得到小鼠的给药剂量分别为125、375 mg/kg。各给药组连续30 d ig相应药物(10 mL/kg),假手术组和模型组ig等体积的生理盐水。
2.2.3 神经行为评价 给药结束后,采用大小鼠旷场活动实验系统评估各组小鼠自发行为及探索行为。旷场箱底部由40 cm×40 cm的光滑黑板构成,侧壁由高40 cm的光滑黑板构成,配有动物行为学数据自动采集和处理系统。数码摄像头置于旷场箱正上方1 m处,用于记录小鼠整个旷场箱视野内的运动影像。旷场实验参考文献方法[16],将底部20 cm×20 cm的正方形区域划分为中央区,小鼠放入中央区的格子,打开摄像头开始计时。每只小鼠实验时间5 min,第1分钟为适应时间,不进行计数,第2分钟开始计录小鼠在4 min内的站立次数及中央区域运动距离,连续测试3 d。
2.2.4 苏木素-伊红(HE)染色观察脑组织病理变化 旷场实验结束后,小鼠ip 10%水合氯醛麻醉后断头后取脑,置4%多聚甲醛浸泡1周固定,常规脱水、透明、浸蜡、包埋、切片、HE染色,光学显微镜下观察脑组织海马区细胞结构变化并拍摄图片。
2.2.5 TUNEL染色观察脑组织神经细胞凋亡情况 脑组织经固定、包埋、切片后,按照TUNEL细胞凋亡检测试剂盒说明书进行操作,在200倍光镜下,观察大脑皮层神经细胞凋亡情况,统计正常及凋亡神经细胞数量,计算细胞凋亡率。
细胞凋亡率=细胞凋亡数/(细胞凋亡数+正常细胞数)
2.2.6 小鼠海马组织ChAC和ChE含量检测 小鼠处死后,迅速取脑,冰上剥离海马组织,加入预冷的生理盐水,冰浴条件下匀浆处理,3000 r/min离心10 min,取上清按照试剂盒说明书进行检测。
2.2.7 Western blotting检测海马组织PI3K/Akt信号通路及凋亡相关蛋白表达 取各组小鼠海马组织,加入RIPA裂解液(RIPA∶PMSF∶磷酸酶抑制剂100∶1∶1),提取总蛋白,BCA法测定蛋白含量。蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭1.5 h,加入一抗,4 ℃过夜孵育;TBST洗膜后,加入二抗(1∶5000),37 ℃孵育1.5 h;TBST洗膜后,结合ECL化学发光法显影,凝胶成像系统采集图像,Image J软件进行分度值分析。
2.3 统计学分析

3 结果
3.1 网络药理学分析结果
3.1.1 桂花活性成分-慢性脑缺血潜在靶点及PPI网络构建 通过TCMSP、BATMAN数据库及文献检索共检索到桂花活性成分12种(表1),可能作用于289个潜在靶点。从OMIM、GeneCards数据库获得的3014个慢性脑缺血相关靶点,通过Venn图对桂花成分靶点与慢性脑缺血疾病靶点进行映射,得二者交集靶点198个(图1-A)。将交集靶点导入STRING数据库,选择交互作用阈值>0.4,去除游离节点,借助Cytoscape软件得到包含198个节点、2207条边的PPI网络(图1-B),再按度值大小筛选前20个靶点作为核心靶点,得到包含20个节点、323条边的核心靶点PPI网络图,其中核心靶点分别为AKT1、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、非受体酪氨酸激酶(sarcoma receptor coactivator,SRC)、半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,CASP1)、CASP3等(图1-C)。
表1 桂花活性成分
Table 1 Active ingredients of O. fragrans
编号成分OB/%DL GH1柚皮素42.360.21 GH21-羟基-2,3,5-三甲氧基呫吨酮101.060.30 GH36-羟基山柰酚62.130.27 GH4黄芩苷33.520.21 GH5芒柄花素69.670.21 GH6山柰酚41.880.24 GH7木犀草素36.160.25 GH8槲皮素46.430.28 GH9*毛蕊花糖苷2.940.62 GH10*红景天苷7.010.20 GH11*异类叶升麻苷1.520.66 GH12*松果菊苷3.140.38
*基于文献检索补充已报道的桂花活性成分
*supplement the reported active ingredients ofbased on literature
3.1.2 桂花的GO功能与KEGG通路富集分析 在线打开DAVID数据库,导入20个“桂花-慢性脑缺血”共同靶点,分别从生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组成(cellular component,CC)3个方面进行功能富集分析,根据基因数进行排序,对富集结果排名靠前且<0.05的条目进行分析。结果显示,桂花治疗慢性脑缺血靶点的生物过程与细胞凋亡过程的负调节、RNA聚合酶II启动子转录的正向调节、信号转导、蛋白质磷酸化的正向调节等相关,细胞组分主要富集于细胞质、质膜、胞质、核、核质、膜筏等,分子功能则与蛋白质结合、酶结合、蛋白激酶活性等密切相关(图2-A)。KEGG结果显示共有131条信号通路被显著富集,包括癌症通路、PI3K/Akt信号通路、EGFR酪氨酸激酶抑制剂耐药、VEGF信号通路、催乳素信号通路、Ras信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路等(图2-B)。将结果可视化构建“成分-靶点-通路”网络(图2-C)。

图1 桂花成分靶点与慢性脑缺血疾病靶点交集Venn图 (A)、桂花与慢性脑缺血共同靶点PPI网络及核心网络(B)、度值排名前20位的核心靶点(C)
3.2 桂花醇提物对慢性脑缺血小鼠的神经保护作用
3.2.1 桂花醇提物对慢性脑缺血小鼠神经行为的影响 旷场实验结果(表2)显示,脑缺血模型小鼠出现抑郁情绪及探索能力减弱等认知功能障碍,表现为站立次数及中央区域运动距离显著减少(<0.001);与模型组比较,桂花醇提物能明显提高小鼠的站立次数与中央区域运动距离(<0.01、0.001),提示其能有效改善小鼠的抑郁情绪。同时旷场运动轨迹结果(图3)显示,模型小鼠活动具边缘周围活动倾向,而桂花醇提物可提高小鼠向中央区域探索的能力,改善其认知功能。
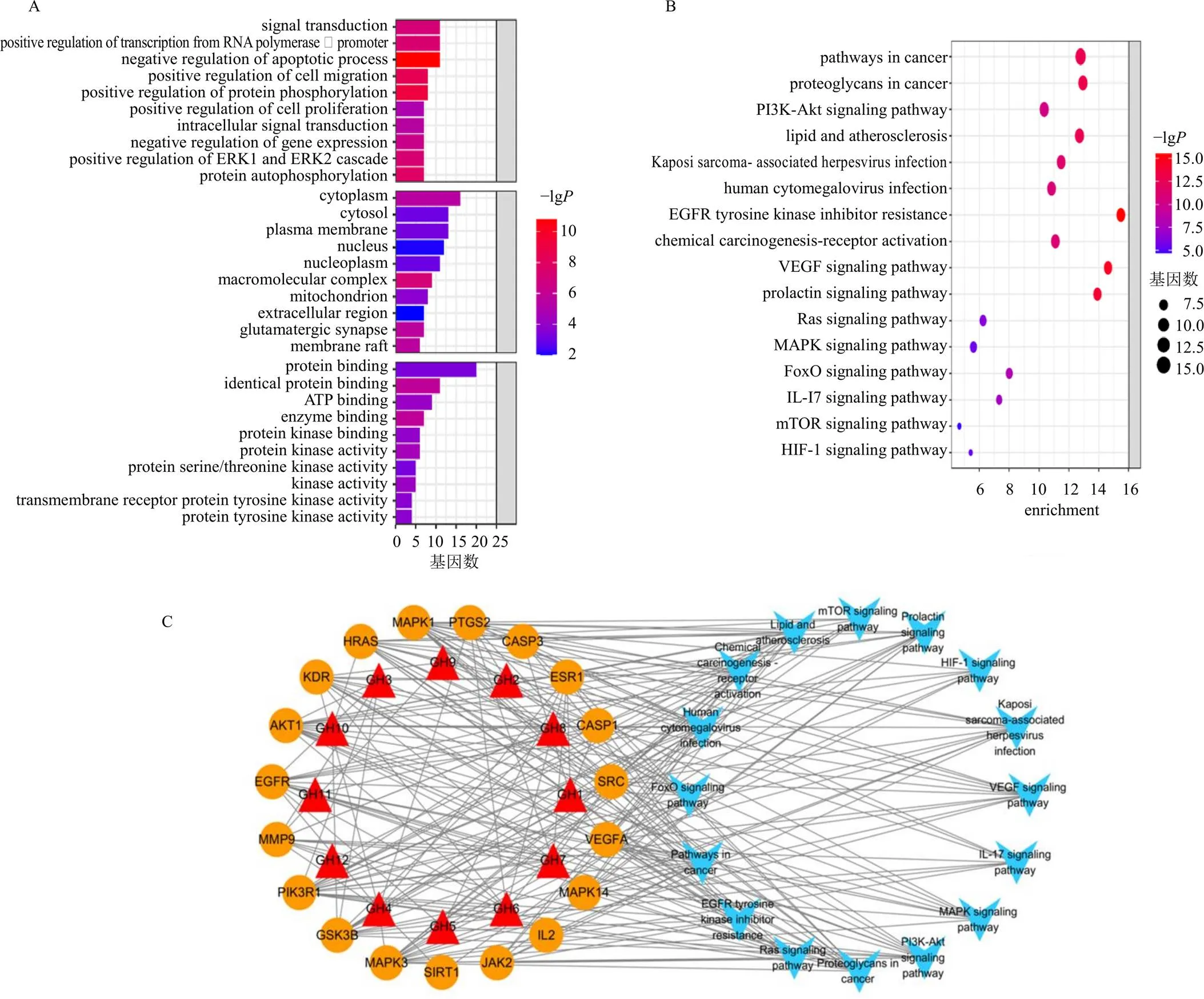
图2 桂花治疗慢性脑缺血靶点的GO功能 (A)、KEGG通路富集分析(B) 和“成分-靶点-通路”网络(C)

表2 桂花醇提物对慢性脑缺血小鼠神经行为的影响(, n = 10)
与假手术组比较:###<0.001;与模型组比较:**<0.01***<0.001,下表同
###< 0.001sham group;**< 0.01***< 0.001model group, same as below tables

图3 各组小鼠旷场实验运动轨迹
3.2.2 桂花醇提物对慢性脑缺血小鼠海马组织ChE和ChAC水平的影响 如表3所示,与假手术组比较,模型组小鼠海马中ChE水平显著升高(<0.001),ChAC水平显著降低(<0.001);与模型组比较,桂花醇提物高、低剂量组可通过升高ChAC水平(<0.001),降低ChE水平(<0.001),增强中枢胆碱系统功能,改善认知功能障碍。
3.2.3 桂花醇提物对慢性脑缺血小鼠海马组织病理变化的影响 如图4所示,假手术组海马神经元结构完整、排列紧密且规则,染色均匀。模型组海马神经细胞较多出现形态异常呈不规则梭形,细胞核固缩深染。桂花醇提物可不同程度地减少海马神经细胞损伤,其中高剂量组药效更明显。

表3 桂花醇提物对慢性脑缺血小鼠海马组织ChE和ChAC水平的影响(, n = 7)

红色箭头代表受损海马神经细胞
3.2.4 桂花醇提物对慢性脑缺血小鼠大脑皮层神经元凋亡率的影响 如图5和表4所示,与假手术组比较,模型组小鼠大脑皮层神经元TUNEL阳性细胞数量增多,凋亡率显著升高(<0.001);与模型组比较,桂花醇提物可有效减少脑缺血小鼠脑皮层TUNEL阳性细胞数,抑制细胞凋亡(<0.001)。

图5 桂花醇提物对慢性脑缺血小鼠脑组织神经元凋亡的影响(×200)

表4 桂花醇提物对慢性脑缺血小鼠脑组织神经元凋亡率的影响(, n = 5)
3.2.5 桂花醇提物对慢性脑缺血小鼠海马组织PI3K/Akt信号通路及凋亡相关蛋白表达的影响 如图6所示,与假手术组比较,模型组小鼠海马组织p-PI3K/PI3K、p-Akt/Akt值显著降低(<0.05),Cyt-C蛋白表达水平明显升高(<0.001);与模型组比较,桂花醇提物高、低剂量组p-PI3K/PI3K、p-Akt/Akt值显著升高(<0.05、0.01),桂花醇提物高剂量组Cyt-C蛋白表达水平显著降低(<0.01)。
如图7所示,与假手术组比较,模型组Bcl-2/Bax值及Bcl-2蛋白表达显著降低(<0.05、0.01),Bax和cleaved Caspase-3蛋白表达水平明显升高(<0.01、0.001);与模型组比较,桂花醇提物高、低剂量组Bcl-2/Bax值和Bcl-2蛋白表达水平明显升高(<0.05、0.01),Bax和cleaved Caspase-3蛋白表达水平明显降低(<0.01)。

与假手术组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,图7同
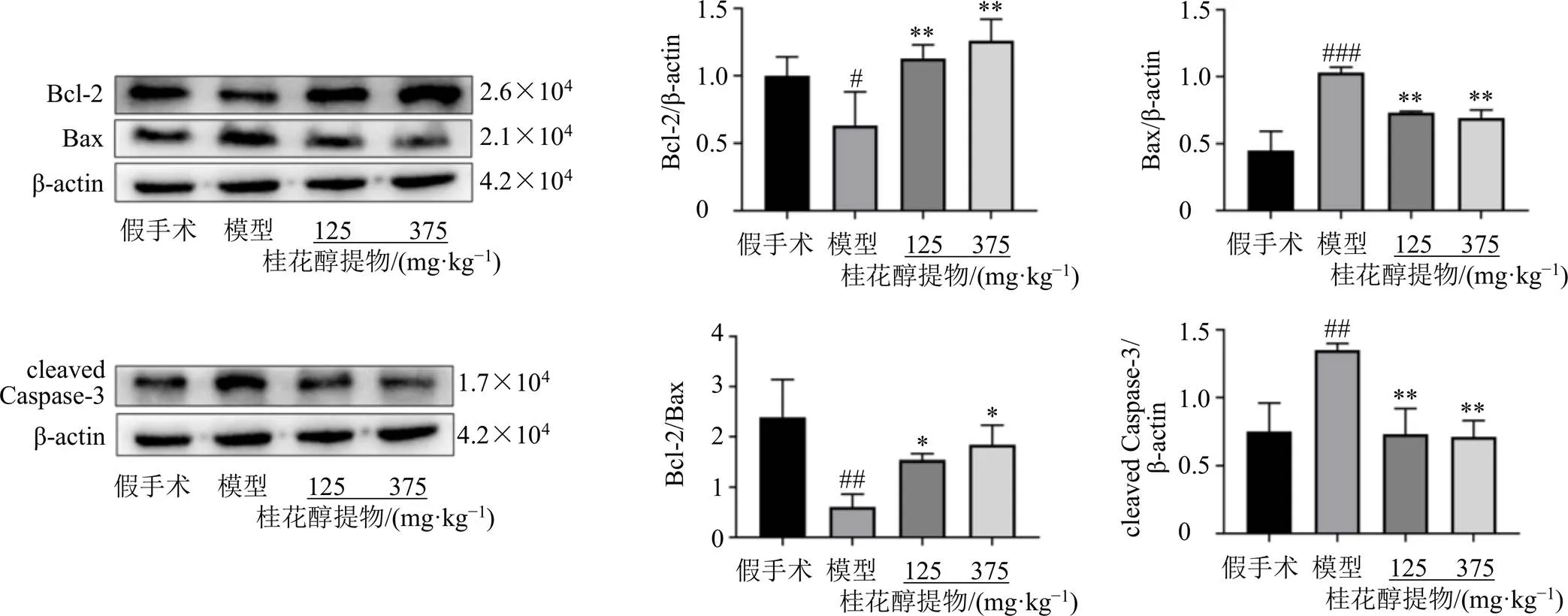
图7 桂花醇提物对慢性脑缺血小鼠海马组织Bcl-2、Bax和cleaved Caspase-3蛋白表达的影响(, n = 3)
4 讨论
近年来,慢性脑缺血患者的数量大量增加。不同年龄阶段统计的慢性脑缺血发病率显示,80岁及以上老人占80%,60岁及以上发病率为70%,45~50岁中也有1/4的人存在慢性脑缺血症状。由此可见,该病发生率趋向年轻化,重视和有效防治慢性脑缺血是当前亟待解决的问题[17]。目前,中药通过多靶点、多途径的整体调控治疗脑缺血已凸显出显著优势。桂花富含多种芳香成分[7],味辛,具有发散、行气、活血等作用特点,易通过血脑屏障、改善脑微循环等途径抵抗脑缺血神经损伤,但其治疗慢性脑缺血的具体分子机制尚不明确,因此本研究采用网络药理学探究桂花治疗慢性脑缺血的潜在作用机制并结合动物实验进行验证,以为后期研究提供理论及实验参考。
网络药理学筛选出桂花潜在作用靶点289个,并预测其可作用于198个慢性脑缺血疾病靶点。通过对这198个靶蛋白进行PPI网络分析,筛得桂花治疗慢性脑缺血的关键靶点为AKT1、VEGFA、CASP3等。AKT1作为一种丝氨酸/苏氨酸蛋白激酶,还有AKT2和AKT3 2种亚型,其中AKT1主要存在于脑、心脏和肺中[18]。研究发现,AKT1可通过抗凋亡机制促进急性脑缺血、阿尔茨海默病等神经系统性疾病的神经元存活,发挥神经元保护作用[19]。VEGFA是一种促血管内皮细胞生长因子。脑缺血发生后,VEGFA通过促进脑部神经血管形成及重构发挥神经保护作用[20-21]。CASP3作为介导细胞凋亡发生的启动子,其活化将触发脑缺血神经元凋亡及细胞焦亡的发生[22]。KEGG通路富集结果表明桂花治疗慢性脑缺血可能与调控癌症通路、PI3K/Akt信号通路、VEGF信号通路等相关,结合PI3K/Akt信号通路富集靶点基因数及核心靶点中AKT1的重要性,推测桂花可能主要通过调控PI3K/Akt信号通路发挥抗慢性脑缺血神经损伤作用。为进一步验证网络药理学预测结果,本研究采用动物实验探讨桂花对慢性脑缺血的神经保护作用及其机制。
长期脑组织血流量低灌注引发认知功能障碍,且慢性脑缺血所致认知功能障碍的形态学基础是胆碱能神经元功能障碍,主要表现为ChE活性升高、ChAC活性及乙酰胆碱水平降低等[23-24]。因此,借助相关检测方法评价桂花醇提物改善慢性脑缺血致神经功能障碍等作用是一种重要措施。右侧颈总动脉结扎法因其死亡率低,可保证脑血流量(cerebral blood flow,CBF)持续轻度降低,并出现符合人体疾病进程的脑缺血认知功能障碍,现已被广泛应用于慢性脑缺血的实验研究[25-26]。本研究采用右侧颈总动脉结扎法复制慢性脑缺血模型,结合行为学评价方法旷场实验发现,与模型组比较,桂花醇提物组小鼠的站立次数、中央区域运动距离均明显增加。且运动轨迹图也显示,模型组小鼠探索行为减少,表现明显的趋触性:即沿着边缘运动,空间中央探索运动减少;相较模型组,桂花醇提物可有效改善以上功能障碍。同时,模型组ChAC活性显著降低,ChE活性升高,而桂花醇提物给药后可以显著逆转。以上结果提示,桂花醇提物可有效增强中枢胆碱能系统功能,改善脑缺血小鼠的认知功能障碍。
长期的脑灌注不足极易对大脑皮层及海马产生影响。研究发现,因慢性脑缺血诱发的认知功能障碍大鼠海马与皮质区的神经元大量丢失、组织结构异常[27-28]。HE染色结果表明,模型小鼠海马区神经细胞结构发生改变,有些甚至固缩为梭形和三角形,海马中的神经细胞较假手术组排列稀疏、紊乱,而桂花醇提物可以修复海马区神经细胞损伤。TUNEL染色结果也进一步提示,桂花醇提物可以显著减少脑缺血小鼠皮层区神经细胞的凋亡,从而发挥神经保护作用。
网络药理学结果表明桂花可能通过调控PI3K/Akt信号途径发挥慢性脑缺血损伤保护作用。PI3K/Akt信号通路作为经典的抗凋亡、促存活信号转导途径,在维持细胞生存以及抑制细胞凋亡中起着重要的作用[29]。激活PI3K/Akt通路,促进Akt磷酸化,降低凋亡蛋白Bax和cleaved Caspase-3等的表达,从而抑制细胞凋亡,是促进神经元存活的重要措施[30-32]。Western blotting检测结果表明,与假手术组比较,模型小鼠p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax值明显降低,Cyt-C和cleaved Caspase-3表达明显增加;与模型组比较,桂花醇提物可明显提高p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax值,下调促凋亡蛋白Cyt-C、cleaved Caspase-3、Bax等的表达。本研究结果验证了网络药理学分析提示的桂花通过调节AKT1、CASP3等关键靶点发挥抗慢性脑缺血神经损伤作用。
综上,本研究首次报道了桂花醇提物抗慢性脑缺血小鼠神经损伤的保护作用及可能机制,为桂花用于慢性脑缺血疾病的防治提供科学依据,也为相应脑缺血神经保护药物的研发开辟新思路。然而其主要药效物质基础及其多途径、多靶点抗脑缺血神经损伤的深入机制尚待进一步探究。
利益冲突 所有作者均声明不存在利益冲突
[1] 穆浩月, 鞠奕, 赵性泉. 慢性脑缺血病理生理机制与临床表现的研究进展 [J]. 中国医学前沿杂志: 电子版, 2021, 13(4): 21-25.
[2] 李江云, 陈红霞. 慢性脑缺血中西医治疗进展 [J]. 新疆中医药, 2021, 39(3): 115-118.
[3] 高利. 慢性脑缺血中西医结合诊疗专家共识 [J]. 中国中西医结合杂志, 2018, 38(10): 1161-1167.
[4] 杨柳, 张敏, 贺曦, 等. 姜黄素对大鼠慢性脑缺血诱发脑损伤的保护作用及分子机制研究 [J]. 中国药业, 2015, 24(4): 31-34.
[5] 倪彩霞. 芳香开窍药抗脑缺血及影响血脑屏障功能的实验研究 [D]. 成都: 成都中医药大学, 2011.
[6] 房仙颖, 周江莲, 王靖秋, 等. 桂花渣粕黄酮提取物的制备及酶法修饰 [J]. 林业工程学报, 2020, 5(6): 99-105.
[7] 赵东, 袁杰彬, 孙琳, 等. 桂花及桂花酒的研究进展 [J]. 酿酒科技, 2017(1): 90-94.
[8] 王利苹, 奉建芳, 胡凯莉. 芳香开窍中药对血脑屏障通透性的调节作用及其机制研究进展 [J]. 中国中药杂志, 2014, 39(6): 949-954.
[9] 熊丽娜, 毛淑琴, 陆柏益, 等. 桂花提取物及毛蕊花糖苷抗-半乳糖致小鼠衰老作用研究[A] // 中国食品科学技术学会第十一届年会论文摘要集[C]. 杭州: 中国食品科学技术学会, 2014: 139-140.
[10] Lee H H, Lin C T, Yang L L. Neuroprotection and free radical scavenging effects of[J]., 2007, 14(6): 819-827.
[11] Zhou F, Zhao Y J, Li M Q,. Degradation of phenylethanoid glycosides inLour. flowers and its effect on anti-hypoxia activity [J]., 2017, 7(1): 10068.
[12] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[13] Zhou Y T, Zhang J, Wang L,. Interleukin-1β impedes oligodendrocyte progenitor cell recruitment and white matter repair following chronic cerebral hypoperfusion [J]., 2017, 60: 93-105.
[14] 程芳, 周子航, 靳冰瑞, 等. 黄芪-灯盏细辛成分联用对慢性脑缺血小鼠神经损伤的保护机制研究 [J]. 中国药学杂志, 2023, 58(1): 57-64.
[15] 殷博武. 名花良药好食材: 桂花 [J]. 中国药店, 2013(18): 77.
[16] 张阳. CSE源性H2S调控RhoA/ROCK通路对小鼠脑缺血再灌注后星形胶质细胞功能和神经损伤的作用研究 [D]. 合肥: 安徽医科大学, 2021.
[17] 李建章, 张杰文, 刘恒方. 慢性脑缺血临床诊治专家共识 [J]. 中国实用神经疾病杂志, 2022, 25(6): 661-667.
[18] Gao Q, Deng H, Yang Z F,. Sodium danshensu attenuates cerebral ischemia-reperfusion injury by targeting AKT1 [J]., 2022, 13: 946668.
[19] 刘艳青. 癫痫持续状态后AKT1在颞叶癫痫大鼠海马中的表达变化 [D]. 天津: 天津医科大学, 2010.
[20] 潘之光, 毛颖, 孙凤艳. 血管内皮生长因子促损伤脑内神经血管单元的重构 [J]. 生理学报, 2017, 69(1): 96-108.
[21] 渠泽平, 杨丙飞, 格日乐图, 等. 远隔缺血预适应对脑小血管病患者认知功能障碍及血管内皮生长因子表达水平的影响 [J]. 中国实用神经疾病杂志, 2021, 24(8): 675-679.
[22] Rogers C, Fernandes-Alnemri T, Mayes L,. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death [J]., 2017, 8: 14128.
[23] Chen D D, Peng C, Xie X F,. Low dose of anisodine hydrobromide induced neuroprotective effects in chronic cerebral hypoperfusion rats [J]., 2017, 16(10): 1111-1119.
[24] Sun Y N, Zhao Z L, Li Q,. Dl-3-n-butylphthalide regulates cholinergic dysfunction in chronic cerebral hypoperfusion rats [J]., 2020, 48(7): 300060520936177.
[25] Yoshizaki K, Adachi K, Kataoka S,. Chronic cerebral hypoperfusion induced by right unilateral common carotid artery occlusion causes delayed white matter lesions and cognitive impairment in adult mice [J]., 2008, 210(2): 585-591.
[26] 项丽玲, 李艳, 曹利华, 等. 基于临床病症特点的慢性脑缺血动物模型分析 [J]. 中药新药与临床药理, 2021, 32(1): 93-98.
[27] 牟静静. 慢性脑缺血致认知障碍大鼠线粒体损伤机制及脑脉泰保护作用研究 [D]. 长春: 吉林大学, 2015.
[28] 丁利静, 赵丹丹, 刘波, 等. 蛇床子素抑制小胶质细胞激活改善血管性痴呆大鼠学习记忆能力 [J]. 中国新药与临床杂志, 2021, 40(6): 470-475.
[29] Zhang Z, Yao L, Yang J H,. PI3K/Akt and HIF‑1 signaling pathway in hypoxia‑ischemia (review) [J]., 2018, 18(4): 3547-3554.
[30] 赵蕾, 张晓红, 吴柏成, 等. 山楂叶总黄酮对脑缺血大鼠脑组织PI3K/Akt信号通路的影响 [J]. 广东医学, 2014, 35(7): 982-984.
[31] 仇志富, 吴晓光, 颜勇, 等. 姜黄素对脑缺血大鼠脑组织PI3K/AKT信号通路的影响 [J]. 中国老年学杂志, 2017, 37(19): 4756-4758.
[32] 丁晓丽, 薛丁嘉, 邓万娟, 等. 铁筷子挥发油对慢性脑缺血致血管性认知功能障碍大鼠的作用及机制研究 [J]. 中草药, 2022, 53(17): 5389-5399.
Protective mechanism ofethanol extract on chronic cerebral ischemia nerve injury based on network pharmacology and animal experiments
CHENG Fang, ZHANG Jie, HU Jia-cheng, XU Huan, XIAN Jin-ran, XIE Xing-liang, SHENG Yan-mei
School of pharmacy, Chengdu Medical College, Chengdu 610500, China
To explore the protective effect and mechanism ofethanol extract against chronic cerebral ischemic nerve injury based on phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt) pathway.The active components and targets ofwere screened by literature, TCMSP and BATMAN database; OMIM and GeneCards disease databases were used to search for disease targets. Protein-protein interaction (PPI) network was constructed by taking intersecting targets. With the help of DAVID database, gene ontology function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were carried out, and “component-target-pathway” network was established. The model of chronic cerebral ischemia in mice was established by ligating the right common carotid artery. The mice were randomly divided into sham group, model group, Naoluotong (脑络通, 195 mg/kg) group andethanol extract low- and high-dose (125, 375 mg/kg) groups. Open field experiments was used to evaluate the spontaneous ability and exploratory behavior of mice in each group; Levels of choline acetylase (ChAC) and cholinesterase (ChE) in hippocampus of mice in each group were detected; HE and TUNEL staining were used to observe pathological changes in brain tissue and neuronal apoptosis; Western blotting was used to detect PI3K/Akt signaling pathway and apoptosis-related protein expressions in hippocampal tissue.A total of 12 active ingredients and 289 potential targets of, 3014 targets of chronic cerebral ischemia disease, and 198 intersection targets ofand chronic cerebral ischemia were screened by network pharmacology, among which AKT1, vascular endothelial growth factor A (VEGFA), and cysteine aspartic protease-3 (Caspase-3) were core targets. Further analysis using KEGG and GO revealed that PI3K/Akt signaling pathway may be an important pathway forto exert neuroprotective effects on chronic cerebral ischemia. The mouse model of chronic cerebral ischemia was replicated using the ligation of the right common carotid artery. The results showed thatethanol extract significantly increased ChAC level in brain tissue (< 0.001), decreased ChE level (< 0.001), and enhanced the function of the central cholinergic system; Significantly increased the number of standing times and central area movement distance in mice with cerebral ischemia (< 0.001), improved cognitive and other neurological dysfunction, and inhibited neuronal apoptosis in the ischemic brain tissue (< 0.001). Its mechanism was related to regulating PI3K/Akt signaling pathway, up-regulating the expressions of p-PI3K, p-Akt and B-cell lymphoma-2 (Bcl-2) proteins (< 0.05, 0.01), and down-regulating the expressions of cytochrome C (Cyt-C), Bcl-2 associated X protein (Bax) and cleaved Caspase-3 proteins (< 0.01).ethanol extract can effectively inhibit the damage of cerebral ischemic nerve cells and improve the neurological dysfunction. Its protective effect on cranial nerves is related to the regulation of PI3K/Akt pathway and inhibition of cell apoptosis.
ethanol extract; chronic cerebral ischemia; network pharmacology; verbascoside; salidroside; apoptosis; PI3K/Akt pathway
R285.5
A
0253 - 2670(2023)16 - 5233 - 11
10.7501/j.issn.0253-2670.2023.16.012
2023-03-19
四川省科技厅重点研发项目(2020YFS0325);成都医学院研究生创新科研基金项目(YCX2022-01-30)
程 芳,硕士研究生,研究方向为中药药效与毒理。E-mail: 1439010973@qq.com
谢兴亮,硕士生导师,教授,研究方向为中药新制剂与新剂型。E-mail: 421733038@qq.com
盛艳梅,硕士生导师,教授,研究方向为中药脑缺血神经保护机制。E-mail: 467131233@qq.com
[责任编辑 李亚楠]

