基于同名同方药的化学物质基础及其创新研究思考
尚海花,廖茂梁,郑雅楠,许飞飞,侯文彬*
基于同名同方药的化学物质基础及其创新研究思考
尚海花1, 2,廖茂梁2, 3*,郑雅楠3,许飞飞1,侯文彬1*
1. 北京协和医学院&中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室,天津 300192 2. 皖西学院生物与制药工程学院,安徽 六安 237012 3. 天津药物研究院,天津 300462
近年来,中药新药创制动力不足严重阻碍产业发展。通过梳理同名同方药注册分类和评审要求,对其注册科学内涵进行分析和思考,提出以临床价值为导向,化学物质基础和临床功效关联为主线的研究思路。在揭示已上市中药中与临床功效和药品品质关联的“化学物质基础”差异性基础上,建立“固有化学成分-体内代谢-生物效应”功效物质成分群的解析研究模式,表征优质、优效中药内涵,以质量标志物统领和提升同名同方药的研制,推动已上市中药的传承创新。
中药;同名同方药;物质基础;质量标志物;新药创制
具有独特理论体系的中医药在我国历史悠久,作为中华民族的瑰宝其产业已经成为国民经济的重要组成部分[1],根据全国医药工业统计数据显示,2021年中药工业总产值达6919亿元,其中中成药产值为4862亿元,在整个医药产业中具有重要的地位和作用。目前,我国已上市中成药制剂品种有8670个,为中医药服务的可及性和预防保健提供了重要的支撑,2020年,国家药品监督管理局发布的《中药注册分类及申报资料要求》明确了同名同方药的定义及其注册要求和审评准则,为已上市药物的创新研究和产业化明晰了法规要求。由于我国中药产业基础薄弱,创新动能不足[2-3],同名同方药物的生产开发周期短、风险小、成药率高,因此讨论和分析同名同方药的科学内涵及其研究关键点对我国医药产业的健康稳定发展意义重大。
1 我国同名同方药物的法规要求和历史沿革
2020年新修订的《药品注册管理办法》首次将中药注册分类分为中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药4类。注册分类的理念不再仅以物质基础作为划分注册类别的依据,对已上市药物的注册申请调整主要包含2个方面:(1)变更引起药用物质或药物的吸收、利用明显改变的,不再属于上市后变更范畴,而要按改良型新药进行研究申报;(2)推动已上市中药的改良与质量提升,“中药增加功能主治”由原来的补充申请改为纳入新药申报范畴。在随后发布的《中药注册分类及申报资料要求》及2022年12月27日发布的《同名同方药研究技术指导原则(试行)》中强调同名同方药不同于中药仿制药,要求其在有效性、安全性、质量可控性方面不低于该已上市中药的制剂。
从法规沿革的角度来看,同名同方药注册分类源于中药仿制药,而中药仿制药概念的提出经历了数次演变。自1978年首部卫生部起草的《药政管理条例》中提出:药品由省、市、自治区卫生局审核批准,把药品的生产纳入了监管的范畴。此时并没有仿制药的概念,直到1985年国家颁发了第1部《药品管理法》才有了仿制药的雏形,以法律的形式对已有国家或地方标准的药品,由省级卫生行政部门与药品生产经营主管部门共同审核批准,颁发批准文号。2002年国家药品监督管理局颁发的《药品注册管理办法》将已有国家标准的中成药和天然药物制剂列为中药注册分类的第11类,同时提出,必要时应当提高质量标准,提高后的质量标准按试行标准管理,免除药理毒理和临床研究,掀起了国内中药仿制药研究开发的热潮,造成了大量的审评积压,为了规范新药研发行为、避免低水平重复,2007年国家食品药品监督管理局颁发了新版《药品注册管理办法》,基本形成了以中药物质基础为核心的注册分类模式,明确提出了仿制药的概念,仿制药申请是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品注册申请,归为中药注册第9类。
为了进一步规范药品研制秩序,加强药品研制申报资料的真实性和完整性,2008年5月23日国家食品药品监督管理局出台了《关于印发药品注册现场核查管理规定的通知》,自2009年,中药仿制药的申请出现了断崖式下降(图1),仿制药申请受理了51件,仅占2008年的1/4,中药仿制药的注册申请进入了10年的低迷期,近年来甚至出现没有注册申报现象,可见行业对其所秉承的态度。历经13年后,2020年3月30日,国家市场监督管理总局颁发了新版《药品注册管理办法》,中药新药注册进入了新的发展时期,以临床需求为导向,守正创新,开创性提出同名同方的新概念,新注册分类提出后于2022年国家药品监督管理局药品审评中心首次受理了2个中药4类品种(标准桃金娘油肠溶胶囊和通阻合牙日仙拜尔片)。同名同方药指通用名称、处方、剂型、功能主治、用法及日用饮片量与已上市中药相同,且在安全性、有效性、质量可控性方面不低于该已上市中药的制剂。从这一概念可以看出,同名同方药与传统的仿制药概念存在一定的差异性,如何与传统的仿制药研发相区别,有效开展研究,在行业内仍然存在较大的困惑和争议,对同名同方药的药物创制思路和方法进行探索具有重要意义。
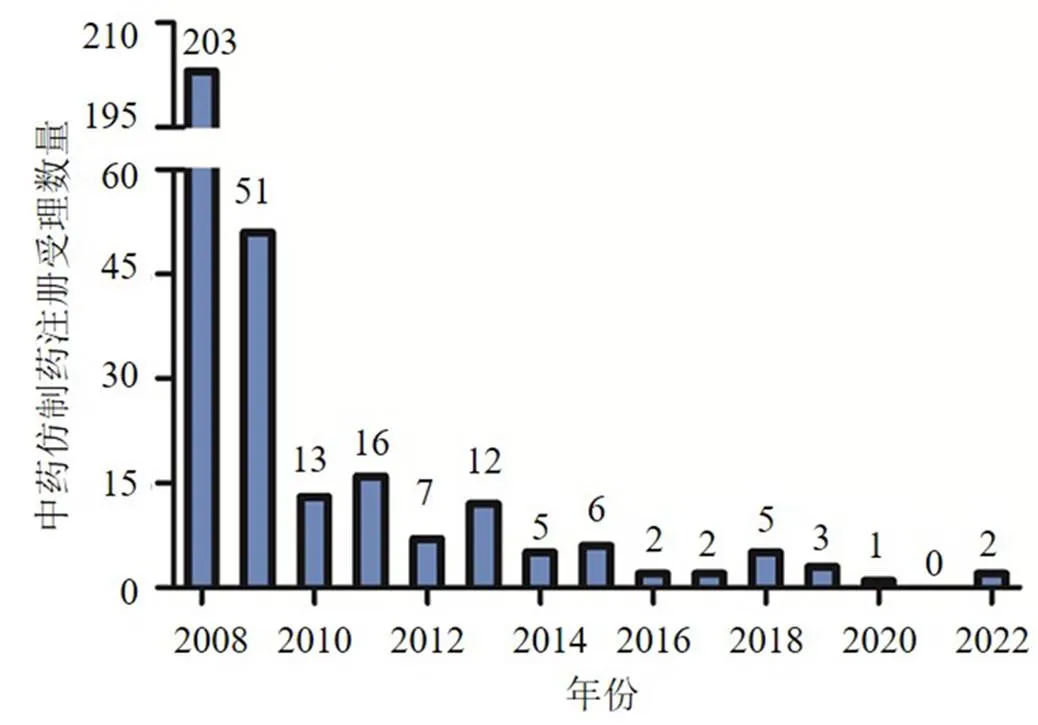
2022年为同名同方药受理数量,其余各年为中药9类受理数量
2 基于已上市中药研究的注册路径
针对近几年中药创新研发动力不足、中药新药创制领域亟需破解的关键难点和问题,以临床价值为导向,促进中医药传承精华,避免低水平重复,鼓励运用新技术、新方法提升药品质量,通过对已上市中药临床价值进行充分评估,推动已上市中药的改良与质量提升,促进中药产业高质量发展[4]。其注册路径主要有2种:(1)经过改良和提升,体现临床应用优势和特点按照改良型新药注册;(2)以临床价值为导向,在有效性、安全性、质量可控性方面不低于该已上市中药的制剂按照同名同方药注册。
而在安全性和有效性方面能够替代已上市药物则属于仿制药的范畴,参照美国联邦法典定义,仿制药是与参比药物具有相同的药物活性成分、剂型、规格、给药途径、说明书、质量、适应证等特性,并且与参比药物生物等效的替代药物。仿制药的本质是与参比药物的临床疗效及其安全性能的相同性和可替代性,但其处方组成并未要求必须完全一致,只需要临床等效即可。而中药由于其药材产地、基原、炮制及生产加工条件等因素的差异,难以保证中药同一配方不同厂家所生产的产品的一致性,即使是同一厂家所生产的同一品种不同批次间,其产品的质量也难以保证其一致性,这也是中药产业未开展中药一致性评价的难点所在[5-7],给中药已上市药物的研究与开发提出了巨大的挑战。
中成药作为临床用药的法律批准用药形式,包括通用名称、处方、制法、剂型、功能主治、性状、鉴别、检查、含量测定、用法及用量、储存条件等限定要求和标准。同名同方中首先是同名,也就是药品通用名称一样,其次是同方,即药物处方组成相同,也就是同名同方的处方药味包括药材的基原、药用部位、炮制与已上市对照药品相一致。剂型相同但并未要求规格一致,这一点与化学仿制药相比存在较大差异;同名同方中要求日用饮片量必须与已上市中药一样,指的是临床给药剂量必须与对照药一致;同名同方药最核心之处在于其有效性、安全性、质量可控性等不低于该已上市中药的制剂,从这个角度来说,同名同方药的范畴要大于仿制药,其本质也是研发更优质、更安全、更高效的中药制剂,这显然是有别于化学药所定义的仿制药研究,因此同名同方药物的研究策略应与一致性评价相区分,应是以临床价值为导向,挖掘和评估所选择已上市中药对照药的优势和特点,应当优先考虑能够体现中医药的优势和特点的品种,尤其是针对多适应证的中药对照药通过科技赋能确定其与临床定位相适应的优势,从而更加精准的定位同名同方药的临床适应证[8]。
3 与临床功效和中药品质关联的“化学物质基础”研究是药物创制的关键
2022年12月26日,国家药品监督管理局药品审评中心发布了《同名同方药研究技术指导原则(试行)》,对同名同方药的研究思路和内容提出了有别于仿制药和改良型新药的要求,同名同方药的研究不是简单的质量比对研究,而是鼓励运用符合产品特点的新技术、新方法对已上市中药对照药的工艺优化、质量提升研究。因此,法规为同名同方药的研究与创制提出了新的要求。在研究过程中宜根据比对实验结果进而对注册分类做出判断和分析,而判断的核心要点是“药效物质基础及其吸收、利用是否发生明显改变”。药效物质基础及其吸收利用的有效控制和质量保障与中药的临床功效及安全性密切相关,这也是当前研制出“优效、优质”同名同方药的关键所在。同时为了有效规避和摆脱低水平重复及生产厂商间的不合理竞争与仿制,应当科学合理的选择具有临床价值对照药,需要对可“仿制”的已上市中药产品进行临床价值依据是否充分的科学评估和临床分析,《中国药典》2020年版收载品种及保护期结束的中药保护品种原则上其价值依据较充分,但也应关注上述品种的临床应用情况及其不良反应数据,依据当前适应证的临床诊疗需求做出全面的分析评估。但是对拟“仿制”的已上市中药产品价值的评价指标该如何选择,安全性及质量可控性研究的手段和评价方法该如何优选,这一系列问题有待深入系统的研究。
因此,可以说同名同方药的创制是一项系统的研究工程,涉及临床适应证的精准定位和评估、药效物质基础的研究和揭示、制备工艺与临床疗效的关联性、质量控制的科学性等系列难题,在可获已上市药物信息的基础上,整合中医药理论、现代药理学、药剂学、药物分析学等多学科的知识进行综合性分析,在体现临床价值和中药优势特点的基础上,针对同名同方药在研究和注册转化过程中的有效性、安全性、质量控制水平及物质基础是否发生显著变化等难点和瓶颈问题,借助现代科学技术理论和手段,通过“性状评价-化学评价-生物评价”等共性技术和难题的攻关,攻克和表征与临床功效和中药品质关联的“化学物质基础”差异性,对提升药品的可及性、满足临床需求和促进中药产业的现代化和健康发展具有重要意义[9]。
4 坚持面向国家重大需求,以临床为导向的创制思路
随着国家新药创制专项、中医药法等一系列政策的扶持,我国新药创制的水平取得了长足进步[10],构建了多个国家和地方新药创制重点实验室及评价平台。药品质量和品种数量稳步提升,医药创新能力和服务水平显著提高,但我国医药产业发展不平衡不充分,药品安全性、有效性和可及性仍需继续提高,新药创制与欧美先进水平相比仍存在差距,原创性药物的研发水平仍处于初期阶段,临床用药主要以化学仿制药为主,中成药市场份额和占比依然偏小,特别是在中医药具有临床优势的慢性病、心脑血管疾病、儿童用药等领域,新药创制前景广阔,重大传染病、难治疾病和罕见病等疾病的防治药物研制及其用药成本降低意义深远,具有自主知识产权的中医药制剂蕴含着巨大的发展潜能[11],为应对此次新型冠状病毒肺炎,以金花清感颗粒、连花清瘟胶囊/颗粒、血必净注射液等为代表的中药制剂,在疫情防控中发挥了重要作用[12],已上市药物的创新研究与注册申请对提升民众用药的可及性和降低患者的用药负担具有重要意义。
已上市的中药制剂大多来源于经典名方、临床经验方或确有疗效的医疗机构制剂,在临床中应用广泛,具有大量的人用经验,虽然由于历史审评监管政策尺度演化变革等原因,部分中成药缺乏系统的安全性、有效性数据,同时由于分析仪器及测试技术手段的匮乏,仍然有部分中成药缺乏质量控制指标,难以有效保障药品的质量[13-17],尽管如此,已上市中成药自上市以来积累了大量的真实世界证据,既是中药新药创新的源泉,也为同名同方药研制临床价值的评估奠定了基础。在明确中药对照药的基础上,尤其是具有多个主治病证的对照药,应进一步依据已上市中药临床应用治疗的优势病种,首选影响国计民生的重大疾病,围绕疾病的分型、分期及药物干预的阶段和方式,辨证与辨病相结合,采用适合中医药特点的数据挖掘技术[18-22],从中医医案、临床报道、中医理论、药理毒理等数据进行挖掘分析其主要/核心病证,挖掘已上市中药的用药指征和临床价值,为同名同方药的传承创新与高质量发展指明方向。
5 以化学物质基础为关键质量属性开展系统研究
中药药效化学物质基础研究是同名同方中药研究和创新的关键科学问题[23-25],采用中医原创思维与现代科技技术融合创新,既是同名同方药物守正创新发展的必然要求,更是中医药产业现代化、智能化的核心环节。同名同方药与已上市药物化学物质的对比研究是安全性研究及临床研究的关键所在,新版《中药注册分类及申报资料要求》(2020年第68号)中明确提出不以物质基础作为新药分类的依据,但是物质基础是否发生改变一直是中药工艺变更研究中关注的重点,也是变更注册分类的判定原则所在。物质基础是中药发挥临床功效的物质载体,中药多成分、多靶点、整体调控的作用特点既是中药特色和魅力所在,同时也是中药物质基础难以辨析和阐释的根源所在,更是阻碍中药现代化发展的内在因素[26-27]。
由于中药材多基原、多产地、不同炮制等复杂情况,使已上市中药的化学物质基础差异悬殊,产业化生产和质量监管中常采用一种、几种或特征性成分来控制产品的稳定性和检验产品的质量,上述指标往往难以有效反映中药复方产品质量与疗效间的关系,为此,采用已上市药物质量标准中的质控指标进行化学物质基础的对比分析难以全面反映二者的异同。
中药中含有多类化学成分,包括无机物、微量元素、有机化学成分等,其组成、配比及存在形态均与中药的有效性和安全性密切相关,这些均构成了中药的化学物质基础和空间形态物质基础,在相关辅料和制剂工艺的作用下制成中成药制剂,制剂在机体相关代谢酶和药物转运体的作用下吸收、转化、代谢发挥出生物效应。因此,中药化学物质基础研究及其比对亟需规范的化学物质表征指导原则或评价流程,见图2。
在中医药理论的指导下,构建逐层递进、多层解析、综合评价的化学物质基础研究策略和流程,采用现代分析技术手段[28-29],从整体到活性部位、活性成分群、非活性物质组等,逐层递进的方式开展研究和表征,通过不同层次、水平、活性的化学成分信息进行剖析和比对,借助敲除/敲入活性成分研究策略[30],对已上市药物和制备样品的不同组分进行活性对比研究,采用网络药理学、分子生物学、大数据分析等现代系统分析技术方法[31-32],明确已上市中药组方的核心物质成分基础和非活性成分群,评价和考察不同基原、产地及生产工艺参数对功效物质群的影响,进而明确已上市药物的关键质量属性。药物功效的发挥与功效物质基础的种类、数量及其在机体的吸收转运相关联,因此已上市药物不同厂家及不同批次的功效物质成分的种类、数量及其配比空间和范围需要系统研究和表征,构建已上市药物合理的功效化学物质基础指纹图谱和限度范围,作为中药药用物质基础是否显著变化的重要评价指标,为同名同方药物的创制提供方向。

图2 基于化学物质基础的关键质量属性研究流程
6 基于全链条的工艺对比与优化研究
在明确关键化学物质基础质量属性的基础上,开展质量关键参数及其参数水平空间的研究,借助质量源于设计的药品创制理念和方法进行系统制备工艺研究。由于中药药材原料来源不同、产地差异、工艺差异、制剂参数不同,使中药制剂中的活性物质数量和种类波动较大,增大了工艺对比研究的复杂性和质量控制的复杂性,更为临床同名同方中药不同厂家的可替代性评价带来了挑战[33-34]。因此,针对不同中药制剂品种的特点及其组成药味情况和制剂工艺的制备原理和路线,从药材基原、前处理工艺、提取工艺、制剂成型工艺等环节进行系统对比分析和研究,见图3。
6.1 药材基原选择和对比
作为中药组方的原料来源,中药基原的选择直接影响成品的质量和疗效,如《中国药典》2020年版大黄药材项下收载了蓼科植物掌叶大黄L.、唐古特大黄Maxim.ex Balf.及药用大黄Baill.。不同基原的大黄其药效活性成分和功效存在差异性[35]。掌叶大黄具有清热泻火、利湿退黄之功,而唐古特大黄偏向于泻下攻积、逐瘀通经之效。研究表明唐古特大黄中总蒽醌(结合型蒽醌和游离型蒽醌)含量高于掌叶大黄和药用大黄[36],在我国已上市的中成药处方中有900余种中成药含有大黄,各部颁标准和药典标准品种项下大多数未对大黄的基原来源进行限定,同名同方药的药材基原如何限定,是品种研究开发之初必须考虑的问题。中药材基原鉴定的方法主要有性状鉴定、显微鉴定、理化鉴定、指纹图谱和分子鉴定等[37]。生粉入药的中成药中各药味的基原鉴定可考虑采用常规鉴定方法进行鉴定,处方药材经提取加工制备的成药中各药味的性状和显微鉴别特征均已发生显著变化无法有效鉴定,特征指纹图谱和分子鉴定有望解决这一难题[38-40]。尤其是近似种、同属近缘物种的鉴定,通过构建植物原料、中药材、饮片、提取物、中间体及成品的特征指纹图谱辨识成药中所用饮片的基原,对于尚无专属性特征性化学成分难以建立化学指纹鉴定方法的,可结合分子鉴定手段进行进一步辨识,为保证与原制剂药材基原的一致性提供依据。
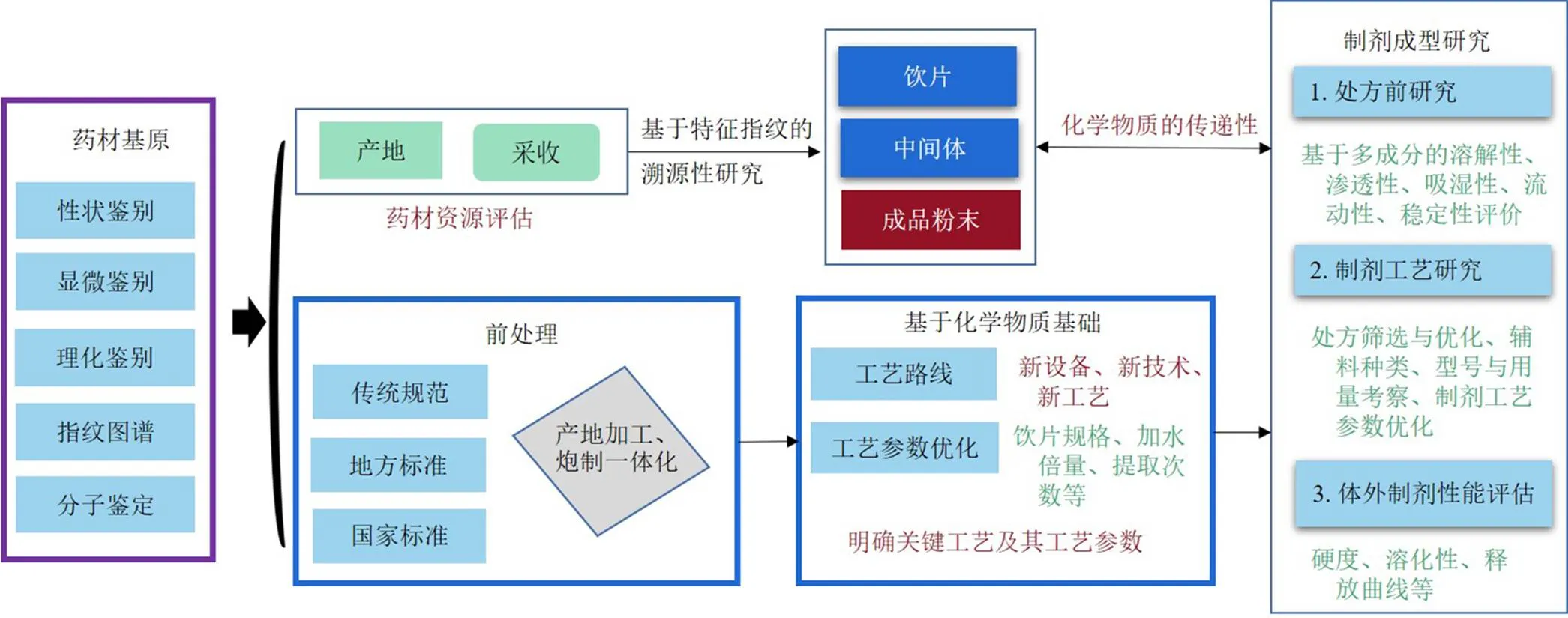
图3 基于功效物质基础的全链条工艺研究与优化
6.2 前处理研究
中药材炮制加工入药是中医临床用药特色,中药材的炮制加工纳入了中成药制备的前处理工序中。在2022年3月29日发布的《同名同方药研究技术指导原则(征求意见稿)》中提出同名同方药“饮片炮制规格及炮制方法等应与对照药一致”。中药炮制的目的是在中医药理论指导下,通过净制、切制或炮制等手段,增强、缓和或改变中药药性,提升临床治疗效果[41]。由于受地方文化、地域气候等因素的影响,中药炮制工艺和技术具有多样性[42-43],涌现出了特色鲜明的炮制流派如江西帮(樟帮、建昌帮)、京帮及川帮等,同一药味的炮制方法存在一定的差异性。如江西帮特色的枳壳、炆地黄、白芍等炮制饮片在有效成分含量和药理活性方面均不同程度优于《中国药典》或其他方法炮制的饮片。中药炮制工艺近年来采用现代科技手段和医学指标揭示传统炮制的科学内涵取得了显著成就和重大突破,尤其是现代机械化、工业化、智能化设备和技术的应用,大大推动了炮制工艺的进步,我国目前批准上市的中成药采用的炮制饮片也是随着科技的进步不断的更新和优化其饮片炮制工艺,当前新版《药品管理法》已将饮片生产纳入药品生产范畴,中药饮片已纳入国家基本药物目录,传统的中药材加工炮制存在二次浸润,产地加工-炮制一体化生产,将初加工与饮片炮制合二为一,可有效减少药材储藏、运输及重复水处理和干燥所引起的有效成分的损耗,具有很强现实意义,值得提倡和鼓励[44]。炮制方法的一致需要辨证对待,炮制工艺和参数的优化可适当放宽要求,无需完全相同,只要与成药中炮制饮片的药性功效相一致,符合国家药品标准、药品注册标准及省、市、自治区药材标准即可。
6.3 提取工艺研究
中药提取制备工艺与中药临床疗效密切相关,然而中药制备工艺的关键工艺及其工艺参数与其有效性和“安全性”的关联是中药提取工艺研究的难点[45-46]。数以千计的已上市中成药品种,大多来源古代医学典籍和临床经典方剂,或由传统汤剂衍化或化裁而来。除少数中成药是采用传统提取制备加工工艺生产,大多数中成药制剂的提取工艺中,多为根据组方药味的传统功效、药理活性及所含活性物质的理化性质,采用多种工艺、多条工艺路线复合制备而成,形成了水提浸膏部分、提取物部位或饮片原粉等复合的功效药用物质。应根据所选对照药的功能主治和临床适应证与处方中所含药味的药效物质基础的关联性进行分析,借鉴已有传统人用经验、现代药理学和提取工艺文献数据,综合分析工艺路线的科学性和合理性。对于存在工艺设计缺陷或不符合当前绿色生产要求的工艺应鼓励修正和优化。为了提升与已上市品种的临床有效性和安全性,有必要开展工艺路线的筛选对比研究,从化学和生物学指标角度进行对比研究。针对药效物质基础的性质特点,选择和优化提取工艺路线和工艺参数。化学指标表征方面通过鉴别、浸出物、含量测定、指纹图谱等,全面表征和反映与已上市对照药化学质量属性,依据统计学方法判断二者的差异性;同时根据核心药理模型和评价指标,建立证候模型及代谢组学等综合评价体系对比分析不同工艺路线的药效作用强度及安全性差异,在此基础上,依据制剂产品的临床适应证、依从性、生产可行性、质量均一性及稳定性等要素,通过对饮片规格大小、加水量、提取时间、蒸汽压力、提取温度、提取次数等进行系统研究和控制,确立科学合理的工艺路线及工艺参数,明确其关键工艺及参数。
6.4 制剂成型研究
中药口服固体制剂是中药临床用药的主要制剂形式,主要包括颗粒剂、片剂、胶囊剂、粉散剂及丸剂等,中药制剂成型工艺对药效成分的溶出、吸收转运及药物制剂稳定性具有重要影响[47-48]。系统开展物料溶解特性、吸湿性、流动性、稳定性、可压性处方前研究,在此基础上依据已上市药物的辅料组成及其配比开展制剂成型工艺研究,通过处方筛选和优化,明确制剂辅料的种类、型号、规格和用量。并通过过程控制技术结合空间设计方法研究设备类型、工艺参数、关键质量属性间的相关性,辨识关键工艺参数,提升药品批间、批内的均一稳定。根据剂型类型和特点,选择硬度、脆碎度、剂量均一性等相关制剂指标评价与上市参比制剂的差异性。口服固体制剂建议开展体外溶出曲线比对研究,中药成分复杂,可以选择代表性单一成分、多个成分或指纹图谱体外溶出曲线方法进行对比分析,判断制剂的优劣性。借鉴化学药品生物药剂学分类系统(biopharmaceutics classification system,BCS)的分类方法,依据标示性活性成分溶解性、渗透性、pKa常数等理化性质,针对组方中药效物质基础的标示性成分进行BCS分类,并通过溶出装置、溶出介质、搅拌速率和取样时间点等溶出条件的优化研究,确定适宜的溶出评价体系,进而考察和比较固体制剂间的溶出行为差异性,为制剂的优劣性分析提供参考。
7 基于质量标志物(quality marker,Q-Marker)的质量标准提升研究
中成药质量标准是中医临床用药的安全保障,其质控要素的选择及质控水平的限定与中药有效性、安全性密切相关[49]。由于历史原因,已上市的许多中成药包括中药大品种的质量控制标准水平比较粗泛、仍然不完善,多数采用化学药的质控模式,以单一成分的含量高低来评价中药质量,这种方法难以满足中成药复方制剂中活性成分复杂性及多样性的要求,缺乏与中药临床的有效性和安全性关联。近年来,国家及地方政府、企业对中药质量标准的提升尤为重视,从依据简单指标成分质量控制模式向整体质量、动态控制及中药生产的全过程生产监控发展[50-51],建立以化学标志物检测为核心的中药质量检验控制体系,但由于中药药效物质基础研究薄弱,质量控制指标专属性差,与中药临床的有效性关联性不强等瓶颈问题依然存在。
针对我国中药质量控制水平的现状,刘昌孝院士[23]提出了中药Q-Marker的新概念[52-53],引起了国内外中医药专家的重视,着眼于实现中药内在质量一致性、质量可追溯性和可溯源性,基于中药Q-Marker五要素“有效、特有、传递与溯源、可测和处方配伍”的特性,深入挖掘和研究已上市药物的Q-Marker,通过多层次表征、多角度生物活性评价技术和手段,分析和评价工艺过程及其工艺参数的可重现性、质控指标与有效性、安全性的关联性,使Q-Marker贯穿中药及其制剂开发的全过程,形成质量和风险控制的“药材-饮片-成药”全过程质量追溯系统[54-55]。基于中医药理论的“性-效-物”技术体系,以中药Q-Marker为抓手的生产过程控制和成品控制策略,如疏风解毒胶囊、元胡止痛滴丸及痹祺胶囊的质量标准的制定[56-58]。结合现代整体生物功效评价、谱-效相关分析技术、方证代谢组学、效-毒研究方法、超分子结构中药、药动学及网络药理学等新技术、新方法,按照深入浅出的质量标准要求,建立点-线-面-体多维、多元质量控制方法,应用数理统计、化学信息学方法构建既反映与有效性、安全性的关联性,同时又表征中药成分的专属性和差异性特征的质量控制模式(图4),全面评价和控制中药整体质量,为中药复方制剂多成分、多靶标的质量控制体系提供新的科学依据,有效突破质量研究及产业化应用的技术瓶颈,切实提升同名同方药物的质量控制水平[59-60]。
8 结语与展望
8.1 已上市药物是中药创新研究的源泉和宝库
截至目前,中国批准上市的中成药共有9000多种,为中华民族的生命健康做出了不可磨灭的贡献。已上市中成药既是临床用药的基础,更是中药创新发展的源泉。临床认可度高、市场应用广泛、疗效确切、具有明显特色与优势的中成药将是未来传承创新的重点。由于各种原因,中成药的制备工艺、质量标准、给药途径、给药剂量及临床用药定位等存在一定的“先天不足,后天失养”。应重视并深入挖掘临床用药经验和现代研究文献报道,守正创新,促进中医药传承创新发展。国家出台了系列促进中药传承创新发展的法规和意见,如《中医药法》《中共中央国务院关于促进中医药传承创新发展的意见》《国家药监局关于促进中药传承创新发展的实施意见》及各级地方政府出台了相应的落实支持措施,鼓励和支持应用新技术和新方法改进和提升已上市中药品种,满足尚未满足的临床需求,同时也支持同名同方药的研制,促进已上市中药同品种的质量竞争,更好地发挥临床应用价值和优势特点。围绕药品质量、适应证、机制、临床用药及工艺等存在问题进行深入研究,研究中药制备工艺-药理活性-临床病证-质量控制多层次整合作用,积累和整理健康调查、电子病历、病例审查或不良事件报告等真实世界数据,进一步聚焦品种的优势病种和适应证,构建中医药理论、人用经验和临床研究相结合的证据体系。采用现代分析技术和生物评价方法阐释中药成药临床疗效产生的功效物质,揭示中药的作用机制和调控的分子生物通路,寻找和认识药物的科学内涵及其价值,优化制剂工艺、明确临床定位、改良给药途径及创新药物组方及其新制剂研究。
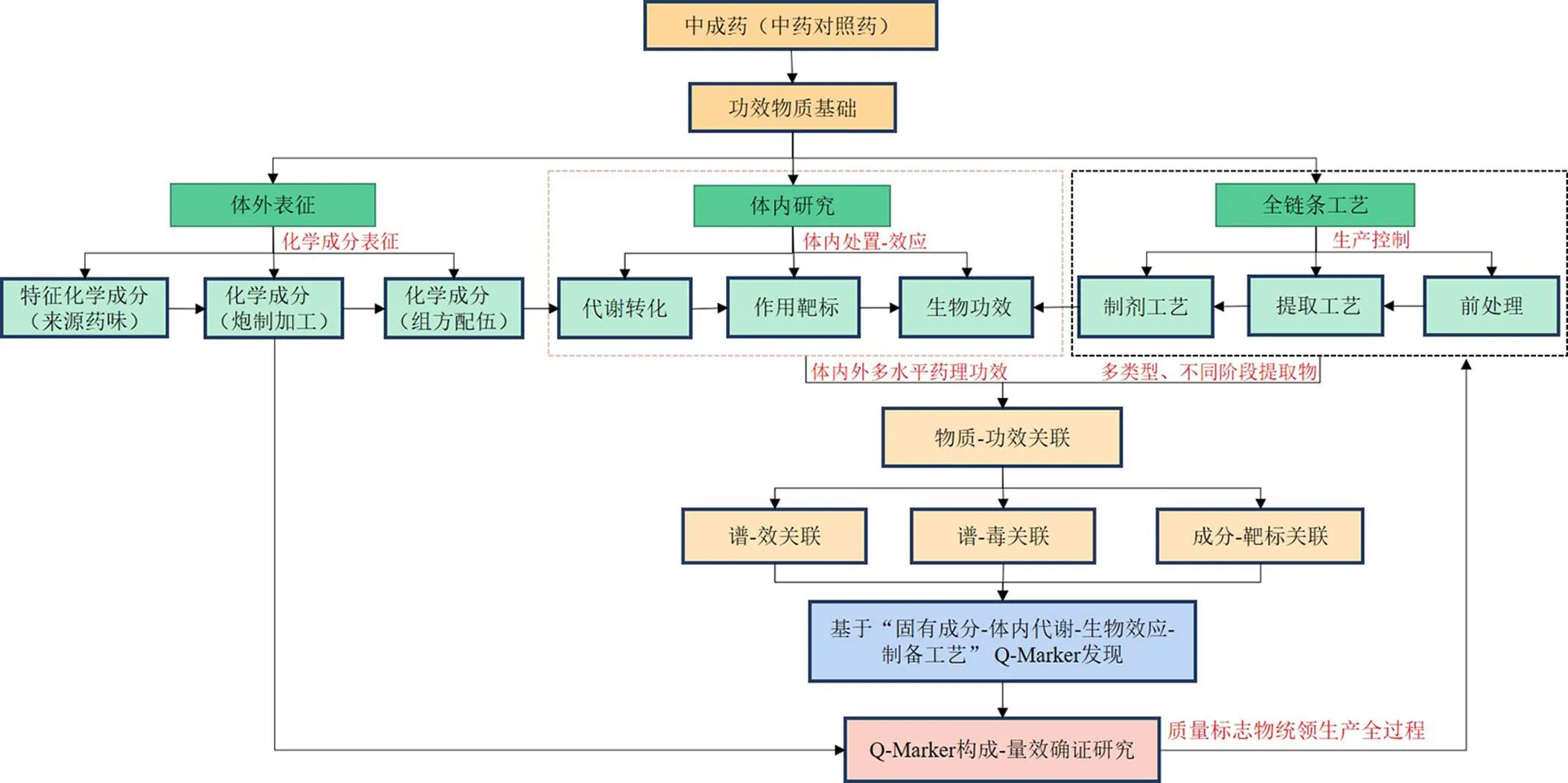
图4 基于Q-Marker的全链条工艺研究与质控体系构建
8.2 同名同方药的对照药选择标准和目录建设有待加强
已上市品种的临床安全性、有效性评价数据的完整性和科学性是限制同名同方药研究与推广的证结所在,对照药的遴选依据和标准仍未形成行业共识,同时相关参比制剂目录也未见公布。我国未能像欧美国家建立药物橙皮书数据库,已上市药品药学评价、药理毒理、临床试验数据等相关信息资料获取路径不够通畅,即使是《中国药典》收录的中成药品种制备工艺参数及制剂处方组成、辅料用量等信息也不完整,质量控制指标和方法难以有效表征和控制产品质量的优劣,如障翳散由丹参、红花、木通、人工麝香等25味中药组成,采用水煎煮2次,每次1.5 h,但却未对加水量进行限定,质量标准对丹参、牛磺胆酸、冰片、大黄素、大黄酚进行鉴定,采用高效液相色谱法和气相色谱法分别对维生素B2、人工麝香进行了含量测定,而对制剂中黄芪、木通、茺蔚子、海螵蛸等19味药味未进行质量控制,难以全面保障产品质量。而由肿节风、三七、红曲等8味药材和吲哚美辛等组成的新癀片,其药典标准中制剂处方中药材用量及制法均未提及,类似的瘀血痹胶囊、新血宝胶囊、瘦祺胶囊等制剂处方均没有药材用量,此类品种的相关信息库建立有待政府相关部门研究并提升行业对信息获取的便捷性,提升企业自证对照参比制剂的积极性,基于中药对照制剂生产企业更多的政策支持,如定价范围、税收优惠及优选纳入医保目录等,同时及时更新和公布对照参比制剂目录,切实提高同名同方药物开发的可及性。
8.3 加快“固有化学成分-体内代谢-生物效应”功效物质成分群解析,促进传统中成药方剂的现代化
“物质-功效”关联性是中药及同名同方药临床用药的核心和基础,功效物质和作用机制研究一直是研究者和企业界的研究热点和难点[13,61],从药效或药理毒理及其机制角度开展研究,缺乏理想的病或证的病理模型和证候模型,不能对中药性味归经理论研究实现实质性突破,难以系统揭示中药功效的物质基础与配伍原理。采用高效液相色谱质谱联用、气相色谱质谱联用等现代综合分析技术对中成药整方进行全成分分析和表征,从饮片、中间体、成品、血液、组织、靶细胞等角度体内外结合的方式辨识整体化学指纹的差异,寻找和确定中成药性效功用物质成分群,进而建立中成药组方性味归经的客观物质表征,同时建立相关的证候模型优化临床评价体系,从整体动物、组织器官、细胞受体等多个层次的生物效应表达研究功效性能,通过系统生物学、网络药理学、化学信息学等技术和方法加以关联和确证,揭示中药高品质内涵及优质中成药科学本质,为中药功效物质基础及影响中药疗效的关键要素辨识提供切实可行的路径,通过成药中“固有化学成分-体内代谢-生物效应”解析和关联,明确中成药方剂的功效物质群组成及其配比,优化制剂处方和工艺参数,为传统中药的临床功效、生产过程监控以及成品质量标准制定提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 张铁军, 许浚, 韩彦琪, 等. 中药大品种质量标准提升研究的思路与实践 [J]. 天津中医药, 2017, 34(1): 4-12.
[2] 孙昱, 徐敢, 汪祺. 中药二次开发的研究思路探讨 [J]. 中草药, 2021, 52(13): 4107-4113.
[3] 商洪才, 刘洋, 张俊华, 等. 名优中药品种二次开发临床定位的关键问题 [J]. 中国中西医结合杂志, 2008, 28(10): 939-940.
[4] 蒋宁, 杜保民, 杜冠华, 等. 新思路·新技术: 中药复方新药研发相关重大科学和技术问题 [J]. 中国药理学与毒理学杂志, 2020, 34(4): 241-260.
[5] 肖美凤. 金(山) 银花清热解毒“异质等效”超分子客体特征研究 [D]. 长沙: 湖南中医药大学, 2019.
[6] 徐小蓉, 张婷, 李潘, 等. 以质量一致性为导向的中药混批勾兑技术研究概况与展望 [J]. 中国中药杂志, 2019, 44(22): 4786-4792.
[7] 张凡, 杨婷, 兰丽丽, 等. 中药一致性评价关键技术: 中药溶出-系统指纹定量法评价溶出曲线相似性 [J]. 中南药学, 2021, 19(11): 2245-2252.
[8] 张双虎, 黄辛. 张卫东: 守正创新做中国的原创新药 [N]. 中国科学报, 2022-08-08(3).
[9] 陶兴宝, 黄银秋, 洪兵, 等. 中药品质一致性评价探索 [J]. 世界科学技术—中医药现代化, 2017, 19(11): 1781-1786.
[10] 陈凯先, 张卫东. 中药现代化与中药创新 [J]. 中国食品药品监管, 2022(8): 4-13.
[11] 张伯礼. 重视中成药科学定价促进产业健康发展 [J]. 中国食品药品监管, 2012(3): 18-19.
[12] 守传, 马君. 从中药升降浮沉药性探讨新冠肺炎“三药”[J]. 亚太传统医药, 2022, 18(10): 225-228.
[13] Song X Y, Li Y D, Shi Y P,. Quality control of traditional Chinese medicines: A review [J]., 2013, 11(6): 596-607.
[14] 张萌, 封亮, 贾晓斌. 基于生物活性与效应基准的中药质量评价技术发展现状与展望 [J]. 世界中医药, 2020, 15(15): 2234-2239.
[15] Zhang H B, Zhang Y, Zhang T J,. Research progress on quality markers of traditional Chinese medicine [J]., 2022, 211: 114588.
[16] Liu C X, Liu L, Guo D A. Quality marker of TCMs: Concept and applications [J]., 2018, 44: 85-86.
[17] Zhao J, Ma S C, Li S P. Advanced strategies for quality control of Chinese medicines [J]., 2018, 147: 473-478.
[18] 李佳珊, 徐盼瑜, 杜寒倩, 等. 基于数据挖掘的具有雄激素样作用中药的规律分析 [J]. 中草药, 2022, 53(18): 5786-5798.
[19] 薛静, 瞿晶田, 韩真真, 等. 基于数据挖掘和网络药理学的中药治疗室性早搏用药规律分析 [J]. 天津中医药, 2022, 39(9): 1197-1204.
[20] 田琴, 杨正春. 中药外治糖尿病周围神经病变的数据挖掘分析 [J]. 光明中医, 2022, 37(15): 2702-2705.
[21] 蔡友德, 何前松, 胡斐然, 等. 基于数据挖掘探讨中药治疗后循环缺血性眩晕的用药规律 [J]. 天津中医药大学学报, 2022, 41(3): 327-331.
[22] 张道平, 姚昆鹏, 李峥嵘, 等. 基于数据挖掘及网络药理学探讨中药复方汤剂治疗乙型肝炎的组方规律及分子机制分析 [J]. 中西医结合肝病杂志, 2022, 32(5): 426-431.
[23] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[24] 封亮, 张明华, 顾俊菲, 等. 中药物质基础“组分结构”理论的创新与实践 [J]. 中国中药杂志, 2013, 38(21): 3603-3607.
[25] 任建勋, 郭浩, 李磊, 等. 以功效为基础的中药复方毒性研究思路与方法探索 [J]. 中国实验方剂学杂志, 2017, 23(4): 203-207.
[26] 施繁莉, 吕慧侠, 张振海. 中药药效物质基础的相对动态性研究进展 [J]. 药学进展, 2021, 45(11): 855-861.
[27] 张燕玲, 乔延江. 基于中药有效成分族信息辨识技术的中药物质基础 [J]. 中国科学: 生命科学, 2016, 46(8): 1023-1028.
[28] Zhou S K, Zhang Y, Ju Y H,. Comparison of content-toxicity-activity of six ingenane-type diterpenoids betweenbefore and after stir-fried with vinegar by using UFLC-MS/MS, zebrafish embryos and HT-29 cells [J]., 2021, 195: 113828.
[29] Shu X, Jiang X W, Cheng B C Y,. Ultra-performance liquid chromatography-quadrupole/time-of-flight mass spectrometry analysis of the impact of processing on toxic components of[J]., 2016, 16(1): 1-8.
[30] Qu C, Wang L Y, Lin H,. Hierarchical identification of bioactive components in a medicinal herb by preparative high-performance liquid chromatography and selective knock-out strategy [J]., 2017, 135: 206-216.
[31] Liao M L, Shang H H, Li Y Z,. An integrated approach to uncover quality marker underlying the effects ofon lipid metabolism, using chemical analysis and network pharmacology [J]., 2018, 45: 93-104.
[32] El-Banna A A, Darwish R S, Ghareeb D A,. Metabolic profiling ofL. using UPLC- MS/MS and revealing its inflammation-related targets using network pharmacology-based and molecular docking analyses [J]., 2022, 12: 14828.
[33] Teymouri M, Alizadeh A. Chemical composition and antimicrobial activity of the essential oil ofJamzad growing wild and cultivated in Iran [J]., 2018, 32(11): 1320-1323.
[34] 胡雁萍, 赵迪, 李焕茹, 等. UPLC-Q-Exactive Orbitrap高分辨质谱定量分析不同产地、炮制前后女贞子中9种成分的含量 [J]. 天然产物研究与开发, 2021, 33(8): 1308-1319.
[35] 陈艳琰, 唐于平, 陈嘉倩, 等. 大黄资源化学研究进展与利用策略 [J]. 中草药, 2018, 49(21): 5170-5178.
[36] 严辉, 谢舒平, 濮宗进, 等. 基于UPLC-PDA指纹图谱及多成分含量的化学模式识别法评价大黄质量 [J]. 中草药, 2020, 51(18): 4755-4762.
[37] 崔占虎, 龙平, 王颖莉, 等. DNA分子标记技术在中成药鉴定中的应用与展望 [J]. 中药材, 2015, 38(1): 188-192.
[38] 黄璐琦, 蒋超, 袁媛. 中药材的分子鉴定研究: 现场、快速分子鉴别金银花 [A] // 第七届中国生物产业大会· 2013基因组学与创新型药物研制高峰论坛论文集 [C]. 昆明: 中国高科技产业化研究会, 2013: 3.
[39] 王雨青, 刘金凤, 于佳禾, 等. 2020年版《中国药典》中收载的多基原中药材鉴别的研究现状、问题及对策 [J]. 华西药学杂志, 2021, 36(2): 214-222.
[40] Dong Y T, Pei F, Su A X,. Multiple fingerprint and fingerprint-activity relationship for quality assessment of polysaccharides from[J]., 2020, 135: 110944.
[41] 薛蓉, 宫静雯, 屈凌芸, 等. 毒性中药饮片炮制研究进展与探讨 [J]. 世界中医药, 2022, 17(9): 1193-1201.
[42] 姜楠. 中药炮制对中药饮片疗效的影响研究 [J]. 中国医药指南, 2021, 19(12): 134-135.
[43] 李梦琪, 罗林, 尚宁宁, 等. 从文化传承到产业现代化的矛盾与对策探究中药炮制现状 [J]. 中成药, 2020, 42(11): 2999-3003.
[44] 李筱玲, 邓寒霜, 石志辉, 等. 陕产丹参产地加工与饮片炮制一体化技术研究 [J]. 亚太传统医药, 2022, 18(9): 57-62.
[45] 董玲, 孙裕, 裴纹萱, 等. 基于全程质量控制理念的中药标准化体系研究思路探讨 [J]. 中国中药杂志, 2017, 42(23): 4481-4487.
[46] Zhang C, Zheng X, Ni H,. Discovery of quality control markers from traditional Chinese medicines by fingerprint-efficacy modeling: Current status and future perspectives [J]., 2018, 159: 296-304.
[47] 李能进, 冯亚茹, 王若宁, 等. 儿童中药制剂常用剂型及共性技术应用研究现状及思考 [J]. 南京中医药大学学报, 2022, 38(9): 780-789.
[48] 白政忠, 刘利群, 张丁丁, 等. 中成药口服固体制剂的系统分类与溶出度方法建立浅析 [J]. 中国药品标准, 2015, 16(3): 163-166.
[49] 阳长明, 杨平, 刘乐环, 等. 中药质量标志物(Q-Marker) 研究进展及对中药质量研究的思考 [J]. 中草药, 2021, 52(9): 2519-2526.
[50] Feng G, Chen Y L, Li W,. Exploring the Q-marker of “sweat soaking method” processed: Based on the “effect-toxicity-chemicals” study [J]., 2018, 45: 49-58.
[51] Chen A Z, Sun L, Yuan H,. A holistic strategy for quality and safety control of traditional Chinese medicines by the “iVarious” standard system [J]., 2017, 7(5): 271-279.
[52] Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[53] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[54] 何盼, 李震宇, 刘月涛, 等. 基于中药质量标志物的多效药材商品规格等级标准研究思考 [J]. 中草药, 2022, 53(6): 1868-1874.
[55] 刘昌孝. 中药质量标志物 (Q-Marker) 研究发展的5年回顾 [J]. 中草药, 2021, 52(9): 2511-2518.
[56] 董亚楠. 基于“性-效-物三元论”及“谱-效关联分析”的疏风解毒胶囊药效物质基础研究 [D]. 天津: 天津医科大学, 2018.
[57] 张铁军, 许浚, 申秀萍, 等. 基于中药质量标志物(Q-Marker) 的元胡止痛滴丸的“性-效-物”三元关系和作用机制研究 [J]. 中草药, 2016, 47(13): 2199-2211.
[58] 刘建庭, 仉瑜, 卜睿臻, 等. 基于UPLC-Q/TOF-MS的痹祺胶囊化学物质组及入血成分的研究 [J]. 中草药, 2021, 52(18): 5496-5513.
[59] Duan S N, Niu L, Yin T J,. A novel strategy for screening bioavailable quality markers of traditional Chinese medicine by integrating intestinal absorption and network pharmacology: Application to Wu Ji Bai Feng Pill [J]., 2020, 76: 153226.
[60] Chen L, Huang X B, Wang H,. Integrated metabolomics and network pharmacology strategy for ascertaining the quality marker of flavonoids for[J]., 2020, 186: 113297.
[61] 杨宁娟, 刘妍如, 唐志书, 等. 基于“质量标志物-生物活性”关联分析评价丹参的等级 [J]. 中草药, 2021, 52(4): 1135-1142.
Consideration and innovative research on basis of chemical substance based on same prescription and name of traditional Chinese medicine
SHANG Hai-hua1, 2, LIAO Mao-liang2, 3, ZHENG Ya-nan3, XU Fei-fei1, HOU Wen-bin1
1. Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine,Institute of Radiation Medicine, Peking Union Medical College & Chinese Academy of Medical Sciences, Tianjin 300192, China 2. College of Biotechnology and Pharmaceutical Engineering, West Anhui University, Lu’an 237012, China 3. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China
In recent years, the lack of motivation for the creation of new traditional Chinese medicine (TCM) seriously hinders the development of the industry. By combing the registration classification and evaluation requirements of TCM of the same name and prescription, this paper analyzes and considers the scientific connotation of registration of listed TCM, and puts forward the research idea of taking the clinical value as the orientation and the correlation research between chemical substance basis and clinical efficacy as the main line. On the basis of revealing the differences of “chemical material basis” related to clinical efficacy and drug quality in listed TCM, an analytical research model of “inherent chemical composition-metabolism-biological effect” was established to characterize the connotation of high-quality and excellent-effect TCM. Quality markers were used to guide and improve the development of TCM of the same name and prescription, so as to promote the inheritance and innovation of listed TCM.
traditional Chinese medicine; traditional Chinese medicine of the same name and prescription; material basis; quality markers; new drug creation
R286
A
0253 - 2670(2023)16 - 5410 - 11
10.7501/j.issn.0253-2670.2023.16.030
2023-03-19
国家重大新药创制计划课题(2017ZX09101002-001);安徽省中药资源保护与持续利用工程实验室开放课题(TCMRPSU-2022-01);皖西学院高层次人才科研启动基金(WGKQ2022074);中国医学科学院医学与健康科技创新工程重大协同创新项目资助(2021-I2M-1-042);中央高校基本科研业务费专项资金资助项目(3332022063)
尚海花(1981—),女,博士研究生,从事中药代谢研究与评价。Tel: 13752514713 E-mail: shanghaihua2006@163.com
廖茂梁,研究员,从事中药新药、药用资源与质量控制研究。Tel: 13072008557 E-mail: liaomaoliang@163.com
侯文彬,研究员,从事中药新药开发研究。Tel: (022)85683040 E-mail: houwenbin@irm-cams.ac.cn
[责任编辑 赵慧亮]

