越橘花青素脂质体对Caco-2 细胞的抗氧化作用
陈玉洁,关荣发,黄海智,钟 浩,孙玉敬,张 维
(1 中国计量大学生命科学学院 杭州 310018 2 浙江工业大学食品科学与工程学院 杭州 310014)
正常生理条件下,体内的自由基维持在正常生理范围内,然而,外界因素的刺激会导致机体内氧化与抗氧化反应不均衡,当体内产生过量自由基时,会损害细胞和组织[1-2],造成细胞内脂质、代谢酶类及功能蛋白等物质活性的丧失[3],炎性细胞浸润,产生炎症[4]。肠上皮细胞因氧化应激而产生的氧化损伤,会引起肠道屏障功能丧失[5]。自由基使机体的性能下降,增加各种疾病的发病率,包括癌症、心血管疾病和神经系统疾病,被认为是导致机体衰老的一个重要因素[6]。安全有效的天然抗氧化剂受到越来越多的关注。
花青素是一种天然的水溶性类黄酮化合物,在许多植物的根以及谷物中广泛存在[7-8]。花青素具有清除自由基、抗氧化、抗炎症、抗肿瘤及预防心血管疾病等多种生物活性[9-12]。然而,花青素存在稳定性较低,易降解的问题,容易受到如温度、酶光等外界因素的影响而发生降解[13-16],其应用受限制。研究表明[17-18],脂质体在改善包装材料的生物稳定性、吸收和生物利用度方面比传统配方有优势。脂质体是一种人工磷脂双层膜,具有类似细胞膜的结构,携带疏水和亲水化合物,作为物理化学屏障,增加亲脂化合物在水中的溶解度[19-22]。利用脂质体作为载体,可以提高包材的溶出率和靶向性,提高脂质体的缓释效果,有效延缓包材的释放。
本试验以脂质体作为载体制备越橘花青素脂质体,用过氧化氢处理人结肠癌上皮细胞Caco-2细胞,制备细胞氧化损伤模型,研究越橘花青素脂质体对细胞氧化损伤的保护作用。
1 材料与方法
1.1 材料与试剂
越橘花青素(≥25%),陕西清雅生物科技有限公司;人结直肠腺癌细胞Caco-2、MEM 培养基、庆大霉素-两性霉素B 混合溶液,上海启达生物科技有限公司;卵磷脂、胆固醇、DMSO、胰蛋白酶、磷酸盐缓冲溶液PBS、试剂盒,北京索莱宝科技有限公司;胎牛血清,上海双洳生物科技有限公司;其它试剂为分析纯级。
1.2 仪器与设备
UV-1200 紫外分光光度计,上海美普达仪器有限公司;RV10 旋转蒸发仪,德国IKA 公司;GENIOS-BASIC 型CO2培养箱,美国赛默飞世尔科技公司;Nano-ZS90 马尔文粒径仪,英国Malvern公司;JEM-2100 透射电子显微镜,日本株式会社;TC20 全自动细胞计数仪,美国Bio-Rad 公司;i-Mark 酶标仪,美国Bio-Rad 公司;TS100 倒置生物显微镜,日本Nikon 尼康公司;930N 荧光分光光度计,上海仪电有限公司;Allegra X-30R 冷冻离心机,美国贝克曼库尔特有限公司;YXQ-SG46-280S 蒸汽压力灭菌锅,上海博讯实业有限公司;SW-CJ-1C 型双人单面净化工作台,苏州净化设备有限公司。
1.3 方法
1.3.1 越橘花青素脂质体的制备 越橘花青素脂质体的制备采用薄膜分散法,称取药脂比1∶11,胆脂比1∶5 的花青素、大豆卵磷脂和胆固醇溶于10 mL 无水乙醇中,并置超声仪中超声20 min,使其完全溶解形成混合物。将混合物旋转蒸发除去有机溶剂,当梨形瓶的瓶底形成均匀的脂质薄膜后,加入预热的PBS 洗脱脂质薄膜,冰水浴超声20 min,获得脂质体悬浊液。分别用0.45 μm 和0.22 μm 的滤膜过滤脂质体悬浊液,置于冰箱4℃保存。
1.3.2 脂质体的微观表征 采用透射电子显微镜观察越橘花青素脂质体的形态,激光马尔文粒径仪测定其粒径分布。取1 mL 脂质体并加PBS 稀释10 倍后,用移液枪吸取1 滴于透射电镜样品专用铜网(直径3 mm,200 目)上,加入1 滴2%乙酰双氧铀溶液进行负染色,在室温放置5 min,干燥后用透射电子显微镜观察。
1.3.3 脂质体储藏稳定性评价 将制备的越橘花青素脂质体于4 ℃条件下保存,在一定的时间(21 d)内测量其粒径和pH 值的变化,分别用马尔文粒径仪和pH 计测定。
1.3.4 细胞培养 人结肠癌细胞Caco-2 细胞常规培养于含有20%胎牛血清、1%双抗的MEM 培养基中,置37 ℃、5% CO2(相对湿度90%)的培养箱中培养,1~2 d 更换1 次培养液,待细胞密度80%时,用含有0.25%胰蛋白酶消化细胞。取对数生长期的细胞做试验。
1.3.5 细胞的毒性试验 研究越橘花青素及其脂质体对细胞的抗氧化作用,需了解其作用于Caco-2 细胞的安全浓度范围,在此范围进行后续试验[23]。将对数生长期的Caco-2 细胞按照1.0×105cells/mL 的密度接种到96 孔板中培养,每孔加入100 μL 细胞悬液,在37 ℃、5%二氧化碳恒温培养箱中培养24 h,试验组中加入10 μL 不同浓度的样品,将样品稀释,最终质量浓度分别为20,50,100,150,200 μg/mL,每组设6 个平行孔,同时设置空白组和对照组。共培养12 h 后,每孔加入10 μL 的CCK-8 溶液,继续培养1~4 h,用酶标仪测光吸收值A490nm。
1.3.6 越橘花青素脂质体对氧化损伤Caco-2 细胞的保护作用 将对数生长期的Caco-2 细胞按照1.0×105cells/mL 的密度接种到96 孔板中培养,每孔加入100 μL 细胞悬液,于37 ℃、5%二氧化碳恒温培养箱中培养24 h。设置空白组、正常组、损伤组和保护组。以200 μmol/L H2O2刺激诱导12 h,保护组加入不同质量浓度(20,50,100,150,200 μg/mL)的越橘花青素脂质体,继续培养6 h 并进行后续试验[24]。
1.3.7 细胞内ROS 水平的测定 细胞内ROS 含量测定方法参照DCFH-DA 荧光探针法[23]。将对数期Caco-2 细胞以6×105cells/孔的密度接种于6 孔板,置于37 ℃、5%二氧化碳恒温培养箱中培养48 h。设置正常组、损伤组、保护组。以200 μmol/L H2O2刺激诱导12 h,保护组加入不同浓度(20,50,100,150,200 μg/mL)的花青素脂质体溶液,继续培养6 h。具体操作步骤根据试剂盒说明书,用荧光分光光度计检测各组细胞在激发波长485 nm,发射波长528 nm 处的荧光强度。
1.3.8 细胞内MDA 含量的测定 MDA 是脂质过氧化的产物,其含量可以反映体内脂质过氧化程度[25]。本试验采用丙二醛(MDA)检测试剂盒对Caco-2 细胞中MDA 含量进行测定。细胞按前述分组处理并培养,加入细胞裂解液,在冰上裂解细胞,获得样品。根据试剂盒方法操作,根据样品蛋白浓度计算MDA 含量。
1.3.9 细胞内总抗氧化能力(T-AOC)的测定 TAOC 可以反映机体抗氧化能力。采用总抗氧化能力检测试剂盒对Caco-2 细胞中T-AOC 的含量进行测定。细胞按前述分组处理并培养,收集细胞,加入预冷的提取液,匀浆或超声以充分破碎细胞并释放其中的抗氧化物。获得的样品在4 ℃,10 000 r/min 条件下离心5 min,取上清液,待测。据样品蛋白浓度计算T-AOC 含量。
1.3.10 细胞内抗氧化酶活性的测定 细胞按前述分组处理并进行培养后。收集细胞,离心后弃上清。加入提取液,超声破碎细胞,4 ℃,8 000×g 条件下离心10 min,取上清,置冰上,待测。根据SOD和CAT 试剂盒方法操作,据样品蛋白浓度计算各抗氧化酶含量。
1.4 数据处理与与分析
实验重复3 次,结果用均值(means)±标准偏差(SD)表示,采用GraphPad Prism 8.0 和SPSS 26.0 软件进行绘图和结果数据统计分析,P<0.05为具有统计差异。
2 结果与分析
2.1 脂质体的表征
脂质体的形态和粒径分析采用透射电镜和马尔文粒径分析仪。如图1a 所示,透射电镜结果显示脂质体呈球形分布,具有囊泡状结构。图1b 为脂质体的分布。所得脂质体的平均粒径为(213.2±13.4)nm,多分散性指数(PDI)为0.201±0.026。
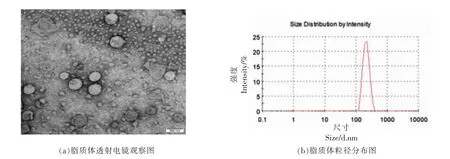
图1 花青素脂质体扫描电镜和粒径分布图Fig.1 The image and size distribution of anthocyanins liposomes
2.2 脂质体的稳定性
21 d 储存时间内花青素脂质体粒径和pH 值变化见图2。随着储存时间的延长,越橘花青素脂质体的粒径呈上升趋势。0~7 d 内粒径缓慢增加,基本在230 nm 左右,之后持续增加,稳定在320 nm 左右。随着储存时间的增加,脂质体会因氧化作用而聚集,从而导致其粒径变大[26]。脂质体的pH 值在0~15 d 处于相对稳定状态,15 d 后逐渐增大。所以,用于试验的脂质体每次均新鲜制备,以防止其特征及理化指标发生变化,减小试验误差。

图2 时间对脂质体粒径和pH 的影响Fig.2 Effect of time on the particle size and pH of liposomes
2.3 越橘花青素脂质体对Caco-2 细胞的毒性情况
根据CCK-8 法评估越橘花青素及其脂质体作用Caco-2 细胞12 h 后的细胞存活率,见图3。与对照组比,20~200 μg/mL 越橘花青素及其脂质体对Caco-2 细胞没有毒性作用,可在此范围做后续试验研究。
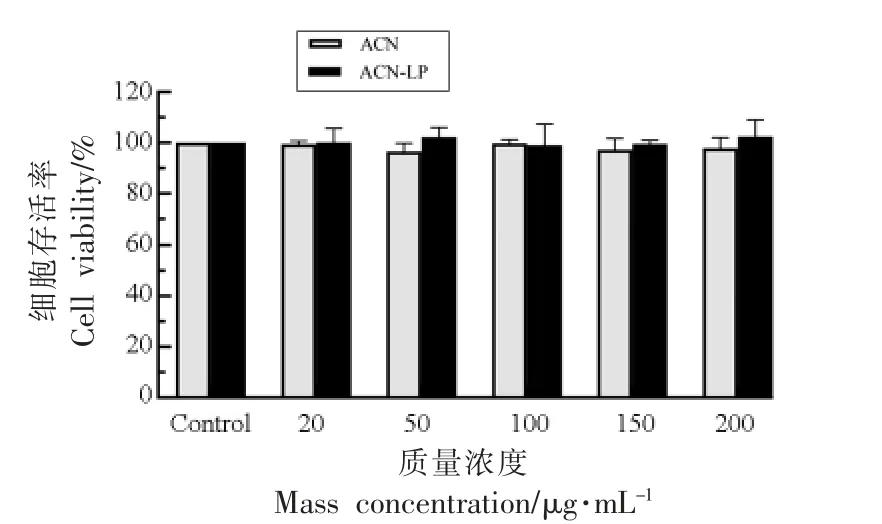
图3 花青素及其脂质体对Caco-2 细胞活性的影响Fig.3 Effects of anthocyanins and anthocyanins liposomes on the activity of Caco-2 cells
2.4 越橘花青素脂质体对细胞氧化应激的保护作用
不同浓度的越橘花青素及其脂质体对处于氧化应激状态下的细胞存活率的影响见图4。结果表明,损伤组的Caco-2 细胞经H2O2处理后生存率下降(P<0.05)。经不同浓度的越橘花青素脂质体处理的保护组,细胞生存率呈上升趋势。同时,越橘花青素脂质体对氧化损伤Caco-2 细胞的保护作用存在剂量效应关系(P<0.05)。当越橘花青素脂质体质量浓度为20 μg/mL 时,细胞存活率(57.34±3.86)%,当其质量浓度为200 μg/mL 时,细胞存活率最高(84.17±2.49)%,高于花青素组的(74.33±4.42)%。在选取范围内,越橘花青素脂质体浓度越高,对细胞的保护效果越好。
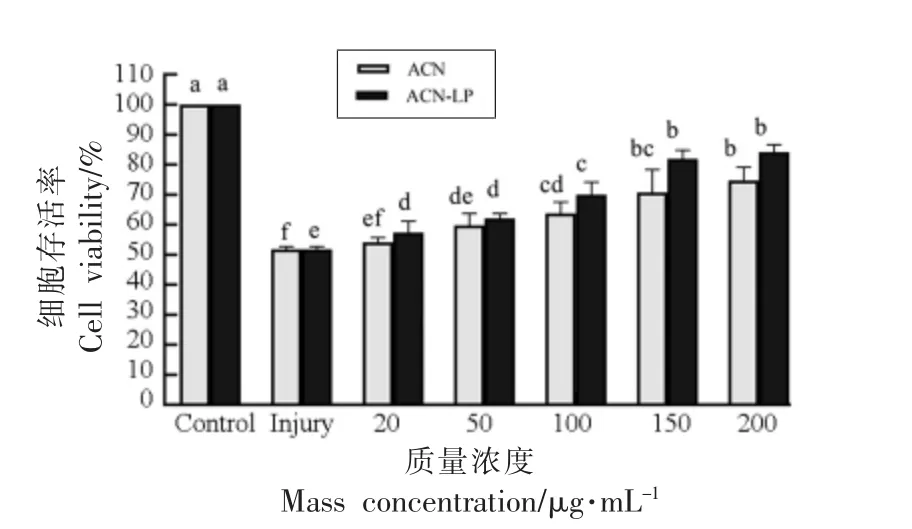
图4 花青素及其脂质体对H2O2 损伤下Caco-2细胞的保护作用Fig.4 Protective effect of anthocyanins and anthocyanins liposomes on Caco-2 cells under H2O2 injury
2.5 越橘花青素脂质体对氧化损伤Caco-2 细胞内ROS 水平的影响
ROS 的积累会对细胞造成不同程度的损伤[27]。采用DCFH-DA 荧光探针法检测细胞内ROS 水平的变化。DCFH-DA 进入细胞后,被细胞内的酯酶水解生成DCFH,而细胞内的活性氧可以氧化无荧光的DCFH 生成有荧光的DCF。检测DCF 的荧光强度便可知道细胞内的活性氧水平。如图5所示,与空白组相比,氧化损伤组的荧光强度增强(P<0.05),表明ROS 含量增加。经不同质量浓度花青素脂质体(20,50,100,150,200 μg/mL)处理的保护组,荧光强度逐渐减弱,在样品质量浓度达到100 μg/mL 后趋于平缓。结果显示,花青素脂质体可以降低氧化损伤的细胞内ROS 水平。
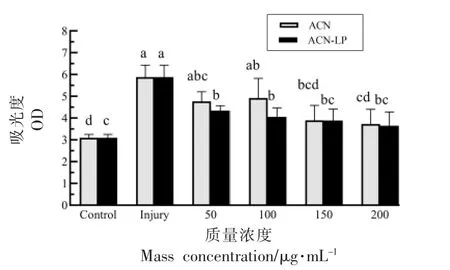
图5 花青素及其脂质体处理H2O2 损伤后各组DCFH-DA 相对荧光强度Fig.5 The relative fluorescence intensity of DCFH-DA in each group after the injury of H2O2 treated by anthocyanins and anthocyanins liposomes
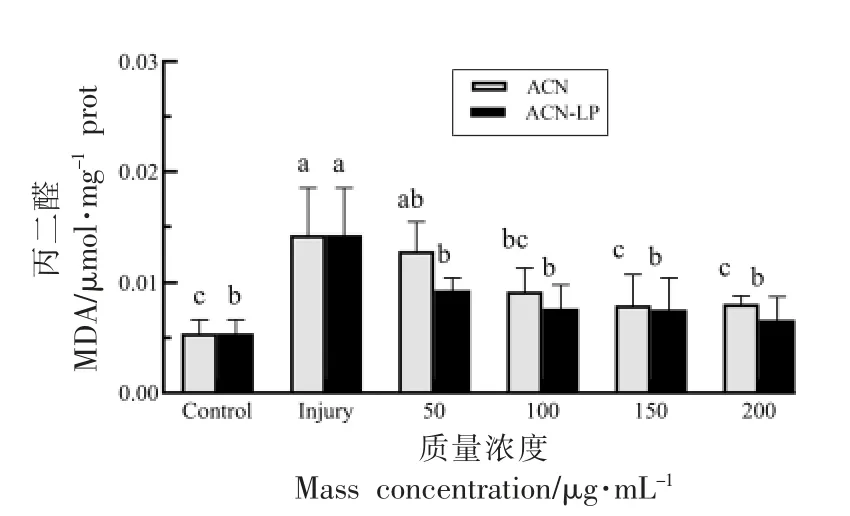
图6 花青素及其脂质体处理H2O2 损伤后各组MDA 含量Fig.6 The MDA content in each group after the injury of H2O2 treated by anthocyanins and anthocyanins liposomes
2.6 越橘花青素脂质体对氧化损伤Caco-2 细胞内MDA 含量的影响
MDA 是脂质过氧化的终产物,其含量可间接反映细胞受活性氧自由基攻击的程度[28]。经H2O2处理后,Caco-2 细胞中MDA 含量升高(P<0.05)。经不同质量浓度花青素脂质体(20,50,100,150,200 μg/mL)处理后,氧化损伤细胞内MDA 含量呈递减趋势。相对于损伤组,花青素和花青素脂质体在最大浓度组分别下降了43.44%,53.66%。结果显示,花青素脂质体可以降低氧化损伤的细胞内MDA 水平。
2.7 越橘花青素脂质体对氧化损伤Caco-2 细胞内T-AOC 含量的影响
总抗氧化能力测定结果见图7。经不同质量浓度花青素脂质体(20,50,100,150,200 μg/mL)处理后,相对于损伤组,处理组的抗氧化能力显著提高(P<0.05),200 μg/mL 组花青素和花青素脂质体分别提高了3.42,8.89 倍。以上结果显示,花青素脂质体可以降低氧化损伤Caco-2 细胞内自由基水平,抑制氧化应激所致细胞脂质过氧化反应,提高细胞总抗氧化能力。
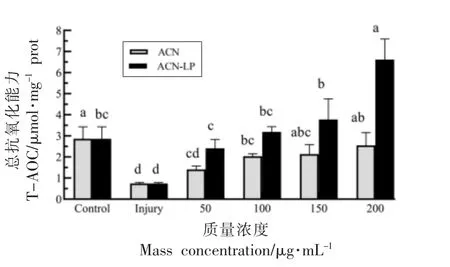
图7 花青素脂质体处理H2O2 损伤后各组T-AOC 含量Fig.7 The T-AOC content in each group after the injury of H2O2 treated by anthocyanins and anthocyanins liposomes
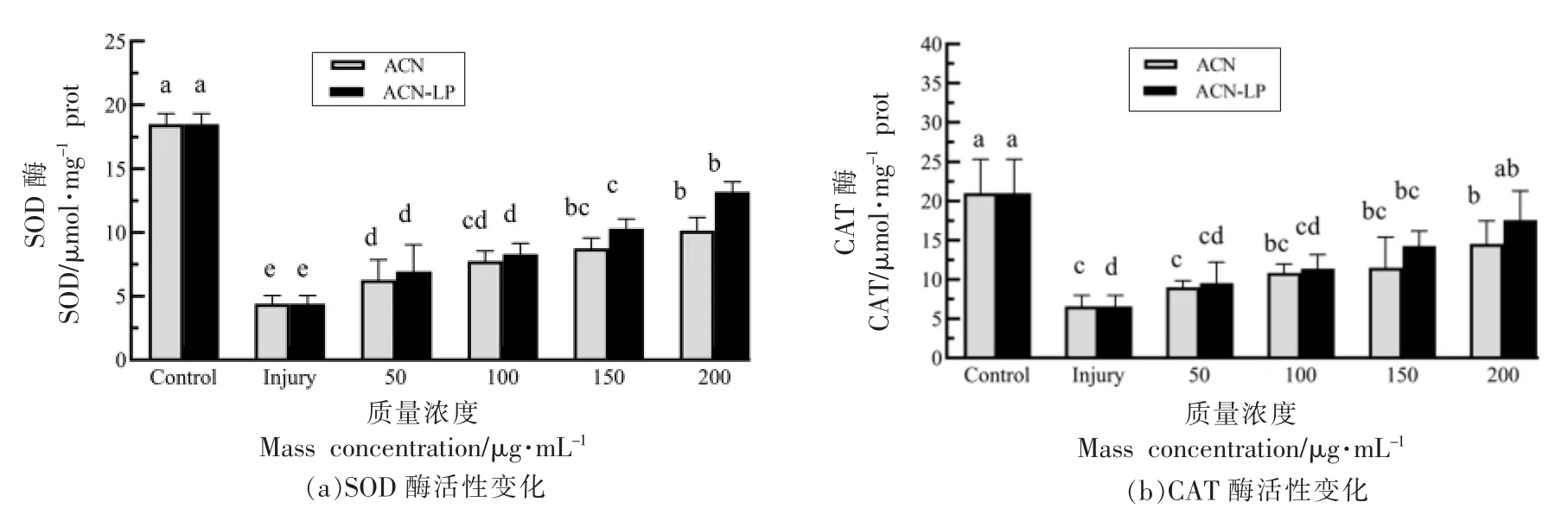
图8 花青素脂质体对H2O2 损伤后各组抗氧化酶活性影响Fig.8 The activity of antioxidant enzymes in each group after the injury of H2O2 treated by anthocyanins and anthocyanins liposomes
2.8 越橘花青素脂质体对氧化损伤Caco-2 细胞内抗氧化酶的影响
细胞内源性抗氧化酶是氧化应激过程中的重要角色[29-30]。经H2O2处理后,Caco-2 细胞中SOD和CAT 的酶活性显著降低(P<0.05)。经不同浓度紫菜薹乙醇提取物处理后,氧化损伤细胞内SOD和CAT 酶的活性增高。与损伤组比,200 μg/mL花青素与花青素脂质体组的SOD 酶活性分别提高了5.76%,8.79%;CAT 酶活性分别提高了9.21%,12.26%。花青素脂质体可以提高受损Caco-2 细胞内抗氧化酶的活力。
3 结论
花青素具有多种生物活性[31-32],然而,容易受到外界作用而发生降解。以脂质体作为载体,通过囊泡状脂质体的包封和运载,可以增加花青素的稳定性和生物利用度[33-34]。本研究以脂质体为载体制备越橘花青素脂质体,利用H2O2作用于Caco-2细胞,获得氧化损伤模型,研究越橘花青素脂质体对氧化应激损伤细胞的抗氧化作用。结果表明,越橘花青素经脂质体包裹后抗氧化活性有所提高,可显著提升受损细胞的生存率,抑制氧化损伤引发的细胞死亡。此外,越橘花青素经脂质体包裹后可进一步抑制氧化损伤细胞内ROS 和MDA 的生成,提高细胞中内源性抗氧化物酶系的活力和细胞总抗氧化能力,可以通过多种途径保护细胞[24,35]。本结果为提高花青素利用率提供试验依据。

