2种菌肥对濒危红树植物红榄李·海滨猫尾木促生研究
曾得华 洪文君 黄永平 孙令俊 赵怀宝 王炳宇

摘要 为更好地保护繁育濒危红树植物,选取海滨猫尾木和红榄李2种濒危红树植物幼苗,使用不同比例的2种菌肥进行培育,定期测量植株高度、基径、冠幅,最后取部分植株測定生物量。结果表明,菌肥显著促进了2种红树植物生长。海滨猫尾木Q1较CK高度提高24.4 cm,基径提高3.34 mm,冠幅提高620.03 cm2,地上生物量提高7.33 g。红榄李T1较CK高度提高8.22 cm,基径提高1.71 mm,冠幅提高129.92 cm2,地上生物量提高2.9 g。且树种、菌肥及两者交互作用对红树植物地上部分生长影响达显著水平(P<0.05)。菌肥对海滨猫尾木促生效果强于红榄李,其中千代田菌肥对海滨猫尾木促生效果好。
关键词 菌肥;红榄李;海滨猫尾木;双因素方差分析
中图分类号 S144 文献标识码 A 文章编号 0517-6611(2023)14-0147-04
doi:10.3969/j.issn.0517-6611.2023.14.036
作者简介 曾德华(1983—),男,海南三亚人,工程师,硕士,从事红树林生态研究。*通信作者,助理工程师,硕士,从事红树林生态研究。
红榄李(Lumnitzera littore)是使君子科榄李属真红树植物,属嗜热窄布种[ 1],目前国内仅自然分布于三亚市铁炉港,2020年被列为国家一级保护植物。海滨猫尾木(Dolichandrone spathacea)是紫葳科猫尾木属常绿乔木,分布于海南和广东两省[ 2],海滨猫尾木已被列入海南省重点保护野生植物名录(2006年)。调查发现海滨猫尾木和红榄李在野外幼苗存活率低,自然更新苗木稀少,种群数量下降趋势明显。濒危红树植物由于自身和环境等原因导致其种群无法扩展和更新[ 3-5]。因此濒危红树人工繁育成为保护其种群的关键。
植物根际促生菌(PGPR)是非致病有益的土壤根际细菌[ 6]。其常位于根际土壤中或附生于根表,与根联合出现的细菌异质群体,能直接或间接提高植物生长的程度或质量,促进植物对矿质营养的吸收和利用,产生促进植物生长的代谢物或生产植物激素、抑制有害微生物的细菌[ 7-11]。
国内关于根际促生菌在红树植物培育的研究较少。红树植物培育过程中使用促生菌等微生物制剂大都经过筛选[ 12],且都是对红树常见种的培育,应用于濒危红树种的报道较少[ 13]。笔者对濒危红树植物海滨猫尾木和红榄李设置不同菌肥梯度培育试验,探讨菌肥快速培育濒危红树植物。
1 材料与方法
1.1 材料
2021年4月选取生长近似的红榄李和海滨猫尾木幼苗,将其移栽入使用塘泥、海沙和椰糠按1∶1.3~3.0∶2.5~4.0的体积比混合而成的营养土内,同时施用2种青岛素丰生物技术有限公司生产的菌肥(千代田、土力根)。
1.2 方法
设置菌肥与营养土不同体积比处理组:千代田1∶5(Q1)、千代田1∶10(Q2)、千代田1∶15(Q3)、土力根1∶5(T1)、土力根1∶10(T2)、土力根1∶15(T3)、对照组(CK),每组45株,对照组只用营养土培育不施用任何菌肥。置于同一苗圃环境中每隔30 d对植株进行生长测量,共培育120 d。最后统一进行收割烘干测定生物量。
1.3 测定项目与方法
观察幼苗生长情况,每隔30 d进行株高、基径、冠幅等生长指标测量,试验结束后进行收割测定生物量。
1.4 数据分析
所有数据用平均值±标准差表示。试验数据用Excel软件进行处理,采用统计分析软件SPSS 22.0二因素方差分析法分析树种与菌肥的交互作用影响,单因素方差分析法分析相同树种内不同菌肥处理的影响,对定期测量的生长指标进行回归分析。
2 结果与分析
2.1 树种与菌肥对红树植物生长影响的双因素方差分析
株高、基径、冠幅、地上生物量、地下生物量、总生物量在树种因素上存在主效应(P<0.01)。株高、基径、冠幅、地上生物量在菌肥因素上存在主效应(P<0.01),同时在两因素上也存交互效应(P<0.05)(表1)。
2.2 净生长量
海滨猫尾木Q1组株高净生长量38.20 cm,CK组株高净生长量13.80 cm,株高净生长量提高24.4 cm。基径净生长量上Q1组比CK组提高了3.34 mm;冠幅净生长量Q1组比CK组提高了620.03 cm2(表2)。
红榄李T1组株高净生长量15.9 cm,CK组株高净生长量7.68 cm,株高净生长量提高8.22 cm。基径净生长量Q1组比CK组提高1.99 mm;冠幅净生长量T1组比CK组提高129.92 cm2(表2)。
净生长量海滨猫尾木高于红榄李。净生长量在树种上有差异。对比千代田和土力根2种菌肥在净生长量上的表现,发现总体上千代田菌肥效果优于土力根,且在海滨猫尾木上表现明显。净生长量在株高、基径、冠幅上的总体表现与双因素差异分析结果一致。
海滨猫尾木Q1组净生长量最高,同等处理下千代田净生长量大于土力根;且所有菌肥处理组净生长均显著高于CK组;菌肥处理组内随着菌肥添加量的减少净生长量也逐渐减少。红榄李中T1和Q1组净生长量最高,千代田总体净生长量高于土力根,且所有菌肥处理组净生长量均高于CK组,净生长量随着菌肥量减少而减少(表2)。
2.3 生物量
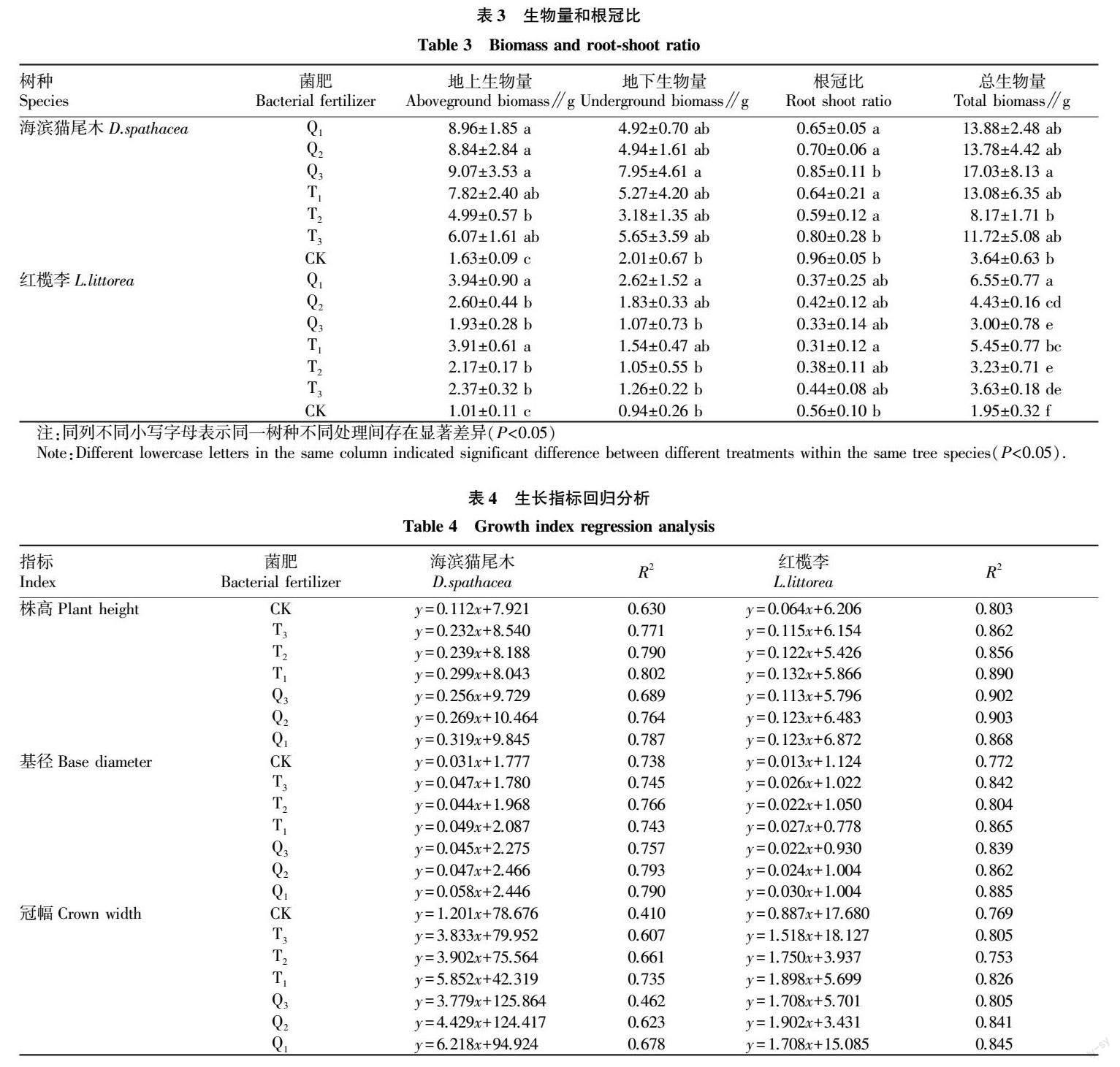
通过对比地上、地下生物量、根冠比、总生物量的表现,发现菌肥处理组生物量均大于对照组;海滨猫尾木所有菌肥处理组生物量均高于红榄李(表3)。菌肥和树种上表现出的结果与表1双因素分析相符。
海滨猫尾木在地上、地下和总生物量Q3组表现最好,分别较CK组提高了7.44、5.94、13.39 g。千代田菌肥处理组生物量随着菌肥用量的减少呈增加趨势;土力根菌肥处理组生物量随菌肥用量减少呈先减少后增加的趋势。2个菌肥处理组根冠比均随菌肥使用量的减少而增加(表3)。
红榄李在地上、地下和总生物量上Q1组表现最好,分别较CK组提高2.93、1.68、4.60 g。千代田菌肥处理组内生物量随菌肥使用量下降而下降。土力根菌肥处理组生物量总体随菌肥用量下降而下降,但T3组生物量稍高于T2组(表3)。
2.4 回归分析
对培养过程中定期测量的生长数据进行回归分析。海滨猫尾木的回归方程斜率和截距都大于红榄李,但R2都小于红榄李。菌肥处理组的斜率和R2都大于对照组。说明菌肥对2种植物生长有显著促进作用。海滨猫尾木在株高、基径上均表现为随菌肥使用量增加回归方程的斜率、截距和R2呈逐渐增大的趋势,且相同用量下千代田处理组回归方程斜率和截距大于土力根处理组。海滨猫尾木在冠幅的截距和斜率上表现刚好相反。总体上海滨猫尾木的R2都小于0.8,表明组内个体间差异较大。总体来看,千代田菌肥对海滨猫尾木生长促进效果最好,且使用量越大促生效果越好。
在红榄李试验组中菌肥处理组的斜率都大于对照组,截距大部分小于对照组;R2总体上菌肥组大于对照组,在0.753~0.903,相同处理下大于海滨猫尾木的R2,说明红榄李各处理组内个体差异较小。就斜率大小来看,千代田大比例使用组总体效果较好,但总体斜率相差不大。就回归分析结果来看,菌肥对红榄李生长有一定促进作用,但单纯使用一种菌肥各处理组间效果差异不明显,如果2种菌肥联用可能效果会更好(表4)。
3 讨论
红树植物生长的潮间带环境变化幅度大[ 14]。红树植物的生长大都依赖根际微生物[ 15-16]。PGPR是生活在植物根际的有益微生物,对植物生长起促进作用。研究表明,PGPB对秋茄、红海榄、桐花树、白骨壤、拉关木的苗高、地径、生物量有显著提高[ 17]。该研究结果与前人研究结果一致。
该试验结果发现PGPR菌肥对海滨猫尾木生长促进效果显著大于红榄李,推测可能由于海滨猫尾木是半红树植物,从生理上更接近陆生植物,因此更适应PGPR菌肥。其次该试验中苗木培育环境更接近半红树植物海滨猫尾木实际生长环境,所以对红榄李促生效果差于海滨猫尾木。研究表明不同红树物种其土壤细菌群落不同[ 18]。在红树植物AMF的研究中发现半红树植物的AMF多样性和丰富度高于红树植物,此外淹水时间是红树植物AMF重要影响因素,不同红树树种对AMF有一定偏爱[ 19]。说明半红树植物与真红树植物根际微生物构成差异较大,真红树植物培育仍需筛选适宜的PGPR菌株。
试验过程中海滨猫尾木出现一定死亡,总体死亡率为6.67%,其中T1组死亡率最高达17.78%,对照组死亡率6.67%处于平均水平,土力根处理组死亡率大于千代田处理组。红榄李试验组并未出现死亡现象。说明半红树植物幼苗抗病能力较弱。
试验过程中发现菌肥处理组中个体差异较大,菌肥各处理在各项指标上的表现也差异较大。海滨猫尾木在生长指标上Q1表现最好,但在地上生物量上则是Q3组最大。类似的情况也出现在菌肥处理的1∶5和1∶15处理组之间。这种现象可能是微生物激发效应导致[ 20],但同时PGPR制剂存在较大的不稳定性[ 21]。因此在濒危红树育苗过程PGPR菌肥的使用量和使用方法仍需进一步探索。
总体来看,在海滨猫尾木和红榄李幼苗人工培育方面使用PGPR菌肥有显著促生效果,尤其是在海滨猫尾木上的促生效果最好,对于真红树植物而言筛选专用菌肥或者多种菌肥混用可能促生效果会进一步提升。该研究表明在濒危红树植物培育中适当使用PGPR菌肥可以加快植物生长,但同时也需要注意植物病虫害的防治。
参考文献
[1] 李元跃,潘文,黎中宝,等.榄李属红树植物叶片结构及其生态适应[J].海洋科学,2010,34(7):72-76.
[2] 胡启明,李泽贤,邢福武.红树林植物海滨猫尾木在我国首次发现[J].广西植物,1987,7(4):303-304.
[3] 张颖,李燕华,张晓楠,等.濒危红树植物红榄李开花生物学特征及繁育系统[J].应用与环境生物学报,2017,23(1):77-81.
[4] 张颖,钟才荣,杨勇,等.濒危红树植物红榄李种质资源挽救[J].分子植物育种,2018,16(12):4112-4118.
[5] 刘德浩,廖文莉,陈智涛,等.海滨猫尾木种子萌发和实生苗抗逆性研究[J].亚热带植物科学,2019,48(2):134-138.
[6] BASU A,PRASAD P,DAS S N,et al.Plant growth promoting rhizobacteria(PGPR)as green bioinoculants:Recent developments,constraints,and prospects[J].Sustainability,2021,13(3):1-20.
[7] 潘晶,黄翠华,彭飞,等.植物根际促生菌诱导植物耐盐促生作用机制[J].生物技术通报,2020,36(9):75-87.
[8] 刘东昀,袁永强,仇荣亮,等.根际促生菌Enterobacter sp.EG16对小白菜生长及硒吸收的影响[J].农业环境科学学报,2021,40(7):1420-1431.
[9] 江美彦,周杨,刘仁浪,等.白芷根际促生菌的筛选及其促生效果研究[J].生物技术通报,2022(8):167-178.
[10] 高亚慧,姜明国,丰景,等.产生促生挥发性物质的潜在PGPR菌株筛选及其促生特性研究[J].生物技术通报,2022,38(3):103-112.
[11] 赵晨阳,戴峰,刘述颖,等.植物根际促生菌的研究进展[J].安徽农业科学,2019,47(16):12-13,24.
[12] BASHAN Y,HOLGUIN G.Plant growthpromoting bacteria:A potential tool for arid mangrove reforestation[J].Trees,2002,16(2):159-166.
[13] 李玫.我国红树林主要造林树种PGPR研究及应用[D].北京:中国林业科学研究院,2009.
[14] KATHIRESAN K,BINGHAM B L.Biology of mangroves and mangrove ecosystems[J].Advances in marine biology,2001,40:81-251.
[15] INOUE T,SHIMONO A,AKAJI Y,et al.Mangrovediazotroph relationships at the root,tree and forest scales:Diazotrophic communities create high soil nitrogenase activities in Rhizophora stylosa rhizospheres[J].Annals of botany,2020,125(1):131-144.
[16] LIU X Y,YANG C,YU X L,et al.Revealing structure and assembly forhizophyteendophyte diazotrophic community in mangrove ecosystem after introduced Sonneratia apetala and Laguncularia racemosa[J].Science of the total environment,2020,721:1-11.
[17] 王荣丽,廖宝文,何雪香,等.PGPB菌剂对5种红树小苗的野外接菌效应[J].东北林业大学学报,2015,43(1):103-106.
[18] WU P,XIONG X F,XU Z Z,et al.Bacterial communities in the rhizospheres of three mangrove tree species from Beilun Estuary,China[J].PLoS One,2016,11(10):1-13.
[19] 王宇涛.珠江河口紅树林生境AMF群落多样性及其环境响应[D].广州:中山大学,2011.
[20] 孙悦,徐兴良,KUZYAKOV YAKOV.根际激发效应的发生机制及其生态重要性[J].植物生态学报,2014,38(1):62-75.
[21] 龚韡斌.本地红树林促生菌(溶P菌和固N菌)的分离及剂型研制[D].长沙:中南林业科技大学,2009.

