CalliSpheres载药微球栓塞介入联合甲磺酸阿帕替尼治疗晚期肝癌患者的效果
胡训豪 黄小锋 吴保兴 张宏文
广东省珠海市中西医结合医院介入医学科 519000
肝癌的发病率居全国恶性肿瘤的第4位,病死率居第2位[1]。由于早期肝癌的症状隐匿,因此绝大部分肝癌患者在确诊时多处于中晚期。肝动脉化疗栓塞(TACE)为治疗晚期肝癌的首选方法,然而在临床实践中发现,栓塞术后缺血、缺氧会导致肿瘤新生血管的形成,为治疗失败的一大因素。甲磺酸阿帕替尼(商品名“艾坦”)是由江苏恒瑞医药研发生产的栓塞微球药物,可抑制肿瘤血管的生成,该药已被证实治疗经标准治疗失败的晚期卵巢癌[2]、晚期胃癌[3]的效果良好。本文旨在探讨艾坦用于辅助治疗晚期肝癌的疗效及肿瘤失败的风险,故展开如下讨论。
1 资料与方法
1.1 一般资料 经伦理审批,选择2021年6月—2022年6月于我院接受治疗的69例晚期肝癌患者,按随机数字表法分为DEB组34例和艾坦组35例。其中DEB组男22例,女12例,年龄55~75岁,平均年龄(65.80±6.72)岁;BMI 18~26kg/m2,平均BMI(22.36±2.10)kg/m2;病因:酒精性肝癌10例,乙肝性肝癌18例,丙肝性肝癌6例;Child-Pugh分级:A级13例,B级21例。艾坦组男20例,女15例,年龄56~78岁,平均年龄(66.10±7.01)岁;BMI 18~25kg/m2,平均BMI(22.40±1.52)kg/m2;病因:酒精性肝癌9例,乙肝性肝癌20例,丙肝性肝癌6例;Child-Pugh分级:A级11例,B级24例。两组一般资料比较无明显差异(P>0.05)。纳入标准:(1)晚期肝癌[4],接受药物治疗;(2)Child-Pugh A/B级且根据ECOG评分<3分;(3)无化疗禁忌证;(4)知情同意。排除标准:(1)有其他重要功能障碍者;(2)存在远处转移病灶者;(3)凝血功能异常者;(4)混合性肝癌者;(5)合并肝昏迷、肝性脑病者。剔除标准:(1)在临床试验期间死亡患者;(2)因各种原因未完成治疗方案者。
1.2 方法 DEB组给予CalliSpheres载药微球栓塞(DEB)介入治疗。在大腿根部行 Seldinger 改良血管穿刺术,消毒后穿刺皮肤,将导管插入股动脉、腹主动脉,最后进入肝动脉,尽量将导管插入肝癌组织的供血血管;行肝动脉造影,经微导管向肝癌组织供血动脉注入DEB,加入表柔比星(浙江海正药业,H20183145,10mg)60~80mg,然后闭塞靶动脉,阻断肿瘤组织血供,缓慢释放药物。栓塞终点:栓塞剂于导管尖端停滞或反流,肿瘤门静脉小分支显影,术后造影肿瘤染色消失及主干血管保留。每月接受1次介入治疗,共计3次治疗。艾坦组:在此基础上增加甲磺酸阿帕替尼(江苏恒瑞医药,H20140104,0.375g/片)治疗,250mg/次,1次/d,分别于每日餐后30min用温水送服。两组患者均接受3个月的治疗,随访观察至患者治疗结束后。
1.3 观察指标 (1)肿瘤蛋白:于治疗前、治疗3个月后,获得肝癌活检组织提取蛋白水平,采用ELisa试剂盒(武汉博士德生物工程)测定亮氨酸拉链EF-hand结构域跨膜蛋白1(LETM1)、波形蛋白(Vimentin)、N-钙蛋白(N-cadherin)水平。(2)血管生成相关指标:于治疗前、治疗3个月后,分别采集患者的静脉血3ml,离心后取得血清样本待检,采用ELisa法测碱性成纤维细胞生长因子(bFGF)、微血管密度(MVD)水平及VEGF。(3)肿瘤标志物:于治疗前、治疗3个月后,分别采集患者的静脉血3ml,离心后取得血清样本待检,采用电化学发光法测定血清AFP、GP73、AFP-L3。(4)肝功能:于治疗前、治疗3个月后,分别采集患者的静脉血3ml,离心后取得血清样本待检,采用生化分析仪(迈瑞BS-280)测定TBIL、ALT。
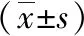
2 结果
2.1 两组肿瘤蛋白对比 治疗前,两组的Vimentin、LETM1、N-cadherin水平比较无统计学差异(P>0.05);治疗3个月后,两组的Vimentin、LETM1、N-cadherin水平均较治疗前下降,且艾坦组显著低于DEB组(P<0.05),见表1。

表1 两组肿瘤蛋白对比
2.2 两组血管生成相关指标对比 治疗前,两组的血清bFGF、VEGF水平及MVD比较无统计学差异(P>0.05);治疗3个月后,两组的血清bFGF、VEGF水平及MVD均较治疗前下降,且艾坦组显著低于DEB组(P<0.05),见表2。

表2 两组血管生成相关指标对比
2.3 两组肿瘤标志物对比 治疗前,两组的血清AFP、GP73、AFP-L3水平比较无统计学差异(P>0.05);治疗3个月后,两组的血清AFP、GP73、AFP-L3水平均较治疗前下降,且艾坦组显著低于DEB组(P<0.05),见表3。

表3 两组肿瘤标志物对比
2.4 两组肝功能对比 治疗前,两组的血清TBIL、ALT水平比较无统计学差异(P>0.05);治疗3个月后,两组的血清TBIL、ALT水平均较治疗前下降,且艾坦组显著低于DEB组(P<0.05),见表4。

表4 两组肝功能对比
3 讨论
80%的早期肝癌无典型变化,确诊时多处于中晚期[5],此时已无法行根治术。因此选择有效的治疗方案已延长晚期肝癌的患者的生存周期是临床亟待解决的问题。
本文发现DEB介入降低患者恶性生物学行为和血清标志物的效果更好。究其原因,DEB的载药微球有可变弹性的特点,其可压缩变小,达到肝靶血管后可恢复自身形态,同时微球之间可相互聚集以阻塞血管,且微球可在肝脏肿瘤组织中长期释放化疗药物,持续性地发挥杀伤肿瘤细胞的作用。能同时通过药物杀伤肿瘤细胞和通过栓塞引起癌细胞组织缺氧死亡两个过程抑制肿瘤生长。由于肝癌病变的特殊性,其癌细胞增殖和血供相对更为活跃,DEB难以彻底消灭癌细胞,为治疗失败的一个重要因素[6]。艾坦是抗血管生成药物,通过拮抗VEGF-2受体阻止正常人体血管和肿瘤组织的血管生成,有利于体内的VEGF水平抑制,在DEB后应用能更快地控制肿瘤生长,抑制肿瘤细胞的浸润生长行为,同时降低相关生物标志物的表达。
此外本文发现DEB介入联合艾坦能有效抑制晚期肝癌患者的肿瘤部位的血管增殖,并可促进其肝功能改善。笔者认为,DEB将管道置入肿瘤组织的供血动脉中,并注入载药微球栓塞进行化疗,载药微球同时具有载药和栓塞的作用,能长久稳定地释放药物、精准栓塞肿瘤的供养血管,抗癌药物长时间作用于肿瘤组织,可导致肿瘤持续性坏死。再联合艾坦,通过高度选择性竞争胞内的VEGF-2与ATP结合位点,能抑制酪氨酸激酶的生成,从而抑制肿瘤组织新生血管的生成,联合治疗的方式具有更优的肿瘤杀伤效应,促进患者的肝功能改善。另有刘震坤等[7]的报道显示,DEB联合艾坦可显著抑制血管生成与癌细胞增殖侵袭,降低肿瘤的恶性生物学行为,与本文结果相似,除此之外,该报道还显示艾坦组治疗 3 个月后总有效率显著高于DEB组(65.85%>41.46%),治疗后 9 个月、12 个月生存率(64.10%、51.28%)显著高于DEB组(41.03%、28.21%),其还表示,联合治疗方案的不足是会导致心脏毒性、血压升高等不良反应增多。
综上所述,DEB介入联合艾坦用于治疗晚期肝癌,可显著降低肿瘤的恶性生物学行为和其血清标志物,并抑制血管生成和增殖,改善患者的肝功能。

