盆腔寄生性平滑肌瘤1例并文献复习
尚志远,周丹,孟庆伟,吕秋波
盆腔寄生性平滑肌瘤1例并文献复习
尚志远,周丹,孟庆伟,吕秋波
北京医院妇产科 国家老年医学中心,北京 100730
寄生性平滑肌瘤是一种自发出现或医源性导致的良性实体肿瘤。在过去,这是一种相对罕见的疾病,但随着腹腔镜手术和旋切器的广泛使用,目前病例数量有所增加。本文报道北京医院诊治的1例寄生性平滑肌瘤病例,并回顾相关文献,讨论该病的临床特点与诊治策略,以期为临床诊疗此类疾病提供参考。
寄生性平滑肌瘤;腹腔镜手术;肌瘤剔除术;分碎术;医源性
寄生性平滑肌瘤是一种与子宫体无解剖学关系、血供来源于周围组织的特殊类型的子宫平滑肌瘤,2011年国际妇产科联盟指南将其归类于特殊类型的子宫肌瘤[1]。现报道1例腹腔镜子宫肌瘤剔除术后盆腔寄生性平滑肌瘤患者,并讨论该病的临床特点与诊治策略。
1 病例资料
患者,女,34岁,因查体发现左附件区肿块于2022年8月12日收住我院。该患者2012年于外院行腹腔镜子宫肌瘤剔除术,术中使用旋切器分碎瘤体后取出标本,病理提示子宫平滑肌瘤。2018年12月患者因早孕于我院超声检查提示子宫后壁肌瘤约5cm,孕期平顺并于2019年2月行剖宫产术,术中未剔除肌瘤。后患者定期随诊,2022年6月阴道超声提示子宫可见多个低回声团,较大者位于左侧壁外,大小约4.9cm×4.3cm×3.0cm,形态规则,呈分叶状,其周边及内部见条形血流信号,后壁间低回声团约5cm,双附件未见异常,见图1A。2周后患者因不规律下腹痛就诊,阴道超声提示:子宫可见多个低回声团,大者位于后壁间5.6cm×5.9cm×4.1cm,右卵巢未见异常,左卵巢外上方可见低回声团,大小约4.4cm×3.1cm×2.0cm,未见血流信号;左卵巢内上方可见低回声团,大小约6.2cm×5.3cm×3.8cm,未见血流信号,见图1B。盆腔CT提示:左附件区结节约5.0cm×4.5cm、4.4cm×2.6cm,子宫后壁结节5.5cm,见图2。盆腔磁共振成像(magnetic resonance imaging,MRI)提示:子宫后壁结节4.5cm×4.1cm;左附件区2个类圆形结节,T1WI混杂低信号,T2WI混杂高信号,DWI中高信号,局部与肠管关系密切,见图3。遂行经脐单孔腹腔镜探查术,术中见左卵巢外侧近盆壁肿块约4cm×3cm,表面光滑,与大网膜、盆壁、左输卵管伞粘连,左卵巢内侧大网膜内包裹肿块1枚约5cm×5cm,局部与肠管粘连,游离大网膜后见肿块有蒂与左卵巢相连,见图4。松解粘连后完整切除盆腔肿块,剔除子宫后壁肌瘤,大小约5cm。经脐切口人工碎瘤后分次取出标本。盆腔肿块呈实性,质韧,切面呈编织状,局部灰黄绿色,质中等。术后石蜡病理为平滑肌瘤,伴玻璃样变及红色变性。
2 讨论
自发性寄生性平滑肌瘤较罕见,多为个案报道[2-3]。目前普遍认为其病因是子宫体肌瘤脱落后种植,也有学者认为非典型位置的寄生性肌瘤可能起源于骨盆间充质组织的成肌细胞[4-6]。1997年,Ostrzenski[7]报道首例腹腔镜分碎术后寄生性平滑肌瘤病例。随着腹腔镜技术的发展和旋切器的广泛应用,医源性寄生性平滑肌瘤并不少见,其发病率为0.12%~1.2%[8-10]。由于该病的隐匿性,真实发病率可能更高。既往报道称,手术后诊断该病的中位时间为术后2.0~5.4年[9,11]。分碎术多见于腹腔镜子宫肌瘤剔除术、腹腔镜子宫次全切除术、腹腔镜子宫切除术中宫体过大无法经阴道取出等情况,旋切器的使用是寄生性平滑肌瘤的主要危险因素[4,12]。旋切器高速旋转切割产生的组织碎屑被认为是寄生性平滑肌瘤的来源。另外,经腹子宫肌瘤剔除或子宫切除术、宫腔镜子宫肌瘤电切也可能造成医源性寄生性平滑肌瘤[5,13-14]。
雌孕激素暴露是子宫肌瘤生长的影响因素之一,因此也有学者猜测,激素暴露也是寄生性平滑肌瘤的危险因素,在接受口服避孕药、激素替代、他莫昔芬、促排卵等药物治疗的患者中均有相关的病例报道[6,8,14]。Takeda等[15]报道1例寄生性平滑肌瘤在妊娠期迅速增大,也有回顾性研究认为患者年龄<40岁是该病的高危因素,这些文献支持激素理论的可能性[10,15]。但Otsuka等[14]回顾相关文献后指出绝经后女性也有关于该病的报道,因此激素暴露在寄生性平滑肌瘤发病中的作用尚不明确。也有研究猜测子宫内膜异位症或炎症反应可能是该病的风险因素之一[16]。
A.子宫左侧低回声团,边界清楚,分叶状;B.左卵巢外上方、内上方低回声团,边界清楚
注:MASS为肿块;Uterus为子宫;Left Ovary/L-OV为左卵巢

图2 盆腔CT图像
注:U为子宫;M为肿块;OV为左卵巢

图3 盆腔磁共振图像
A.T1WI成像左卵巢内侧肿块呈低信号,子宫后壁可见低信号结节;B.T2WI成像肿块呈高信号;C.DWI成像肿块呈中高信号,子宫后壁高信号结节;D.T1WI成像左侧盆壁结节呈低信号;E.T2WI成像左侧盆壁结节呈中高信号;F.DWI成像左侧盆壁结节呈高信号
注:白色箭头为子宫及后壁肌瘤;红色箭头为左卵巢;绿色箭头为肿块
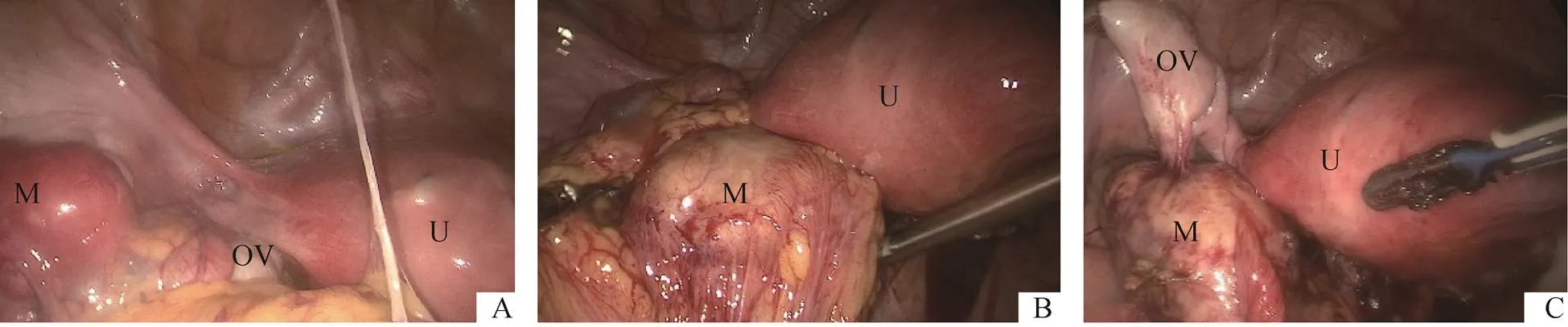
图4 术中所见
A.左卵巢外侧近盆壁肿块,表面光滑,与大网膜、盆壁、左附件粘连;B.左卵巢内侧肿块,包裹于大网膜内,局部与肠管粘连;C.松解粘连后见肿块有蒂与左卵巢相连
注:U为子宫;OV为卵巢;M为肿块
寄生性平滑肌瘤多见于育龄期女性,通常没有特异性的临床表现。根据其寄生部位,患者可能伴有腹痛、腹胀、尿频等压迫症状,或触及腹部肿块,或在压迫严重时出现腰痛、尿路梗阻、肠梗阻,亦可无任何症状[4,10,17]。部分患者在常规检查、盆腹腔影像学检查或手术中偶然发现[12]。由于重力作用,医源性寄生性平滑肌瘤发生部位多见于盆腹腔较低位置,如肠系膜、大网膜、盆腔腹膜、腹壁腹膜、肠管、腹壁穿刺孔、手术切口等位置,也可种植于卵巢输卵管,上腹部、膈上少见[5,18-19]。病灶可呈单发或多发,部分病例可见广泛散在病灶[12,15,20]。本例患者因腹痛就诊,结合术中表现和术后病理诊断推测,可能因平滑肌瘤变性或肿块在盆腔游走压迫周围组织所致。
病理学检查是诊断寄生性平滑肌瘤的金标准,尚无其他方法能够在术前准确鉴别该病[21]。结合该病的病因学特点,对游离于子宫体的盆腹腔肿块、有腹腔镜子宫肌瘤剔除术、分碎术史的病例,需警惕寄生性平滑肌瘤。患者肿瘤标志物多在正常范围内。影像学表现类似于子宫肌瘤。超声表现为边界清楚、形态规则的低回声或实性结节。本例患者盆腔肿块在重力作用下位置发生改变,超声见子宫旁分叶状低回声团,被误认为子宫浆膜下肌瘤。MRI表现为信号均匀的T1中等信号、T2低信号结节,当平滑肌瘤表面覆有假包膜、脉管或水肿带时,MRI可呈现病灶周边光滑的T2高信号边界,此时能显示病灶与周围组织毗邻关系。当存在平滑肌瘤变性时,MRI可呈现出混杂信号,ADC成像表现为中高或高信号,此时需与平滑肌肉瘤相鉴别[22]。本例患者影像学表现为附件区占位,MRI表现与恶性肿瘤相似,因此术前无法除外卵巢或消化道来源恶性肿瘤,需手术探查进一步明确诊断。石蜡病理有助于鉴别病灶良恶性,免疫组织化学染色如SAM、Desmin等平滑肌标志物有助于鉴别其来源[10,23]。
寄生性平滑肌瘤的治疗以手术切除为主,需根据病灶大小、部位选择合适的术式。无症状、病灶体积小的患者可选择随诊,有手术禁忌证的患者可考虑内分泌治疗[24]。腹腔镜探查+病灶切除是大多数病例的首选术式,但当病灶体积大、位置特殊、粘连致密、损伤周围脏器风险高或术前评估怀疑恶变可能时,可考虑经腹手术。Takeda等[15]的病例中,平滑肌瘤切除术前在膀胱镜下置入输尿管支架可预防输尿管损伤。
由于寄生性平滑肌瘤主要来源于旋切器产生的组织碎屑,因此减少组织碎屑的产生和播散是预防寄生性平滑肌瘤的重要手段。取物袋中碎瘤、人工碎瘤术取代旋切器、经腹小切口、经脐单孔或经阴道碎瘤等方案都能够减少组织碎屑的产生或播散[12]。如必须在无保护的情况下进行旋切碎瘤术,碎瘤后应仔细探查大网膜及肠管表面、膀胱、Douglas窝、直肠侧窝、腹腔镜套管、腹壁切口等部位,充分冲洗盆腹腔、器械、穿刺孔、切口,尽可能清除残留的组织碎片[4]。本例患者通过经脐单孔手术、人工碎瘤、盆腹腔冲洗的方式避免组织播散。2020年美国食品药品监督管理局的更新安全通告中将腹腔镜分碎术的使用限制在某些特定的适合接受子宫肌瘤切除术或子宫切除术的患者,并建议如需进行分碎术,只能采用封闭式分碎术,另外术前需告知患者封闭式碎瘤术并不能避免组织播散种植。寄生性平滑肌瘤术后预后良好,术后复发报道罕见[25]。
综上,除医源性因素外,寄生性平滑肌瘤的确切发病机制和风险因素仍无定论,尚需进一步研究。对因盆腹腔包块就诊、有腹腔镜碎瘤术史的患者,需鉴别寄生性平滑肌瘤。MRI有助于明确病灶位置、评估毗邻关系、鉴别良恶性病变,是重要的术前检查手段。尽管临床上已应用多种预防措施,仍无法完全避免医源性寄生性平滑肌瘤的发生,对该病的研究仍需进一步完善。
[1] MUNRO M G, CRITCHLEY H O, BRODER M S, et al. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age[J]. Int J Gynaecol Obstet, 2011, 113(1): 3–13.
[2] GARRIDO-OYARZÚN M F, SACO A, CASTELO- BRANCO C. Anterior abdominal wall parasitic leiomyoma: Case report[J]. Gynecol Endocrinol, 2018, 34(2): 103–106.
[3] KYOZUKA H, JIN T, SUGENO M, et al. A case of spontaneous parasitic myoma in a patient without a history of myomectomy treated laparoscopically[J]. Fukushima J Med Sci, 2022, 68(2): 123–127.
[4] KHO K A, NEZHAT C. Parasitic myomas[J]. Obstet Gynecol, 2009, 114(3): 611–615.
[5] 许阡, 王欣. 寄生性平滑肌瘤22例临床分析[J]. 国际妇产科学杂志, 2023, 50(1): 39–42.
[6] VAN DER MEULEN J F, PIJNENBORG J M, BOOMSMA C M, et al. Parasitic myoma after laparoscopic morcellation: A systematic review of the literature[J]. BJOG, 2016, 123(1): 69–75.
[7] OSTRZENSKI A. Uterine leiomyoma particle growing in an abdominal-wall incision after laparoscopic retrieval[J]. Obstet Gynecol, 1997, 89(5 Pt 2): 853–854.
[8] CUCINELLA G, GRANESE R, CALAGNA G, et al. Parasitic myomas after laparoscopic surgery: An emerging complication in the use of morcellator? Description of four cases[J]. Fertil Steril, 2011, 96(2): e90–e96.
[9] LEREN V, LANGEBREKKE A, QVIGSTAD E. Parasitic leiomyomas after laparoscopic surgery with morcellation[J]. Acta Obstet Gynecol Scand, 2012, 91(10): 1233–1236.
[10] TAN-KIM J, HARTZELL K A, REINSCH C S, et al. Uterine sarcomas and parasitic myomas after laparoscopic hysterectomy with power morcellation[J]. Am J Obstet Gynecol, 2015, 212(5): 594.
[11] LETE I, GONZÁLEZ J, UGARTE L, et al. Parasitic leiomyomas: A systematic review[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 203: 250–259.
[12] PAUL P G, SHINTRE H, MEHTA S, et al. Parasitic myomas: An unusual risk after morcellation[J]. Gynecol Minim Invasive Ther, 2018, 7(3): 124–126.
[13] CHO I A, BAEK J C, PARK J K, et al. Torsion of a parasitic myoma that developed after abdominal myomectomy[J]. Obstet Gynecol Sci, 2016, 59(1): 75–78.
[14] OTSUKA S, YANAZUME S, MIZUNO M, et al. Metastatic leiomyoma following menopause: A case report and review of literature[J]. Cureus, 2022, 14(11): e31549.
[15] TAKEDA A, MORI M, SAKAI K, et al. Parasitic peritoneal leiomyomatosis diagnosed 6 years after laparoscopic myomectomy with electric tissue morcellation: Report of a case and review of the literature[J]. J Minim Invasive Gynecol, 2007, 14(6): 770–775.
[16] EMERY S L, PLUCHINO N, MARTINO A, et al. Case report iatrogenic parasitic leiomyoma: The surgeon’s invisible hand[J]. Front Surg, 2023, 10: 1101078.
[17] REHMAN F, TALIB S, RAZETTO A, et al. Parasitic leiomyoma as a cause for primary small bowel obstruction[J]. Cureus, 2022, 14(3): e23473.
[18] LU B, XU J, PAN Z. Iatrogenic parasitic leiomyoma and leiomyomatosis peritonealis disseminata following uterine morcellation[J]. J Obstet Gynaecol Res, 2016, 42(8): 990–999.
[19] JEON G, PARK S Y. Parasitic leiomyoma with lymphatic dilatation in trocar port-site of abdominal wall: A case report[J]. J Korean Soc Radiol, 2023, 84(1): 280–285.
[20] PAI A H, YEN C F, LIN SL. Parasitic leiomyoma[J]. Gynecol Minim Invasive Ther, 2020, 9(2): 108–109.
[21] PARK J Y, PARK S K, KIM D Y, et al. The impact of tumor morcellation during surgery on the prognosis of patients with apparently early uterine leiomyosarcoma[J]. Gynecol Oncol, 2011, 122(2): 255–259.
[22] FASIH N, PRASAD SHANBHOGUE A K, MACDONALD D B, et al. Leiomyomas beyond the uterus: Unusual locations, rare manifestations[J]. Radiographics, 2008, 28(7): 1931–1948.
[23] 戴春阳, 韩璐. 腹腔镜术后继发寄生性平滑肌瘤8例临床病理特征分析[J]. 中国妇产科临床杂志, 2020, 21(2): 184–185.
[24] MIZUNO M, NAWA A, NAKANISHI T, et al. Clinical benefit of endocrine therapy for benign metastasizing leiomyoma[J]. Int J Clin Oncol, 2011, 16(5): 587–591.
[25] YANG R, XU T, FU Y, et al. Leiomyomatosis peritonealis disseminata associated with endometriosis: A case report and review of the literature[J]. Oncol Lett, 2015, 9(2): 717–720.
(2023–04–29)
(2023–06–28)
R711
A
10.3969/j.issn.1673-9701.2023.22.033
周丹,电子信箱:zhoudan_791124@163.com

