小鼠玻璃体血管退化与视网膜血管发育的关系
秦佳慧 郭雅图 张伟
1天津医科大学眼科临床学院,天津 300020;2天津市眼科医院 天津市眼科研究所 天津市眼科学与视觉科学重点实验室,天津 300020
小鼠视网膜与玻璃体血管系统是研究血管生长的重要模型。了解小鼠视网膜血管的发育以及玻璃体血管的退化过程有助于对血管退化和视网膜血管系统发育分子机制的理解。外层视网膜无血管,其代谢由脉络膜负责,而内层视网膜在胚胎发育期间由玻璃体血管系统提供营养和氧气[1]。玻璃体血管系统由玻璃体动脉(hyaloid artery,HA)、玻璃体固有血管(vasa hyaloidea propria,VHP)、晶状体血管膜(tunica vasculosa lentis,TVL)和瞳孔膜组成。HA在晶状体后表面的分支形成了TVL;VHP从HA更近的位置分支,最初位于视网膜上,随着眼球尺寸的增大,视网膜半径增加,VHP逐渐脱离视网膜并与靠近晶状体赤道的TVL吻合[2]。目前已有研究说明了玻璃体脉管系统的退化过程,但并未对玻璃体脉管系统退化与视网膜血管发育之间的关系进行观察与分析。本研究拟观察小鼠视网膜血管发育与玻璃体血管系统退化的时机和过程,并评估视网膜血管正常生长与VHP退化之间的关系,此外观察分析了出生后早期处于高氧环境对玻璃体血管退化的影响,为早产儿视网膜病变(retinopathy of prematurity,ROP)和永存原始玻璃体增生症(persistent fetal vasculature,PFV)发病机制研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1实验动物 将南开医院动物中心饲养的雄性和雌性C57BL/6J品系小鼠交配,所得新生仔鼠75只以及5只成年C57BL/6J小鼠用于实验,雌雄不限,实验鼠均在SPF级动物房饲养并进行实验。本研究经南开医院实验动物学部伦理委员会批准(批文号:NKYY-DWLL-2021-070)。实验动物的使用和饲养均遵循ARVO制定的科研动物使用规范和国家科学技术委员会颁布的《实验动物质量管理办法》。
1.1.2主要试剂及仪器 DyLight 594 Labeled GSL I-isolectin B4(MP6316-250UG,上海懋康生物科技有限公司);GFAP兔多克隆抗体(80788,美国CST公司);FITC标记的山羊抗兔IgG二抗(SA00013-21,美国Proteintech公司);钠石灰(上海钠辉干燥试剂厂);磷酸盐缓冲液(phosphate buffered saline,PBS)干粉(北京索莱宝生物科技有限公司);Triton X-100(美国Sigma公司)。Nikon体式显微镜(日本尼康公司);激光扫描共聚焦显微镜(德国Leica公司);氧气瓶(40 L,天津市津西环达化工气体经营部);定制玻璃氧舱(50 cm×40 cm×25 cm,广东皇拓亚克力制品贸易有限公司);CY-12C测氧仪(杭州佳长电子科技有限公司);眼科显微剪、眼科显微镊(江苏臻邦医药科技有限公司);Micron Ⅳ视网膜影像系统(德国Phoenix Research Labs公司)。
1.2 方法
1.2.1实验分组及处理 取75只出生后第1天(postnatal day 1,P1)的健康小鼠,采用随机数表法将其分为对照组65只和氧诱导视网膜病变(oxygen-induced retinopathy,OIR)模型组10只,其中对照组幼鼠不做处理,OIR模型组幼鼠建立OIR模型。对照组分别在P1~P12、P17采用断颈法各处死5只幼鼠,摘取眼球进行后续实验;同时取15个月龄的成年小鼠5只作为成年对照组。OIR模型组幼鼠分别在P12、P17各处死5只幼鼠,摘取眼球进行后续实验。
1.2.2OIR动物模型的建立 取10只P7的健康幼鼠与哺乳母鼠一起放入玻璃氧舱。氧舱留有2个直径为1 cm的通气孔,分别用来通入氧气和连接CY-12C测氧仪,每小时测1次氧气体积分数,通过调节氧气流量使玻璃氧舱内氧气体积分数维持在(75±3)%。控制室温(23±2)℃,12 h昼夜循环光照。每24 h打开玻璃容器快速更换哺乳母鼠、垫料,加饲料、换水。幼鼠连续在高氧环境下饲养5 d,于P12时返回正常氧气环境中继续饲养5 d。
1.2.3小鼠视网膜和晶状体的分离及玻璃体血管计数 取各组不同时间点眼球,浸入4%多聚甲醛中4 ℃过夜。将眼球置于PBS中,体式显微镜下用手术刀片在角膜上做1个放射状切口。用镊子从切口处开始,小心地向视神经剥除巩膜、视神经和视网膜色素上皮,暴露出视网膜。视网膜类似碗状结构,晶状体位于碗状结构之中。为了观察晶状体赤道部与视网膜内表面的血管数量,需要将晶状体从视网膜中取出,在体式显微镜下观察视网膜上HA、VHP的血管数量以及晶状体赤道部位上TVL的血管数量。观察视盘附近是否存在HA;计数视盘与晶状体后极之间的中间位置处HA分支出的血管数量即VHP数量;计数晶状体上血管的数量即TVL数量。通过体式显微镜在同一放大倍数下对视网膜和晶状体组织的不同位置进行拍照,所有照片采用ImageJ软件进行玻璃体血管的手动计数。
1.2.4视网膜铺片联合免疫荧光染色观察小鼠视网膜血管形态 将视网膜在0.3% Triton X-100中透膜过夜,之后在DyLight 594 Labeled GSL I-isolectin B4(5 μg/ml)中孵育过夜。染色后,在培养皿中从视网膜锯齿口到赤道做4个放射状切口,使用眼线刷捞至盖玻片上,视网膜内侧面朝盖玻片展平,滴PBS至视网膜组织上封片,指甲油涂抹到盖玻片边缘封闭4周。激光扫描共聚焦显微镜下观察视网膜血管形态及VHP的退化情况。
1.2.5免疫荧光双染法观察视网膜表层血管、VHP与星形胶质细胞的位置关系 视网膜在含有5% BSA和0.5% Triton X 100的PBS中4 ℃封闭过夜。将视网膜与DyLight 594 Labeled GSL I-isolectin B4 (1∶200)、GFAP(1∶200)的一抗4 ℃孵育过夜;PBS洗涤后,加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)结合的二抗,室温孵育2 h;用PBS洗涤后进行视网膜铺片,抗荧光淬灭封片剂封片。激光扫描共聚焦显微镜下血管呈红色荧光,星形胶质细胞呈绿色荧光,并观察星形胶质细胞与视网膜表层血管、VHP的分布位置关系。
1.2.6光学相干断层扫描观察成年小鼠玻璃体血管的退化情况 5%水合氯醛溶液腹腔注射麻醉15个月龄小鼠后,复方托吡卡胺滴眼液点眼扩瞳,角膜表面涂甲基纤维素眼用凝胶,保持屈光间质透明,调整Micron Ⅳ视网膜影像系统镜头焦距,直至视网膜血管清晰可见,通过调节操作台或者调节接收器增益,降噪后拍摄光学相干断层扫描(optical coherence tomography,OCT)图像,观察玻璃体血管退化情况。
1.3 统计学方法

2 结果
2.1 HA生理性退化过程
HA起源于视盘,穿过玻璃体向前到达晶状体后表面。通过视网膜铺片显示,对照组HA在P1~P8一直存在(图1)。15个月龄小鼠视网膜OCT显示,仍存在未退化的HA(图2)。
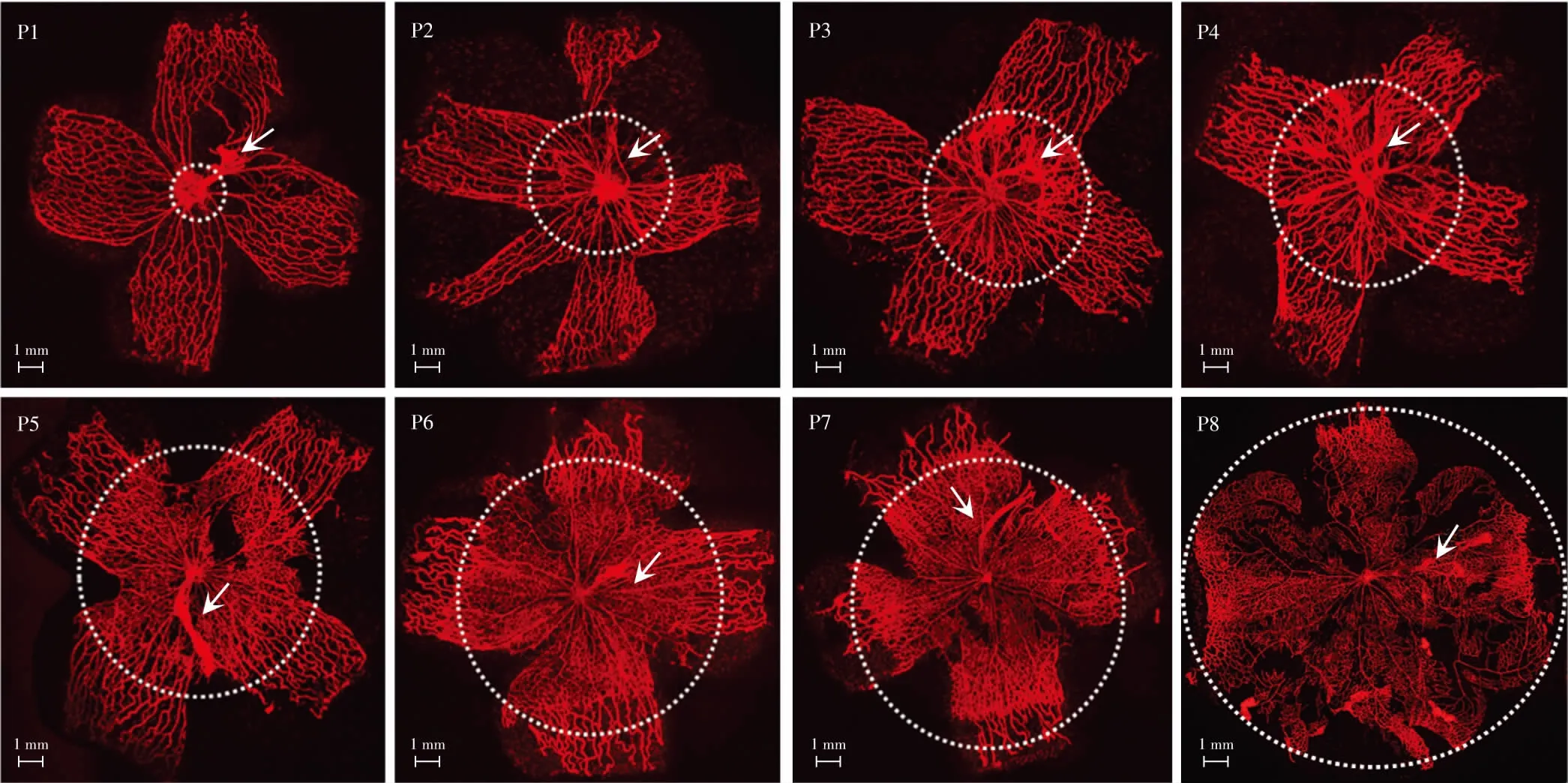
图1 不同出生时间点小鼠视网膜铺片联合血管荧光染色(DyLight 594-isolectin B4 ×10,标尺=1 mm) P1~P8小鼠视网膜血管(虚线内)、VHP(虚线外)、HA(箭头) P:出生后Figure 1 Whole-mount retinas with vascular fluorescence staining of mice at different time points (DyLight 594-isolectin B4 ×10,bar=1 mm) Retinal vessels (within dotted lines),VHP (outside dotted lines) and HA (arrows) of mice from P1 to P8 P:postnatal

图2 4只15个月龄雄性小鼠视网膜OCT成像 A、B、C、D:4只小鼠均存在未退化的玻璃体血管(箭头)Figure 2 Retinal OCT images of four 15-month-old male mice A,B,C,D:Undegenerated hyaloid vessels (arrows) in four mice
2.2 VHP的生理性退化过程
P1小鼠视网膜血管从视盘发出,随后在视网膜表面呈放射状向外蔓延,直到P8血管到达视网膜的外周,视网膜初级血管层形成(图1)。VHP起源于视盘,在视网膜血管出现之前存在(图3A)。P1~P8发育中的视网膜血管仅位于视网膜表面,在视网膜外周为网格状结构的VHP(图1)。当视网膜初级毛细血管网到达视网膜周边时,VHP也在视网膜上退化到一定程度;在视网膜血管覆盖到的位置,VHP管径变细,失去网格状结构,变成径直的血管线并且位于视网膜血管层之上(图3B)。在体式显微镜下观察到VHP血管数量在P5~P8时期急速下降,P10之后VHP血管数量趋于稳定(图4,表1,图5)。
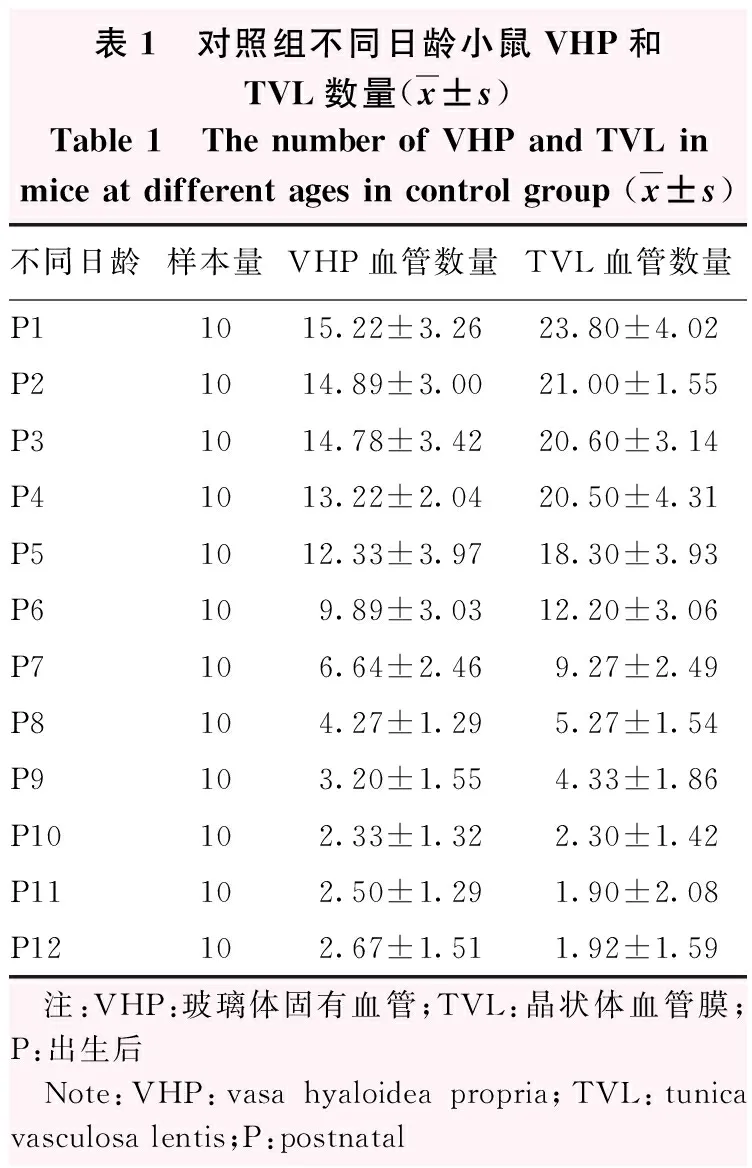
表1 对照组不同日龄小鼠VHP和TVL数量(x±s)Table 1 The number of VHP and TVL inmice at different ages in control group (x±s)不同日龄样本量VHP血管数量TVL血管数量P11015.22±3.2623.80±4.02P21014.89±3.0021.00±1.55P31014.78±3.4220.60±3.14P41013.22±2.0420.50±4.31P51012.33±3.9718.30±3.93P6109.89±3.0312.20±3.06P7106.64±2.469.27±2.49P8104.27±1.295.27±1.54P9103.20±1.554.33±1.86P10102.33±1.322.30±1.42P11102.50±1.291.90±2.08P12102.67±1.511.92±1.59 注:VHP:玻璃体固有血管;TVL:晶状体血管膜;P:出生后 Note:VHP:vasa hyaloidea propria;TVL:tunica vasculosa lentis;P:postnatal
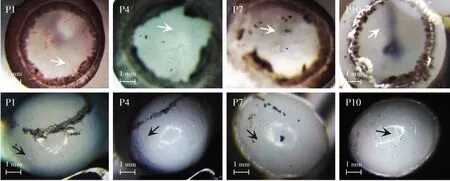
图4 体式显微镜下不同日龄小鼠VHP及TVL数量(×40,标尺=1 mm) 随着小鼠日龄的增加,VHP(白色箭头)和TVL(黑色箭头)数量不断减少 P:出生后Figure 4 The number of VHP and TVL in mice of different ages under a microscope (×40,bar=1 mm) The number of VHP (white arrow) and TVL (black arrow) decreased in mice with the increase of age P:postnatal

图5 对照组与OIR模型组P12、P17小鼠VHP及TVL情况(×40,标尺=1 mm) OIR模型组与对照组P12小鼠VHP(白色箭头)数量和TVL(黑色箭头)血管数量无明显差别,OIR模型组P17小鼠VHP(白色箭头)数量和TVL(黑色箭头)血管数量多于对照组 OIR:氧诱导视网膜病变;P:出生后Figure 5 VHP and TVL in P12 and P17 mice in control and OIR model groups (×40,bar=1 mm) There was no difference in the number of VHP (white arrow) and TVL (black arrow) vessels in P12 mice between the two groups.There were more VHP (white arrow) and TVL (black arrow) vessels in P17 mice in OIR model group than in control group OIR:oxygen-induced retinopathy;P:postnatal
在视网膜血管发育的前端由星形胶质细胞引导视网膜血管的尖端细胞走向(图3C)。在视网膜血管形成的部位,星形胶质细胞包绕视网膜血管,参与形成血-视网膜屏障(图3D)。在视网膜血管未发育的位置,无视网膜血管,只有VHP和呈细丝状的星形胶质细胞,星形胶质细胞所形成的网络也与VHP的网状结构不重合(图3E)。
2.3 TVL的生理性退化过程
P1小鼠玻璃体血管HA到达了晶状体后极,呈辐射状向前包绕晶状体,到达晶状体赤道部,形成TVL。P5~P9,TVL数量急速下降,P10时大部分TVL血管呈透明状态,血供消失(图4,表1),P17时TVL平均数量减少为(0.30±0.48)个(图5,表2)。
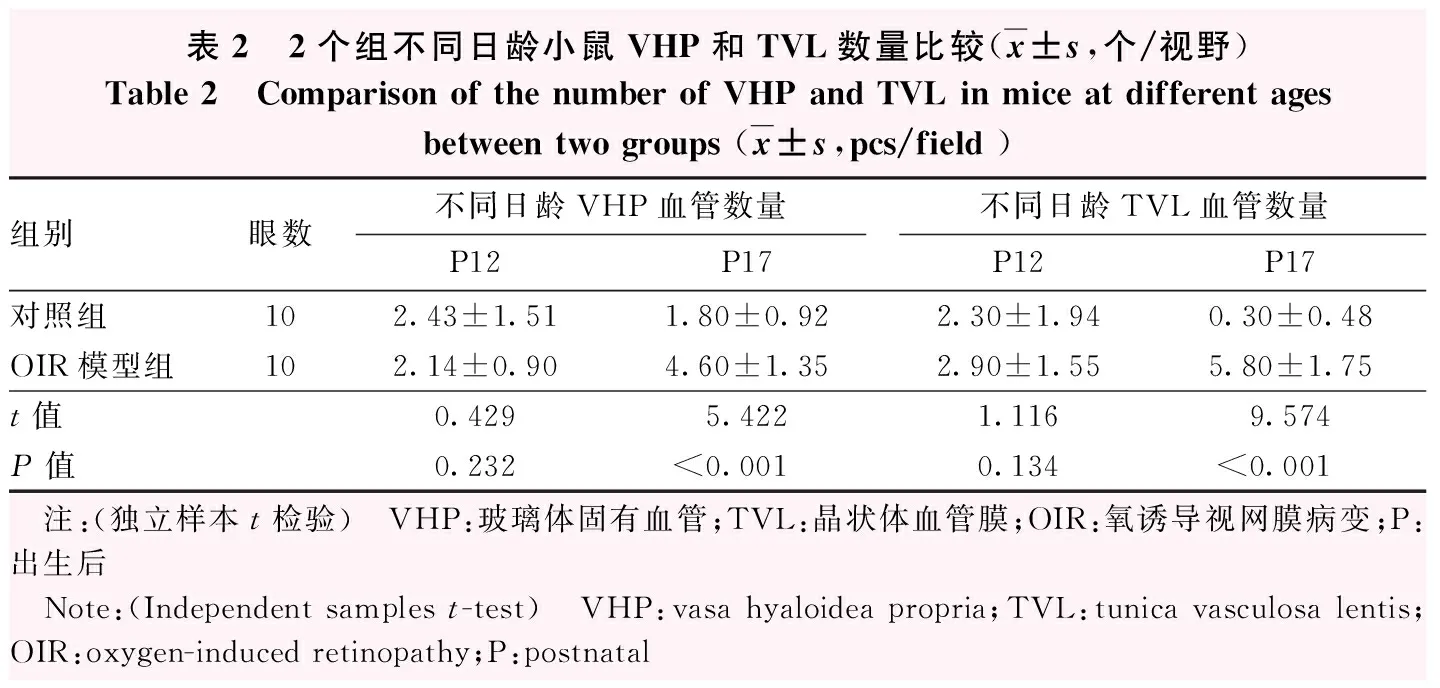
表2 2个组不同日龄小鼠VHP和TVL数量比较(x±s,个/视野)Table 2 Comparison of the number of VHP and TVL in mice at different agesbetween two groups (x±s,pcs/field )组别眼数不同日龄VHP血管数量不同日龄TVL血管数量P12P17P12P17对照组102.43±1.511.80±0.922.30±1.940.30±0.48OIR模型组102.14±0.904.60±1.352.90±1.555.80±1.75t值0.4295.4221.1169.574P值0.232<0.0010.134<0.001 注:(独立样本t检验) VHP:玻璃体固有血管;TVL:晶状体血管膜;OIR:氧诱导视网膜病变;P:出生后 Note:(Independent samples t-test) VHP:vasa hyaloidea propria;TVL:tunica vasculosa lentis;OIR:oxygen-induced retinopathy;P:postnatal
2.4 OIR模型组与对照组不同日龄小鼠VHP、TVL数量比较
OIR模型组与对照组P12小鼠VHP数量比较,差异无统计学意义(t=0.429,P=0.232);OIR模型组P17小鼠VHP数量明显多于对照组,差异有统计学意义(t=5.422,P<0.001)(图5,表2)。OIR模型组P17小鼠VHP数量明显多于P12小鼠,差异有统计学意义(t=4.188,P<0.001)。
OIR模型组和对照组P12小鼠TVL血管数量比较,差异无统计学意义(t=1.116,P=0.134)(图5,表2)。OIR模型组和对照组P17小鼠TVL血管数量比较,差异有统计学意义(t=9.574,P<0.001)(表2)。OIR模型组P17小鼠TVL血管数量明显多于P12小鼠,差异有统计学意义(t=4.668,P<0.001)。
3 讨论
ROP是早产儿视网膜血管异常发育和纤维增生所致疾病,PFV是胚胎学、原发性玻璃体和玻璃体血管系统发育失败或不完全退化造成的[3-5]。了解视网膜血管的正常发育过程以及玻璃体脉管系统的退化过程将有利于我们了解ROP、PFV等血管发育异常和玻璃体脉管系统退化异常的病理机制。本研究通过激光扫描共聚焦显微镜完整并且清楚地观察到了VHP未脱离视网膜之前的结构改变,并发现C57BL/6J小鼠的视网膜血管发育是在出生后才开始;然而人类视网膜血管发育则主要在胚胎发育期,在学龄期发育至成人水平[3],这种发育上的差异可能导致实验动物模型中视网膜血管的病理改变不能完全等同于临床疾病。
随着视网膜血管的发育,眼球内部血流重新分布,视网膜血流增加,玻璃体血管血流停止[4]。缺乏血液动力和巨噬细胞积聚均会引发内皮细胞凋亡[5]。剪切应力激活的信号级联也会影响内皮细胞的增生和迁移[6-9]。本研究结果也显示,视网膜血管发育的同时,VHP和TVL退化,因此推测视网膜血管的正常发育促进了玻璃体血管的退化。
星形胶质细胞通过视网膜神经节细胞的轴突迁移到视网膜中,并径向向外周视网膜扩散[10]。内皮细胞沿着星形胶质细胞网络迁移,形成视网膜表层脉管系统[11]。视网膜血管化延迟导致星形胶质细胞网络形成延迟,以及视神经头和血管前部星形胶质细胞数量增加[12]。星形胶质细胞的发育缺陷抑制了哺乳动物眼中玻璃样脉管系统的程序性退化[13]。而星形胶质细胞中的HIF-1α/MIF信号可调节巨噬细胞积聚和透明血管退化[14]。因此视网膜血管发育异常可导致星形胶质细胞行为异常,而星形胶质细胞的异常又能导致玻璃体血管系统退化异常。虽然星形胶质细胞在形态上与VHP无重合,但星形胶质细胞功能的正常发挥促进了玻璃体血管的退化。而出生后早期暴露于高氧环境可导致双侧玻璃体出血[15],持续的出血可导致胎儿脉管系统组织化,纤维血管柄包含星形胶质细胞诱导PFV的形成[16]。因此,在血管发育异常的情况下,星形胶质细胞也是视网膜病理改变的原因之一。
组织氧传感机制也参与调节玻璃体血管系统的退化。von Hippel-Lindau protein(pVHL)是一种E3泛素连接酶的底物识别成分,在常氧状态下能高效、快速地破坏缺氧诱导因子(hypoxia inducible factor,HIF)α亚单位,如HIF-1α和HIF-2α的稳定性,通过条件性灭活pVHL导致HIF过度活跃,从而延缓玻璃样血管系统的退化[17]。此外,Cited2在胚胎晶状体中表达,是HIF-1α的负向转录调节剂,Cited2缺乏可上调HIF-1信号,导致玻璃样脉管系统紊乱[18]。因此,HIF的上调会导致玻璃体血管系统退化延迟。在OIR造模过程中,P7~P12小鼠处于高氧环境中,导致血管闭塞,出现视网膜无血管区域;P12~P17小鼠处于常氧环境中,视网膜无血管区域缺血和缺氧,导致HIF表达上调[19]。视网膜缺氧和HIF上调可能是本研究中OIR模型组P17小鼠VHP和TVL数量较多的原因。但视网膜HIF的上调是否直接进入玻璃体影响玻璃体血管退化,即影响玻璃体血管退化的HIF与视网膜缺血缺氧上调的HIF是否来源一致仍需进一步研究。
在OIR动物模型中,视网膜高氧期形成了无血管区域,而此时玻璃体脉管系统退化却未受到影响,当视网膜处于缺氧状态时,玻璃体血管退化异常,视网膜血管也会出现异常增生,说明影响玻璃体脉管系统退化更重要的因素不是视网膜血管是否正常分布,而是视网膜是否缺氧。因此视网膜缺氧是视网膜血管异常增生和玻璃体血管退化异常的共同调节因素。但视网膜缺氧时,除了HIF之外是否有其他细胞因子参与其中尚不明确,其与玻璃体血管退化之间的关系还有待进一步研究。此外,在本研究中,OIR动物模型组P17小鼠VHP、TVL的数量多于P12小鼠,说明在P12时退化的VHP、TVL经过视网膜缺氧后数量明显增多,其机制也有待进一步研究。
综上所述,本研究结果表明视网膜血管和星形胶质细胞的正常发育促进了玻璃体血管的正常退化;视网膜处于缺血缺氧状态时,延缓了玻璃体血管退化。正确认识小鼠玻璃体血管系统退化过程及其与视网膜血管发育的关系为OIR发病机制研究提供了参考依据,有利于进一步探索ROP、PFV的病理机制。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明秦佳慧:直接参与酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草文章;郭雅图:直接参与酝酿和设计实验、统计分析、对文章的知识性内容作批评性审阅;张伟:直接参与酝酿和设计实验、对文章的知识性内容作批评性审阅

