三白草酮对STZ 糖尿病小鼠胰岛β 细胞凋亡与氧化应激的保护作用
李秋月,袁铭阳,吴丽娜,王小龙,张春晶,李 林,吴朋烊,李淑艳,赵正林
(齐齐哈尔医学院,黑龙江齐齐哈尔 161006)
糖尿病(Diabetes mellitus,DM)已成为威胁人类健康的慢性代谢性疾病,而中国是全球糖尿病患者数最多的国家,其中2 型糖尿病(Type 2 diabetes mellitus,T2DM)是最常见的类型[1-3]。其发病机制复杂,认为胰岛β细胞损伤导致其功能衰竭和胰岛素抵抗是T2DM 发病的中心环节[4-5]。氧化应激是T2DM发生发展的重要因素。长期高糖环境使胰岛β细胞发生氧化应激导致机体氧化系统与抗氧化系统失衡,自由基过度释放诱导胰岛β细胞凋亡减少胰岛素分泌。研究表明抑制胰岛β细胞氧化应激和凋亡是控制糖尿病发展的有效治疗手段[6-8]。基于复杂的发病机制临床上尚无治疗效果良好的药物,晚期会带来严重的并发症。
三白草(Saururus chinensisi(Lour.)Baill),又叫塘边藕,是我国民间广泛利用的药食两用植物,含有木脂素类、黄酮类、多糖类等成分[9-11]。三白草酮(Sauchinone,Sch)是三白草中提取的单体类化合物,具有清热解毒、消肿利尿、抗炎等众多的药理活性,它能抑制ROS 的增生,清除过量自由基,通过抗氧化、抗炎机制对一些肿瘤和炎症性疾病具有良好的治疗作用[12-13]。然而目前Sch 对于降糖作用及其机制的研究限于起步阶段,利用体内实验对氧化应激与凋亡等途径的调控及其机制的实验尚未有深入的研究。本研究利用STZ 诱导糖尿病小鼠模型,观察氧化应激指标和凋亡的变化,探讨三白草酮对胰岛β细胞的保护作用及其机制,为临床上对糖尿病治疗药物的中药研发提供可靠的基础实验依据。
1 材料与方法
1.1 材料与仪器
小鼠 随机选取体重在8 周龄25~28 g,SPF 级雄性BALB/C 小鼠50 只,由齐齐哈尔医学院动物实验中心提供;实验动物饲养在恒温恒湿的独立通气系统中,昼夜日光节律,室温(22±1)℃,湿度45%~55%,实验期间饮食饮水自由。实验动物使用许可证:SYXK(黑)2016-001。本实验已通过齐齐哈尔医学院实验动物伦理委员会批准,并所有操作均按照相关指南执行。小鼠普通标准饲料(蛋白25%、碳水化合物55%、脂肪5%、辅料15%),由齐齐哈尔医学院实验动物中心提供;三白草酮(纯度>98%) 湖州展舒科技有限公司(CAS 号:177931-17-8);高糖高脂饲料武汉亚法生物技术公司(批号040508);STZ 美国Sigma 公司(S0130-100);MDA、SOD、GSHPx 试剂盒 碧云天生物技术公司;血清胰岛素ELISA试剂盒 南京建成生物工程研究所;TNF-α、IL-6上海酶联生物科技有限公司;Bcl-2、Caspase-3、NFκB 抗体 美国Cell Signaling Technology。
Tecan Infinite® 200 Pro 多功能酶标仪 奥地利Tecan 公司;1658001 小型垂直电泳槽、1703935电泳转印系统 美国BIO-RAD 公司;UVP Chemstudio touch 多功能成像仪 德国Analytikjena 公司;ACCU-CHEK Active 罗氏血糖仪 德国罗氏诊断有限公司。
1.2 实验方法
1.2.1 实验分组、模型建立、给药 将雄性BALB/C小鼠50 只适应环境饲养7 d,随机取出8 只为正常对照组,给予普通标准饲料喂养;其余小鼠用高糖高脂喂养2 周后,禁食8 h,用0.1 mmol/L 柠檬酸钠缓冲液将STZ 配成1%的溶液,按40 mg/kg 腹腔注射;正常对照组小鼠注射等量柠檬酸钠缓冲液。72 h 后用血糖测试仪取尾静脉血测空腹血糖,大于11.1 mmol/L作为糖尿病小鼠模型[3,14]。造模后继续给予高糖高脂喂养2 周后,取持续维持空腹血糖大于11.1 mmol/L小鼠,随机分为模型组、Sch 低剂量组、Sch 高剂量组、二甲双胍阳性对照组(Metformin),每组8 只,立即进行灌胃给药。Sch 剂量按照人-小鼠体表面积换算系数10 计算等效药物剂量[15],Sch 低剂量组和Sch高剂量组分别每日灌胃一次Sch 10 和30 mg/kg,二甲双胍阳性对照组每日灌胃一次100 mg/kg/次,连续给药4 周。正常对照组和模型组灌胃等量无菌生理盐水。
1.2.2 各组小鼠体重的测定 实验期间每天观察小鼠的进食、排尿、生长、活动等一般情况。Sch 给药开始后每周测定一次各组小鼠的体重。
1.2.3 各组小鼠空腹血糖(Fasting blood glucose,FBG)、血清胰岛素(Fasting insulin,FINS)、炎症因子TNF-α、IL-6 浓度的测定 末次给药后禁食12 h,利用血糖测试仪取尾静脉血测定FBG。用5%水合氯醛腹腔注射麻醉小鼠后从眼眶静脉丛采血,3000 r/min 离心15 min 收集血清。按照试剂盒说明用酶联免疫吸附(ELISA)法检测FINS、TNF-α和IL-6浓度。胰岛素抵抗指数(Homeostasis model assessment insulin resistance,HOMA-IR)按以下公式计算。
1.2.4 胰腺组织中氧化应激指标的检测 取胰腺组织充分研磨后,用RIPA 蛋白裂解液提取总蛋白,3000 r/min 离心15 min 取上清液,用试剂盒检测胰腺组织中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)含量。
1.2.5 Western Blot 检测胰腺组织Bcl-2、Caspase-3 和NF-κB 蛋白表达 将胰腺组织充分研磨后,利用RIPA 蛋白裂解液(含有蛋白酶抑制剂)进行匀浆离心,然后利用上清液按照蛋白浓度检测试剂盒的说明进行蛋白质定量。每孔上样30 μg 蛋白质,并按照常规操作方法进行电泳、转膜、封闭后加入Bcl-2、Caspase-3 和NF-κB 一抗4 ℃孵育24 h,再加入二抗孵育1 h 后,用ECL 显色。利用图像分析系统扫描,GAPDH 作为内参对照。
1.3 数据处理
采用GraphPad Prism 6.02 统计软件进行数据分析,数据均采用均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用Newman–Keuls 法进行检验,P<0.05为差异有统计学意义。
2 结果与分析
2.1 三白草酮对糖尿病小鼠体重的影响
与正常对照组相比,模型组小鼠出现多饮、多食、多尿现象,各组小鼠的体重变化如表1 所示,STZ 注射造模后各组小鼠体重与正常对照组比较无显著性差异(P>0.05),Sch 给药过程中正常对照组小鼠体重逐渐增加而模型组小鼠体重减少,且在给药第2 周开始,模型组小鼠体重显著减少(P<0.05),第3 周、第4 周极显著减少(P<0.01)。与模型组比较,Sch 低剂量组、Sch 高剂量组、Metformin 组小鼠“三多一少”症状显著缓解,体重的增加速度比较缓慢,Sch 高剂量组在第3 周和第4 周体重增加的速度快于其他组,但Sch 低剂量、高剂量组对体重的变化无显著剂量依赖性(P>0.05)。此结果说明高糖高脂联合STZ诱导糖尿病模型成功,同时Sch 对体重的增加有促进作用。

表1 Sch 对糖尿病小鼠体重的影响(n=8)Table 1 Effect of sauchinone on body weight in diabetic mice (n=8)
2.2 三白草酮对糖尿病小鼠空腹血糖(FBG)、血清胰岛素(FINS)、胰岛素抵抗的影响
各组小鼠FBG、FINS、HOMA-IR 的变化如表2所示,与正常对照组比较,模型组小鼠FBG 显著增高(P<0.05),FINS 水平明显降低而胰岛素抵抗指数极显著升高(P<0.01);与模型组比较,Sch 低剂量组小鼠FBG 显著下降、FINS 水平升高且胰岛素抵抗显著减弱(P<0.05),Sch 高剂量组、Metformin 组小鼠FBG 极显著下降,FINS 水平极显著升高而胰岛素抵抗指数呈极显著下降趋势(P<0.01);Sch 低剂量组和Sch 高剂量组FBG(P<0.01)和FINS(P<0.05)水平均有剂量依赖性。以上结果可知,STZ 对诱导糖尿病造模后,小鼠胰岛β细胞损伤使胰岛素分泌减少,诱导胰岛素抵抗性导致显著的血糖升高。利用Sch 低剂量、高剂量干预后血糖显著控制而且胰岛素水平有显著升高趋势,表明Sch 具有一定的降糖作用与二甲双胍阳性对照组效果接近,而且有剂量依赖性,可推测Sch 可以改善胰岛β细胞功能降低糖尿病小鼠胰岛素抵抗性,提高胰岛素敏感性,增加胰岛β细胞的胰岛素分泌功能。
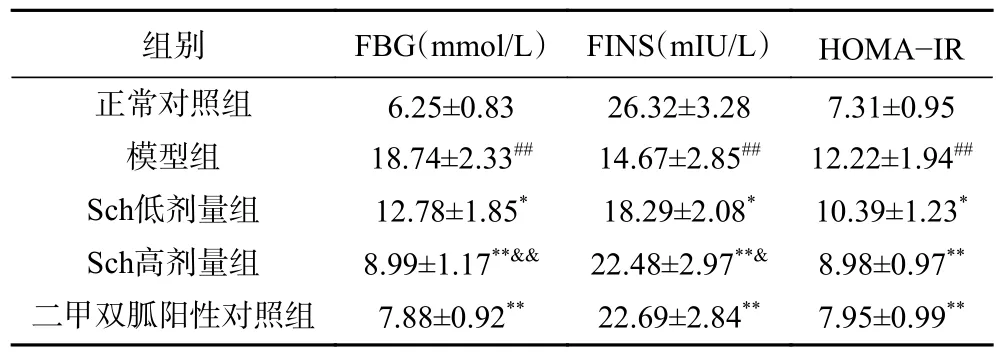
表2 Sch 对糖尿病小鼠FBG、FINS、胰岛素抵抗的影响(n=8)Table 2 Effect of sauchinone on fasting blood glucose, fasting insulin and insulin resistance in diabetic mice (n=8)
2.3 三白草酮对糖尿病小鼠血清炎症因子表达的影响
糖尿病的发生过程中存在明显的炎症反应,TNFα和IL-6 是体内主要的炎症因子,会诱导胰岛素抵抗的同时降低胰岛β细胞对葡萄糖的敏感性,促进胰岛β细胞的损伤导致细胞凋亡的发生最终影响胰岛素分泌[16]。ELISA 检测各组小鼠血清中TNF-α和IL-6 变化如表3 所示,与正常对照组比较,模型组小鼠血清TNF-α和IL-6 极显著升高(P<0.01);与模型组比较,Sch 低剂量组TNF-α和IL-6 水平显著降低(P<0.05),Sch 高剂量组小鼠血清中TNF-α和IL-6水平极显著降低(P<0.01);Sch 低剂量组和Sch 高剂量组血清中TNF-α和IL-6 的变化无剂量依赖趋势(P>0.05)。此结果说明,在糖尿病的发病过程中炎症因子TNF-α和IL-6 的表达增高会促进机体炎症的发生,引起胰腺组织的炎症损伤影响胰岛β细胞的胰岛素分泌功能,可推断炎症反应在糖尿病发病机制中的重要作用。Sch 的干预可以抑制体内炎症反应减轻胰岛β细胞的损伤,抑制胰岛β细胞的凋亡而保护胰岛β细胞。

表3 Sch 对糖尿病小鼠血清TNF-α 和IL-6水平的影响(n=8)Table 3 Effect of sauchinone on the serum concentrations of TNF-α and IL-6 in diabetic mice (n=8)
2.4 三白草酮对糖尿病小鼠胰腺组织氧化应激指标的影响
长期的高糖环境能诱发体内氧化应激状态。MDA是评价体内氧化应激反应的主要指标,具有强烈的细胞毒性,可以反映氧化应激的强度以及细胞损伤的程度。SOD 是一种抗氧化酶,能清除体内产生的自由基,具有抗氧化作用。GSH-Px 是一种抗氧化物分解酶,以GSH 为底物与SOD 协同清除体内的各种氧自由基,使细胞免受氧化损伤而保护细胞的作用[17-18]。各组小鼠胰腺组织中氧化应激指标的变化如表4 所示,与正常对照组比较,模型组小鼠胰腺组织MDA水平极显著升高,而SOD 和GSH-Px 活性极显著降低(P<0.01);与模型组比较,Sch 低剂量组小鼠胰腺组织中MDA 水平显著降低,而SOD 和GSH-Px 活性显著升高(P<0.05),Sch 高剂组MDA 水平极显著降低,而SOD 和GSH-Px 活性极显著升高(P<0.01);Sch 低剂量组和Sch 高剂量组小鼠胰腺组织中MDA、SOD 和GSH-Px 活性的变化均有剂量依赖性,具有极显著差异(P<0.01)。因此可以认为,体内在氧化应激状态下,会失去机体中氧化与抗氧化系统的动态平衡,诱导胰岛β细胞的应激损伤,破坏胰岛细胞功能,减少胰岛素分泌,能进一步说明糖尿病发病机制中氧化应激的重要作用。Sch 干预后体内MDA、SOD、GSHPx 等氧化与抗氧化指标明显得到改善,因此能够缓解体内氧化应激状态,提高抗氧化能力,减轻胰岛β细胞的损伤。
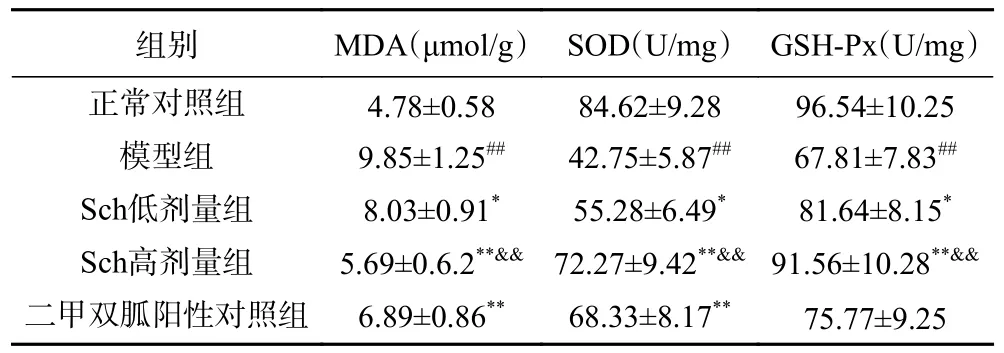
表4 Sch 对糖尿病小鼠胰腺组织MDA、SOD 和GSH-Px活性的影响(n=8)Table 4 Effect of sauchinone on pancreatic MDA, SOD and GSH-Px in diabetic mice (n=8)
2.5 三白草酮对糖尿病小鼠胰腺组织中Bcl-2、Caspase-3、NF-κB 蛋白表达的影响
氧化应激与炎症会导致胰岛β细胞的损伤与凋亡。Caspase 和Bcl-2 蛋白家族是细胞凋亡过程中最关键的调控因子。Caspase-3 是细胞凋亡的关键因子,是细胞凋亡发生的不可逆标志,Bcl-2 蛋白在凋亡的发生过程中发挥抑制凋亡的作用,NF-κB 是与细胞的生长、分化、凋亡、炎症等相关的重要调控因子,被激活后可以促进各种炎症因子的表达和氧化应激的产生,导致细胞的凋亡[19-21]。Western blot 检测各组小鼠胰腺组织中相关蛋白表达结果如图1 所示,与正常对照组比较,模型组Bcl-2 表达极显著减少,而Caspase-3、NF-κB 蛋白表达极显著增加(P<0.01);与模型组相比较,Sch 低剂量组胰腺组织中Bcl-2 蛋白表达极显著增高(P<0.01),Caspase-3、NFκB 蛋白表达显著减少(P<0.05),而Sch 高剂量组Bcl-2蛋白表达极显著增高,Caspase-3、NF-κB蛋白表达极显著减少(P<0.01);Sch 低剂量组和Sch 高剂量组比较, Caspase-3 蛋白表达有剂量依赖性,有显著差异(P<0.05)而Bcl-2、NF-κB 蛋白表达剂量依赖性具有极显著差异(P<0.01)。由此可以说明,高糖环境容易导致炎症和氧化应激使胰岛细胞损伤产生胰岛素抵抗,影响胰岛细胞的功能逐渐诱导β细胞凋亡,凋亡相关蛋白的表达与糖尿病发病机制密切相关。

图1 各组小鼠胰腺组织中Bcl-2、Caspase-3、NF-κB蛋白表达(n=3)Fig.1 Protein expressions of Bcl-2, Caspase-3, and NF-κB in pancreatic tissues of diabetic mice (n=3)
3 讨论与结论
糖尿病(Diabetes Mellitus,DM)是由于遗传以及体内外各种因素而导致的复杂的内分泌代谢性疾病,是全球范围内危害人类健康的三大疾病之一,而且发病率逐年增高,给社会和家庭带来严重的负担。其中90%以上为T2DM[1]。因此,目前对T2DM 发病机制及其治疗的研究是众多学者关注的热点问题。首先,本研究利用STZ 诱导T2DM 小鼠模型后,检测小鼠的体重等一般状况,FBG、FINS 和胰岛素抵抗指数等生化指标,成功得出稳定的糖尿病动物模型,并且用Sch 干预后发现Sch 对糖尿病小鼠胰岛β细胞具有明显的保护作用。
很多研究认为二甲双胍是临床上常用的糖尿病治疗药物,虽然降糖效果良好,但是长期服用具有明显的胃肠道刺激作用。因此,降糖作用显著同时没有副作用的糖尿病治疗药物的研发具有非常重要的临床意义[22]。本研究发现,Sch 低剂量和高剂量干预显著降低糖尿病小鼠FBG,分别降低31.8%和52.03%,增加胰岛素分泌同时改善胰岛素抵抗作用。因此Sch 有显著的降血糖作用且对胰岛β细胞具有保护作用,但是目前对其机制没有详细而系统的解释。糖尿病的发病机制非常复杂,与多种因素有关。其中氧化应激与凋亡导致胰岛β细胞功能降低是重要发病机制[7]。长期的高血糖诱导氧化应激状态,体内产生过多的ROS,使机体对抗氧化功能的负荷过重,最终导致体内氧化与抗氧化调节失衡,从而造成蛋白质、脂类、核酸等分子的过度氧化影响胰岛β细胞的正常功能,导致胰岛β细胞损伤和胰岛素抵抗。因此目前认为氧化应激是糖尿病及其并发症发生发展的关键机制之一[23-24]。本研究发现,糖尿病小鼠胰腺组织中MDA 明显增多,而抗氧化酶SOD 和GSH-Px 活性明显降低,说明高糖导致体内氧自由基的聚集使脂质发生过氧化,同时体内抗氧化酶的活性降低促进氧自由基的堆积,加快细胞的损伤,符合氧化与抗氧化失去平衡导致细胞自我保护机制破坏造成组织损伤的理论[8,18]。本研究发现Sch 干预后可以有效改善胰岛细胞的氧化应激状态。近年研究表明,三白草的不同成分对糖尿病动物模型中有明显降血糖的作用,通过对氧化与抗氧化指标的作用,改善胰岛β细胞的功能[25-26]。
氧化应激状态下产生的过多的ROS 还可以激活细胞凋亡信号,发生胰岛β细胞凋亡,减少胰岛素分泌,产生胰岛素抵抗。细胞凋亡是由多种基因调控的细胞程序性死亡过程,与细胞内胞质、线粒体以及内质网的多种信号通路相关。其中Caspase 家族和Bcl-2 家族是最常见的调控因子。Caspases 在体内维持内稳态中发挥关键作用,控制细胞凋亡和炎症等重要过程。目前认为Caspase 家族是细胞凋亡过程中发挥主要作用的蛋白质,其中Caspase-3 起关键作用[27-28]。当细胞受到凋亡刺激后立即激活并活化相关信号通路诱导细胞进入凋亡阶段。Bcl-2 家族蛋白激活内源性凋亡途径,诱导细胞的凋亡。Bcl-2 蛋白定位于细胞内膜、内质网和线粒体,一些家族成员在细胞死亡的刺激下从细胞质移位到线粒体。Bcl-2的家族中有促进凋亡蛋白和抑凋亡蛋白组成,其中Bcl-2 是目前认为最普遍的抑制凋亡的蛋白,其表达降低与细胞凋亡的加快有密切相关[29]。一些文献报道显示,糖尿病大鼠胰腺组织中Bax/Bcl-2 及Caspase-3 水平升高,如果上调抗凋亡基因Bcl-2 的表达水平,能有效抑制Caspase-3 的表达水平,可以降低细胞凋亡[14,30]。
NF-κB 是一种核转录因子,参与各种细胞的增殖分化以及免疫应答相关的信号通路,在细胞凋亡的过程中起重要的调节作用。在DM 的发病过程中,高血糖导致细胞内ROS 的含量增多,激活细胞内的NF-κB,会破坏NF-κB 与其他各种核转录因子的相对稳定和动态平衡,激活IκB 激酶(IKK),使之发生磷酸化导致与NF-κB 解离,游离的NF-κB 进入细胞核内启动炎症因子TNF-α和IL-6 等的表达[21,31]。TNFα和IL-6 是炎症反应中最重要的炎性介质,也是外源性激活细胞内凋亡的细胞因子,能加快胰岛β细胞凋亡的同时促进胰腺组织的炎症损伤,诱导胰岛素抵抗[32-33]。本研究结果发现,模型组小鼠胰腺组织中Bcl-2 蛋白表达明显减少而Caspase-3、NF-κB 蛋白表达明显升高,同时血清中炎症因子的表达也明显增高,此结果说明凋亡可以诱导胰岛β细胞损伤紊乱体内糖脂代谢使胰岛素分泌减少FBG 升高,产生明显的胰岛素抵抗。
糖尿病是病因复杂的代谢性疾病,长期的高血糖导致糖代谢的紊乱会影响脂类和蛋白质等营养物质的代谢,没有及时调整健康的膳食环境或治疗不当容易诱发严重的并发症。因此在日常生活中,利用食品或保健品的多途径、多靶点和多系统的作用特点,开发有效的调节糖代谢的食品资源来治疗DM 及其并发症是关键问题。三白草酮(sauchinone,Sch)是从传统三白草中提取的主要单体类化合物之一,具有清热解毒、消肿利尿、抗炎之功效,通过抗炎、抗病毒、抗氧化等机制对肿瘤、肝炎、神经退行性病变、急性肺损伤、气道变应性疾病、细菌感染等具有良好的治疗作用,尤其通过降血糖、抗氧化作用及其对细胞的保护作用备受关注[12,34]。本研究发现,利用Sch 低剂量、高剂量给药过程中,糖尿病小鼠的“三多一少”症状明显改善,降血糖作用显著。为进一步分析其机制,检测胰腺组织中氧化应激指标,Sch 干预后与模型组比较MDA 水平降低,SOD、GSHPx 活性明显升高,说明有效清除高糖所引起的氧自由基的堆积,改善机体内氧化应激状态,缓解胰岛β细胞的损伤。还发现Sch 能增加胰腺组织的抗凋亡蛋白Bcl-2 的表达,抑制Caspase-3 和NF-κB 蛋白的表达,从而明显抑制炎症因子TNF-α和IL-6 的水平。
综上所述,Sch 减轻胰岛β细胞的损伤,增加胰岛素分泌,抑制胰岛素抵抗,主要通过DM 发病机制中的氧化应激和凋亡为靶点,能抑制高糖所致的氧化应激,维持内环境稳态,减少细胞的凋亡而发挥保护胰岛β细胞的作用。今后进一步深入研究Sch 的作用靶点和探讨调控相关信号通路的作用机制,为糖尿病治疗药物的研发提供更加可靠的基础实验依据。

