补救性卵子激活技术在挽救ICSI未受精卵子中的应用研究
王淑林 翁崇双 巢时斌 郑雯雯
(上饶市妇幼保健院辅助生殖科,江西 上饶 334100)
卵胞浆内单精子显微注射(injection of single sperm,ICSI)是一种通过直接在卵母细胞胞质内注射入精子的辅助受精技术,现目前已在畸精子症、少精子症等病症中得到广泛应用[1]。ICSI受精方式绕过了自然受孕时精子获能、顶体反应及穿过卵子透明带等过程。因此ICSI常被认为是有保障的受精方式,但是临床治疗中仍然有2%~3%患者ICSI受精失败,加上受精率低下的患者也占到ICSI的20%~30%[2]。到目前为止临床上仍没有办法预测和预防ICSI受精失败,由于观察受精时间一般在ICSI后16 h左右,完全不受精或者低受精率的卵子已老化,目前仍然无较好的解决方案改善本次ICSI治疗受精失败后的临床结局[3]。在辅助生殖技术中,激活卵母细胞是受精过程中的关键环节,受精失败和受精率低的主要原因是精子缺乏头部的卵子激活因子,导致卵子激活失败[4]。越来越多的研究以及试验数据表明[5],对于反复ICSI受精失败的患者,采用ICSI授精方式联合补救性卵子激活(assisted oocyte activation,AOA技术能够显著提高受精率、卵裂率以及胚胎着床率。但目前临床上关于补救性AOA挽救ICSI受精失败卵子中的案例仍罕见报道。基于此背景,本次研究通过观察AOA技术在挽救ICSI受精失败卵子中的应用研究,以更加全面深入的探讨ICSI-AOA是否能够有效改善既往ICSI后受精失败患者临床结局的潜在作用。报道如下。
1 资料与方法
1.1 一般资料 收集2020年11月致2021年11月我院生殖医学中心接受ICSI-AOA治疗的患者58例患者设为试验组,将ICSI助孕失败且仅行常规治疗的58例患者作为对照组(未行AOA处理);同时将治疗成功的200例患者的新生儿结局作为空白对照组。纳入标准:①本周期获得成熟卵数≥3枚。②符合以下1项标准:前次ICSI周期正常受精率≤30%,前次ICSI周期第3天无优质胚胎,诊断为圆头精子症患者。③距离前次ICSI周期失败间隔<1年。④患者知情并同意。排除标准如下:①其他类型的严重精子畸形。②卵母细胞本身质量差或畸形。③前次ICSI受精失败的非激活障碍者。因对照组分娩数据样本量偏小,为此选择本院同期接受常规ICSI的200对患者分娩数据进行新生儿结局比较设为对照组。本研究已经通过医学伦理委员会批准。
1.2 方法
1.2.1 卵子收集 监测到卵泡发育至少满足下列一个条件时进行扳机:①有3个卵泡直径≥16 mm。②2个主导卵泡直径≥17 mm。③1个主导卵泡直径≥18 mm。扳机后35~38 h后超声引导下经阴道取卵。于5% O2、6% CO2和37 ℃条件下的培养箱(澳大利亚Cook公司)中保持培养2~3 h。去卵冠丘后对裸露卵子进行成熟度评估,对成熟的MII期卵子进行ICSI操作。
1.2.2 ICSI后卵子激活 ICSI注射后,于G-IVF Plus培养基配置的10 μmol/L离子霉素(德国Merck KgAA公司)中进行培养,37 ℃培养10 min。激活后,将卵母细胞经预平衡的受精液漂洗至少3次,继续培养直至受精观察。
1.2.3 原核观察 ICSI后卵子激活16~18 h后显微镜(日本Nikon公司,ECLIPSETi-S、SM2645)下观察评估受精情况,显示不为2个原核(pronucleus,PN)的胚胎为异常受精,只有可见2PN的为正常受精卵。在新配置的培养基中进行正常受精卵培养,3 d后进行卵裂期胚胎发育情况的评估。
1.2.4 胚胎培养及冷冻 在第3天胚胎移植和玻璃化冷冻处理后,将剩余的胚胎转移至囊胚培养基培养5~6 d。采用Gardner评判标准进行囊胚评分[6],B4-B6囊胚扩张同时有至少一个B的内细胞团和更好等级的囊胚或滋养外胚层用于移植。
1.3 观察指标 ①比较试验组与对照组的总性腺激素剂量、促排时间、子宫内膜厚度、启动性腺激素剂量、扳机日血清孕酮和雌二醇水平等临床特征。②比较试验组和对照组试验结果,包括:获卵数目、注射MII卵子数目、卵裂率、囊胚形成率、完全受精失败率、低受精率、正常受精率、总受精率、D3优质胚胎率、D3可利用胚胎率。评估标准如下。优质胚胎:胚胎中碎片程度≤20%,且卵裂球大小均匀,数目7~9个。可利用胚胎:胚胎中碎片≤20%,且卵裂球数目≥5个[7]。③比较试验组和对照组临床结局,包括取卵和移植周期临床妊娠率、种植率、流产率、取卵和移植周期活产率,胚胎种植率=具有胎心搏动的孕囊数目/同移植胚胎数目×100%;临床妊娠率=临床妊娠患者数/进行胚胎移植患者数×100%。妊娠第4周经阴道超声观察到有胎心的孕囊被确定为临床妊娠;在妊娠20周之前失去临床妊娠被认定为流产;分娩至少1名活产婴儿被确定为活产。④比较试验组和空白对照组新生儿结局,包括新生儿出生体质量、双胎率、早产儿率结局、低出生体质量率、大于胎龄儿率。
1.4 统计学方法 采用SPSS22.0软件分析,定量资料用()表示,两组间比较采用t检验,计数资料用率(%)表示,行χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 试验组与对照组一般情况比较 两组总性腺激素剂量、促排时间、子宫内膜厚度、启动性腺激素剂量、扳机日血清孕酮和雌二醇水平均差异不显著(P>0.05)。见表1。
表1 试验组与对照组一般情况比较()
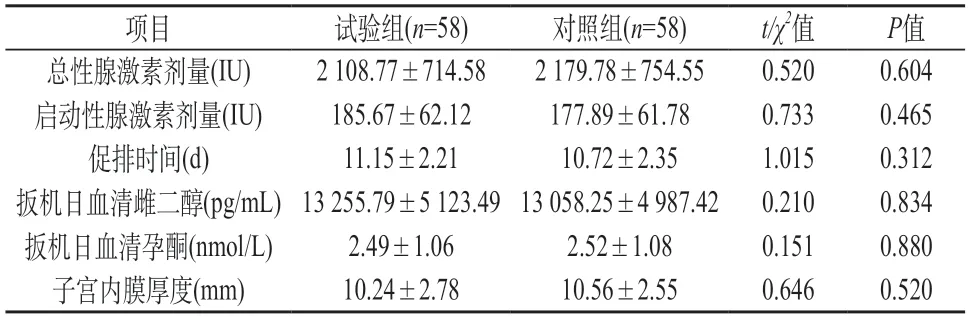
表1 试验组与对照组一般情况比较()
2.2 试验组和对照组受精和胚胎发育情况 试验组和对照组在获卵数目、注射MII卵子数目、卵裂率、囊胚形成率比较差异不显著(P>0.05);试验组完全受精失败率、低受精率显著低于对照组(χ2=46.561,15.253,P<0.05);正常受精率、总受精率、D3优质胚胎率、D3可利用胚胎率显著高于对照组(χ2=339.888,444.509,6.168,7.523,P<0.05)。见表2。
表2 试验组和对照组受精和胚胎发育情况比较[n=58,,(%)]

表2 试验组和对照组受精和胚胎发育情况比较[n=58,,(%)]
2.3 试验组和对照组临床结局比较 试验组在取卵和移植周期临床妊娠率、种植率、取卵和移植周期活产率均显著高于对照组(χ2=27.228,5.447,5.860,28.554,10.290,P<0.05)。试验组和对照组流产率比较差异不显著(χ2=2.438,P>0.05)。见表3。
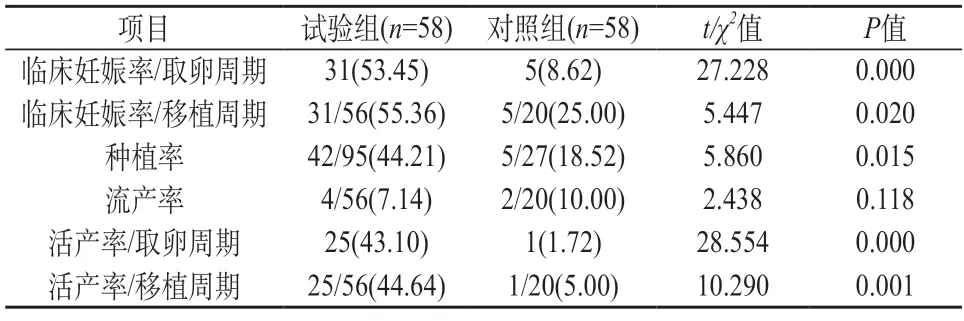
表3 试验组和对照组临床结局比较[n(%)]
2.4 试验组和空白对照组新生儿结局比较 试验组和空白对照组新生儿出生体质量、双胎率、早产儿率结局、低出生体质量率、大于胎龄儿率比较差异均不显著(χ2=1.114,0.007,0.280,0.038,2.436,P>0.05)。见表4。
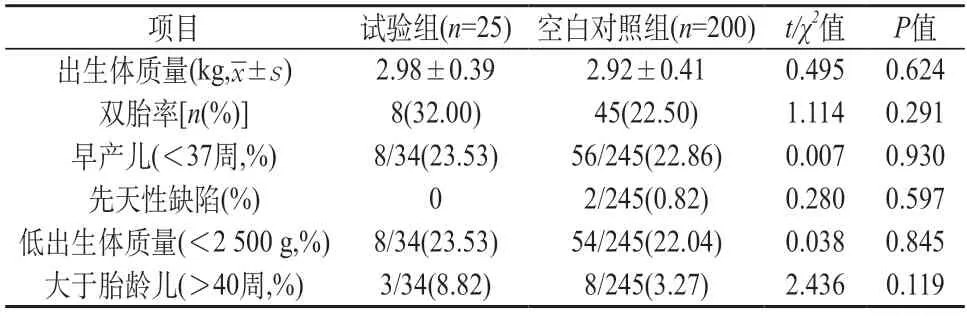
表4 试验组和空白对照组新生儿结局比较
3 讨论
常规体外受精(in vitro fertilization,IVF)受精率为60%~80%,但是仍存在3.5%~20%的受精率低下和完全受精失败的现象[8]。ICSI技术通过将单个精子注入卵胞质内进行受精,有效解决了不孕夫妇中男方及受精障碍等因素导致不育,在治疗男性不育中疗效显著。但ICSI周期中出现完全受精失败的患者仍然还有2%~3%,ICSI后卵子的受精率为70%~80%,成熟卵子中的20%~30%即使注射精子仍无法受精[9]。这多是因为卵母细胞激活失败造成的[10]。注入精子的生物刺激和机械刺激是在ICSI过程中对卵母细胞的主要刺激。当精子进入卵母细胞后会产生一系列的生物反应激活卵母细胞。卵母细胞在针刺进入后会诱发Ca2+波动,但影响并不显著,卵母细胞的酶在完成精子注入后可以修饰精子膜,释放“钙振素”活化卵子,三磷酸肌醇和其他第二信使系统被激活。因此卵母细胞激活失败可能是由ICSI操作过程引发其细胞胞质结构改变导致卵母细胞死亡。有研究表明,磷脂酶C-ζ作为精子赤道板区含有的酶,将其直接注入卵母细胞后,可诱发钙振荡,当精子缺乏磷脂酶C-ζ时会导致受精失败[11]。目前AOA报道中应用包括了钙离子载体激活、化学激活、电激活、注射磷脂酶C-ζcRNA 等方式,其中离子载体在AOA应用效果较好,其作用机制为通过在钙离子载体溶液中暴露卵母细胞,提高卵子胞质中的胞内Ca2+水平,激活下游蛋白级联反应,能够显著提高临床妊娠率[12-13]。
在本研究中,笔者通过建立对照试验观察了因ICSI受精低下或失败再次接受ICSI助孕时进行AOA处理的58例患者,结果显示,试验组和对照组在获卵数目、注射MII卵子数目、卵裂率、囊胚形成率比较差异不显著,试验组完全受精失败率、低受精率显著低于对照组,正常受精率、总受精率、D3优质胚胎率、D3可利用胚胎率、取卵和移植周期临床妊娠率、种植率、取卵和移植周期活产率均显著高于对照组。表明既往ICSI后受精失败患者选择ICSI-AOA技术能够有效提高胚胎发育质量改善其临床结局,有效提高受精率和妊娠率。这一结果与罗阳等[14]和张希等[15]在ICSI-AOA技术中采用离子霉素激活卵母细胞对受精率、胚胎的发育质量影响的试验中所得到的结果相似。结果还表明,试验组和空白对照组新生儿出生体质量、双胎率、早产儿率结局、低出生体质量率、大于胎龄儿率比较差异均不显著。提示ICSI-AOA技术,新生儿结局良好无影响。这与国外的一项关于ICSI-AOA与常规ICSI在双胞胎率、出生体质量等安全性问题的讨论研究结果相同[16]。与Li等[17]在ICSIAOA试验中关于新生儿缺陷类型、出生体质量、分娩时孕周、畸形类型和胎儿性别方面均无显著差异的研究结果相同。
综上所述,既往ICSI后受精失败患者选择ICSIAOA技术能够有效改善其临床结局,有效提高受精率和妊娠率,且新生儿结局良好良好,临床应用价值较高。

