血小板源性转化生长因子β1对胃腺癌细胞增殖和迁移的影响
林有东 李 芳 阮海涛
(1 福建省立医院检验科,福建 福州 350001;2 三明市第一医院药剂科,福建 三明 365000;3 福建医科大学医学技术工程学院/福建中医药大学附属人民医院检验科,福建 福州 350004)
胃癌是全球常见的癌症之一,也是位居病死率第三位的癌症[1]。胃腺癌是胃癌中最常见的组织类型,但其潜在的发生发展机制仍尚未阐明[2]。血小板是巨核细胞脱落而来的细胞质碎片,主要在骨髓、血液和肺中生成[3]。血小板与血栓的形成、止血以及机体的免疫和炎性反应包括肿瘤免疫反应密切相关[4-6]。同时也有很多研究发现,血小板通过其颗粒内的生物活性因子促进肿瘤的发生发展。血小板分泌大量的血小板衍生因子,如转化生长因子β(TGFβ)。TGFβ是一种多功能的细胞因子,它代表一个由33个结构相关的细胞外蛋白组成的超家族,它影响了多种生物学功能,如细胞生长、分化、免疫调节和调控各种肿瘤如胃腺癌、肝癌和乳腺癌等的发生发展[7]。因此,目前研究普遍认为TGFβ是治疗多种癌症潜在的重要靶标。TGFβ共有5种亚型,但在哺乳动物如人类体内仅存在TGFβ1、TGFβ2、TGFβ3,这3种亚型具有相似的作用,其中以TGFβ1最为丰富。人体内的TGFβ主要来源于血小板内的α颗粒。血小板源性的TGFβ1可以通过降低NK细胞介导的细胞毒性的NK组2D(NKG2D)因子及抑制NK细胞的抗肿瘤反应性来降低NK细胞的活性,或者通过降低NK细胞Fas配体和TNF相关的凋亡诱导配体识别和消除肿瘤细胞的作用。血小板源性的TGFβ1也可通过激活TGF-β/Smad和NF-κB通路,诱导上皮细胞间质转化(EMT)促进肿瘤细胞的增殖和转移。也有一些研究认为TGFβ1对肿瘤细胞的作用具有两面性,其参与了肿瘤细胞的免疫逃逸,血小板被肿瘤细胞活化后可能通过纤维蛋白、P-选择素和整合素等分子黏附在肿瘤细胞上形成一层保护物质,使肿瘤细胞避免受到NK细胞的杀伤。体内外试验表明血小板源性的TGFβ1能影响肝癌和卵巢凋亡和转移,但其对胃腺癌细胞生物学行为的影响尚未见报道。因此,本课题探讨血小板源性TGFβ1对胃腺癌细胞增殖和迁移的影响,可以更好地为阐明胃腺癌发生发展的分子机制奠定基础。
1 实验材料与方法
1.1 胃腺癌细胞株 胃腺癌AGS、MKN-45两种细胞株,其中AGS细胞株购买自广州赛诺实验有限公司,MKN-45细胞株为本课题组冻存于福建省立医院检验科细胞室。
1.2 试剂耗材 MKN-45细胞液体培养基DMEM购自赛默飞世尔科技(中国)有限公司;AGS细胞液体培养基F12和PBS缓冲液购自武汉普诺赛生命科技有限公司;胰蛋白酶、青霉素-链霉素混合液和CCK试剂购自北京全式金生物技术有限公司;胎牛血清购自天津市灏洋生物制品科技有限责任公司;siRNA(包括NCsiRNA和TGFβR1-homo-351siRNA)由苏州吉玛基因股份有限公司合成;转染试剂购自上海碧云天生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养 将细胞冻存管从液氮罐中取出复苏,于25 cm2细胞培养瓶各加入5 mL培养液后移至37 ℃、5%二氧化碳培养箱中培养。培养瓶内细胞生长状态良好且无污染,贴壁细胞密度已达到80%以上后进行传代分组备用。
1.3.2 实验分组 CCK增殖实验:细胞定量培养于96孔板,每株细胞设未处理组(without treated)、健康人血小板组(normal)、胃腺癌血小板组(cancer)3组。分别是不加血小板、加健康人血小板、加胃腺癌患者血小板进行共培养。划痕实验:细胞定量培养于6孔板。每株细胞设未处理组(without treated)、健康人血小板组(normal)、胃腺癌血小板组(cancer)、胃腺癌血小板+NCsiRNA组(cancer+NCsiRNA)、胃腺癌血小板+TGFβR1siRNA351(cancer+siRNA351)组共5组,分别是不加血小板、加健康人血小板、加胃腺癌患者血小板、加胃腺癌患者血小板和NcSiRNA、胃腺癌血小板和TGFβR1siRNA351进行共培养。
1.3.3 血小板制备 取健康人或者胃腺癌患者静脉血于无菌玻璃管采血管,以800 rpm离心15 min;吸离心后的上清液于无菌玻璃采血管,3 000 rpm离心10 min;弃上清液,得到浓缩血小板团块,之后加入5 mL无菌生理盐水轻轻吹打混匀,再3 000 rpm离心10 min;再次弃上清液,加入5 mL未加小牛血清和双抗的细胞培养液,轻轻吹打混匀备用,显微镜下计数,调整血小板浓度为2×104个/μL。

图1 血小板显微镜镜下计数(400倍)
1.3.4 siRNA转染 细胞定量培养后细胞密度需达到约70%时转染;在进行转染前,需将每孔内的旧培养液弃去,换成新鲜的已配制的培养液2 mL;取无菌离心管,加125 μL未配制的培养液和5 μLsiRNA,用移液枪轻轻吹打混匀,再加入4 μL转染试剂,再次轻轻吹打混匀,避光存放30 min后使用,所得试剂6 h内可用。
1.3.5 CCK细胞增殖实验 ①取对数生长期的肿瘤细胞,制成细胞悬液。进行细胞计数后,96孔板中按照实验分组每孔接种1 0 μL的细胞悬液(每孔2×10³个细胞),再加入140 μL的培养液,每组共8个复孔,放置于37 ℃、5%二氧化碳培养箱中培养12~24 h。②96孔板置显微镜下观察,确认细胞贴壁生长且有足够细胞密度后,根据分组每孔加入浓度为2×104个/μL血小板悬液40 μL、siRNA与细胞共培养12 h。③培养后每孔加入CCK试剂20 μL,轻轻混匀后继续培养,于添加CCK试剂后0、6、18 h用酶标仪测定450 nm的吸光值。
1.3.6 划痕实验 ①取对数生长期的肿瘤细胞,制成细胞悬液。进行细胞计数后,6孔板中每孔各接种300 μL的细胞悬液(每孔5×104个细胞),再加入2 mL配制好的培养液,放置于37 ℃、5%二氧化碳培养箱中培养24 h。②6孔板置显微镜下观察,确认细胞贴壁生长且有足够细胞密度后,弃去培养液,使用10 μL无菌枪头进行划线。③用PBS溶液洗涤划线后的各孔,以使划下的细胞被洗去。洗涤后置于显微镜下观察并拍照记录(0 h)。④根据分组每孔加入浓度为2×104个/μL血小板悬液1 mL、siRNA与细胞共培养;自接种72 h后于显微镜下拍照,使用软件计算划痕面积。
1.4 统计分析 图表绘制使用GraphPad Prism 9.3.1,划痕实验面积计算使用ImageJ软件,结果分析用SPSS 20.0软件,检验水准为双侧P<0.05有统计学意义。
2 结果
2.1 CCK细胞增殖实验
2.1.1 AGS细胞增殖实验 AGS细胞在加入CCK试剂并进行温浴后0、6、18 h的OD值见表1,3组的OD值均值分别从0 h的1.107、1.320、0.639快速增长到18 h的4.281、4.805、2.112。在18 h时未处理组OD值(4.281±1.362)与健康人血小板组OD值(4.805±1.393),无统计学差异(P>0.05);未处理组OD值(4.281±1.362)高于胃腺癌血小板组OD值(2.112±0.473),有统计学差异(P<0.05);健康人血小板组OD值(4.805±1.393)亦明显高于胃腺癌血小板组;OD值(2.112±0.473),有显著统计学差异(P<0.01)。
表1 AGS细胞CCK增殖实验OD值()

表1 AGS细胞CCK增殖实验OD值()
2.1.2 MKN-45细胞增殖实验 MKN-45细胞在加入CCK试剂并温浴后0、6、18 h的OD值见表2。3组的均值分别从0.303、0.397、0.370增长到4.924、4.965、0.988。在18 h时未处理组OD值(4.924±1.102)与健康人血小板组OD值(4.965±1.207)比较变化不大(P>0.05);未处理组与健康人血小板组OD值均明显高于胃腺癌血小板组OD值,差异有显著性(P<0.01)。
表2 MKN-45细胞CCK增殖实验OD值()
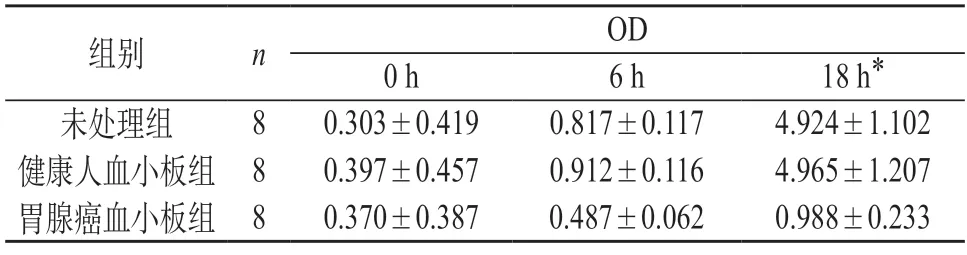
表2 MKN-45细胞CCK增殖实验OD值()
2.2 划痕实验
2.2.1 AGS细胞划痕实验 AGS细胞划线培养72 h后AGS细胞的各组细胞划痕的面积如图2、图3和表3所示。未处理组划痕面积(2.393±0.370)与健康人血小板组(2.748±0.214)无差别(P>0.05);胃腺癌血小板组的划痕几乎被AGS细胞迁移覆盖,其划痕面积(0.799±0.141)均明显小于未处理组、健康人血小板组与胃腺癌血小板加TGFβR1siRNA351组的划痕面积(2.393±0.370、2.748±0.214、2.670±0.387,P<0.01);而胃腺癌血小板加TGFβR1siRNA351组的划痕面积(2.670±0.387)明显大于胃腺癌血小板加NCsiRNA组(0.714±0.103,P<0.01)。
表3 AGS细胞各组划痕面积()

表3 AGS细胞各组划痕面积()
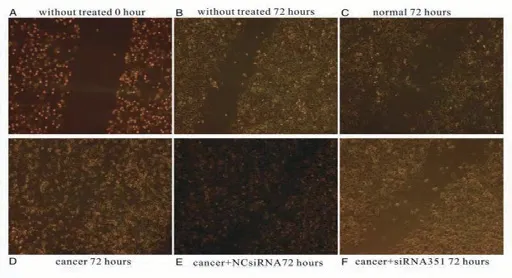
图2 AGS细胞各组划痕

图3 AGS细胞各组划痕面积
2.2.2 MKN-45细胞划痕实验 细胞划线培养72 h后MKN-45细胞的各组划痕的面积如图4、图5和表4所示。未处理组划痕面积(5.742±0.288)与健康人血小板组(6.182±0.106)无差别(P>0.05);胃腺癌血小板组的划痕大部分被MKN-45迁移,其划痕面积(1.304±0.288)均明显小于未处理组、健康人血小板组与胃腺癌血小板加TGFβR1siRNA351组的划痕面积(5.742±0.288)、(6.182±0.106)、(4.078±0.458),均P<0.01;而胃腺癌血小板加TGFβR1si-RNA351组的划痕面积(4.078±0.458)明显大于胃腺癌血小板加NCsiRNA组(1.585±0.749),P<0.01。
表4 MKN-45细胞各组划痕面积()

表4 MKN-45细胞各组划痕面积()

图4 MKN-45细胞各组划痕

图5 MKN-45细胞各组划痕面积
3 讨论
胃腺癌目前仍然是严重威胁人类健康的恶性肿瘤之一,但控制肿瘤的增殖与转移是尚未解决的一大难题[8-9]。因此,研究胃腺癌细胞增殖与迁移的机制具有重要的价值。本研究为明确血小板源性的TGFβ1是否对胃腺癌细胞的增殖和迁移产生影响,我们选择了AGS和MKN-45两株胃腺癌细胞同时进行体外试验,使用两株细胞提高了实验结果的可靠性[10-12]。
AGS细胞的CCK增殖实验时我们发现,在加入CCK试剂并进行4 h的孵育后,在进行0 h的第1次吸光度测定时,有加入siRNA和转染剂的两组(NCsiRNA与TGFβR1siRNA)所测定的吸光度较接近且均低于未处理组和健康人血小板组。但在同样条件处理下,MKN-45细胞测定的实验结果并没有这种情况,在0 h时,MKN-45细胞的4组实验所测得的吸光度较为接近,因此,我们推测加入的siRNA或转染试剂对AGS细胞具有毒性作用[13]。另外,本研究发现AGS细胞的胃腺癌血小板+NCsiRNA组与胃腺癌血小板+TGFβR1siRNA组之间CCK实验的OD值没有差别,证明血小板源性的TGFβ1对胃腺癌细胞的增殖没有影响。基于以上2个原因,CCK实验只比较了未处理组、健康人血小板组与胃腺癌血小板组的结果。
两株细胞CCK增殖实验结果均表明,未处理组与健康人血小板组两组细胞的增殖差异较小,提示加入健康人血小板不影响胃腺癌细胞的增殖;两株细胞和胃腺癌血小板共培养后,随着培养时间的增加,胃腺癌血小板组的细胞增殖程度明显低于另外两组,结果提示胃腺癌患者的血小板在体外可以抑制胃腺癌细胞的增殖[14]。
AGS细胞和MKN-45细胞的划痕实验结果显示,划线72 h后未处理组与健康人血小板组划痕面积基本相同,汇合度无明显变化,提示健康人血小板对胃腺癌细胞的迁移无明显影响。胃腺癌血小板组划线72 h后划痕内出现大量胃腺癌细胞,划痕面积明显小于未处理组与健康人血小板组,此结果表明胃腺癌患者的血小板在体外可以促进胃腺癌细胞的迁移[15]。
胃腺癌血小板+NCsiRNA组作为利用siRNA进行基因敲减的阴性对照,我们发现胃腺癌血小板+TGFβR1siRNA351组的划痕面积明显增大,进一步证明了胃腺癌细胞的TGFβR1被siRNA351抑制后,胃腺癌细胞的迁移能力较未抑制前明显下降。划痕实验结果证明胃腺癌患者血小板源性的TGFβ1在体外促进了胃腺癌细胞的迁移。
Plantureux等[16]于2020年发表的研究报道通过体内动物实验表明,直肠癌患者的血小板可以抑制结直肠癌细胞的增殖及促进其迁移。我们的实验结果与此报道的结果一致。但由于本实验为体外细胞实验,具有一定的局限性。为进一步探讨血小板对胃腺癌的影响,我们须完善动物体内实验。

