基于Web of Science肺癌手术联合新辅助免疫治疗研究的可视化分析
汪 玲,刘彩霞
肺癌是目前全球常见的恶性肿瘤之一,我国肺癌的发病率和病死率均高居恶性肿瘤之首,严重危害人民健康[1]。新辅助免疫治疗通过术前激活病人体内的先天性免疫和特异性免疫系统,诱导肿瘤浸润免疫细胞发挥作用,直接杀伤病人体内肿瘤细胞,降低肿瘤分期,提高病人机体免疫功能及生存率,进而使病人获得更明显、更持久的疗效,达到长期生存获益。肺癌病人术后应用新辅助免疫治疗有助于防止疾病复发[2-7]。手术联合新辅助免疫治疗方案为肺癌治疗开启了新篇章,但免疫治疗也会产生差异性[8],如何将手术联合新辅助免疫治疗的获益最大化是我们目前的挑战。本研究采用CiteSpace 6.1.R4软件对Web of Science数据库2000—2022年肺癌手术联合新辅助免疫治疗的文献进行可视化分析,为今后肺癌的相关治疗进行更深层次的研究提供借鉴。
1 资料与方法
1.1 数据来源
检索Web of Science数据库中关于肺癌手术联合新辅助免疫治疗的相关文献,检索时段为2000年1月1日—2022年12月4日,英文主题词检索策略为(“pulmonary cancer” OR “lung neoplasm”,“lung cancer” OR “small cell lung cancer” OR “non-small cell lung cancer”,“SCLC” OR “NSCLC”) AND (“lobectomy” OR “pulmonary lobectomy” OR “radical resection” OR “surgery”) AND (“immune checkpoint inhibitor” OR “immunotherapy”)。经人工分析文献内容,剔除文摘、重复发表的文献、与主题无关的文献、会议摘要、科普宣传等。
1.2 数据分析
运用CiteSpace 6.1.R4软件对肺癌手术联合新辅助免疫治疗的研究力量、热点及前沿进行可视化分析。设置分析时间为2000—2022年,绘制国家合作图谱、文献共被引图谱、关键词共现图谱、共被引聚类标签的时间轴视图。
2 结果
2.1 研究文献基本概况
经人工分析筛选、剔除与主题不相关的文献,利用CiteSpace 6.1.R4软件剔除重复文献,最终纳入280篇。Web of Science数据库显示肺癌手术联合新辅助免疫治疗相关文献最早发表于2009年,此后缓慢增加,从2019年起发文量增加趋势显著,呈快速增长态势,2022年年发文量高达92篇,结果见图1。
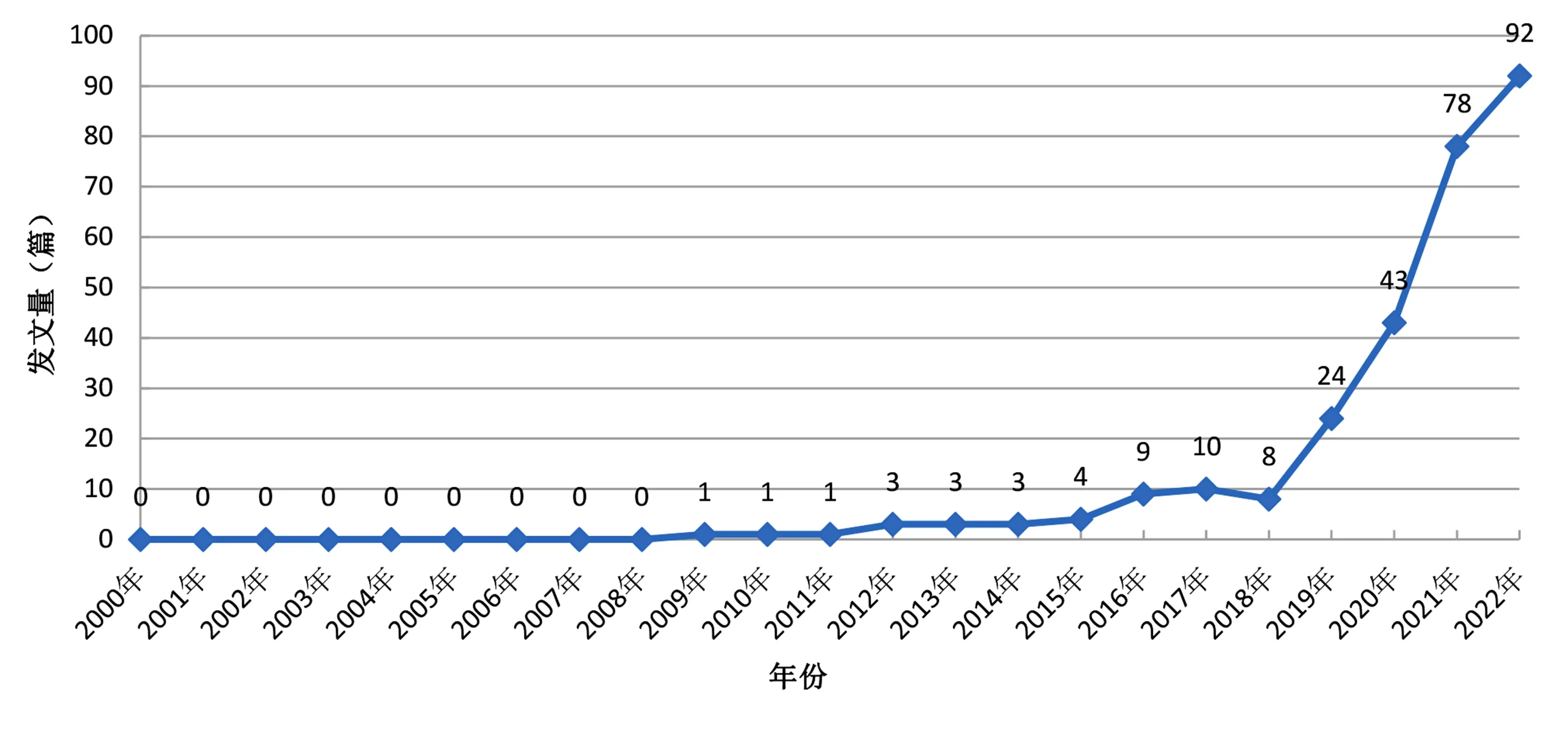
图1 2000—2022年肺癌手术联合新辅助免疫治疗研究发文量趋势
2.2 研究国别图谱分析
CiteSpace能将不同国家关于肺癌手术联合新辅助免疫治疗研究文献的数量以年轮形式直观地展示,如图2所示圆圈节点的大小代表国家的发文量。关于肺癌手术联合新辅助免疫治疗发文量排名前5位的国家为PEOPLES R CHINA(中国)、USA(美国)、JAPAN(日本)、ITALY(意大利)、SPAIN(西班牙),其中中国的发文量高于其他国家,对于手术联合免疫治疗的关注度最高。节点之间连线的颜色代表了各国初始合作时间,连线的数量代表了与之合作的国家数量。总体而言,对于肺癌手术联合新辅助免疫治疗的研究各国之间的连线较稀疏,且偏暖色,深色连线较少,说明各国之间合作较少,开始合作时间较晚。美国的中心性为0.44,而我国的中心性为0.29,说明美国在肺癌手术联合新辅助免疫治疗的研究中仍占据着重要地位。
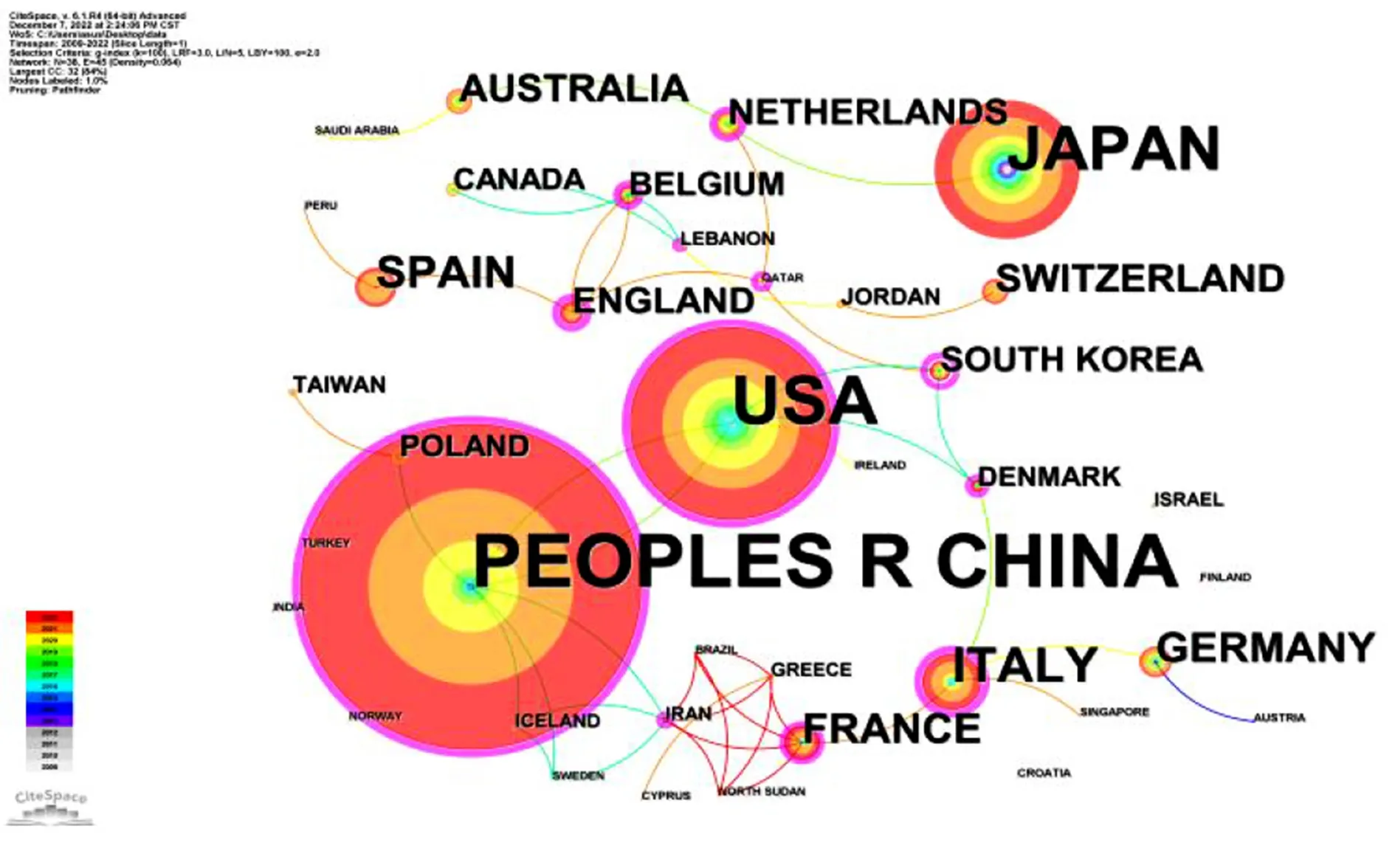
图2 2000—2022年肺癌手术联合新辅助免疫治疗发文国家合作关系网络图
2.3 共被引文献图谱分析
共被引文献表明其在相关领域内具有重要影响,图3是共被引文献的可视化图谱,引用次数最多的6篇文献[9-14]均是临床研究。被引量最高的6篇文献对单抗治疗(帕博利珠单抗、阿替利珠单抗)或者新辅助免疫治疗联合化疗治疗可切除非小细胞肺癌(non-small cell lung cancer,NSCLC)的关注度最高,此外研究者关注免疫抑制分子、肺癌的TNM分期(tumor node metastasis classification)等方面的研究主题,主要发表于NEWENGLJMED、LANCETONCOL等高水平杂志,代表了当下的主要研究方向,引领且推动了该领域的进一步研究。
2.4 研究的关键词共现图谱分析
关键词共现是对当前研究问题的集中表达,描述研究的前沿[15]。肺癌手术联合新辅助免疫治疗研究关键词集中于肺癌(lung cancer)、免疫治疗(immunotherapy)、手术(surgery)、新辅助治疗(neoadjuvant therapy)、免疫检查点抑制剂(immune checkpoint inhibitor)、化学疗法(chemotherapy)、肺切除(lung resection)、程序性死亡蛋白-1(pd-1)等,结果见图4。图5显示,癌症(cancer/testis antigen)、局部淋巴结的淋巴细胞(regional lymph node lymphocyte)、调节性T细胞(regulatory t cell)、免疫逃逸机制(immune escape mechanism)突现强度较强。
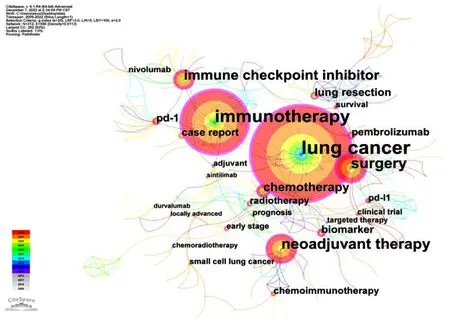
图4 2000—2022年肺癌手术联合新辅助免疫治疗的关键词共现图

图5 2000—2022年肺癌手术联合新辅助免疫治疗的关键词突现图
2.5 研究共被引聚类标签的时间轴视图分析
X轴为关键词所在年份,Y轴为关键词所属聚类标签,将同一聚类中的关键词按照时间顺序排列在同一时间线上,得到研究共被引聚类标签的时间轴视图,见图6。按10个聚类出现的先后顺序可将肺癌手术联合新辅助免疫治疗研究趋势大致分为3个阶段。第一阶段:#0聚类——肺叶切除(lobectomy)、#1聚类——免疫治疗(immunotherapy),关于此类研究出现的时间最早、持续时间长且与其他聚类联系紧密,主要关注于肺癌的手术治疗和免疫治疗等治疗方法。第二阶段:#2聚类——纳武利尤单抗(nivolumab)、#3聚类——化学疗法(chemotherapy)、#4聚类——生存率(survival)、#5聚类——程序性死亡蛋白配体-1(pd-l1)、#6聚类——生物标志物(biomarker)、#7聚类——化学免疫治疗(chemoimmunotherapy)、#8聚类——免疫检查点抑制剂(immune checkpoint inhibitor),此阶段对肺癌免疫治疗的各个方面的关注度相继出现,对肺癌手术联合新辅助免疫治疗进行了更深层次的研究。第三阶段:#9聚类——筛查(screening),此阶段肺癌筛查的相关研究开始萌芽。相对于其他聚类热度,关于肺癌筛查出现的时间较晚。
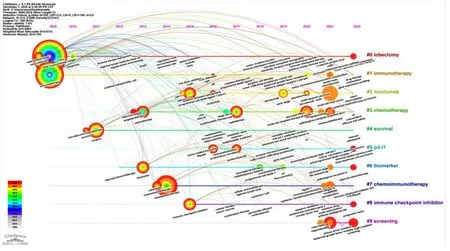
图6 2000—2022年肺癌手术联合新辅助免疫治疗研究文献共被引聚类时间轴视图
3 讨论
3.1 研究文献、国别分析
2019—2022年肺癌手术联合新辅助免疫治疗相关文献年发文量呈快速增长趋势,说明对此领域关注度越来越高,未来此领域的研究依然呈增长态势。我国发文量高于其他国家,但连线较稀疏且偏暖色,说明与他国的联系较少,这是目前各国普遍存在的问题。美国的中心性高于其他国家,具有较高的学术影响力,日后开展肺癌手术联合新辅助免疫治疗相关研究时可加强与美国等国的合作。
3.2 共被引文献分析
引用较多的文献是关于单抗治疗或者新辅助免疫治疗联合化疗治疗可切除非小细胞肺癌方面的文献,其中对于单抗的研究文献引用较多。研究显示不良事件通常与培美曲塞和铂类药物的化疗方案相关,与帕博利珠单抗无关[12]。与联合化疗相比,帕博利珠单抗能减少不良事件的发生和提高生存率[11],说明开展肺癌手术联合新辅助免疫治疗需依赖于免疫治疗更深层次的研究结果,新辅助疗法是一个相对较新的领域,需要我们更多地研究[16]。日后研究者可多关注和开展免疫检查点抑制剂、生物标志物、新辅助免疫治疗临床试验、新辅助免疫联合手术治疗等相关研究。
3.3 研究热点前沿分析和未来趋势
肺癌手术联合新辅助免疫治疗研究热点集中于肺癌、免疫治疗、手术、新辅助治疗、免疫检查点抑制剂、化学疗法、肺切除、程序性死亡蛋白-1等方面。目前,美国临床肿瘤学会、欧洲肿瘤内科学会、美国国立综合癌症网络和日本肺癌协会等制定的指南指出[17-18]:Ⅰ期、Ⅱ期NSCLC采用根治性手术治疗;Ⅲ期NSCLC通常采用多模式方法治疗,包括手术、化疗和放疗;Ⅳ期或复发性NSCLC病人接受全身药物治疗,包括化疗和免疫检查点抑制剂治疗。
随着多学科诊疗模式的开展、微创技术的改进和快速康复的实施,以病人为中心的多学科讨论为肺癌病人提供了新型治疗方式,包括免疫检查点抑制剂联合或不联合化疗、立体定向放疗和靶向全身治疗,为手术切除NSCLC的治愈提供最佳机会。虽然化疗和放疗在肺癌的管理中发挥作用,但针对早期和局部晚期肺癌病人,手术治疗仍然是治疗肺癌的重要方式,最近免疫疗法、靶向治疗、预测性生物标志物的发展改善了可手术NSCLC病人的生存结果[19]。免疫治疗中程序性死亡蛋白-1抑制剂或程序性死亡蛋白配体-1抑制剂可以激活病人自身的免疫系统,使肿瘤特异性T细胞更好地识别和消除癌细胞和肿瘤组织。与化疗和靶向药物相比,免疫治疗的最大特点不是利用抑制剂将癌细胞本身消灭,而是通过宿主的免疫反应杀死癌细胞,从而使病人自身的免疫功能恢复正常[20]。未来研究方向重点关注Ⅰ~Ⅳ期NSCLC手术治疗的适应证、多模式治疗肺癌方法以及相关护理措施。
3.4 研究的局限性
本研究对肺癌手术联合新辅助免疫治疗研究的可视化分析存在一定的局限性:由于CiteSpace软件自身的限制,本研究数据仅来源于Web of Science数据库,未对PubMed等数据库进行检索分析。
4 小结
本研究采用文献计量学方法呈现了2000—2022年肺癌手术联合新辅助免疫治疗的研究热点,研究结果可为此领域研究方向提供参考。新辅助免疫治疗和靶向治疗彻底改变了肺癌的治疗方式,而关于免疫检查点抑制剂、预测性生物标志物、新辅助免疫治疗临床试验、新辅助治疗最佳联合方法、免疫治疗需求等方面的问题仍需更多研究来解决,以此在肺癌治疗领域实现精准医学,提高肺癌病人术后生存率,提高病人的生活质量。

