有机解磷菌对天鹅湖潟湖沉积物中磷释放的影响
马凯,谢嘉慧,魏烈群,姜晓静,高丽
(烟台大学海洋学院,山东 烟台 264005)
磷是导致大多数水体富营养化的重要诱因,当外源输入减缓或得到有效控制的情况下,沉积物内源磷的释放可使湖泊等水体长时间处于富营养化状态[1]。微生物作为生态系统中的分解者,在水圈生境氮、磷等生源要素的循环过程中发挥着关键的驱动作用,从而影响着水体的营养状态[2]。研究表明,沉积物中解磷菌的溶磷作用可使上覆水的可溶性磷水平明显升高,从而为有害藻华的暴发提供了必要条件[3-4]。近年来,解磷菌在水体磷循环过程中的作用机制越来越受到关注。
有机解磷菌(OPB)可通过分泌磷酸酶、植酸酶等促进有机磷矿化,其中碱性磷酸酶在水体磷循环过程中起着重要作用,其活性与解磷量关系密切[5-6]。在太湖,沉积物中碱性磷酸酶活性(APA)与OPB数量呈正相关关系[7],解磷菌数量是影响解磷能力的重要因素。已有模拟研究证实,接种解磷菌可改变水体的pH、Eh等理化因子,并对沉积物中磷的释放具有一定促进作用,但解磷效果与解磷菌的种类、数量以及沉积物磷的赋存形态等有关[8-9]。Qu 等[9]将类芽孢杆菌属(Paenibillus sp.)菌株接种至沉积物中,发现其可改变水体pH 和金属离子浓度,并促进沉积物磷的释放。由此可见,解磷菌是影响沉积物内源磷释放的重要生物因子。研究表明,不同生境中解磷菌的优势种属及解磷能力均存在较大差异[8,10]。目前沉积物解磷菌的相关研究多集中于淡水湖泊和河口水域,解磷能力评估大多在培养基条件下进行,而针对大型藻华暴发的潟湖中OPB 的种属及其对沉积物的解磷效果鲜见报道。
荣成天鹅湖是位于山东半岛的天然潟湖,东南端与荣成湾相连,受潮汐影响水体交换频繁,其生境与湖泊、河流等水体差异较大。近年来,由于污水排放、水产养殖等人为活动影响,丝状硬毛藻(Chaetomor⁃pha spp.)在湖内常年暴发,导致鳗草(Zostera marina)数量明显减少,并对底栖生物的生存造成了一定威胁[11]。此外,藻体死亡后大量堆积于沉积物表面,使得沉积物内源污染加剧[12]。天鹅湖湿地因其独特的地理位置和生境特性而具有较高的科研价值。本研究对天鹅湖冬季沉积物中OPB 进行了分离和鉴定,并探究了不同OPB 菌株对藻华区沉积物磷释放的影响,以期明确OPB 在沉积物磷释放过程中的作用,旨在为进一步阐明潟湖生境中OPB 的解磷机制提供参考,并为近海藻华水体内源污染的治理提供依据。
1 材料与方法
1.1 供试材料
2020 年1 月,在天鹅湖的西部(37°20'53″ N,122°33'33″ E)和湖中心(37°20'49″ N,122°34'11″E)用柱状采泥器采集表层沉积物(0~5 cm),沉积物室内冷冻保存(-20 ℃),用于OPB的分离筛选。
2021 年12 月,在湖中心采集表层5 cm 沉积物和底层湖水,用于接种模拟试验;该区域水位较深,沉积物为黏质,有大量硬毛藻和鳗草生长。沉积物样品放入冷藏箱中尽快送至实验室,分析磷形态和APA,其余样品4 ℃冷藏供模拟试验使用。湖水一部分进行煮沸,供灭菌组处理使用。底层湖水pH 为8.49,盐度为28.33‰,总磷(TP)和可溶性磷浓度分别为0.009 mg·L-1和0.004 mg·L-1。
1.2 研究方法
1.2.1 沉积物中解磷菌的分离鉴定
利用选择性培养基对沉积物中OPB 进行筛选分离。具体步骤:称取1 g 沉积物样品加入到99 mL 蒙金娜有机磷液体培养基中,振荡富集培养24 h,稀释后涂布于蒙金娜有机磷固体培养基,在30 ℃条件下培养2~7 d。培养过程中,出现明显透明圈的菌落视为具有解磷能力的菌株,经多次划线纯化后进行16S rDNA测序鉴定,并构建系统发育树。
1.2.2 不同解磷菌菌株对藻华区沉积物磷释放的影响
试验材料为湖中心的新鲜沉积物、底层湖水及3株代表性OPB[OPB3:嗜热脂肪地芽孢杆菌(Geobacil⁃lus stearothermophilus);OPB10:弯曲芽孢杆菌(Bacil⁃lus flexus);OPB11:短小芽孢杆菌(Bacillus altitudi⁃nis)]。试验分为灭菌和非灭菌两组,每组设置5 个处理:沉积物+湖水(CK1)、沉积物+湖水+葡萄糖(CK2)、沉积物+湖水+葡萄糖+OPB3、沉积物+湖水+葡萄糖+OPB10、沉积物+湖水+葡萄糖+OPB11。添加葡萄糖的目的是给菌株生长提供能量和碳源。灭菌组沉积物采用高温方式灭菌(121 ℃,30 min),湖水进行煮沸灭菌。设置非灭菌组是为了分析土著微生物存在条件下解磷菌接种对沉积物磷释放的影响。操作步骤:称取300 g沉积物平铺于烧杯(2.0 L)底部,根据处理不同分别加入20 mL 菌液(OD600约为0.8)和3 g 葡萄糖,混匀后加入1.8 L 湖水。每个处理设3 次重复,试验周期为15 d。
1.3 样品采集与测定
试验过程中,每2 d 用注射器在沉积物-水界面上方3 cm处采集水样,分析上覆水TP浓度,并原位测定界面的pH 和溶解氧(DO)浓度;在试验结束时,测定沉积物的APA 和各形态磷含量。界面pH 采用多参数分析仪(SG78)测定;DO 采用溶氧仪(SG6-FK2)测定;水体TP采用过硫酸钾消解,钼锑抗分光光度法测定[13];沉积物APA 分析采用对硝基磷酸苯二钠法[14],磷形态采用化学连续提取法[15]。
1.4 统计分析
利用Origin 2021 软件制图;采用SPSS 27.0 软件进行方差分析、相关性分析以及T 检验,在灭菌组和非灭菌组的各处理间分别进行差异显著性检验(Dun⁃can法,P<0.05)。
2 结果与分析
2.1 沉积物中OPB的筛选和鉴定
如图1 所示,经过多次传代培养,从天鹅湖冬季表层沉积物中共筛选得到11 株OPB。在湖西部沉积物中共分离纯化出4 株具有解磷能力的菌株(OPB1~OPB4),其中OPB1 和OPB3 的透明圈直径比(D/d)较大,范围分别为1.65~2.06和1.23~2.17。与湖西部相比,湖中心沉积物中解磷菌种类较为丰富(OPB5~OPB11),且大部分菌株的解磷能力较强。湖中心解磷菌中OPB5、OPB6 和OPB10 的D/d 值较大,其中OPB10的D/d值为3.89~4.11,为已筛选菌株的最大值,初步判断其具有较强的解磷能力。
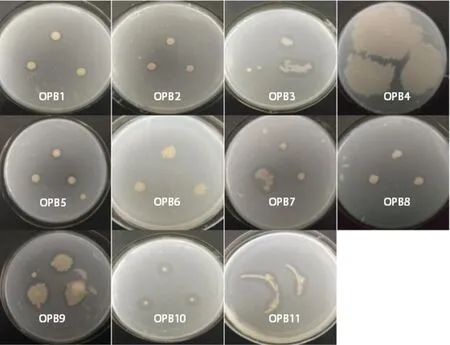
图1 11株OPB在蒙金娜有机磷培养基上的菌落形态Figure 1 Colony morphology of eleven organic phosphate-solubilizing bacterial strains on Mengjinna organic phosphorus medium
对分离纯化的菌株进行16S rDNA 基因测序,用MEGA X 软件构建系统进化树(bootstrap 值为1 000,图2)。初步结果表明,解磷菌株中有10株属于Bacil⁃lus sp.,1 株属于Geobacillus sp.。依据《伯杰细菌鉴定手册》[16],结合其形态特征和16S rDNA 序列,判断OPB1 为Bacillus cereus,OPB2 为Bacillus paramy⁃codies,OPB3 为Geobacillus stearothermophilus,OPB4、OPB7、OPB11 均为Bacillus altitudinis,OPB5 为Bacil⁃lus thuringiensis,OPB6 为 Bacillus stratosphericus,OPB8、OPB10 为Bacillus flexus,OPB9 为Bacillus pumi⁃lus。
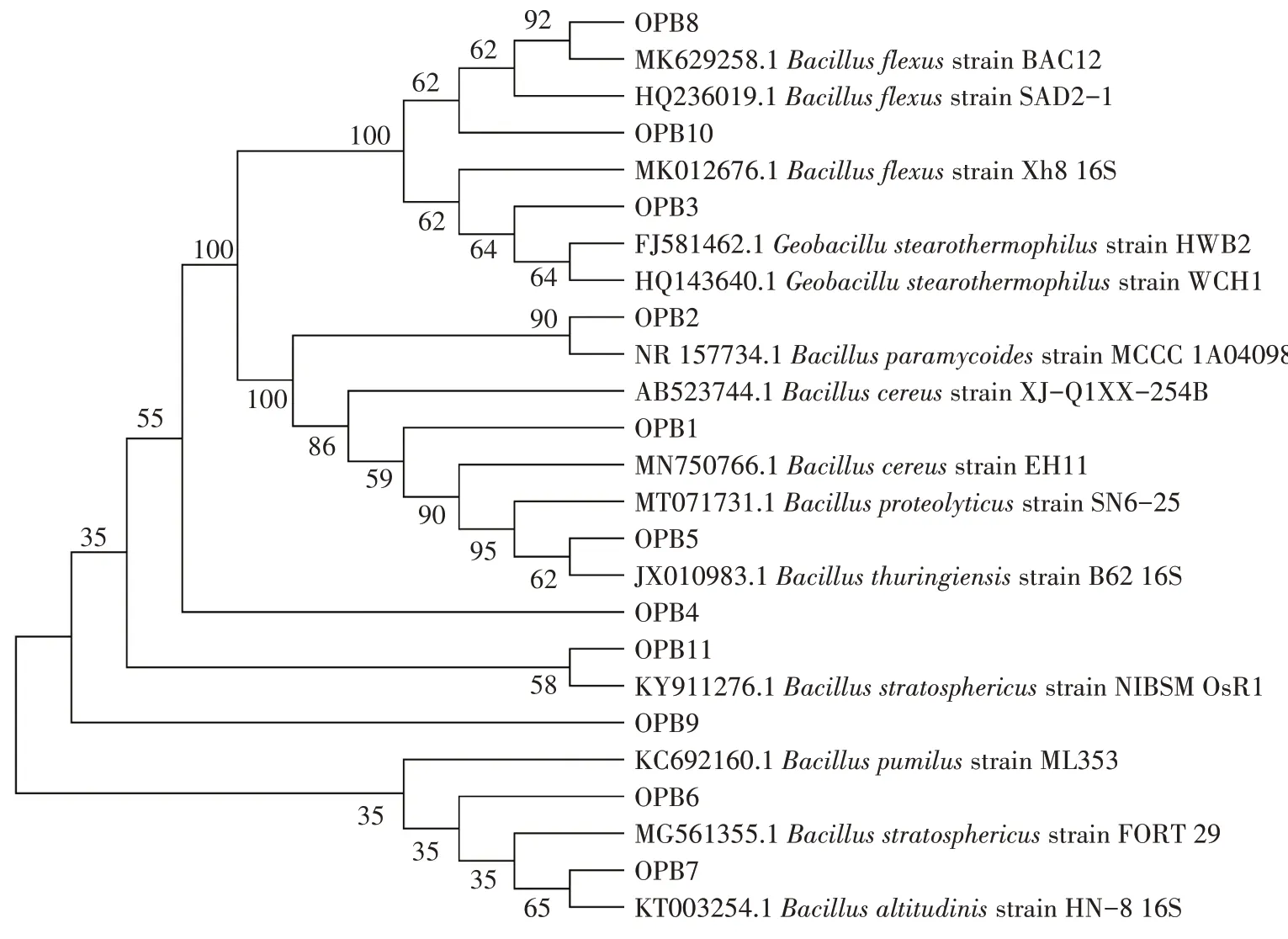
图2 基于16S rDNA 序列构建的11株OPB的系统发育树Figure 2 Phylogenetic tree of eleven organic phosphate-solubilizing bacterial strains based on 16S rDNA gene sequences
2.2 培养过程中沉积物-水界面理化因子的变化
2.2.1 DO浓度的变化
由图3a 可见,试验期间灭菌组各处理水体的DO浓度整体呈下降趋势(除CK1 外)。3 个接种处理的DO 浓度均在试验前期迅速降低,很快达厌氧状态,其中OPB11 处理降幅最大,中后期浓度基本稳定(1.55~2.49 mg·L-1)。不同处理相比,3 个接种处理水体DO 浓度均低于两对照(CK1、CK2),其中与CK1 差异达显著水平(P<0.05),但不同菌株处理间差异不显著(P>0.05)。
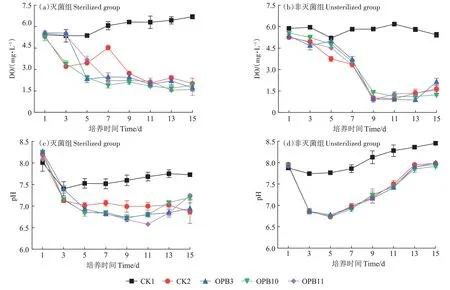
图3 不同处理下沉积物-水界面pH和DO浓度的变化Figure 3 Changes in pH and dissolved oxygen concentration at the sediment-water interface under different treatments
非灭菌组各处理DO 浓度为0.87~6.18 mg·L-1(图3b),与灭菌组相比,其试验后期厌氧状态更为明显。除CK1 在试验期间变化较小外,其余处理DO 浓度均表现为在前9 d急剧下降,处于严重厌氧状态,后期变化较小。试验结束时,OPB3 处理DO 浓度显著高于OPB10 和OPB11 处理。在试验后期,大多数处理在非灭菌条件下的DO 浓度低于灭菌组,其中OPB10 处理在两者间的差异达显著水平(P<0.05)。
2.2.2 pH的变化
图3c 显示,试验期间灭菌组各处理水体pH 变幅为6.58~8.01,随时间延长呈降低趋势。在试验前5 d,各处理间的差异不明显(除CK1外),之后随着试验进行差异逐渐变大。在第11 天,接种处理pH 表现为OPB11 处理显著低于OPB3 和OPB10 处理(P<0.05),且3 个接种处理与对照间的差异均达显著水平。在非灭菌组(图3d),水体pH 变幅为6.73~8.45,各处理pH 随时间延长均呈先下降后上升的变化趋势。不同处理相比,各接种处理pH 均显著低于CK1。在试验后期,非灭菌组各接种处理的水体pH均高于灭菌组。
2.3 OPB接种对上覆水TP浓度影响
试验过程中,灭菌组水体TP 浓度随时间延长呈迅速上升趋势,变幅为0.049~0.335 mg·L-1(图4a)。在试验前3 d,大多数处理TP 浓度有所下降,但处理间差异较小;随着试验进行,各处理TP浓度均大幅增加。在第13 天,不同处理间的差异较大,其中OPB10处理显著高于CK1 和OPB3 处理,OPB11 处理显著高于CK1(P<0.05)。在试验结束时,OPB10 处理TP 浓度达最高,为0.335 mg·L-1。总体来说,OPB 的接种使得水体TP 浓度明显增加,不同菌株表现为OPB10>OPB11>OPB3。
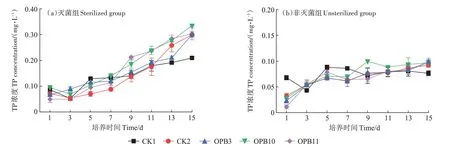
图4 不同处理下水体TP浓度的变化Figure 4 Changes in total phosphorus concentration in water under different treatments
在非灭菌组,试验期间水体TP 浓度变幅为0.011~0.100 mg·L-1(图4b)。与灭菌组相比,各处理TP 浓度随时间的延长增幅较小。其中OPB11处理变化最大,结束时的TP 浓度较初始值增加了0.085 mg·L-1;其余2 个接种处理增幅也均高于对照。在第9天,各处理间的差异较为明显,表现为OPB10>OPB3、CK2>CK1>OPB11,其中OPB10 处理显著高于CK1 和OPB11 处理(P<0.05)。对3 个接种处理而言,非灭菌条件下水体菌株的TP 浓度均显著低于灭菌组(P<0.05),其中OPB10处理的差异最大(0.235 mg·L-1)。
2.4 沉积物磷形态及APA的变化
2.4.1 试验前后沉积物中磷形态的变化
试验前后沉积物中各形态磷的含量如图5 所示。在试验结束时,灭菌组弱吸附态磷(NH4Cl-P)含量变幅为1.28~2.07 mg·kg-1(图5a),各接种处理均比初始值显著增加,表现为OPB3 和OPB10 处理显著高于初始值、CK1 和OPB11 处理(P<0.05),而OPB11 含量较低;非灭菌组NH4Cl-P 含量明显低于灭菌组,其中OPB3处理低于初始值,而OPB10处理显著高于CK1。试验结束时,灭菌组各处理的可还原态磷(BD-P)含量相较于初始值均有所下降(图5b),其中OPB10 处理显著低于初始值和CK1;在非灭菌组,CK1的BD-P含量最高,与OPB11 处理间差异显著(P<0.05),不同接种处理的含量顺序为OPB3>OPB10>OPB11。
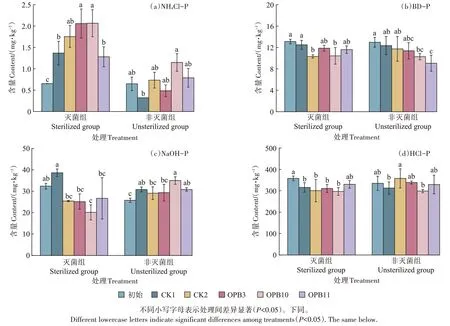
图5 不同处理下沉积物中各形态磷的含量Figure 5 Contents of different phosphorus forms in sediments under different treatments
就铁铝结合态磷(NaOH-P)而言(图5c),灭菌组的含量变幅为20.12~38.62 mg·kg-1,不同处理表现为CK1>OPB11>CK2、OPB3>OPB10,其中CK1 与其余处理间的差异均达显著水平,3 个接种处理间差异不显著;非灭菌组各处理中OPB10 处理较高,与CK2 和OPB3 间差异达显著水平(P<0.05)。钙结合态磷(HCl-P)为天鹅湖沉积物中含量最高的磷形态,试验结束时除OPB11 处理外,灭菌组其余各处理含量均显著低于初始值(图5d),但处理间差异不显著(P>0.05);非灭菌组HCl-P 含量变幅为298.90~357.86 mg·kg-1,不同接种处理表现为OPB3>OPB11>OPB10。
2.4.2 试验前后沉积物中APA的变化
试验结束时,各接种处理沉积物的APA 总体表现为非灭菌组高于灭菌组(图6)。灭菌组APA 变幅为0.66~1.58 μmol·g-1·h-1,不同接种处理大小为OPB3>OPB10>OPB11,其中OPB3 显著高于其余2 个菌株(P<0.05);OPB3 和OPB10 处理的APA 分别是CK1的2.40倍和1.87倍。在非灭菌组,试验结束时沉积物APA 变幅为1.18~1.66 μmol·g-1·h-1。除CK1 外,各处理APA 较初始值(0.81 μmol·g-1·h-1)均有所增加,其中3 个接种处理显著高于对照(P<0.05),但不同菌株间差异不显著(P>0.05)。对同一菌株而言,非灭菌条件下沉积物的APA 高于灭菌组,其中OPB11处理在两者间的差异最大。
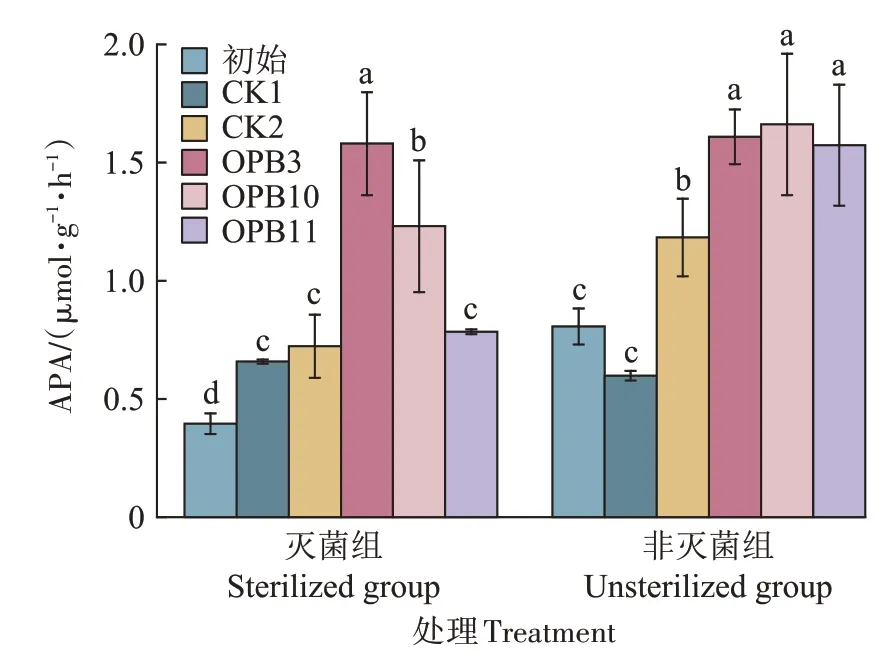
图6 不同处理下沉积物中APAFigure 6 Alkaline phosphatase activity in sediments under different treatments
3 讨论
3.1 解磷菌接种对水体理化因子的影响
近年来,解磷微生物在水体磷生物地球化学循环中的作用日益受到关注。研究表明,解磷菌接种可使水体理化性质发生一定变化,进而影响到沉积物中磷的释放[17-20]。例如,Maitra 等[3]发现,解磷菌可通过降低pH直接促进沉积物钙结合态磷的释放。本试验表明,灭菌组不同处理间DO 浓度存在明显差异,除空白对照CK1外,其余处理均随培养时间延长而大幅降低。3 个接种处理DO 浓度显著降低,沉积物-水界面很快呈厌氧状态,这主要是解磷菌呼吸作用消耗大量氧气所致[21],其中生长速度较快的OPB10 降幅最大;CK2 处理的DO 也出现明显下降,这可能与试验期间有少量空气中细菌进入,存在葡萄糖的降解耗氧有关。非灭菌条件下,CK1 处理由于未添加葡萄糖,微生物生长受到抑制,因而DO 下降不明显,而其余处理浓度明显低于灭菌组。但由于沉积物中土著微生物的大量存在,非灭菌组的接种与未接种处理间的DO浓度差异较小。
水体pH在灭菌组和非灭菌组间的差异同样十分明显。灭菌条件下,接种处理pH 明显低于CK1,试验后期各接种处理均降至7.0以下,且处理间差异较大,微生物呼吸或者有机酸产生可能是本研究水体pH降低的主要原因[22]。然而,非灭菌组由于大量土著微生物的存在,除CK1 外其余处理间pH 差异较小;此外,由于微生物数量较多,种群竞争加剧,这可能导致试验过程中部分菌体死亡或发生自溶释放出碱性物质,从而使得后期pH明显上升[23-24]。
本研究发现,灭菌组各接种处理水体TP 浓度明显增加,表明解磷菌促进了天鹅湖沉积物中磷的释放,其中OPB10 菌株具有较强的解磷能力。两因素方差分析结果表明,沉积物是否灭菌对水体TP 影响显著(F=244.4,P<0.05)。在未灭菌组,藻华区沉积物中分布着包括解磷菌在内的大量微生物,因而自身具有一定的解磷能力;但由于微生物数量较多,释放的磷大部分被其吸收利用以维持生长[25],且接种的解磷菌和土著微生物间存在着一定的种群竞争,以上原因导致了解磷菌接种对水体TP 影响效果不明显,且非灭菌组浓度显著低于灭菌组。pH、DO 等是影响沉积物磷释放的重要环境因子。对水体TP、pH、DO 等进行相关性分析,发现TP 浓度与pH 呈显著负相关(r=-0.87**,P<0.01),表明解磷菌能通过降低pH 影响沉积物中磷的释放,导致上覆水磷浓度升高[20]。综上所述,天鹅湖沉积物中解磷菌的接种可对水体理化性质产生明显影响,并对沉积物磷具有一定促溶作用,但可能由于接种量不足等因素影响[26],增磷效果不显著;相较于非灭菌组,沉积物在灭菌条件下接种解磷菌的作用效果较为明显。
3.2 解磷菌接种对沉积物磷形态的影响
解磷菌可通过酶解或酸解等机制影响沉积物磷的形态转化,因而在水体磷循环过程中起着重要作用[8]。NH4Cl-P 是沉积物中活性较强的一种磷形态[27],对比试验前后可见灭菌组NH4Cl-P 含量明显升高,表明可能存在其他形态磷向NH4Cl-P 的转化;灭菌组NH4Cl-P含量明显高于非灭菌组,且大多数接种处理显著高于对照(图5a),说明适量接种解磷菌有助于沉积物磷形态间的相互转化[28]。对各形态磷含量进行方差分析(表1),发现是否灭菌对NH4Cl-P 和NaOH-P 均具有极显著影响(P<0.01),是否灭菌×菌株对NH4Cl-P和BD-P有显著影响(P<0.05)。在灭菌条件下,接种解磷菌有利于沉积物中NH4Cl-P 和BDP向上覆水的释放(图5a、图5b)。巢湖水华大规模暴发时,沉积物中NH4Cl-P和BD-P含量也大幅降低,其中BD-P 的释放尤为明显[29]。沉积物中BD-P 的释放主要受氧化还原条件的影响[27]。本试验期间各接种处理水体DO 浓度明显下降,后期沉积物-水界面呈厌氧状态,这为BD-P 的释放提供了有利条件;且非灭菌组DO 浓度较低,试验结束时其沉积物中BD-P的含量降幅也相应较大。
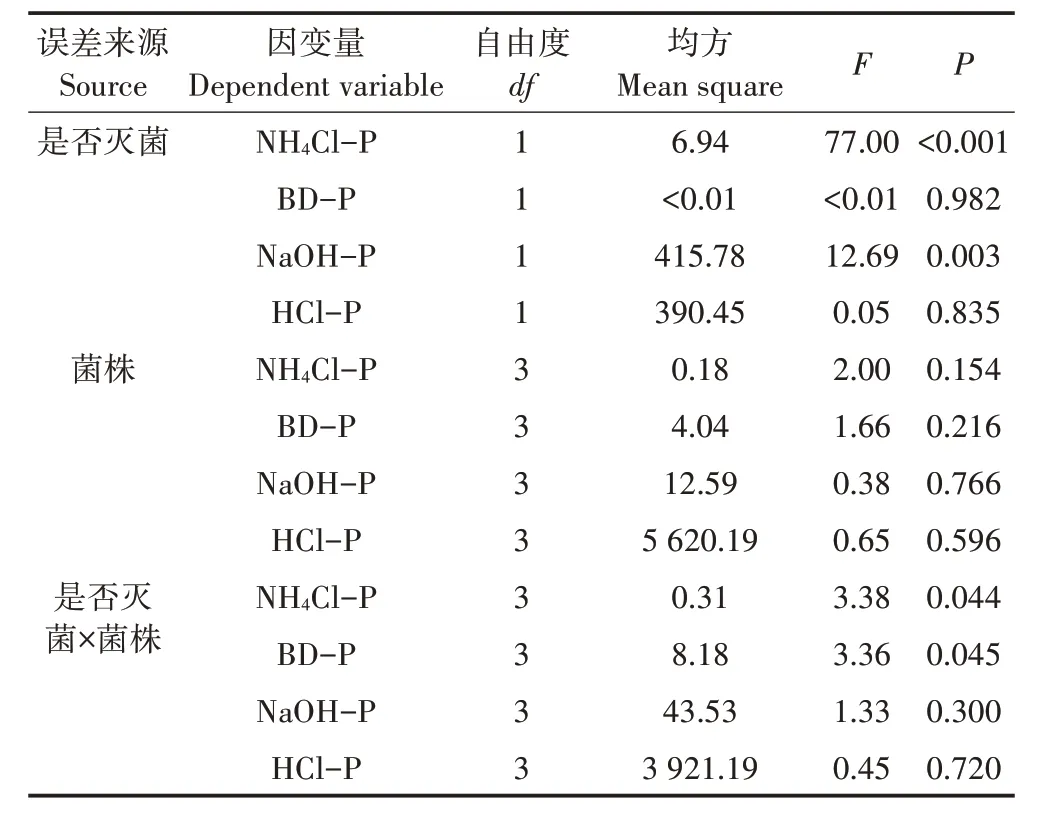
表1 两因素方差分析检验是否灭菌和菌株对沉积物磷形态的影响Table 1 Two-way ANOVA for effects of sterilization and OPB strain on phosphorus fractions in sediments
碱性磷酸酶在沉积物有机磷的矿化分解中起着重要作用,高APA 有助于界面磷的再生[8]。本试验表明,大多数接种处理沉积物的APA 显著高于对照(P<0.05),说明增加解磷菌数量有利于提高沉积物的APA[10]。对水体TP 和沉积物APA 进行相关性分析,发现未灭菌条件下二者呈显著正相关(r=0.98**,P<0.01),这与Barik 等[30]的研究结果相一致。不同接种菌株间相比,OPB10 处理沉积物的APA 较高,且水体TP 浓度增幅较大。可以推断,天鹅湖潟湖沉积物中分离的OPB10 菌株具有较高的酶分泌能力和较大的解磷潜力。综上所述,OPB的接种促进了天鹅湖沉积物中磷的释放,使得上覆水磷的水平明显增加,从而为大型藻华发生提供了有利条件。在藻华频繁暴发水体,有机解磷菌、沉积物磷形态(有机磷)、藻生长三者间的相互关系有待于深入研究。
4 结论
(1)从荣成天鹅湖的西部和湖中心沉积物中共分离得到11株有机解磷菌(OPB),其中在藻华暴发的湖中心解磷菌种类较多,芽孢杆菌属(Bacillus sp.)为OPB的优势菌属。
(2)嗜热脂肪地芽孢杆菌(Geobacillus stearother⁃mophilus)、弯曲芽孢杆菌(Bacillus flexus)和短小芽孢杆菌(Bacillus altitudinis)接种后,底层水体pH 和溶解氧浓度明显降低。3 株解磷菌的接种均促进了天鹅湖沉积物中磷的释放,使得上覆水总磷浓度明显增加。非灭菌组由于土著微生物的生长吸收,试验期间总磷浓度显著低于灭菌组。
(3)OPB接种明显提高了沉积物中碱性磷酸酶活性,其中弯曲芽孢杆菌具有较高的酶分泌和解磷能力。灭菌条件下,解磷菌的接种促进了沉积物磷的形态转化,接种处理的弱吸附态磷(NH4Cl-P)含量显著增加,而试验后期的厌氧环境有利于可还原态磷(BD-P)的释放。

