遗传性痉挛性截瘫5 型患者脑白质微结构改变的脑白质纤维束追踪法研究
张帆,涂宇卿,林毅,邱煜森,刘颖*
1.福建医科大学附属第一医院滨海院区国家区域医疗中心医学影像科,福建 福州 350212;2.福建医科大学附属第一医院医学影像科,福建 福州 350005;3.福建医科大学附属第一医院神经内科,神经病学研究所,福建省分子神经病学重点实验室,福建 福州 350005;*通信作者 刘颖 liuying840102@163.com;林毅 linyi7811@163.com
遗传性痉挛性截瘫5型(hereditary spasmodic paraplegia type 5,SPG5)是较罕见的遗传性痉挛性截瘫(hereditary spastic paraplegia,HSP)亚型,以双下肢肌张力增高、剪刀步态、腱反射亢进、病理反射阳性为特征。SPG5由编码羟甾醇-7α-羟化酶的CYP7B1基因的隐性突变引起,导致神经毒性27-羟基胆固醇(27-OHC)的积累[1]。研究显示SPG5患者脑白质信号异常[2],由于缺乏临床病理及动物实验,27-OHC对SPG5患者脑白质微结构的损伤情况尚未明确。磁共振扩散张量成像(diffusion tensor imaging,DTI)通过脑组织内水分子的扩散定量反映脑内白质纤维束的完整性,是显示白质纤维束是否损伤及损伤程度的敏感指标,能发现常规MRI无法显示的脑白质微结构异常[3-4]。前期基于纤维骨架的空间统计(tract based spatial statistics,TBSS)方法提示,SPG5患者呈脱髓鞘为主伴轴索损伤的白质纤维束异常[5],然而,SPG5患者的白质损伤特点是节段性的还是逆行性尚未明确。同时,SPG5患者不仅出现运动相关的下肢痉挛性截瘫,还存在较其他HSP亚型更严重的深感觉障碍。本研究受文献[6]启发,基于感兴趣区(ROI)的脑白质纤维束追踪法,分段分析SPG5患者颅脑运动及躯体感觉传导通路纤维束的各向异性分数(fractional anisotropy,FA)和平均扩散系数(mean diffusivity,MD),探讨SPG5患者脑白质微结构损伤趋势,并探索脑白质DTI参数与患者临床病程、病情严重程度及血浆神经毒性物质27-OHC含量的相关性。
1 资料与方法
1.1 研究对象 前瞻性收集2019年1月—2020年12月在福建医科大学附属第一医院神经内科建立的HSP队列(研究注册号:NCT04006418)中经临床及基因诊断确诊的SPG5患者34例,最终17例患者纳入本研究。纳入标准:①基因诊断SPG5;②临床根据Harding's诊断标准[7],将HSP分为单纯型与复杂型,单纯型HSP表现为孤立的锥体束受累伴或不伴神经源性膀胱和振动觉损害,复杂型HSP为在单纯型的基础上合并其他系统受累;③年龄10~70岁;④接受颅脑MRI检查。排除标准:①除HSP以外的其他神经系统疾病;②酗酒、吸毒、药物滥用;③常规MRI显示其他原因引起的颅脑病变;④MRI图像质量不能满足诊断需求;⑤具有MRI检查禁忌证。通过社会招募年龄、性别与SPG5患者匹配的健康对照17名。神经内科医师根据痉挛性截瘫评价量表(spastic paraplegia rating scale,SPRS)评估患者痉挛性截瘫的严重程度,总分为0~52分,分数越高,病情越重[8]。所有受试者均签署知情同意书。本研究通过福建医科大学附属第一医院伦理委员会批准,批准号(闽医大附一伦理医研〔2019〕194号)。
1.2 仪器与方法 采用西门子3.0T Skyra MR扫描仪,20通道头颈联合相控阵线圈。扫描过程中泡沫垫固定受试者头部,防噪声耳塞填充外耳道。常规MR序列[横断位2D-T2WI、T2-FLAIR、磁敏感加权成像(SWI)]了解颅脑形态及信号改变。DTI扫描采用单次激发自旋回波-回波平面图像序列:TR 7 700 ms,TE 104 ms,视野230 mm×230 mm,体素1.8 mm×1.8 mm×2.0 mm,矩阵128×128,激励次数2,层厚2.0 mm,施加30个非线性扩散梯度方向,b值=0、1 000 s/mm2。
1.3 数据处理及分析 采用牛津大学FMRIB Software Library(http://fsl.fmrib.ox.ac.uk/fsl)对受试者颅脑DTI数据进行预处理:数据格式转换和质控检查;脑组织提取;去涡流和头动校正。扩散张量模型估计:使用FSL的扩散张量拟合工具包,输入去涡流和头动校正后的DTI数据、大脑组织掩模和梯度表参数进行计算,以获取FA和MD参数图,用于下一步基于ROI的纤维追踪法分析。
参考颅内解剖(图1),运动传导通路主要由皮质脊髓束(corticospinal tract,CST)构成:由中央前回下行通过内囊后肢、大脑脚、脑桥腹侧于延髓锥体下方交叉至对侧后出颅;ROI设置在单侧脑桥前部、内囊后肢和中央前回水平的大脑皮层下白质。感觉传导通路(somatosensory pathway,SSP)主要由脊髓丘脑束与内侧丘系构成,在丘脑腹后外侧核换元后投射到中央后回;ROI设置在单侧脑桥后部、丘脑腹后外侧和中央后回水平的大脑皮层下白质。使用DTI DTK工具包(http://www.trackvis.org/dtk/)进行基于ROI的纤维束追踪分析提取SPG5患者及健康对照者的颅内感觉传导通路和运动传导通路的相关纤维束(图2)。预设FA阈值和主特征向量转向角(分别为0.2和40°)计算纤维束。设置脑桥以外的2个ROI的目的是剔除穿过至对侧小脑或落在传导通路之外的纤维束。
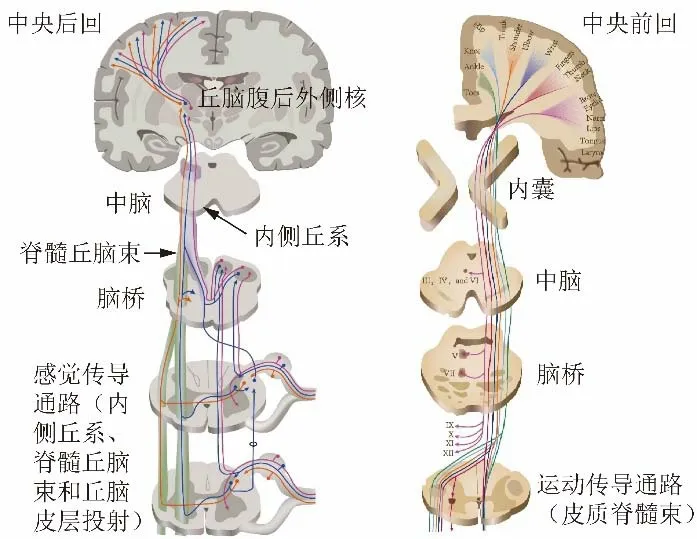
图1 躯体感觉传导通路和运动传导通路(皮质脊髓束)
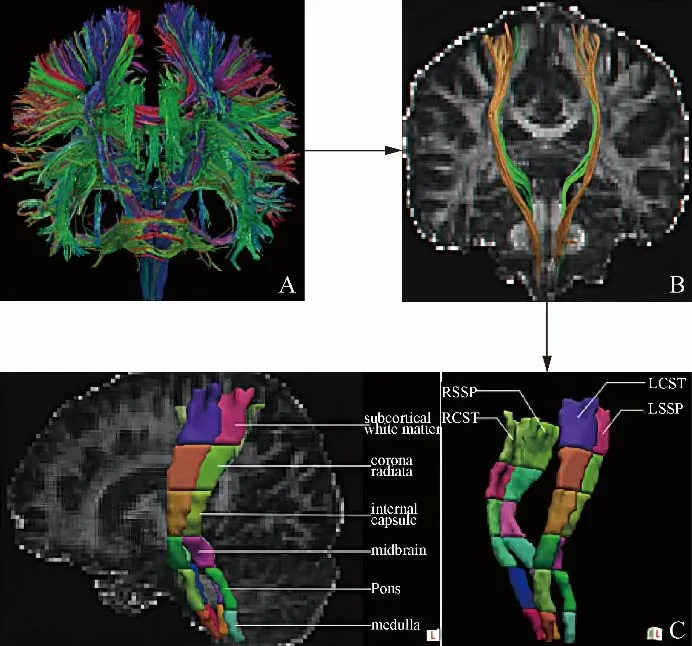
图2 基于ROI的白质纤维束追踪分析法流程。A:构建全脑白质纤维束;B:双侧运动传导通路CST和躯体SSP的白质纤维束的提取;C:为了解DTI参数在大脑双侧CST及躯体SSP纤维束的变化趋势,对双侧CST及SSP进行分段(包括延髓、脑桥、中脑、内囊、放射冠、大脑皮层下白质6个节段)分析,提取每1段的CST及SSP 2个DTI参数(FA和MD)
2名医师在不了解所有受试者临床和基因信息的基础上,独立进行基于ROI的白质纤维束追踪分析。根据CST和SSP的走行(图1),每名医师在左、右侧脑桥后部、丘脑腹后外侧和中央后回水平的大脑皮层下白质的纤维束走行区画直径约5 mm的圆形区域作为ROI,追踪CST和SSP纤维束。为了解SPG5患者双侧运动及SSP上纤维束DTI各项指标的变化趋势,参照文献[9],对提取的纤维束的FA和MD值进一步分段(延髓、脑桥、中脑、内囊、放射冠及皮层下白质6个节段)分析(图2)。采用2名医师分别测量获得的2个DTI指标的平均值作为后续统计分析的数据;并对结果进行一致性分析。
1.4 血浆27-OHC检测方法 通过乙二胺四乙酸抗凝管收集新鲜全血,分离血浆,用超高效液相色谱-串联质谱(UPLC-MS/MS)分析血浆中27-OHC的含量,用稳定同位素稀释法定量,检测方法:将-80℃下保存的血浆样本取出,室温下解冻,移取样本100 μl,加入50 μl同位素内标混合物,涡旋振荡10 s;加入5 μl丁羟甲苯,轻摇混匀;加入氢氧化钾乙醇溶液,使终浓度为1 mol/L,37℃下慢摇孵育;加入正己烷萃取游离氧甾醇,萃取液蒸发干燥;提取的游离甾醇重悬于衍生化试剂(吡啶、三乙胺和吡啶甲酸)中,于60℃、400转下孵育90 min;加入正己烷停止反应后将上清液转移到新的微量离心管中,在有机模式下用SpeedVac进行干燥;提取物使用乙腈∶水(9∶1)重悬;使用Ultimate-U3000 DGLC(Thermofisher Scientific)耦合6500 Plus QTRAP(Sciex)系统上机检测。
1.5 统计学方法 应用SPSS 22.0软件。计量资料采用Shapiro Wilk检验观察数据是否服从正态分布,采用Fisher确切概率法比较性别之间的差异。符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用非参数检验。采用独立样本t检验比较SPG5患者与健康对照组颅脑双侧CST和SSP的FA与MD值的差异;颅脑DTI数据由于分为6个节段(延髓、脑桥、中脑、内囊、放射冠、皮层下白质)分析,结果经过多重比较的Bonferroni校正,P<0.008 3(即0.05/6)表示差异有统计学意义。计数资料以例数表示,组间比较采用χ2检验。使用组内相关系数(ICC)分析2名医师在颅脑双侧CST和SSP的2个DTI指标分层测量的一致性。颅脑FA、MD值与临床指标(病程与SPRS评分)及血浆27-OHC含量进行Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组基础资料比较 SPG5 患者年龄29±11(13~49)岁,健康对照组29±10(14~49)岁,差异无统计学意义(t=0.047,P=0.963)。两组男女性别比均为11∶6,差异无统计学意义(P=1.000)。17例SPG5患者中,16例为单纯型HSP,1例为复杂型HSP。SPG5患者病程14(6,40)年,均存在不同程度的痉挛性截瘫,SPRS评分为15(10,23)分。17例患者均存在不同程度的后索功能障碍,其中16例下肢振动觉减低或消失,1例患有膀胱功能障碍。17名健康对照者均无神经系统疾病。
2.2 常规颅脑MRI结果 SPG5患者与健康对照组的颅脑常规MRI(T2WI、T1WI、T2-FLAIR及SWI序列)均未见明显异常信号,未见胼胝体或小脑萎缩征象。
2.3 基于ROI纤维束追踪分析法的颅脑DTI结果 2名医师在颅脑双侧CST和SSP的FA和MD值测量的一致性良好(ICC0.62~0.84,P<0.05)。与健康对照组比较,SPG5组颅脑双侧CST和SSP上6个分段的FA值呈减低趋势,MD值呈增高趋势(表1、2)。SPG5患者CST和SSP射冠及大脑皮层下白质节段的FA值与MD与健康对照者差异均有统计学意义,FA值在内囊(双侧CST)、延髓(双侧CST及右侧SSP)及脑桥(左侧CST)层面两者差异也有统计学意义;MD值在SSP内囊层面两者差异有统计学意义(P<0.008 3,Bonferroni校正)。不论CST或SSP纤维束上中脑节段差异均无统计学意义(P>0.008 3,Bonferroni校正)(表1、2)。
表1 基于白质纤维束追踪法分析大脑皮质脊髓束的FA及MD值(±s)
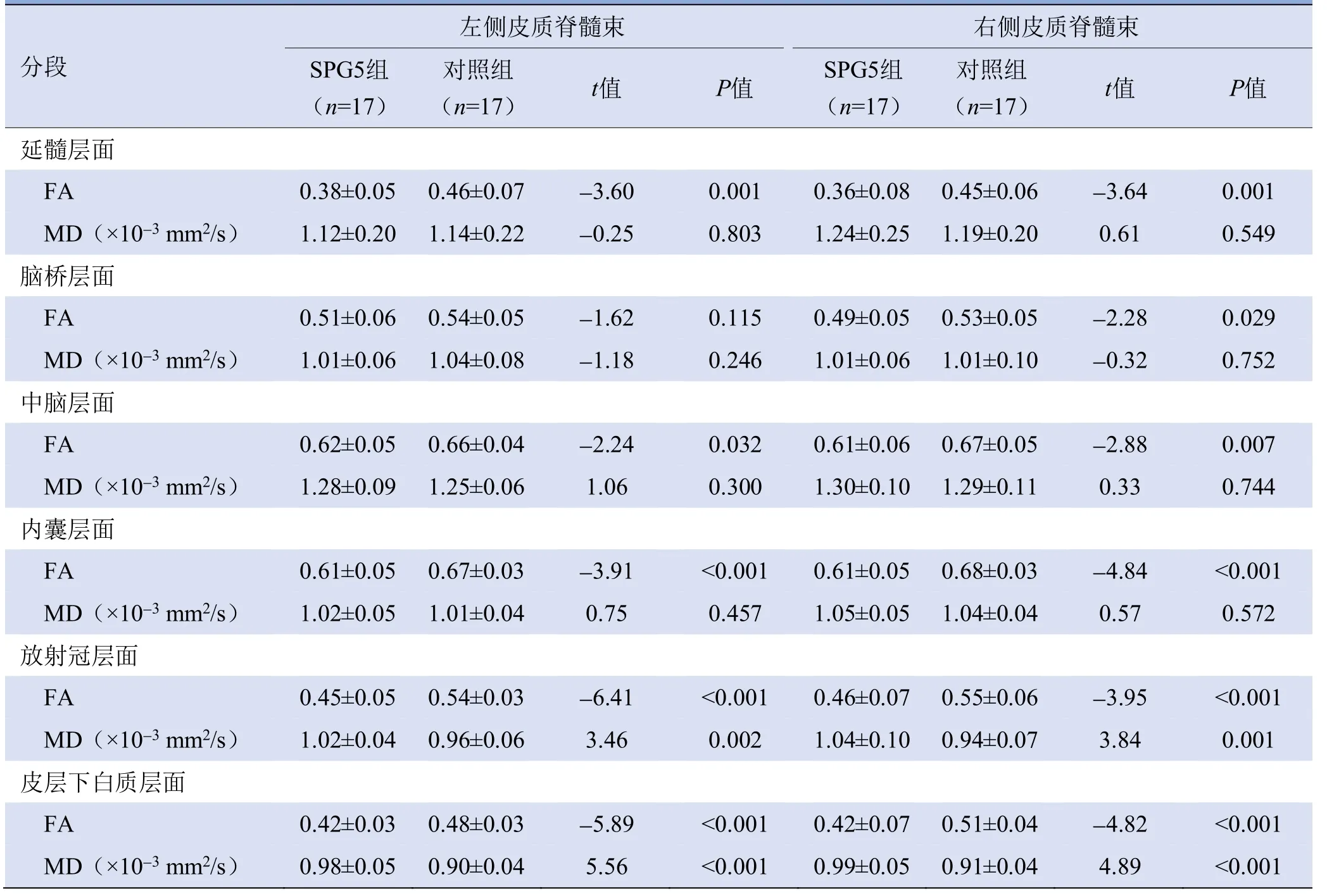
表1 基于白质纤维束追踪法分析大脑皮质脊髓束的FA及MD值(±s)
注:SPG5为遗传性痉挛性截瘫5亚型,FA为各向异性分数,MD为平均扩散系数
左侧皮质脊髓束右侧皮质脊髓束分段SPG5组对照组t值P值SPG5组对照组(n=17)(n=17)(n=17)(n=17)t值P值延髓层面FA 0.38±0.05 0.46±0.07-3.60 0.001 0.36±0.08 0.45±0.06-3.64 0.001 MD(×10-3 mm2/s)0.549 1.12±0.20 1.14±0.22-0.25 0.803 1.24±0.25 1.19±0.20 0.61脑桥层面FA 0.51±0.06 0.54±0.05-1.62 0.115 0.49±0.05 0.53±0.05-2.28 0.029 MD(×10-3 mm2/s)0.752 1.01±0.06 1.04±0.08-1.18 0.246 1.01±0.06 1.01±0.10-0.32中脑层面FA 0.62±0.05 0.66±0.04-2.24 0.032 0.61±0.06 0.67±0.05-2.88 0.007 MD(×10-3 mm2/s)0.744 1.28±0.09 1.25±0.06 1.06 0.300 1.30±0.10 1.29±0.11 0.33内囊层面FA 0.61±0.05 0.67±0.03-3.91<0.001 0.61±0.05 0.68±0.03-4.84<0.001 MD(×10-3 mm2/s)0.572 1.02±0.05 1.01±0.04 0.75 0.457 1.05±0.05 1.04±0.04 0.57放射冠层面FA 0.45±0.05 0.54±0.03-6.41<0.001 0.46±0.07 0.55±0.06-3.95<0.001 MD(×10-3 mm2/s)0.001 1.02±0.04 0.96±0.06 3.46 0.002 1.04±0.10 0.94±0.07 3.84皮层下白质层面FA 0.42±0.03 0.48±0.03-5.89<0.001 0.42±0.07 0.51±0.04-4.82<0.001 MD(×10-3 mm2/s)0.98±0.05 0.90±0.04 5.56<0.001 0.99±0.05 0.91±0.04 4.89<0.001
表2 基于白质纤维束追踪法分析大脑躯体感觉传导通路的FA及MD值(±s)
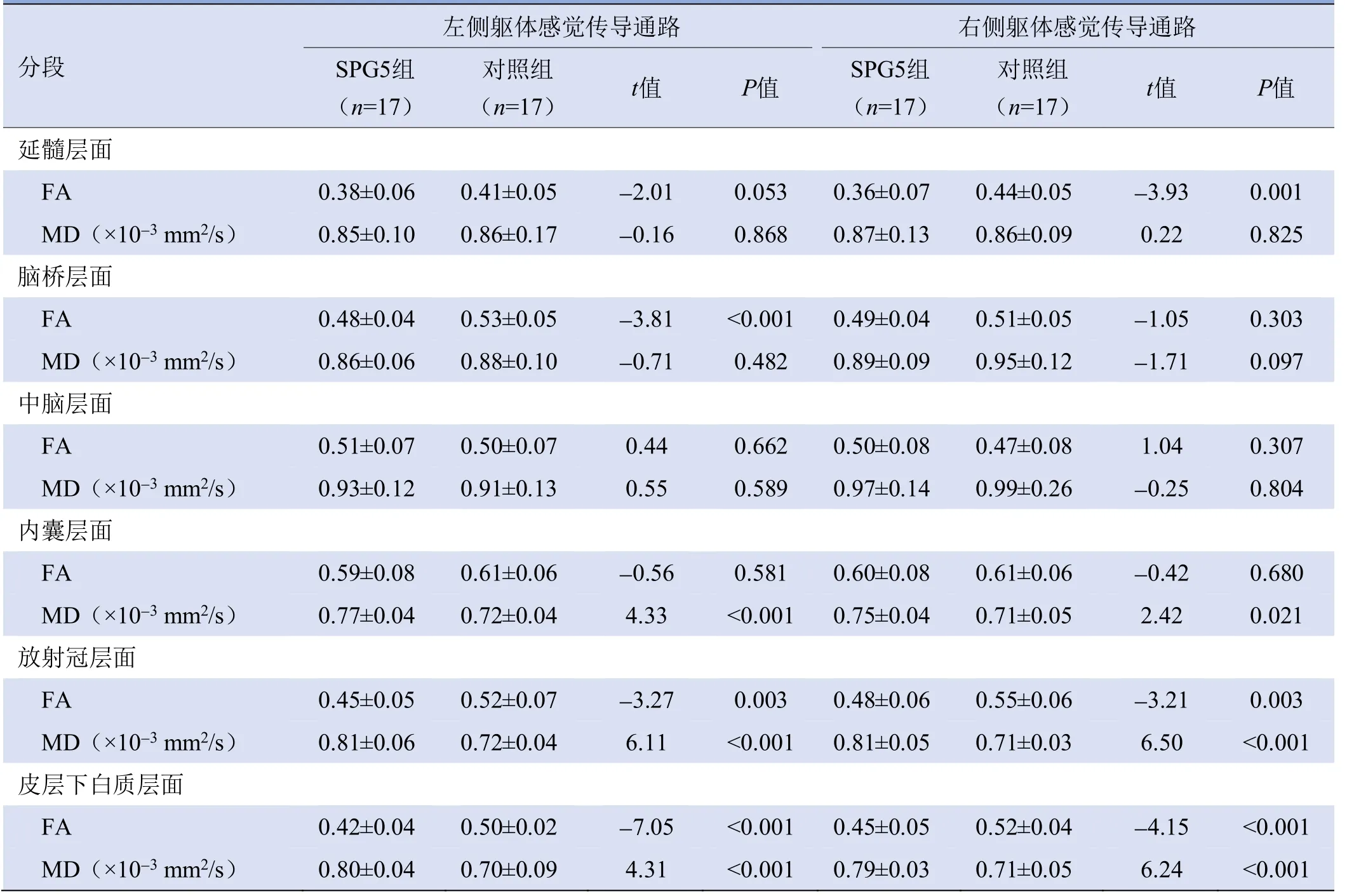
表2 基于白质纤维束追踪法分析大脑躯体感觉传导通路的FA及MD值(±s)
注:SPG5为遗传性痉挛性截瘫5亚型,FA为各向异性分数,MD为平均扩散系数
左侧躯体感觉传导通路右侧躯体感觉传导通路分段SPG5组对照组t值P值SPG5组对照组(n=17)(n=17)(n=17)(n=17)t值P值延髓层面FA 0.38±0.06 0.41±0.05-2.01 0.053 0.36±0.07 0.44±0.05-3.93 0.001 MD(×10-3 mm2/s)0.825脑桥层面0.85±0.10 0.86±0.17-0.16 0.868 0.87±0.13 0.86±0.09 0.22 FA 0.48±0.04 0.53±0.05-3.81<0.001 0.49±0.04 0.51±0.05-1.05 0.303 MD(×10-3 mm2/s)0.097中脑层面0.86±0.06 0.88±0.10-0.71 0.482 0.89±0.09 0.95±0.12-1.71 FA 0.51±0.07 0.50±0.07 0.44 0.662 0.50±0.08 0.47±0.08 1.04 0.307 MD(×10-3 mm2/s)0.804内囊层面0.93±0.12 0.91±0.13 0.55 0.589 0.97±0.14 0.99±0.26-0.25 FA 0.59±0.08 0.61±0.06-0.56 0.581 0.60±0.08 0.61±0.06-0.42 0.680 MD(×10-3 mm2/s)0.021放射冠层面0.77±0.04 0.72±0.04 4.33<0.001 0.75±0.04 0.71±0.05 2.42 FA 0.45±0.05 0.52±0.07-3.27 0.003 0.48±0.06 0.55±0.06-3.21 0.003 MD(×10-3 mm2/s)<0.001皮层下白质层面0.81±0.06 0.72±0.04 6.11<0.001 0.81±0.05 0.71±0.03 6.50 FA 0.42±0.04 0.50±0.02-7.05<0.001 0.45±0.05 0.52±0.04-4.15<0.001 MD(×10-3 mm2/s)0.80±0.04 0.70±0.09 4.31<0.001 0.79±0.03 0.71±0.05 6.24<0.001
2.4 大脑白质纤维束DTI参数与临床指标的相关性以健康对照组为参照,SPG5患者颅脑CST及躯体SSP纤维束上差异有统计学意义的FA、MD值与SPRS评分(FA:r=-0.175~0.345;MD:r=-0.202~0.349;P>0.05)或病程(FA:r=-0.814~0.470;MD:r=-0.343~0.763;P>0.05)或血浆27-OHC含量(FA:r=-0.270~0.407;MD:r=-0.538~0.347;P>0.05)均无相关性。
3 讨论
本研究采用脑白质纤维束追踪法评估SPG5患者白质微结构损伤特点,结果发现:①SPG5患者脑白质运动传导通路与感觉传导通路的FA值降低,MD值升高,提示SPG5患者运动及深感觉相关的白质纤维束损伤;②延髓、放射冠及大脑皮层下白质节段两组受试者FA与MD值的差异较脑桥、中脑节段大,推测SPG5患者可能是节段性白质损伤;③SPG5患者脑白质FA、MD值与临床SPRS评分或病程或血浆27-OHC含量均无相关性。
3.1 脑白质常规序列的信号分析 研究报道SPG5患者常规FLAIR和T2WI序列脑白质可见散在高信号影[10-11],然而,本研究17例SPG5患者脑白质信号未见明显异常,表明脑白质高信号对大部分SPG5并不具有特异性[12]。特别指出的是,本研究纳入的SPG5患者多为单纯型HSP,与文献报道的单纯型HSP患者常规MRI通常未见白质信号异常一致[13]。
3.2 脑白质微结构损伤情况 DTI参数是临床量化脑白质损伤的重要指标,对于中枢神经系统病变运动、认知等相关功能损伤情况的判断具有较高的临床应用价值[14-16]。FA值代表水分子在脑白质纤维束中扩散各向异性的大小,MD值表示水在组织内的扩散能力和速度[3,17],两者间接反映脑白质微观结构的完整性。本研究发现SPG5患者脑干、放射冠、内囊及皮层下白质的FA值降低和MD值升高,提示虽然SPG5患者常规颅脑MR未见异常信号,但脑白质微结构已出现损伤;与文献报道SPG5患者胼胝体、皮质脊髓束、皮层下白质纤维束明显减少相符[11]。
3.3 脑白质纤维束追踪法结果的方向性分析 SPG5患者脑白质FA值减低及MD值增高可能是由轴索纤维变性和(或)髓鞘破坏引起的[3]。前期基于TBSS分析SPG5患者全脑白质微结构变化,提示SPG5以脱髓鞘为主伴有轴索损伤[5],这与HSP常见亚型如SPG4及SPG11相似[6,18-20]。也在本课题组前期定量测量SPG5患者脑脊液的髓鞘及轴索相关物质结果中得到验证[5]。然而,关于SPG5患者中枢神经系统白质损伤的方向性,究竟是节段性脱髓鞘还是逆行性损伤,尚未见报道。本研究参照文献[9]的分段分析法,与健康对照组比较,SPG5患者不论在CST还是SSP,延髓、放射冠、皮层下白质等节段的FA及MD值有显著差异,而其他节段两者差异不显著,表明SPG5患者DTI参数变化的方向性趋势不明确。因此,笔者推测SPG5患者的中枢神经系统白质脱髓鞘可能是节段性的,而不是文献报道的其他遗传性痉挛性截瘫白质逆行性损伤的特点[6],但该结论仍需大量研究进一步证实。
3.4 脑白质结构损伤程度与临床及实验室指标的相关性分析 本研究基于多个ROI,提取运动相关的CST及深感觉相关的躯体SSP的纤维束,发现两条纤维束走行区均出现FA值降低与MD值增高趋势,此影像改变一定程度上解释了SPG5患者下肢痉挛性截瘫及深感觉障碍的临床表征。然而,本研究发现SPG5患者脑白质DTI参数与临床病程、SPRS评分及血浆27-OHC含量均无相关,与本课题组前期研究结果相似,SPG5患者的脊髓萎缩程度与病程、SPRS评分无相关性[21],表明SPG5患者中枢神经系统的损伤程度与患者病史长短、病情严重程度并无直接关系,与血浆中的神经毒性物质(27-OHC)含量也无相关性;参照HSP文献中通过“天花板效应”来解释或许比较合理[20],提示SPG5患者的脑白质均已出现明显损伤,与SPRS评分的高低及体内毒性物质的多少并无直接相关,也不随着患者病程的延长而导致白质损伤程度加重。本研究纳入患者病程较长,大多病程超过10年(病程最短的患者6年),可能在一定程度上影响了结果。同时,考虑到SPG5疾病进展缓慢,白质损伤可能通过神经轴索冗余或适应性神经可塑性代偿,而导致SPG5患者的DTI结构评估与临床评价之间存在差异[6]。这种差异提示应该同时评估SPG5患者的电生理指标和MRI监测疾病进展。
3.5 本研究的局限性 首先,SPG5作为罕见病样本量较少,统计分析可能产生假阳性或假阴性结果,后续研究将纳入更多被试进一步验证本研究结果;第二,本研究仅针对患者某个时间点的DTI研究,为了确认相关机制,今后工作应该加大样本量,并对患者进行纵向随访研究;第三,本研究仅采用DTI技术,对于DTI在纤维束追踪方面的限制,下一步的研究将引入扩散峰度成像、NODDI及HARDI等新兴发展的白质纤维束分析方法。
总之,DTI提示SPG5患者运动传导通路和感觉传导通路出现不同程度的白质纤维结构的损害,以节段性脱髓鞘为主,一定程度上解释了SPG5患者下肢痉挛性截瘫及深感觉障碍的病理学基础。

