心脏脂肪沉积机制及相关影像学研究进展
熊子衿 李晓欢 徐婷 颜梅 许华燕
(1.四川大学华西第二医院放射科 出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041;2.达州市中心医院影像中心,四川 达州 635000)
心血管疾病患病率处于持续上升阶段,诸多研究表明心脏脂肪组织已成为心血管疾病的独立预测因素及防治要点。心肌内脂肪代谢异常导致游离脂肪酸(free fatty acids, FFA)及脂肪代谢产物堆积引起心肌脂肪变性;心外膜脂肪组织(epicardial adipose tissue,EAT)增多,沿心肌间质进入心肌细胞间引起心肌脂肪浸润;EAT功能紊乱作用邻近心肌及冠状动脉,这三方面是相关心血管疾病发生和发展的基础。不同影像技术对相关疾病有预测、诊断和预后评估价值,现从心脏脂肪沉积机制及其导致的心血管疾病研究进展和影像学评价等方面进行阐述。
1 心脏脂肪组织的解剖及生理特性
心脏脂肪组织包含心包外脂肪组织、EAT(心肌旁和冠状动脉周围)及心肌内少量脂肪组织。心包外脂肪组织位于心包壁层外,源于胸中胚层,由非冠状动脉供血。EAT位于心包脏层内及心肌间,源于内脏胸膜中胚层,沿房室间沟、室间沟及冠状动脉主要分支走行分布[1],包括紧邻心肌的脂肪组织及冠状动脉周围脂肪组织(pericoronary adipose tissue,PCAT),与心肌一样,由紧邻冠状动脉供血,大致解剖如图1。
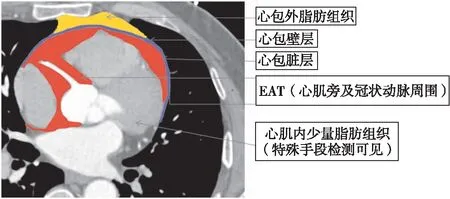
图1 心脏脂肪组织解剖示意图
EAT具有多种生理特性[2],包括:(1)对心脏的机械保护作用;(2)含多细胞的内分泌组织,分泌多种因子;(3)发挥棕色脂肪组织产热作用,保护心脏免受低温损伤;(4)储存心肌周围过多FFA,降低心肌脂毒性;(5)作为脂肪组织,释放FFA,为心肌提供代谢底物。
心肌细胞为非脂肪细胞,正常情况下含极少量脂滴,心肌内脂肪组织来源对于揭示其病理过程和发病机制有着非常重要的意义,为其提供潜在的治疗靶点。从基因层面,黄欣彦等[3]通过各种遗传模型进行谱系追踪研究发现,心肌内脂肪组织主要来源于血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)α/β间充质干细胞,在致心律失常性心肌病模型中,转录因子SOX9蛋白、PDGFRα和PDGFRβ间充质细胞对心肌内脂肪细胞有贡献,骨形态发生蛋白质4在模型小鼠心脏中高度表达,并在体外试验中促进心脏间充质细胞到脂肪组织的转变。从代谢方面,正常状态下,成熟的心肌细胞中脂肪酸β氧化是ATP供能的主要来源。FFA经细胞膜上的心型脂肪酸结合蛋白介导,通过其表达的CD36识别和摄取,在一系列酶的作用下进入线粒体内β氧化(如图2)。脂肪酸结合蛋白4在人EAT中广泛表达,这种蛋白质通过分泌途径将FFA从EAT转移到邻近的心肌[2,4],在细胞应激和低能量供应状态下,EAT分泌的促脂肪因子激活蛋白激酶A通道,诱导分解代谢途径并限制合成代谢途径,以提高细胞ATP水平并调节葡萄糖和FFA的摄取。最新研究[5]表明,心肌脂肪代谢似乎受生物钟核受体Rev-erbα/β调控,此结果仍需更多研究支持。

注:cAMP,环磷酸腺苷;AC,腺苷酸环化酶;PKA,蛋白激酶A;TAG,甘油三酯;ATGL,甘油三酯脂肪酶;DAG,甘油二酯;HSL,激素敏感性脂肪酶;MAG,甘油一酯;MGL,单酰甘油;Acsl-1,乙酰辅酶A合成酶1;acyl-CoA,脂酰辅酶A;CPT-1,肉毒碱棕榈酰转移酶-1;CACT,肉碱-酰基肉碱转位酶;LPL,脂蛋白脂酶;FADH2,还原型黄素腺嘌呤二核苷酸;NADH,还原型烟酰胺腺嘌呤二核苷酸;TCA,三羧酸;acetyl-CoA,乙酰辅酶A。示意图通过WPS绘制,部分内容参考教科书人教版第8版生物化学与分子生物学。
2 心脏脂肪沉积机制
心脏脂肪沉积机制可从三方面解释:(1)心肌细胞内FFA代谢紊乱。肥胖、糖尿病等导致FFA的摄取、转运及β氧化平衡被打破,FFA及脂肪代谢产物(如二酰基甘油、神经酰胺)堆积,通过增加活性氧和内质网应激刺激导致肌节断裂、心肌收缩能力及顺应性减低,导致心肌细胞死亡、心脏结构和功能改变[6]。脂滴包被蛋白调节甘油三酯脂肪酶和激素敏感性脂肪酶的活化[7]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)调节脂肪酸代谢,PPARα增加肉毒碱棕榈酰转移酶和CD36的表达,提升脂肪酸氧化,降低循环甘油三酯水平[7],PPARγ激动剂可改善胰岛素敏感性[8]。他莫昔芬诱导小鼠心脏PPARα过表达,增加了心血管疾病的发生,其机制与脂滴包被蛋白表达减少有关[7]。(2)心肌细胞被脂肪细胞及纤维脂肪组织代替,引起心脏结构重构[3]。(3)EAT与心肌、冠状动脉间无筋膜分割的解剖学缺陷使串扰变得容易[9],Malavazos等[10]通过超声心动图测量EAT厚度,用磁共振氢质子波谱定量心肌内脂肪组织,发现EAT增加与心肌内脂肪组织含量呈正比,证实了相互串扰机制。EAT旁分泌及血管分泌途径被认为是EAT与心脏之间两条互相作用途径。EAT通过旁分泌及血管分泌将FFA转移进心肌细胞内。旁分泌使脂肪因子从PCAT扩散到动脉壁,并与内皮和血管平滑细胞直接相互作用;血管分泌方式包括将FFA和脂肪因子转运到冠状动脉的滋养血管[2,4]。EAT增多及功能紊乱改变心肌代谢及电生理特征[11]、致血管内皮功能障碍和纤维细胞增殖胶原沉积等[12],其参与心肌生理紊乱、功能失调和冠状动脉粥样硬化进展的各个方面。
3 心脏脂肪沉积相关疾病
3.1 心肌病
3.1.1 致心律失常性右室心肌病
致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)是常染色体显性遗传病,以右心室局部或全部心肌被脂肪组织或纤维脂肪组织进行性替代[13]为特点,主要累及流出道、心尖及前下壁,严重者表现为瘢痕性室性心律失常以及心源性猝死,是运动员及年轻人主要猝死原因。在致心律失常性心肌病模型[3]中,证明了心内脂肪细胞主要来源于PDGFRα和PDGFRβ间充质细胞,通过心脏磁共振(cardiac magnetic resonance,CMR)等检测手段可发现心肌内脂肪替代。
3.1.2 肌营养不良性心肌病
肌营养不良性心肌病是由细胞骨架中抗肌萎缩蛋白基因突变引起的一组神经肌肉疾病,包括进行性假肥大性肌营养不良(Duchenne muscular dystrophy,DMD)和贝克肌营养不良,是X连锁隐性遗传病,同时累及骨骼肌和心肌,是青年及儿童患者的主要死亡原因,以肌肉组织中严重的组织病理学改变为特点[14],包括进行性纤维变性、脂肪浸润、血管病变和慢性炎症。患有DMD遗传同源的肌肉萎缩症犬[15]会发展为类似于DMD的进行性心肌病,脂肪浸润及心肌纤维化是其突出特征。
3.1.3 扩张型心肌病
扩张型心肌病是引起心力衰竭、心律失常和猝死的常见疾病之一,其特征是心室腔扩大和收缩功能障碍。研究[5]发现心肌细胞Rev-erb基因敲除小鼠表现为进行性的扩张型心肌病,最终发生致死性的心力衰竭。Rev-erb基因通过多种途径调控脂肪酸代谢基因,Rev-erb基因靶点E4BP4的上调导致脂肪酸代谢下降,而抑制日间周期的糖酵解以及夜间周期的脂质氧化,可改善基因敲除小鼠的心脏功能障碍。同时,心脏Rev-erb基因表达的时间模式改变与扩张型心肌病患者心脏扩张的严重程度有关[5],临床可能通过改变心肌代谢的饮食因素或在不同时间的药物试剂来改善心脏功能。
3.1.4 肥厚型心肌病
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种复杂的疾病,部分原因是基因变异对肌节蛋白生物力学产生了影响。在细胞水平研究上,HCM突变的增强导致对能量的需求更高[16]。有研究[16]发现HCM患者心肌内见大量FFA堆积,调节脂肪代谢不同阶段的主要酶表达减少,而线粒体脂肪酸氧化的主要调节因子未上调,致心肌内有毒的脂质中间产物堆积,活性氧增加,导致线粒体功能损伤,使心肌能量再生能力受限。能量受损可能是HCM患者心肌功能恶化的一个重要机制,也是治疗HCM的一个潜在靶点。
3.2 心房颤动
心房颤动(房颤)是临床最常见的心律失常,以心房纤维化为特征的心房重构是房颤维持机制的核心[17]。多项实验研究证实EAT分泌因子如转化生长因子、壳多糖酶3样蛋白1、血管生成素样蛋白2与心肌纤维化相关[18-21],心肌的纤维化标志物可作为EAT沉积患者心肌纤维化与心肌脂毒性损伤的临床预测因素。但也有研究表明EAT与左心房纤维化相关性较弱[22],他们之间存在其他介导机制,而EAT与房颤复发性具有更强烈的相关性,但这一结论还需更多研究去验证。心房肌电生理紊乱是房颤发病的另一始作俑者。心肌代谢紊乱、线粒体功能障碍、氧化应激导致心房肌电生理和结构重构引起心律失常[6]。心脏特异性过表达脂滴包被蛋白的转基因小鼠诱导心肌脂肪变性及间隙连接蛋白43重塑,增加了房颤的发病率[23],因此,针对心肌脂肪变性的治疗可能为临床治疗肥胖或糖尿病患者的房颤提供了新思路。持续性的左心房低压区患者房颤发生率更高[24],而左心房外EAT体积和衰减可独立预测非瓣膜性房颤患者的左心房低压区[25]。
3.3 心力衰竭
心脏结构重构是心力衰竭的典型特征,EAT在解剖学上与心肌相连,EAT通过炎症、纤维化和自主神经失调增加来影响心脏功能。有研究[26]表明EAT体积的增加与男女心力衰竭风险增加相关,特别是射血分数保留的心力衰竭。一项荟萃分析[27]表明心脏代谢药物(如他汀类药物、胰高血糖素样肽-1受体激动剂及钠-葡糖糖共转运蛋白2抑制剂)对减少EAT有显著作用,尤其是对体重指数较高的年轻患者疗效显著。
3.4 冠心病
早期人们发现,冠状动脉硬化节段多发生在有PCAT包裹的区域,这一现象让大多数人将目光聚焦于此。有研究[28]发现,凝集素样氧化低密度脂蛋白受体-1在PCAT包裹的冠状动脉中高表达,相应冠状动脉节段出现广泛的闭塞。EAT沉积引起微动脉弹性异常、功能障碍是冠心病发病的病理基础[29],Malhotra等[30]认为冠心病本质是一种血管慢性炎症反应。Conceição等[9]收集了大量EAT分泌谱相关性研究数据进行分析,得出一种假设:EAT功能失调可能是冠心病患者过度炎症的关键因素,这可能与EAT中巨噬细胞M1的促炎和巨噬细胞M2的抗炎之间失衡有关,并更利于M1极化和促进炎症环境,冠状动脉在炎症环境下,局部血管壁功能受损,加剧动脉硬化、斑块形成和破裂,而同时,炎症血管节段释放细胞因子引起局部PCAT结构异常及功能紊乱[31],由此可见,炎症在EAT及动脉粥样硬化相互作用中发挥重要作用。有研究[27]已证实心脏代谢药物能减少EAT体积,从而减少冠状动脉炎症。解决EAT炎症是临床治疗和干预冠心病的新思路。
4 相关影像学评价
4.1 超声心动图
超声心动图是非侵入性常规检查技术,近几年超声心动图技术发展迅速,三维超声心动图、斑点追踪超声心动图及声学造影等技术越来越多地应用于心血管疾病,目前二维经胸超声心动图是EAT评估中最容易获得和最廉价的检测手段[10]。
4.2 CT
CT在心血管疾病检测及诊断方面的应用越来越广泛,可直观地观察心脏、大血管及EAT的形态和结构(图3)。在脂肪浸润性疾病的形态、分布及鉴别方面有重要价值。CT脂肪衰减指数是近几年出现的新兴技术,用于反映局部脂肪细胞的大小和脂质含量。基于冠状动脉CT血管成像测量冠状动脉[31]及心房[32]周围的脂肪衰减来预测房颤及冠状动脉炎症,正在成为一种有前途的非侵入性成像工具(图3)。
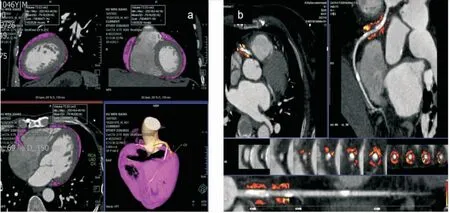
注:图a示EAT(红色勾勒区域),图b示冠状动脉周围脂肪衰减指数。该图制作于本院snygo.via及pasc。
4.3 CMR
CMR能对心脏形态、结构、功能及组织特性进行评估,目前磁共振技术发展迅速,提供了多种心脏脂肪组织可视化评估技术:(1)水脂分离技术:借助向量运算分解磁共振信号,求出水、脂含量,并实现水脂分离,多用于脂肪定量等场合,如表征心脏脂肪肿块、评估心脏脂肪沉积等。与传统的脂肪饱和技术相比,该技术具有不影响纵向磁化、对静磁场及射频不均匀性不敏感、微观脂肪对比度高等优势[33]。(2)电影成像技术:采集从左心室底部向心尖部多层短轴位图像,可动态、多平面观察EAT及心肌脂肪变性及浸润情况(图4)。多与心肌延迟强化(late gadolinium enhancement,LGE)及T1 mapping技术结合,在检测心脏脂肪沉积、心肌纤维化及心脏结构功能方面具有重要临床意义[34-35]。(3)LGE:ARVC患者左心室心肌纤维脂肪替代区表现为延迟强化[34],对DMD患者局灶性脂肪浸润有一定检出价值,但其对弥漫性脂肪浸润检查不敏感,易出现阴性。(4)T1 mapping技术:心肌脂肪浸润时,增强前T1值缩短,通过增强前后T1 mapping图像,得到固有T1值及细胞外容积分数[35],可监测DMD及ARVC随时间推移的组织特异性变化及弥漫性脂肪沉积,细胞外容积分数及LGE相结合,弥补了LGE只能识别局灶性脂肪浸润的局限性[36],在LGE的阴性检查中应用广泛。(5)磁共振氢质子波谱:一种体内精准定量心肌细胞内甘油三酯及肌酸含量的非侵入性手段[37],早期通过磁共振氢质子波谱技术发现糖尿病患者中心肌甘油三酯水平增高[38],为糖尿病患者定量代谢底物提供了技术手段。
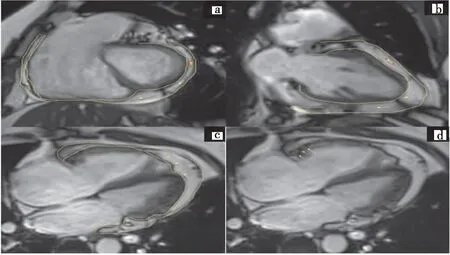
注:a、b、c图为电影序列EAT分割黄线区域,d图为ARVC右心室基底段少许脂肪浸润(黄箭头)。该图制作来源于DICOM Viewer。
不同影像检查技术优缺点对比见表1。

表1 不同影像检查技术优缺点对比
5 结论与展望
综上,心肌代谢紊乱脂质堆积、间充质干细胞引导脂肪替代、EAT邻近浸润及分泌因子作用等机制对心血管疾病各方面产生了严重影响,充分了解其作用机制,对临床处理脂肪组织相关心血管疾病有重要意义,但其机制在分子层面的研究较少,还需继续探究及完善;多模态影像技术作为辅助手段,对相关心血管疾病的预防、检测和诊断具有一定临床价值,影像技术在相关心血管疾病的应用还有更多发展前景,需进一步探索。