浒苔绿潮暴发期间海水溶解有机碳的生物可利用性及其碳汇作用
冯秀婷 ,李佳怡,吴旺池,李鸿妹,张永雨,石晓勇,5*,汤坤贤
(1.中国海洋大学化学化工学院,山东 青岛 266100;2.中国科学院青岛生物能源与过程研究所,山东 青岛 266101;3.福建省海洋生态保护与修复重点实验室,福建 厦门 361005;4.青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;5.国家海洋局海洋减灾中心,北京 100194;6.自然资源部海洋生态保护与修复重点实验室,福建 厦门 361005;7.自然资源部第三海洋研究所,福建 厦门 361005)
海洋中的DOC通常拥有复杂的组分,由于不同组分的生物可利用性不同,使得其在海洋中的周转时间也不尽相同。DOC的生物可利用性通常通过微生物降解实验确定,其中活性DOC(LDOC)的生物可利用性很高,可在数小时至数天内被微生物快速利用或转化,难以在海洋中积累;半活性DOC(SLDOC)的生物可利用性次于LDOC,其周转时间为数周至数月;惰性DOC(RDOC)则拥有强的抗降解能力,难以被微生物利用或转化,可在海洋中储存几年至几十年,甚至上千年[1]。RDOC已被证实是海洋中最大的DOC储库,其碳储量约为630 Pg,占海洋总有机碳库的90%~95%[2],其能够将碳以溶解态形式长期储存在海水中,是海洋碳汇的重要组成部分[3]。以往的研究发现大型海藻通过光合作用可产生大量LDOC[4],而海洋微型生物碳泵(microbial carbon pump)理论指出部分LDOC被微生物利用后可进一步转化为RDOC[3,5-7]。
海洋溶解有机物中能够吸收紫外线和可见光辐射并发出荧光的部分被称为荧光溶解有机物(FDOM),通常作为DOC组分的重要表征之一[8-9]。近年来,三维荧光光谱结合平行因子分析技术(EEMs-PARAFAC)被广泛用于FDOM的成分分析[10-12]。根据其激发和发射的波长特征(Ex/Em),FDOM通常被分为类蛋白和类腐殖质两大类,类蛋白组分由于活性较高,在海洋中的周转时间较短,常被作为LDOC的主要表征组分;而类腐殖质组分的稳定性较高,通常不易被微生物利用或转化,被用于表征RDOC的存在[6,13-16]。
2007—2021年,浒苔(Ulvaprolifera)绿潮在我国南黄海连续15年暴发,其最大覆盖面积可达6.1×104km2,占黄海总面积的近1/10[17-18]。浒苔作为主要肇事藻种,是一种机会主义大型海藻,拥有很高的初级生产力,可通过光合作用吸收CO2,同时以溶解有机碳(DOC)等形式向周围水体释放大量的有机物质。浒苔的DOC释放速率非常高,浒苔释放碳的速率约73.8 μmol/(g·h)(干重),这主要归因于其藻体自身快速的碳周转率和较高的表面积/体积比[19]。以往的调查发现,浒苔绿潮暴发海水的DOC浓度显著高于正常海水,高出约1.2倍[20]。然而,浒苔绿潮贡献的这些DOC能否长久储存在于海洋中主要取决于DOC的生物可利用性,只有那些不容易被微生物利用的惰性DOC(RDOC)可长期存留在海洋中,贡献于近海碳库[21-22]。
浒苔绿潮暴发贡献的大量DOC的生物可利用性对DOC在海洋中的周转时间及最终命运至关重要,然而目前尚无关于绿潮暴发海水中DOC的生物可利用性的报道,浒苔绿潮暴发对近海碳库的影响机制也不清晰。因此,本研究选择浒苔绿潮大规模暴发时期(2019年6月),在浒苔暴发站位富集DOC进行长期(300 d)的微生物降解实验,并选择无浒苔站位作为对照,期望通过DOC浓度和FDOM荧光组分的动态变化特征反映浒苔绿潮暴发对DOC生物可利用性以及近海RDOC储库的潜在影响。
1 材料与方法
1.1 样品采集与预处理
于2019年夏季(6月10日—20日)浒苔绿潮大规模暴发时期搭载“科学三号”科考船进行现场采样,根据浒苔绿潮暴发实况,在浒苔暴发海区选取3个大量浒苔覆盖站位(A、B、C)各采集30 L表层海水(图1),并选取距离较远的无浒苔海区(D、E、F)作为对照,每个站位同样采集30 L表层海水。并用CTD剖面仪(Seabird 911 Plus)对所有站位的温度、盐度和叶绿素浓度(Chl a)等环境参数进行监测。现场采用固相萃取方法富集海水中的DOC,具体而言,首先将海水过滤20 μm筛绢,再过滤0.7 μm GF/F滤膜(450 ℃预灼烧,5 h),收集滤液,使用6 mol/L H2SO4(ACS,Fisher Scientific)将海水酸化至pH=2.5,之后使用C18固相萃取柱(HF Mega BE-C18,10 mg,60 mL,Agilent)对DOC进行富集。富集后的DOC用甲醇洗脱,N2吹干,重复溶解于50 ml灭菌人工海水(115 ℃,30 min)中用于后续的微生物降解实验。C18固相萃取方法的DOC回收率一般为29%~30%[23],本研究的DOC回收率为27.3%±1.0%。这主要是由于固相萃取方法主要依赖于非极性固定相和疏水相交互作用优先选择海水中的中性和非极性分子,从而导致部分极性分子缺失[24-25]。因此,固相萃取富集的DOC中通常富含惰性组分(例如类腐殖质组分)[23,26-27]。然而,由于DOC生物可利用性测定实验通常依托于微生物的长期降解过程[5],原位海水中的DOC浓度不足以进行长期降解,因此通过固相萃取方法富集海水DOC是目前较为通用的方法[23]。

图1 2019年浒苔绿潮暴发时期现场调查站位Fig.1 Sampling stations during Ulva prolifera green tide in 2019A、B、C为大量浒苔覆盖站位,D、E、F为无浒苔站位。
在富集DOC的同时,分别在上述站位再采集30 L海水进行微生物富集。首先将海水预过滤20 μm筛绢去除海水中的大颗粒物质,再过滤3.0 μm 滤膜(PC,Millipore)除去大部分浮游生物,最后过滤0.2 μm 滤膜(PC,Millipore),滤膜上截留的即是大部分海洋微生物[28]。将0.2 μm滤膜置于灭菌离心管中并加入灭菌人工海水(115 ℃,30 min),旋涡震荡10 min后取出滤膜,离心管中洗脱液即为微生物富集液。
1.2 长期DOC微生物降解实验
为了探究浒苔绿潮暴发海水DOC的生物可利用性,将大量浒苔覆盖站位富集的DOC与微生物混合,在室温、黑暗条件下进行长期(300 d)的微生物降解实验。具体而言,将分别含有富集DOC和微生物的人工海水按1∶1混合(体积比),并继续加入人工海水使最终体积为2.5 L[29],添加氮、磷营养盐(终浓度NaNO3为48.5 μmol/L,KH2PO4为3.0 μmol/L)。同时,以无浒苔站位采集样品作为对照组,相同浒苔暴发状况的站位作为平行样。降解过程中,分别于第0、1、2、3、5、10、20、30、60、100、170、230、300天采集样品,取样参数包括DOC浓度、FDOM荧光组分和微生物丰度。其中,DOC样品使用0.7 μm GF/F滤膜(450 ℃预灼烧,5 h)过滤,滤液转移至40 ml棕色玻璃瓶中,于-20 ℃保存。FDOM样品使用GF/F滤膜过滤后进一步使用0.2 μm一次性聚醚砜针头滤器过滤,滤液储存在20 mL棕色玻璃瓶中,于-20℃保存。微生物丰度(micobial abundance,MA)样品取1.8 ml海水加入灭菌冻存管(115 ℃,30 min)中,并加入18 μL 50%戊二醛,室温黑暗条件下固定20 min,使用液氮速冻后于-80℃保存。所有样品均在取样后两周内完成测定。此外,降解体系的溶解氧(DO)使用荧光光纤氧气测量仪(FireSting O2,Pyro Science)测定,pH使用便携式多参数分析仪(雷磁,DZB-718-B)测定。
1.3 样品测定及分析
DOC浓度:使用总有机碳分析仪(Shimadzu,TOC-L CPH)利用高温催化氧化红外分析法进行DOC测定[13]。标准溶液使用邻苯二甲酸氢钾(KHP),样品空白使用Milli-Q水,每5个DOC样品插入1个空白样品。测定时,首先将DOC样品常温避光解冻,再使用6 mol/L HCl酸化样品至pH=2,每个样品重复测定3次,精密度为±3%。
FDOM荧光组分及强度:采用三维荧光光谱结合平行因子分析技术(EEMs-PARAFAC)对FDOM主要组分进行分析。使用荧光分光光度计(Hitachi F-4600)测定FDOM样品的激发-发射矩阵(EEMs),激发波长(Ex)范围为200~480 nm,发射波长(Em)范围为250~650 nm,步长为5 nm,扫描速度为1 200 nm/min,扫描信号的积分时间为0.05 s。采用Delaunay三角形内插值法去除瑞利散射和拉曼散射对荧光信号的干扰[30]。为了统一单位,测定1 μg/L硫酸奎宁溶液在Ex=350 nm,Em=450 nm处的荧光值(1 QSU),对所有样品进行归一化处理[31]。使用Matlab R2016b软件和DOM Fluor工具箱通过PARAFAC对EEMs数据进行荧光组分解析。
微生物丰度:使用流式细胞仪(BD FACS Aria II)对微生物丰度进行测定[32]。向990 μL样品中加入10 μL无菌100×SYBR GREEN I核酸染料[33],黑暗避光染色15 min,加入标准荧光小球作为内参进行测定。
1.4 DOC降解速率常数计算
在DOC降解过程中,利用一阶动力学衰减模型对DOC浓度和降解时间进行拟合:
Ct=C0·e-k·t
(1)
式(1)中:C0和Ct分别为第0天和第t天的DOC浓度,t为降解时间,k为降解速率常数(d-1),k值越大,表示DOC的降解速率越快[34]。k的倒数为DOC的周转时间。
1.5 统计分析
为了探究大量浒苔覆盖站位和无浒苔站位DOC的生物可利用性差异,使用Sigmaplot 14软件对不同组的DOC浓度和FDOM荧光组分进行单因素方差分析,显著性水平为P<0.05。
2 结果
2.1 长期降解过程中DOC浓度及微生物丰度的动态变化特征
在浒苔绿潮大规模暴发时期,大量浒苔覆盖站位和无浒苔站位表层海水的DOC浓度分别平均为156±12 μmol/L和128±19 μmol/L。并且,温度分别为21.0±0.5 ℃和20.0±0.9 ℃,盐度分别为32.0±0.3和31.0±0.8,Chl a浓度分别为0.7±0.1 mg/m3和2.0±1.2 mg/m3。可见,大量浒苔覆盖站位的DOC浓度明显高于无浒苔站位,而Chl a浓度明显低于无浒苔站位。这暗示了浒苔的暴发在一定程度上抑制了海水中浮游藻类的生长,浒苔站位的高DOC可能大部分来自于浒苔生长向海水中的释放。
在DOC降解实验中,为了反映DOC的生物可利用性,我们将DOC广泛地分为活性DOC(LDOC)和惰性DOC(RDOC)。其中LDOC被定义为在降解过程中呈现快速下降特征,容易被微生物利用或转化的DOC;而RDOC被定义为在降解过程中表现出强抗降解能力,在系统中可长期保持稳定的DOC。根据DOC的动态变化特征,我们发现DOC降解主要发生在前60 d,这期间浒苔站位和无浒苔站位富集的DOC浓度均呈现快速下降[图2(a)],大量浒苔组DOC从503±13 μmol/L下降至231±8 μmol/L,无浒苔组DOC从443±3 μmol/L下降至165±11 μmol/L。与此同时,微生物丰度则迅速增加[图2(b)]。因此,这些被快速消耗的DOC被看作是容易被微生物利用的LDOC,微生物则通过利用这些LDOC从而快速增长至最高丰度。此后,DOC浓度在60~300 d内保持稳定,这些剩余DOC被看作是对微生物降解具有强抵抗力的RDOC。由于这一阶段LDOC被耗尽,微生物丰度呈现持续下降并逐渐趋于稳定的特征。同时,利用一阶动力学衰减模型对60 d内被消耗的LDOC进行拟合,得到大量浒苔组LDOC的降解速率常数k=0.016 8 d-1,无浒苔组的降解速率常数k=0.019 0 d-1。可见,对比无浒苔组,大量浒苔组的DOC降解速率稍慢。300 d后,通过计算得到,大量浒苔站位富集的DOC中约46%为RDOC(230/503),而无浒苔组的RDOC比例则显著降低(P<0.05),为36%(159/443)。由于RDOC可长时间保持稳定,因此RDOC的周转时间无法通过衰减模型计算获得[5],但降解体系的RDOC可在长达240 d内保持稳定,推测其在海洋中的周转时间较长。

图2 长期降解过程中DOC浓度和微生物丰度的动态变化特征Fig.2 Dynamic changes of DOC and microbial abundance during long-term degradation process
2.2 长期降解过程中FDOM组分的动态变化特征
根据EEMs-PARAFAC分析方法,DOC降解过程中的FDOM主要包含3种荧光组分。其中,C1和C3为类蛋白组分,C2为类腐殖质组分(表1)。在大量浒苔组,与DOC的动态变化类似,FDOM荧光组分的变化特征也主要集中在前60 d,但类蛋白组分和类腐殖质组分呈现完全相反的变化趋势[图3(a)]。两种类蛋白组分(C1和C3)的荧光强度在降解过程中呈现持续下降,表明它们是极易被微生物利用的活性组分,随着降解的进行被快速消耗或转化。相反,类腐殖质组分(C2)的荧光强度则随着降解的进行持续增加,表明它是新产生的RDOC组分,具有强抗降解能力。60 d后,当LDOC组分被耗尽,体系中的FDOM以惰性组分为主,惰性的类腐殖质组分可在60~300 d内保持稳定,进一步证明了体系中剩余的DOC为RDOC。并且,类蛋白组分的逐渐消耗和类腐殖质组分的积累也暗示了体系中的RDOC中除了来自原位海水富集的惰性DOC组分外,还有一部分来自于微生物对活性组分的转化。在对照组中,无浒苔站位的3种FDOM荧光组分也呈现类似的变化特征,然而类腐殖质组分积累的荧光强度明显小于大量浒苔组的[图3(b)],进一步证明了浒苔暴发使海水中含有更多的RDOC。

表1 根据EEMs-PARAFAC方法解析得到的长期降解过程中荧光溶解有机物的主要荧光组分特征Tab.1 Characteristics of the main components of FDOM identified by EEMs-PARAFAC method
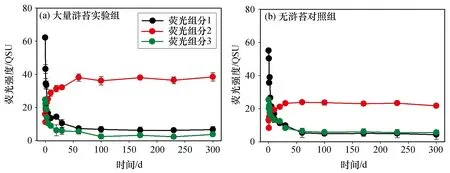
图3 长期降解过程中FDOM荧光组分的动态变化特征Fig.3 Dynamic changes of FDOM components during long-term degradation process
2.3 长期降解过程中DO及pH的动态变化特征
在长期降解过程中,溶液中的pH和DO也呈现出阶段性的变化(图4)。在0~60 d内,随着LDOC被快速利用,微生物丰度显著增加,剧烈的微生物呼吸作用导致溶液的DO快速下降,pH值剧烈波动,呈现先快速降低后小幅增加的特征。60 d以后,系统中的LDOC被耗尽,剩余的DOC变得越来越惰性,导致微生物活性逐渐下降,DO和pH也逐渐趋于稳定。在降解后期,降解体系稳定的DO和pH间接反映了剩余RDOC的稳定性。

图4 长期降解过程中DO和pH的动态变化特征Fig.4 Dynamic changes of DO and pH during long-term degradation process
3 讨论
近15年来我国南黄海暴发的浒苔绿潮是世界最大规模的藻华灾害之一,目前关于浒苔绿潮的起源、生消特征及给生态环境带来的负面危害已有大量的报道[42-44],然而关于浒苔绿潮暴发对海洋碳储库的影响却极少关注。当前,在全球气候变化的严峻形势下,探索浒苔绿潮暴发对近海碳循环的深远影响至关重要[13]。RDOC由于在海洋中拥有极高的惰性、不容易被微生物转化及利用,在海洋中的周转时间可达上千年,被看作是可贡献于海洋溶解态碳汇的重要碳组分[1,21]。本研究通过探究浒苔绿潮暴发海水和无浒苔海水富集DOC的生物可利用性,发现浒苔暴发海水中的RDOC比例明显高于非浒苔站位(46%vs36%),暗示了浒苔绿潮暴发在一定程度上可增加近海的RDOC储库,贡献于溶解态碳汇。
在近海生态系统中,大型海藻是初级生产力的重要贡献者。据统计大型海藻的年净初级生产力(NPP)高达91~522 g/m2,占全球初级生产的5%~10%[19,45]。并且,大型海藻在生长过程中,可将其初级生产力的18%~62%以DOC的形式释放到海水中[46],因此,这些藻源DOC的生物可利用性直接决定了其在海洋中的存留时间和对碳储库的贡献。目前,海洋DOC的生物可利用性一般通过特定条件下的生物降解实验测定,根据其周转时间不同常分为不同的组分[47-48]。本研究通过长期的微生物降解实验,发现浒苔绿潮暴发海水的DOC一半以上为LDOC(图2),它们在微生物的作用下被快速利用,并且有一部分被转化为RDOC。随着微生物的利用,FDOM中类蛋白组分逐渐下降、类腐殖质组分逐渐积累(图3),进一步证明了LDOC向RDOC的转化。根据海洋微型生物碳泵理论,微生物是RDOC来源中最重要的贡献者,大约有5%~7%的RDOC来自于微生物对LDOC的转化[11.49]。可见,浒苔暴发海水富集后的RDOC组分,和微生物利用LDOC后转化生成的RDOC组分,共同构成了降解体系最终的RDOC,这些RDOC占浒苔暴发海水富集DOC的46%。
大型海藻一般包含绿藻、褐藻和红藻,其中绿藻的DOC释放速率[0~266 μmol/(g·h),干重]远高于褐藻[0~90 μmol/(g·h),干重]和红藻[0~41 μmol/(g·h),干重][50]。浒苔作为一种绿藻藻种,可通过光合作用将空气中的CO2转化为初级生产力,然后以DOC的形式释放到海水中。本研究调查的浒苔绿潮爆发站位DOC浓度为156±12 μmol/L,比非浒苔爆发站位DOC高约18%。这与以往的调查结果类似,2017年针对浒苔绿潮爆发的研究指出,浒苔绿潮爆发海水的DOC浓度(平均值约89 μmol/L)显著高于非浒苔海区,大约高1.2倍[20]。本研究通过长期的DOC降解实验表明,浒苔绿潮海水中的DOC近一半(46%)为RDOC。因此,浒苔绿潮暴发除了显著增加海水中的DOC浓度,还可在一定程度上贡献于近海的RDOC库积累。然而,本研究是在通过实验室模拟条件下获得,忽略了海流、温度变化、光化学分解等因素的影响。并且,C18固相萃取的方法优先萃取海洋中的极性分子,导致部分非极性分子缺失。因此,本实验结果与现场真实状况有一定的差别,后续需要更多的现场调查及围隔实验加以验证。
4 结论
本研究通过DOC的长期微生物降解实验,探究了浒苔绿潮暴发海水DOC的生物可利用性,证明了浒苔绿潮暴发在一定程度上可贡献于近海RDOC储库的积累。主要结论为:
(1)经过微生物对DOC的长期降解,大量浒苔覆盖海水的RDOC比例(46%)明显高于无浒苔海水,证明了浒苔绿潮暴发可增加海水的RDOC含量。
(2)通过解析DOC的长期微生物降解过程中FDOM的荧光组分变化,发现部分LDOC可在微生物的作用下转化为RDOC,证明了微生物在RDOC产生中扮演着重要角色。

