七种蜜蜂病毒病的流行病学调查
王红坤,张炫,李雨时,宗德琴,梁铖,张洋逸,赵洪木
(1 云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101;2.云南农业大学动物科学技术学院蜂学系,云南 昆明 650201)
约80%的异花传粉植物需要昆虫授粉进行繁殖,而人工栽培的作物有2/3 必须通过昆虫授粉才能获得高产和丰产,蜜蜂科内昆虫是地球最为重要的授粉昆虫,在粮食安全、生态可持续性和生物多样性方面发挥着不可替代的作用[1]。尽管在过去的50 年间我国蜂群饲养数量仍保持快速增长趋势,但是由于疾病流行与频发导致的饲养蜂群持续性的丢失,极大制约了我国养蜂业的健康发展[2]。在众多蜜蜂病害中,蜜蜂病毒病尤其特殊。第一个蜜蜂病毒——蜜蜂囊状幼虫病毒于2013 年被首次报道,随后陆续有30 余种蜜蜂病毒被报道,最常见和传播最广的病毒包括急性蜜蜂麻痹病毒(Acute bee paralysis virus,ABPV)、黑蜂王台病毒(Black queen cell virus,BQCV)、慢性蜜蜂麻痹病毒 (Chronic bee paralysis virus,CBPV)、 残翅病毒(Deformed wing virus,DWV)、以色列急性麻痹病毒(Israeli acute paralysis virus,IAPV)、克什米尔蜜蜂病毒(Kashmir bee virus,KBV) 和蜜蜂囊状病毒(Sacbrood virus,SBV),但并未引起足够的重视[3-5]。与其他昆虫病毒相比,蜜蜂病毒多为RNA 病毒,具有种类多、易变异、多因素联合致病和多寄主寄生能力等特点,可在同生境条件下进行相互交叉传播,对蜜蜂的影响非常复杂,导致在致病机理研究和疾病防控上依然知之甚少,也一直是蜜蜂病害研究的热点[6-7]。由于缺乏在病毒传播动力学、发病机制、流行病学和寄主免疫学方面的知识及相关数据,蜜蜂病毒病的流行与传播机制仍未得到完全揭示,目前尚无有效预防和治疗手段;加上蜜蜂的新引进和国际交流,蜜蜂病毒在全球范围内迅速传播[8]。规模化养蜂生产的饲养管理模式下的饲养蜂群因生产需求、饲养品种、营养条件、饲养小环境、病虫害流行等多种生物及非生物因素协同作用,饲养蜂群疾病流行与爆发呈现多因子联合胁迫的趋势,给疾病防控与诊断带来新的挑战[9]。
在试验中,我们以人工饲养蜂场内的东西方蜜蜂实验蜂群以及蜂场周围的部分蜜粉源植物作为研究对象,检测七种最常见和传播最广的病毒在其体内或不同组织中的存在情况,为蜂场内蜜蜂病毒病的流行病学调查及其传播途径研究提供参考。
1 材料与方法
1.1 试验设计
分别采集自实验蜂场的东、西方蜜蜂样本,以及蜂场周围的有花植物的花、茎、叶组织样本,放置于-80℃短期保存或直接进行下一步操作。采用TRNzol 法提取样本总RNA,使用FarstKing 一步法反转录试剂盒进行一步法RT-PCR,凝胶电泳后送至上海生工生物检测验证,进行蜜蜂常见病毒病的流行病学调查。
1.2 试验仪器与试剂
1.2.1 主要仪器设备
数显鼓风干燥箱(GAX-9140),电子分析天平,台式高速冷冻离心机,琼脂糖水平电泳仪,伯乐普通PCR 仪(T100),超微量核酸测定仪(NanoPhotometer N50-Touch),超净工作台(SJ-CJ2FD 双人单面洁净工作台),雪科制冰机,超低温冰箱,高压灭菌锅,微波炉。
1.2.2 主要试剂
细胞裂解液(TRNzol Universal),纯化回收试剂盒、一步法反转录RT-PCR 试剂、cDNA 第一链合成试剂、荧光定量预混试剂[EastepTM Gel and PCR Clean-up System、FastKing One Step RT-PCR Kit、FastKing RT Kit(With gDNase)、SuperReal PreMix Color (SYBR Green),天根生化科技有限公司];低熔点琼脂糖粉。
1.3 引物设计与合成
通过文献查阅[10]确定用于蜜蜂病毒病流行病学调查的引物对,具体引物信息见表1。本试验所用引物均由生工生物股份有限公司合成。用RNase-free H2O 溶解至浓度为10 μmol/L,-20℃保存备用。
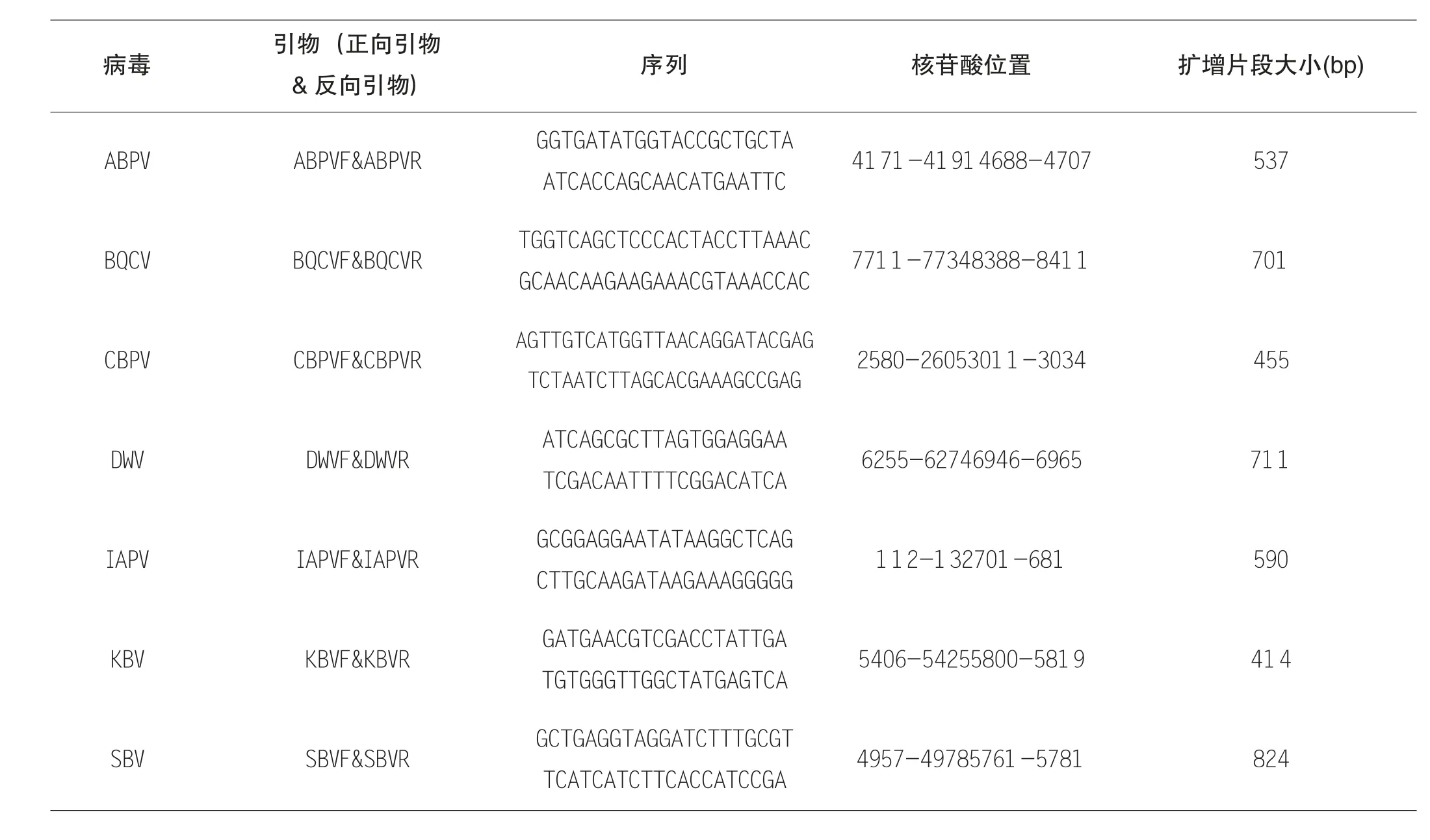
表1 用于蜜蜂病毒病的流行病学调查的七种蜜蜂病毒引物的碱基序列
1.4 核酸提取
按照TRNzol Universal 说明书,将待处理样本进行核酸提取,获得样本总RNA,用超微量核酸测定仪,通过测定260 nm 处的吸收峰来测定总RNA 的浓度,以260 nm/280 nm的吸光度比来估计RNA的纯度,所有样本OD260/OD280 值均高于1.8。将RNA 置于-80℃暂存备用或直接用于下一步试验。
1.5 反应条件的设定
根据FastKing One Step RT-PCR Kit 说明书,扩增体系如下:12.5 μL 2×FarstKing One Step RT-PCR MasterMix,1 μL 25×RT-PCR Enzyme Mix,各0.75 μL 上下游特异性引物,1 μL 样本总RNA 模板,7 μL RNase-free H2O。利用PCR 仪对提取的RNA 进行扩增,反应条件为:42 ℃,30 min;95 ℃,3 min;94 ℃,30 sec;60℃,30 sec;72 ℃,30 sec;40 个循环;72 ℃,5 min。扩增结束后,使用1%~2%琼脂糖凝胶电泳进行检测,将经过紫外透射观察到目的条带片段的样本送至上海生工生物股份有限公司进行测序确定。
2 结果
2.1 RT-PCR 检测结果
分别使用七种蜜蜂病毒的特异性引物对将获得的各样本总RNA 进行RT-PCR 扩增反应后用琼脂糖凝胶电泳进行检测,。只有DWV、BQCV 和SBV 三种蜜蜂病毒特异性引物对在目标位置附近出现且仅出现一个条带。以DWV 为例,其特异性引物对在Marker 711 bp 附近出现且仅出现一个条带,与预期相符(图1),将经过紫外透射观察到目的条带片段的样本送至上海生工生物股份有限公司进行测序,将测序结果使用NCBI 的BLAST 程序与参考基因组MH165180 进行比对,结果核苷酸序列同一性均超过96.32%,确定获得的片段为DWV 片段。

图1 引物对DWVF/DWVR 的RT-PCR 扩增结果Fig.1 Results of RT-PCR amplification of DWVF/DWVR with primers
2.2 东、西方蜜蜂中的蜜蜂病毒病流行病学调查
对采集的东、西方蜜蜂样品进行一步法RT-PCR 调查七种蜜蜂病毒病流行病学,凝胶电泳后送检测序确定。检测结果显示,东方蜜蜂研究所实验蜂场内仅有BQCV、DWV、IAPV、SBV 存在,且DWV 的总样品阳性检出率最高。其中,东方蜜蜂样品中仅发现BQCV、DWV 和SBV 三种病毒,且DWV 的检出率最高;西方蜜蜂样品中仅发现BQCV、DWV、IAPV 和SBV 四种病毒,且DWV 的检出率最高。西方蜜蜂中的BQCV、DWV 和SBV 三种病毒检出率均高于东方蜜蜂(表2-1)。
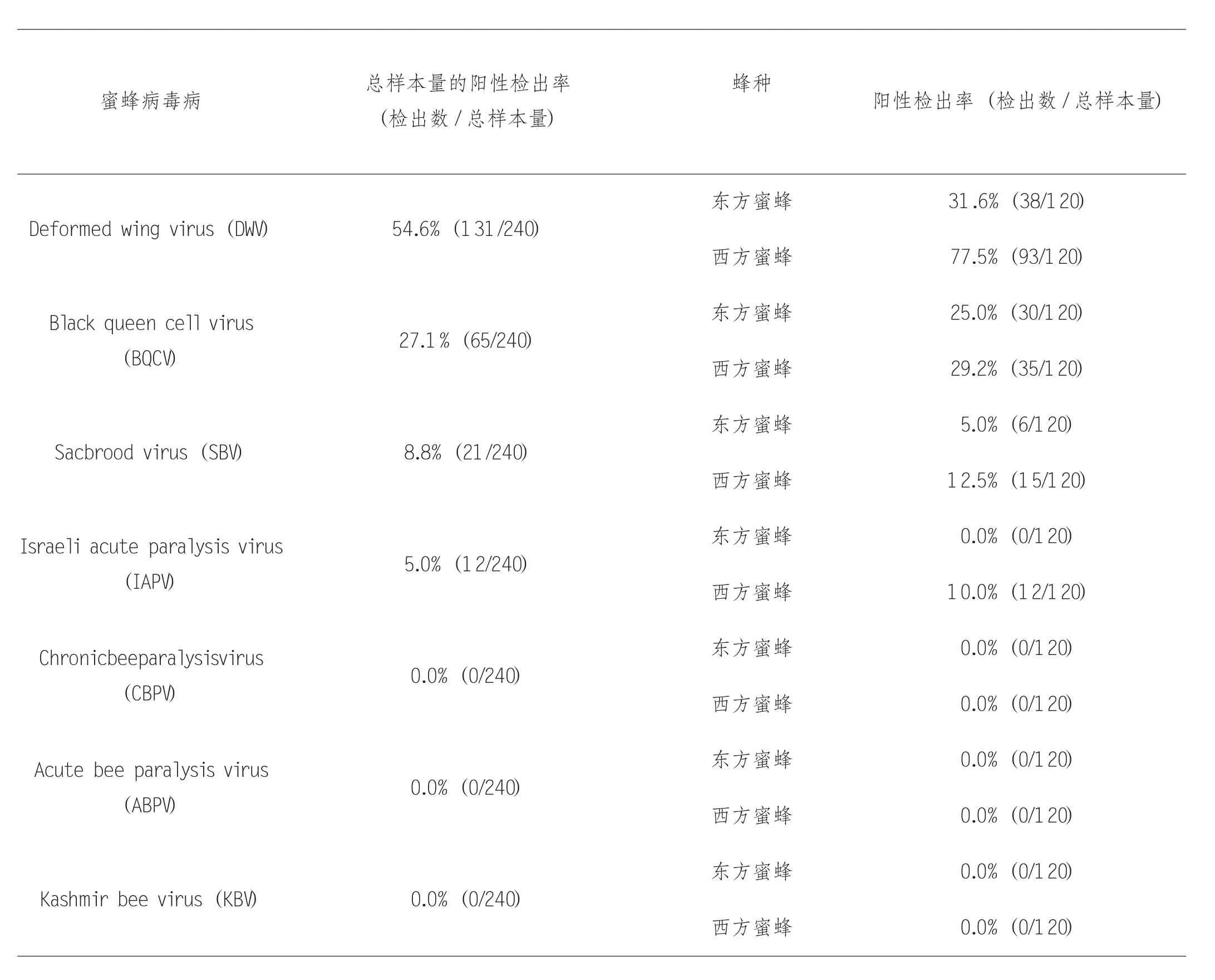
表2-1 东、西方蜜蜂中七种蜜蜂病毒病流行病学结果
2.3 有花植物中的蜜蜂病毒病流行病学调查
对采集的东、西方蜜蜂样品进行一步法RT-PCR 调查七种蜜蜂病毒病流行病学,凝胶电泳后送检测序确定。检测结果显示,采集自东方蜜蜂研究所实验蜂场周围的24 种有花植物中,有10 种有花植物的花组织中存在DWV,有4 种有花植物的叶组织中存在DWV,有3 种有花植物的茎组织中检测到DWV。其中,三角梅、紫藤、迎春的花、茎、叶组织中均检出DWV。所有检出DWV的有花植物中花组织的DWV 检出率最高(表2-2)。另外,对24 种有花植物进行BQCV 的流行病学调查显示,仅在迎春花组织中检出 BQCV, 且检出率较低 6.7%(2/30)。

表2-2 有花植物中七种蜜蜂病毒病流行病学结果
3 结论与讨论
病毒病是人类和动植物共同关注的全球性问题[126]。蜜蜂的病毒圈也十分多样化,其中蜜蜂残翅病毒可以在多个宿主中检测到[127],并形成了全球范围的流行。病毒是专性寄生生物,其复制周期的所有步骤都依赖于宿主,一旦复制完成并且宿主的资源耗尽,病毒就必须克服跨越物理和空间障碍才能到达并入侵另一个宿主的生物防御系统[11]。本试验中东、西方蜜蜂样品中均发现BQCV、DWV 和SBV 三种病毒,除此以外,西方蜜蜂样品中还发现了IAPV。几种病毒中的DWV 检出率都最高,其次是BQCV。这与蜂群内多种病毒共同感染,且DWV 是最流行的病毒[12]的结论一致。此外,西方蜜蜂样品中的病毒阳性检出率普遍高于东方蜜蜂,这与前人的研究成果一致[13]。从结果来看,实验蜂场DWV 感染率相对较高,因此,提高对DWV 的认识,加强监测和防控迫在眉睫。
本试验结果显示,蜂场附近的部分有花植物中仅存在DWV 和BQCV 两种病毒,再次验证了蜜蜂病毒具备强大的适应能力;其中,BQCV 的检出率较低,而DWV 广泛地存活于有花植物的花组织中(10/24),这些有花植物涵盖了乔木、灌木、蔓生草本、草本、藤本和草质藤本[14-17];相比较而言,植物的花组织最容易检出DWV,茎组织最难检出DWV,这在一定程度上支持了DWV 可以通过共享花卉资源进行蜂群的种间、种内及跨物种传播[18-20]这一假设,但茎组织检出DWV 也为传播途径研究提供了新方向。另一方面,因三角梅无蜜无粉,迎春有粉无蜜,而紫藤属于蜜粉源植物,表明蜜粉源植物可能因其长期的协同进化而表现出对蜜蜂病毒的较强抗性。本次试验研究结果为蜜蜂病毒病的蜜源植物至蜜蜂寄主传播途径研究提供了基础数据。

