超高效液相色谱串联质谱法测定柑橘中的草甘膦及其代谢物残留
张梦娜 杨云 王立平等
关键词 农药残留;柑橘;草甘膦;代谢物
中图分类号:S 481.8 文献标识码:A DOI:10.16688/j.zwbh.2022319
柑橘是我国种植面积大、产量高的水果之一,其农药残留问题一直被公众广泛关注。草甘膦(glyphosate)是由美国孟山都公司开发的一种内吸广谱型非选择性除草剂,其除草机制主要是通过抑制植物体内的烯醇丙酮基莽草素磷酸合成酶,从而抑制莽草素向苯丙氨酸、酪氨酸及色氨酸的转化,使蛋白质合成受到干扰,导致植株死亡,对多年生深根杂草的地下组织破坏力很强[1-3]。草甘膦因其具有高效、低毒的特点已成为我国柑橘园用量最大、使用频次最高的除草剂[4]。目前,我国已有362个草甘膦制剂产品在柑橘上取得了登记。《食品安全国家标准食品中农药最大残留限量》(GB 2763-2021)规定草甘膦在柑、橘、橙中的最大残留限量为0.5 mg/kg。草甘膦在我国植物源性食品中的残留物定义和膳食风险评估定义分别为草甘膦和草甘膦与氨甲基膦酸(AMPA)之和,以草甘膦表示。随着耐草甘膦转基因作物在全球推广种植,2013年世界粮农组织/世界卫生组织农药残留联合专家会议(Joint Meeting on Pesticide Residues)根据草甘膦在转基因作物中的代谢试验结果将其在玉米、大豆、油菜中的残留物定义修改为草甘膦与N-乙酰草甘膦之和,以草甘膦表示,并将草甘膦在植物源性和动物源性食品中膳食风险评估定义修改为草甘膦、N-乙酰草甘膦、AMPA、N-乙酰AMPA之和,以草甘膦表示[5]。2016年,欧洲食品安全局(EFSA)提议将草甘膦在所有植物源性食品中的残留物定义修改为草甘膦、N-乙酰草甘膦、AMPA之和,以草甘膦表示,并将其膳食风险评估定义修改为草甘膦、N-乙酰草甘膦、AMPA、N-乙酰AMPA之和,以草甘膦表示[6]。随着草甘膦的大量、长期使用,较多的草甘膦直接进入土壤或通过飘移进入水体和大气而污染环境,同时在植物中残留的草甘膦及其代谢物通过食物链对动物和人体产生潜在的健康风险。2017年,国际癌症研究机构(International Agency for Research on Cancer,IARC)将草甘膦归类为2A类致癌物,即很可能对人类致癌,并对草甘膦在食品中的残留进行严格管控[3]。因此,建立一种快速、稳定且灵敏度高的草甘膦及其代谢物在柑橘中的残留检测方法具有重要意义。
草甘膦及其代谢物属于强极性化合物,极易溶于水,不溶于有机溶剂,同时其分子结构中不含有发色和荧光基团,从食品中提取、检测难度较大。目前草甘膦及其代谢物氨甲基膦酸的检测方法主要有酶联免疫检测法、离子色谱法、毛细管电泳法、液相色谱法、气相色谱串联质谱法和液相色谱串联质谱法[7-8]。其中,毛细管电泳法和离子色谱法具有简单快速的优势,但其方法定量限不能满足残留分析方法的要求。色质联用因其具有较高的灵敏度,在草甘膦的检测中被广泛应用,但在前处理过程中均需衍生化,步骤繁琐、耗时长,且反应条件难以控制,无法满足大量样品的快速检测[9]。
本研究结合阴离子分离色谱柱,并通过对前处理方法和色谱、质谱条件优化,首次建立了一种基于反相液相色谱串联质谱检测柑橘中草甘膦及其代谢物N-乙酰草甘膦、AMPA、N-乙酰AMPA的方法,该方法操作简单,无需衍生化,为植物源食品中草甘膦及其代谢物的快速、准确检测提供了方法借鉴。
1材料与方法
1.1药剂与试剂
草甘膦标准品(CAS: 1071-83-6,99.3%),德国Dr.Ehrenstorfer GmbH公司;N-乙酰草甘膦标准品(CAS: 129660-96-4,99.3%),中国天津阿尔塔科技有限公司;氨甲基磷酸标准品(CAS:1066-51-9,98%),美国Worcester公司;N-乙酰氨甲基磷酸标准品(CAS: 57637-97-5,纯品,96.7%),美国Worcester公司;乙腈(分析纯)、甲醇(分析纯)、甲酸(分析纯)从北京精细化工有限公司购得;N-丙基乙二胺(PSA,40μm)、十八烷基硅烷键合硅胶(C,40μm)和石墨化炭黑(GCB,40μm)等分散剂均从天津博纳艾杰尔科技有限公司購得;超纯水由Milli-Q(Bedford,MA,美国)制得。
1.2仪器设备
检测仪器为AB SCIEX4500高效液相色谱质谱仪(Triple Quad 4500型),Triple QXW-80A涡旋混合器,Scientific industries,美国;KQ-500B型超声波清洗器,昆山市超声波仪器有限公司;SIGMA 1-15离心机,德国Sigma公司;TG16-WS台式高速离心机,湘仪离心机仪器有限公司;G501A型电子天平(精确度0.1g),江苏常熟衡器厂;电子分析天平(精确度0.0001g),德国Sartorious公司;医用无菌注射器,上海治宇医疗器械有限公司;微孔Filter Unit滤膜(有机相,0.22μm),MILLEX-GV,美国密理博公司。
1.3试验方法
1.3.1样品前处理
柑橘样品(果肉、全果)经匀浆机均质后称取2g试样(精确至0.1g)至50 mL聚四氟乙烯离心管中,加入20 mL 0.5%甲酸水,剧烈振荡10 min,超声5min后以4000r/min离心5min,吸取1.5 mL的上清液至2mL已加入40mg C的塑料离心管中,涡旋混匀1min,以10000r/min离心5min,经0.22μm的有机滤膜过滤至进样小瓶中待测。
1.3.2色谱-质谱检测条件
色谱条件:色谱柱为Metrosep A Supp 5 col-umn (4.0 mm×150 mm,5μm,Metrohm公司);进样量50μL,流速0.6 mL/min;柱温40℃;流动相A为水,流动相B为200 mmol/L碳酸氢铵溶液(含0.1%氨水);梯度洗脱程序见表1。
质谱条件:电喷雾离子源,负离子扫描模式;气帘气:35 psi;离子化电压:-4500 V;源温度600℃;喷雾气:55 psi;辅助加热气:45 psi;数据采集采用多反应监测模式,质谱参数见表2。
2结果与分析
2.1提取剂的选择
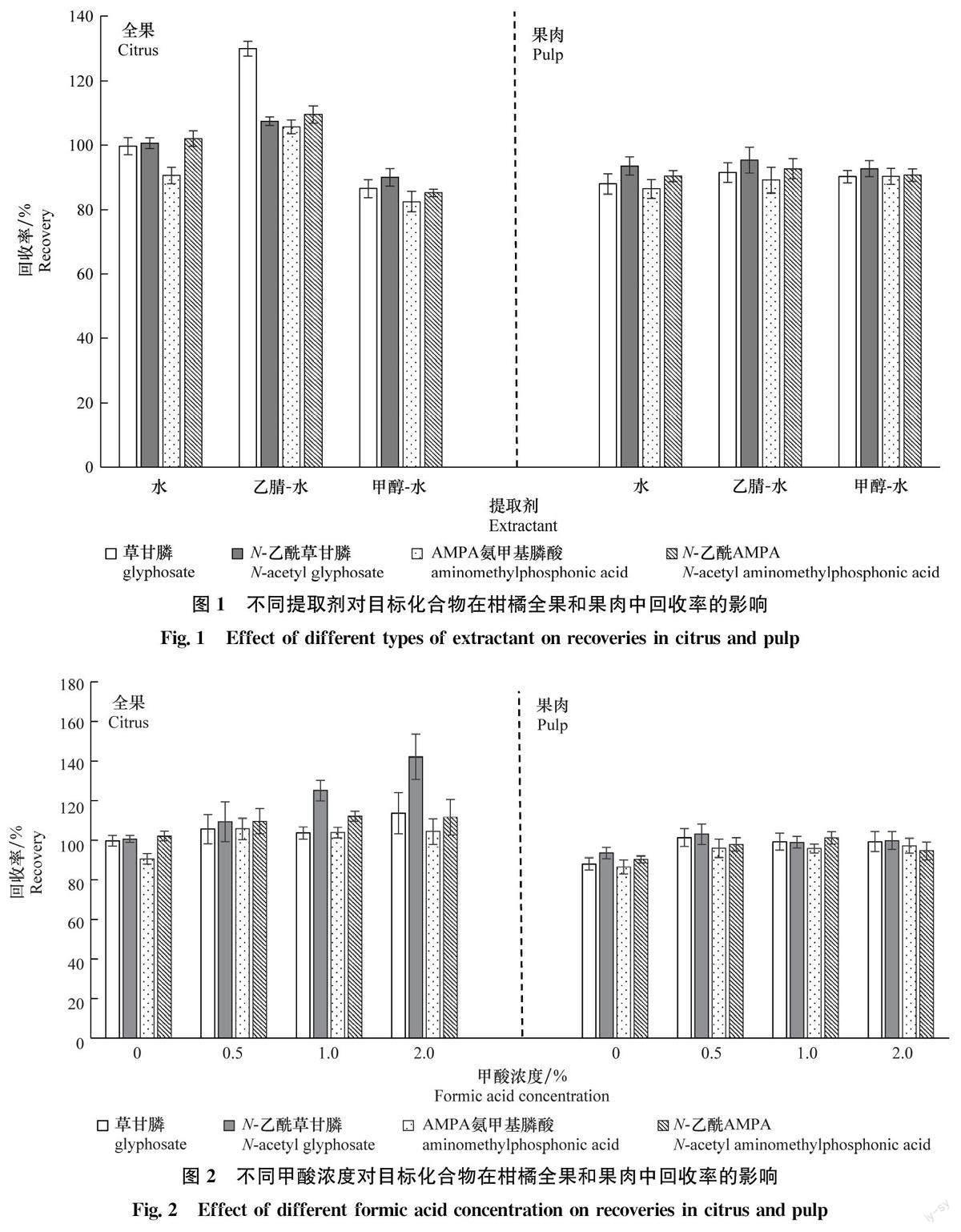
在QuEChERS方法中,乙腈作为最常用的提取劑,具有优良的溶剂性能,能溶解多种有机、无机和气体物质;甲醇溶解性好、渗透强,也是农产品基质中常用的提取溶剂之一。本研究考虑到目标化合物的亲水性质,采用水、甲醇-水体系、乙腈-水体系进行提取效果的优化,提取液总体积为20 mL,混合提取液水和甲醇体积比为1:1,水和乙腈体积比为8:2;其他前处理条件保持一致。结果如图1所示,对于柑橘全果而言,采用乙腈-水体系提取草甘膦的回收率为130%,不满足《农作物中农药残留试验准则》(NY/T788-2018)添加水平为0.01~0.1mg/kg时,目标化合物的回收率为70%~120%的要求;而水或甲醇-水作为提取液时,草甘膦及其代谢物回收率均在70%~110%,说明水和甲醇一水体系提取均满足回收率要求,且回收率之间差异不明显;由于水作为提取剂具有经济成本低、环境相容性好及试验操作简便快捷等特点,所以在后续试验中采用水作为提取剂。在提取液中加入适量甲酸可以使酸性化合物呈现分子态,进而增加其在提取剂中的溶解性,本研究比较了水、0.5%甲酸水、1%甲酸水及2%甲酸水的提取效果,结果如图2所示,随着甲酸浓度的增加柑橘全果中N-乙酰草甘膦回收率逐渐升高,且当甲酸浓度大于0.5%时,N-乙酰草甘膦回收率超过110%;而在柑橘果肉中,随着甲酸浓度的增加4种目标物的回收率基本呈现先上升后下降的趋势,且甲酸浓度为0.5%时提取效果最好。所以,最终选取0.5%甲酸水作为提取剂。
2.2净化剂的选择
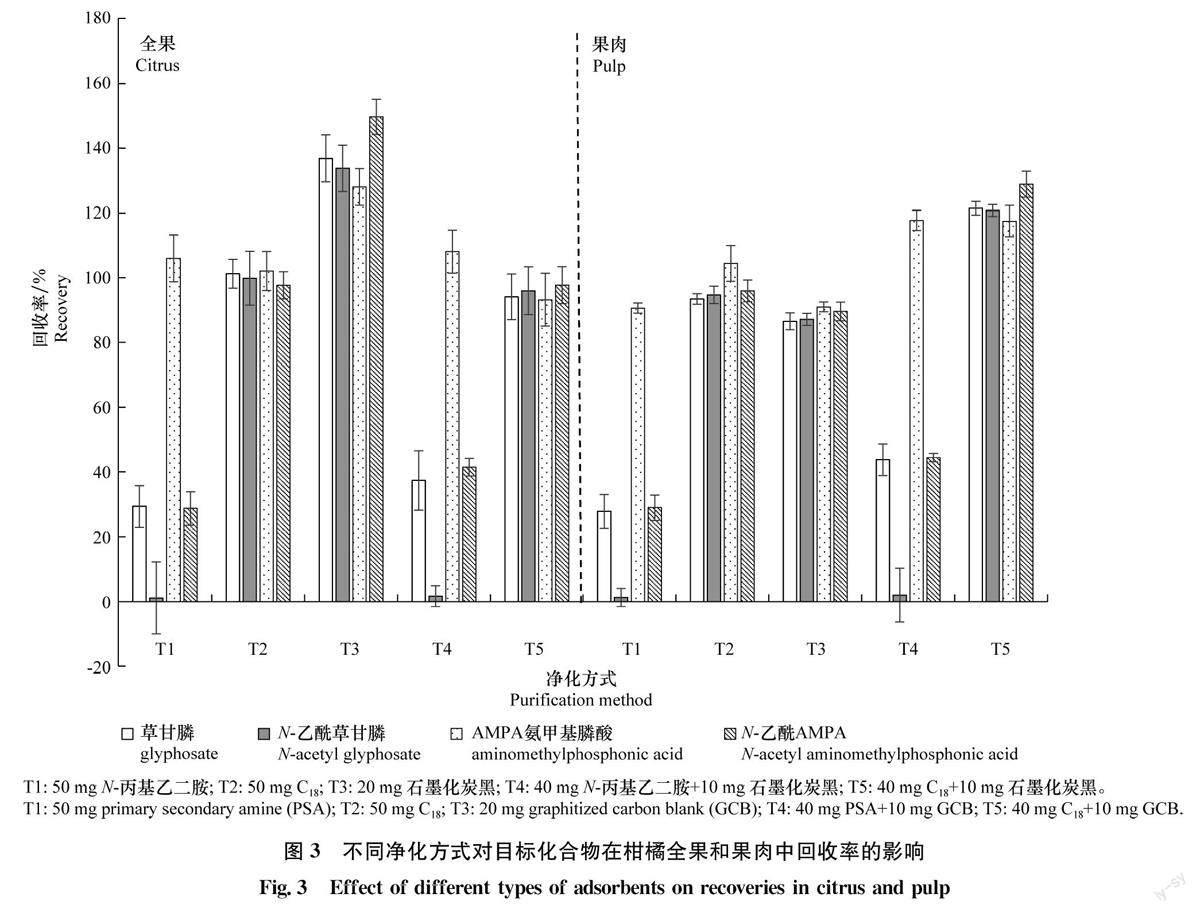
在农药残留分析中常用的净化剂有N-丙基乙二胺(PSA)、十八烷基硅烷键合硅胶(C)及石墨化炭黑(GCB)。PSA可以有效去除脂肪酸、有机酸和一些极性色素及糖类物质;C主要去除一些非极性组分;GCB主要吸附一些具有平面结构的化合物,如色素等。柑橘全果和果肉中有机酸、糖类、色素含量较高,容易对检测结果产生干扰,本研究对50 mg PSA(T1)、50 mg C18 (T2)、20 mgGCB(T3)以及40 mg PSA+10 mg GCB(T4)、40 mg C+10 mg GCB(T5)5种净化剂进行了净化效果对比。经5种方式净化后,提取液的上清液均变澄清,说明5种净化方式都能很好地去除色素。如图3所示,使用PSA作为净化剂时,草甘膦、N-乙酰草甘膦及N-乙酰AMPA回收率均低于50%,主要是由于PSA在吸附杂质的同时,也对强极性的草甘膦及其代谢物有较强的吸附作用,导致回收率不能满足要求;单独使用GCB时柑橘全果中4种目标化合物的回收率均大于120%,使用C18+GCB组合作为净化剂时柑橘果肉中3种目标化合物的回收率大于120%,不满足《农作物中农药残留试验准则》(NY/T788-2018)要求;单独使用C进行净化时,柑橘全果和果肉中4种目标化合物回收率均在70%~110%,满足回收率的要求。所以,最终选取采用40 mg C18作为净化剂对提取液进行净化。
2.3方法验证
2.3.1线性关系
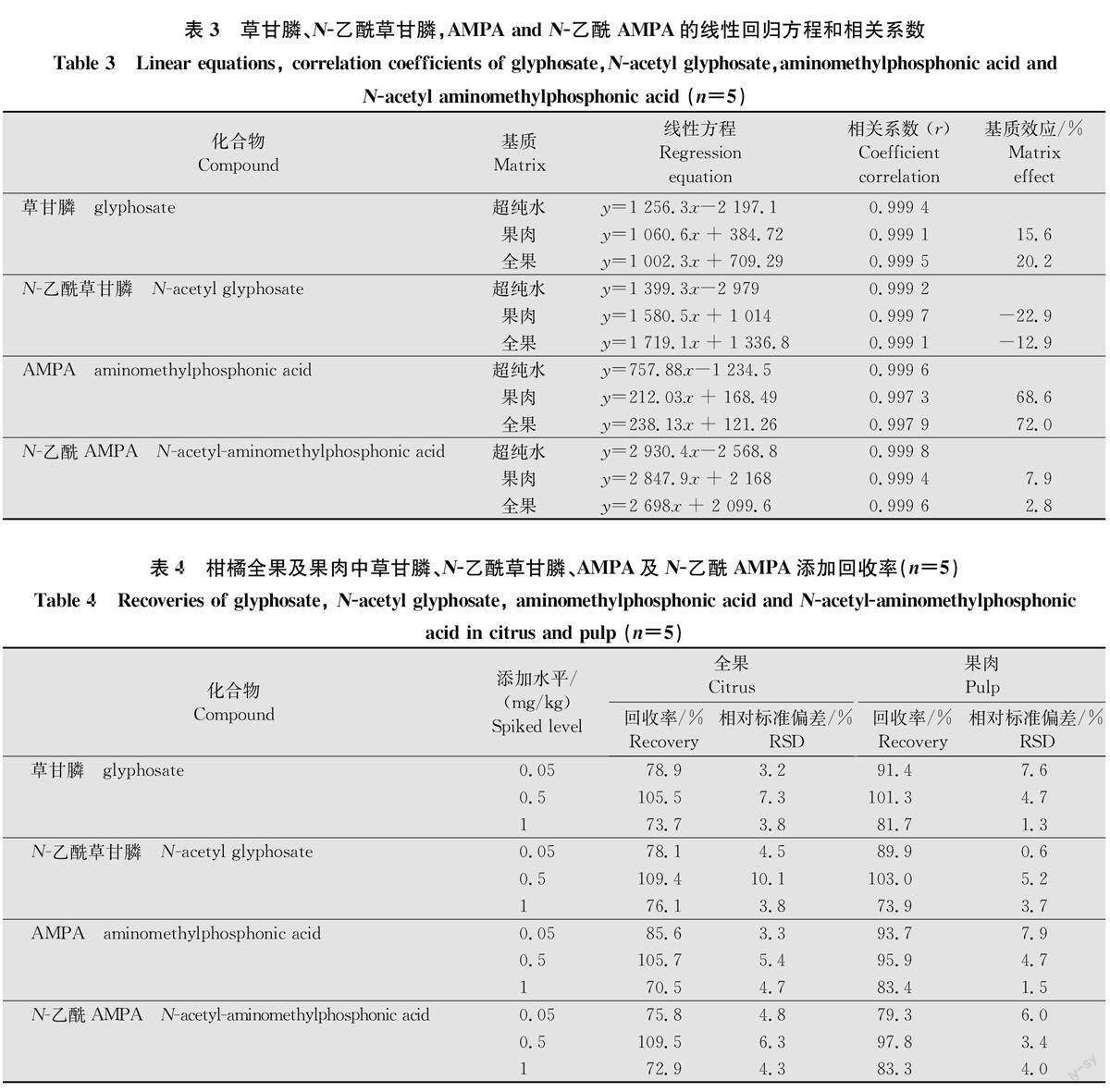
用超纯水和柑橘全果及果肉空白基质提取液配制标准溶液,以目标物的质量浓度(x,mg/kg)为横坐标,峰面积(y)为纵坐标绘制标准曲线。如表3所示,在0.05~1mg/kg范围内,本方法线性回归相关系数R均大于0.99,线性关系良好。
2.3.2基质效应分析
影响基质效应的因素有很多,基质类型、化合物的理化性质以及样品前处理过程均可对基质效应造成影响。基质效应的存在会影响残留农药的准确定量分析,通过基质标准曲线斜率与溶剂标准曲线斜率的比值,可以判断基质效应的大小[11]。即当基质效应在±20%之间时,被认为基质效应较低;当基质效应在±50%之间时,被认为基质效应中等;当基质效应超出±50%时,被认为基质效应较强[12]。如表3所示,柑橘果肉和全果对草甘膦及其代谢物存在不同程度的基质增强和减弱效应,其中草甘膦、N-乙酰草甘膦和N-乙酰AMPA在果肉和全果中的基质效应在-22.9%~20.2%,表明存在较弱的基质效应,可以忽略;而AMPA在柑橘果肉和全果中的基质效应分别为68.6%和72.0%,表明存在较强的基质增强作用,采用溶剂标准溶液定量可能导致检测结果偏高。因此,本研究采用基质匹配标准溶液校正法对基质效应进行了补偿,以提高定量准确性[13]。
2.3.3回收率和定量限
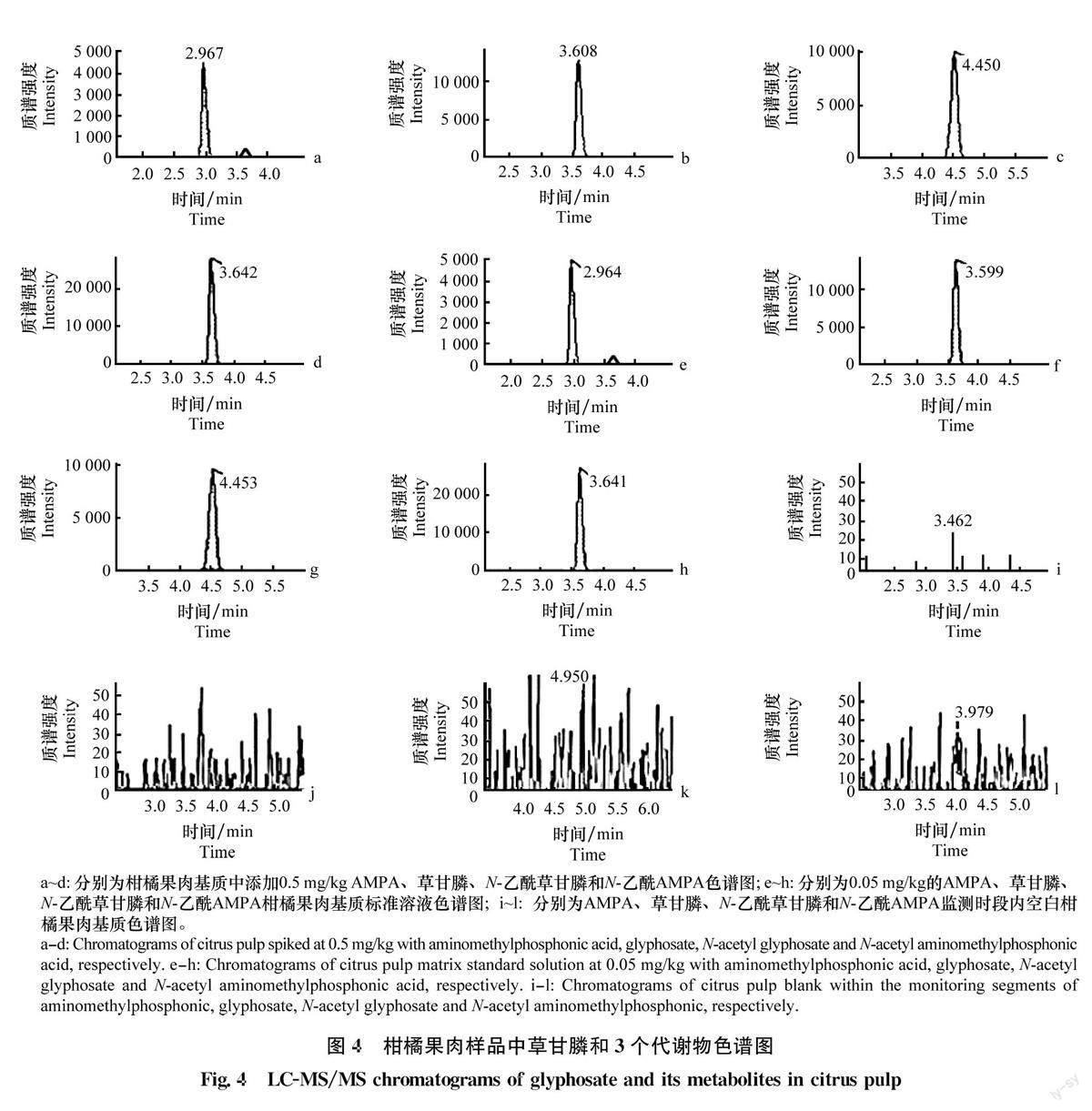
在空白柑橘全果和果肉样品中添加0.05mg/kg(检测方法能够稳定测定的最小值),0.5 mg/kg(MRL值),1.0mg/kg(涵盖样品中可能的最大值)3个不同水平的4种混合目标物,每个加标水平设5个重复。结果表明(表4),柑橘全果中草甘膦及其3种代谢物在3个加标水平下的回收率范围为70.5%~109.5%,RSD为3.2%~10.1%,柑橘果肉中草甘膦及其3种代谢物在3个加标水平下的回收率范围为73.9%~103.0%,RSD为0.6%~7.9%,满足残留分析方法的要求,相关谱图见图4。
2.4实际样品检测
将在北京超市及农贸市场购买的柑橘,按上述方法进行前处理和检测,结果发现,草甘膦及其代谢物在柑橘全果和果肉中均未检出。
3结论
首次建立了超高效液相色谱-串联质谱法(UHPLC-MS/MS)同时测定草甘膦及其代谢物N-乙酰草甘膦、氨甲基磷酸(AMPA)和N-乙酰AM-PA在柑橘中的残留检测方法。草甘膦及其代谢物可在7min内完成分离检测,在0.05~1 mg/kg浓度范围内呈良好的线性关系;样品经过0.5%甲酸水提取,十八烷基硅烷键合硅胶柱(C)净化,采用基质匹配标准溶液校正法对基质效应进行补偿,草甘膦及其代谢物在柑橘中的回收率在70.5%~109.5%,相对标准偏差在0.6%~10.1%,最低检测浓度(LOQ)为0.05mg/kg。与传统方法相比,该方法操作简便,准确可靠、无需衍生化,可满足农药残留分析的要求,并可用于大量样品的快速检测。

