基于虚实辨证探讨中药干预肝癌炎性微环境的研究进展
龙飘,房盛懿,杨雨莹,欧阳丹,曹建中(湖南中医药大学,长沙 湖南 410208)
肝癌临床表现以肝区疼痛或肿块、腹胀、纳差、乏力、消瘦、黄疸、腹水为主,具有恶性程度高、易转移复发的特征。2020 年我国肝癌新增病例约90 万,约83 万患者死亡,已成为研究的热点和难点[1-2]。研究[3-4]发现,炎性微环境与肝癌的发生发展密切相关,在促进肿瘤细胞的增殖、新生血管的形成、癌肿的侵袭和转移中发挥重要作用。《黄帝内经·素问》曰“百病之生,皆有虚实。”虚实是八纲辨证的两个纲领。“邪气盛则实,精气夺则虚。”通过虚实辨证,了解病体的邪正盛衰,可为治疗提供依据[5]。肝癌属中医“肝积”“癥瘕”等范畴,为本虚标实之证,其病机可概括为虚(正虚)、实(痰、瘀、毒)两端,与炎性因子在肝癌中的动态变化有共通之处[6-7]。故本研究基于虚实辨证探讨中医药对肝癌炎性微环境的认识,系统总结中医药干预肝癌炎性微环境的研究进展,以期为临床治疗提供参考。
1 炎性微环境是促进肝癌进展的关键因素
肝癌的炎性微环境由两部分组成,即细胞成分:肿瘤相关巨噬细胞、淋巴细胞、肝星状细胞、肿瘤相关成纤维细胞等;非细胞成分:炎性因子、促血管生成因子等。炎性微环境主要通过抑制机体的免疫功能、促进新生血管的形成以及诱导干细胞的增殖分化,在肝癌的发生、发展、转移及复发中起着重要作用[7-8]。
炎性微环境中的细胞成分可通过相互作用,不断打破内环境的平衡,塑造适合癌细胞生长的微环境,促进肝癌细胞的生长和转移,诱导机体发生免疫抑制。研究[9-10]发现,肿瘤相关巨噬细胞(TAM)具有显著的免疫抑制作用,与效应T 细胞的免疫应答和功能关系密切。一方面,TAM 通过产生多种趋化因子(如CCL17、CCL18、CCL22),将调节性T 细胞(Treg)募集至肿瘤部位,抑制细胞毒性T 细胞活化,分泌白细胞介素(IL)-10、转化生长因子(TGF)-β 等抗炎因子来调控机体免疫反应,为癌症的免疫抑制作用提供新的研究维度[11-12]。另一方面,辅助性T 细胞2 衍生的细胞因子(如IL-4、IL-10、IL-13、TGF-β)刺激单核细胞分化为M2 型巨噬细胞,M2 型巨噬细胞通过表达IL-10、程序性死亡配体1(PD-L1)和TGF-β 等免疫抑制分子,抑制T 细胞介导的免疫反应,促进肿瘤进展[13-14]。肝星状细胞可分泌多种炎症因子及细胞因子,重构细胞外基质、促进肿瘤微血管的形成、导致免疫抑制,从而促成肿瘤炎性微环境,还可通过和其他细胞相互作用,调控肝癌的进程[15]。肿瘤相关成纤维细胞可通过分泌多种细胞因子,如生长因子、炎性因子和趋化因子等,促进肿瘤的生成和增殖,还可通过释放促血管生成因子促进肿瘤新生血管形成,促进肝癌转移[16]。
新生血管通过向肿瘤细胞提供养分,维持肿瘤细胞的恶性增殖并向周围组织进行侵袭转移。研究[17]证实TGF-β1 介导血管内皮生长因子(VEGF)上调,促进了肿瘤细胞的增殖和侵袭。JIANG 等[18]认为炎性微环境中的IL-1、干扰素(IFN)、肿瘤坏死因子(TNF)和TGF-β 等炎性细胞因子促进血管生成和肿瘤进展;而IL-6、IL-8 和IL-22 通过调节VEGF、成纤维细胞生长因子(bFGF)和血小板衍生生长因子(PDGF)等血管生成因子的表达来促进肿瘤的血管生成。肝癌炎性微环境在肿瘤血管生成过程中作用显著,而肿瘤血管生成是促进肝癌生长、侵袭和转移的关键环节。
肝癌干细胞(LCSC)具有自我更新、分化和癌变的能力,对肿瘤的存活、增殖、转移及复发有重要作用。研究[19]证实,炎性微环境分泌大量炎性因子如IL-6、IL-8、TNF-α、TGF-β 诱导正常的肝脏干细胞转化为LCSC。WANG 等[20]发现LCSC 通过改变炎性微环境,促进原发性癌细胞的肿瘤生长和移植继发性肿瘤的转移,导致肝癌复发和治疗耐药。LCSC通过自我更新和无限增殖维持肿瘤细胞群的生命力,其运动和迁徙能力可促使肿瘤细胞发生转移。LCSC 可长时间处于休眠状态且具有多种耐药分子,导致肿瘤细胞对外界刺激因素不敏感,促使其发生免疫逃逸,导致肝癌的复发。因此,炎性微环境是促进肝癌进展的关键因素,故临床上改善炎性微环境,对延缓肝癌进展、提高疗效、减少并发症具有重要意义。
2 虚实辨证与肝癌炎性微环境的关系
在肝癌炎性微环境的变化过程中,肝脾肾亏虚为发病之本。 津液输布失常、脏腑功能下降、气血阴阳失和导致气滞、血瘀、痰结、湿聚等实邪阻滞机体,久郁内生热毒,聚生积块,因“虚”致“实”,为肝癌发病之标[21-22]。机体痰、瘀、毒的产生影响炎性微环境,炎性微环境的改变又促进痰、瘀、毒的产生,肝癌患者炎性微环境的变化与痰、瘀、毒密切相关,而痰、瘀、毒的存在可损耗机体正气[23]。肿瘤“因虚而实”“因实而虚”的过程与炎性微环境诱导肝癌细胞增殖分化、促使其侵袭转移而大量增殖,到癌细胞无限增殖、机体供能不足致使其大量死亡有相似之处[24]。根据“虚”“实”程度不同,可将肝癌分为3 期,即早期“虚”轻“实”重、中期“虚”“实”并重、晚期“虚”重“实”轻[25]。
2.1 早期虚轻实重肝癌早期,病位在肝,临床表现为气滞、气郁(实)等郁滞之象,此时肝气郁结乘脾尚轻,故以郁、滞为主,脾虚为辅,即“虚”轻“实”重。《格致余论·阳有余阴不足论》言“主闭藏者肾也,司疏泄者肝也”[26]。肝以其条达疏泄之性,调畅全身气机,维持自身及其他脏器的正常活动。肝癌早期多因素体虚衰、情志内伤等因素,导致肝脏功能失调,气血津液运行紊乱,产生气滞、气郁等病理变化,即“实”重;肝气郁结,轻犯脾土,影响脾之运化,即“虚”轻。肝癌炎性微环境与气郁、气滞等病理变化构成的内环境存在共通之处,肝气郁结所致病理环境(实)为肝癌早期炎性微环境的表现,导致炎性因子轻度升高,影响脾之运化,使机体免疫功能下降,正气内虚,则邪气盛实[27-28]。故肝癌早期表现为“虚”轻“实”重,微环境中的炎性因子为气滞、气郁(实)等病理变化的微观表现。
2.2 中期虚实并重肝癌中期,病位在肝脾,临床表现为脾虚、气滞、血瘀、痰结、湿聚、热毒等“虚”“实”夹杂之象。此时肝气郁结进一步发展,横逆犯脾,致脾土亏虚,故以肝郁、脾虚为主,“虚”“实”并重。《医碥·五脏生克说》记载:“木能疏土而脾滞以行”[29]。肝主疏泄,调畅气机,协调脾胃升降,促进脾胃运化,则肝得脾土濡养,气机调达,脾气健运,化源充足,则肝有所藏,脾有所统。肝癌中期,肝失疏泄,气机郁滞,致脾土亏虚,为“虚”;气血津液输布失常,形成气滞、血瘀、痰结、湿聚,久郁则内生热毒,聚生结块,为“实”。
“虚”“实”相互裹挟,形成恶性循环,促进肝癌发展[30]。肝癌炎性微环境与气滞、血瘀、痰结、湿聚、热毒等病理变化构成的内环境存在共通之处[31-33]。肝郁脾虚所致病理环境(虚实夹杂)为肝癌中期炎性微环境的表现,导致炎性因子过度释放、肿瘤血管形成,促进肝癌细胞增殖、转移,肿瘤转移后又能释放炎性因子,形成炎症级联反应,与中医因“虚”而“实”,因“实”而“虚”的恶性循环类似[34-35]。国医大师周仲英[36]认为痰、瘀、毒互结,随气流窜,致病广泛、变化多端,是引起肿瘤浸润、转移的前提条件。故肝癌中期表现为“虚”“实”并重,炎性微环境导致免疫功能下降,可视为脾虚的微观病机;微环境中的炎性因子、促血管生成因子、趋化因子等为气滞、血瘀、痰结、湿聚、热毒(实)等病理变化的微观表现。
2.3 晚期虚重实轻肝癌晚期,病位在肝脾肾,临床表现为气血衰少、阴阳两虚等虚衰之象。病至晚期,肝脾肾亏虚,气血衰少,体质羸弱,郁、滞较轻,即“虚”重“实”轻。肝主疏泄,调达气机,脾为气血生化之源,为后天之本,肾藏元阴元阳,为先天之本,先天与后天,相互促进,互相资生,主司气血津液代谢平衡。肝癌晚期,积聚日久,脏腑功能严重失调,出现气血衰少、阴阳两虚,即“虚”重;而痰、瘀、毒等病理因素相对较轻,即“实”轻。肝癌炎性微环境与气血衰少、阴阳两虚的病理环境(虚)有相似之处,肝脾肾亏虚所致病理环境为肝癌晚期炎性微环境的表现,导致肝癌细胞增殖失序,癌瘤耗伤气血,脾虚失运,气血衰少,营养失供,形成正气衰竭、阴阳两虚之势[37-39]。故肝癌晚期表现为“虚”重“实”轻,炎性微环境抑制机体免疫功能,导致肝癌细胞无限增殖,氧气、能量等供不应求,可视为肝脾肾亏虚的微观病机。
综上所述,肝癌为虚实夹杂的病变。“虚”“实”的程度是相对而言。在肝癌进程中,“虚”日益增长、“实”逐渐减少,机体在“正虚”内生的基础上,形成气滞、血瘀、痰结、湿聚、热毒等“实邪”。肝癌早期,肝气郁结,气机不畅,导致炎性因子轻度升高,多属实,即“虚”轻“实”重;肝郁加重,横逆犯脾,免疫功能下降,大量分泌炎性因子、促血管生成因子、趋化因子等,发展为虚实夹杂之证,则表现为“虚”“实”并重;后因积块日久,抑制机体免疫功能,导致肝癌细胞无限增殖,氧气、能量等供不应求,耗伤气血,转以虚为主,即“虚”重“实”轻。见图1。
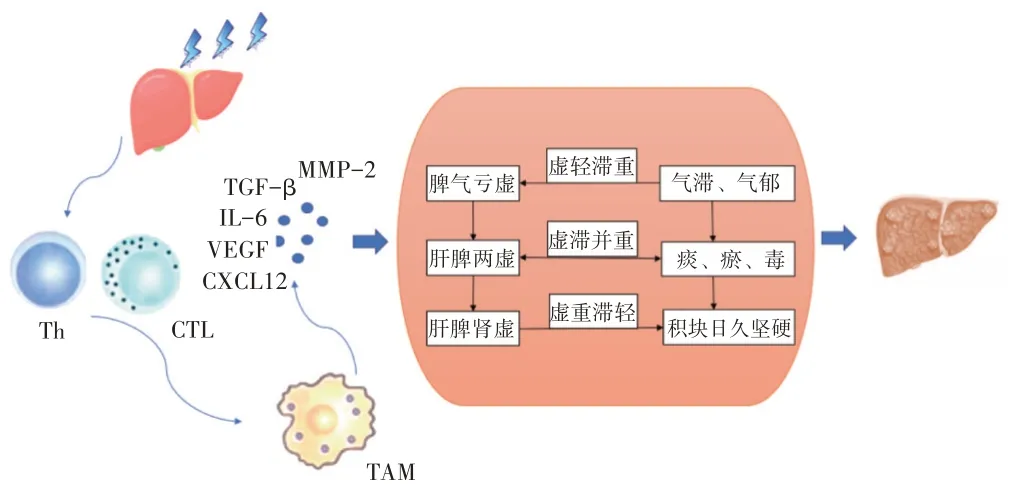
图1 肝癌炎性微环境与虚实的关系Figure 1The relationship between the inflammatory microenvironment of liver cancer and “healthy energy deficiency”and“pathogenic excess”
3 中医药干预肝癌炎性微环境的研究进展
肝癌炎性微环境可归属于中医学的本虚标实之证,正气亏虚(肝、脾、肾亏虚)为炎性微环境发病之本,实邪(痰、瘀、毒)为炎性微环境发病之标。治疗以补虚通实为主,即培补正气、通利实邪。中医药通过辨证论治、攻补兼施,在控制肝癌炎症、延缓病程进展、提高患者生存质量等方面发挥独特优势,其机制主要体现在下调炎性因子水平,抑制肿瘤血管生成,以调节气血津液输布,改善脏腑功能,调和阴阳,增强机体免疫功能,抑制肿瘤增殖转移。
3.1 中药复方肝癌为炎性相关性恶性肿瘤,临床以虚实并见为主,单一证型较少。根据方药功效可归纳为3 类:补虚通实类,针对气阴亏虚、气滞血瘀、痰毒互结证;通利实邪类,针对气滞血瘀、痰毒互结证;培补正气类,针对脾气亏虚证。其治疗机制与调控炎性因子、促血管生成因子、趋化因子等表达有关。
3.1.1 补虚通实 肝癌炎性微环境多因肝脾肾亏虚,导致气血津液输布失常,形成痰、瘀、毒互结等郁滞之象,郁久内生积块,故临床治疗以补虚通实类方药,针对气阴亏虚、气滞血瘀、痰毒互结证,以改善脏腑功能、滋补气血、调和阴阳。补虚通实类方药据程度不同可分为益气化瘀解毒类、益气化瘀解毒散结类和益气滋阴通滞类。
益气化瘀解毒类方药通过上调IL-2 水平,下调IL-6、TNF-α、TGF-β1、VEGF、MMP-2、CXCL1等水平,抑制肿瘤血管生成,提高机体免疫功能,延缓肝癌进展,改善预后。如加味四君子汤健脾益气、扶正祛邪,通过上调H22 肝癌小鼠IL-2 水平,抑制VEGF、VEGFR2、TNF-α 分泌,抑制肿瘤组织血管内皮标记物(CD31)的表达,增强免疫功能,减少肿瘤组织新生血管生成,抑制肿瘤进展[40-41]。培元抗癌汤通过抑制H22 肝癌小鼠MMP-2、MMP-9、CXCL1、CXCL2、CXCL8 的表达,调控肿瘤转移[42-43]。益气活血方通过下调肝癌患者VEGF、HIF-1α、VEGFR-2 水平,抑制肿瘤血管生成[44]。黄芩汤益气和中、清热止利、缓急止痛,通过降低肝癌患者血清NF-κB、HIF-1α 水平,缓解炎症,改善肝功能[45-46]。苦参黄芪汤益气扶正、活血化瘀、清热解毒,通过降低肝癌患者bFGF、VEGF、TGF-β1 血清生长因子水平,改善T 细胞CD4+、CD4+/CD8+免疫功能指标,增强患者免疫力,抑制肿瘤增殖转移,缓解临床症状[47]。肝积方疏肝健脾、化瘀解毒,通过降低肝癌患者IL-8、IL-10 表达水平,抑制肝脏炎症反应,调控炎性微环境[48]。肝宁方清热解毒、健脾益气、祛瘀通络,通过降低IL-6、IL-1β、TNF-α 水平,抑制Toll 样受体(TLR)4、NF-κB 的表达,改善肝癌癌前病变的炎性微环境[49]。白莲化癖汤扶正化瘀、疏肝解郁、解毒抗癌,通过降低VEGF 水平,抑制肿瘤细胞的血管形成[50]。
益气化瘀解毒散结类方药通过抑制IL-1β、TNF-α、VEGF 等表达,改善肝功能,延缓病程,提高生存率。如健脾养肝方益气活血、解毒散结,通过降低肝癌大鼠IL-6、TNF-α 的水平,抑制炎性微环境,改善肝功能,延缓肝癌进展[51]。益气活血化瘀汤通过下调肝癌术后患者血清中TLR4 及下游炎症因子细胞间黏附分子1(ICAM-1)、TNF-α、IL-1β、IL-6 水平,改善患者肝功能,缓解氧化应激反应,提高中期生存率[52]。健脾化瘀方益气健脾、化瘀散结、清热解毒、理气化湿,通过降低肝癌患者术后VEGF 的活性并下调其表达,从而抑制肿瘤新生血管形成,预防复发[53]。敷和备化方健脾疏肝、清热利湿、化瘀散结,通过上调肝癌患者IL-2 的表达,下调IL-6、IL-8、TNF-α、VEGF、bFGF、PDGF 水平,可提高临床疗效[54-55]。鳖甲煎丸益气养血、软坚散结、活血化瘀,能促使Hepa1-6 小鼠肝癌皮下转移瘤血管结构和功能正常化[56]。扶正解毒散结方健脾益气、解毒散结、养血柔肝,通过降低肝癌患者IL-6、IL-10、TNF-α、VEGF、bFGF、MMP-2、TGF-β1表达,上调IL-12、血清总抗氧化能力(TAOC)、超氧化物歧化酶(SOD)、CD3+、CD4+、NK 细胞水平,调节微环境,增强机体免疫应答,抑制机体炎性反应、氧化应激以及肿瘤血管新生[57]。
益气滋阴通滞类方药通过提高IFN-γ 含量,降低TNF-α、IL-6、C-反应蛋白(CRP)等表达,抑制肝癌细胞增殖、转移。如麻黄升麻汤滋阴和阳、清上温下、发越郁阳,通过降低肝癌术后患者TNF-α、IL-6、IL-8、CRP 水平,减少肝功能损害,改善预后[58-59]。山仙颗粒益气养阴、活血化瘀、软坚散结,通过下调H22 小鼠肝癌移植瘤组织中IL-6、TGF-β的表达,提高IFN-γ 含量,从而增强小鼠免疫功能来调控炎性微环境,抑制肿瘤细胞增殖[60]。化浊解毒软坚方化浊解毒、益气养阴、软坚消积,通过下调H22 肝癌小鼠IL-6 水平,抑制STAT3 蛋白表达,调控炎性微环境,抑制肿瘤的生长与转移[61]。
3.1.2 通利实邪 痰、瘀、毒互结为肝癌炎性微环境发病之标,通利实邪类方药主要针对气滞血瘀、痰毒互结证。如柴胡蚤休汤疏肝解郁,通过降低肝癌患者血清MMP-2、MMP-9、VEGF 和胰岛素样生长因子(IGF)-2 表达,上调IL-2 水平,减少发生不良反应,提高临床疗效[62]。清热解毒方通过降低肝癌大鼠CXCL12、CXCR4、IL-6、TNF-α、TGF-β1 表达,抑制肿瘤生长、延缓肝癌进展[63]。加味小柴胡汤和解少阳、疏肝健脾、理气止痛、活血软坚、清热解毒、燥湿化痰,通过降低TNF-α、TGF-β、VEGF和MMP-2 水平,调节肿瘤微环境,抑制肝癌生长[64]。解毒疏肝汤通过降低肝癌术后患者IL-1、IL-6和TNF-α 表达,调控炎症反应,改善肝功能,提高疗效[65]。
3.1.3 培补正气 脾气亏虚为肝癌炎性微环境发病之本,培补正气类方药主要针对脾气亏虚证。如黄芪补气汤通过降低肝癌患者TNF-α、IL-6 水平,明显改善肝功能,降低氧化应激及炎症反应水平[66]。健脾益气方通过降低肝癌大鼠CXCL12、CXCR4、IL-6、TNF-α、TGF-β1 表达,抑制肿瘤生长、延缓肝癌进展[63]。
3.2 中药及中药单体目前干预肝癌炎性微环境的中药及中药单体有穿心莲内酯、熊胆粉、雷公藤红素、华蟾素、莪术二酮、L-岩藻糖、苦参素、小豆蔻明、麦冬皂苷B。这些中药有效成分具有清热解毒、软坚散结、燥湿、滋阴等功效,通过降低IL-6、TNF-α、TGF-β、MMP-2、VEGF 等水平,抑制新生血管生成,改善炎性微环境,从而发挥抗肿瘤的作用。如穿心莲内酯通过降低肝癌射频消融术后IL-6、HS-CRP、VEGF 表达,控制炎症反应,延缓残余肿瘤进展[67]。熊胆粉通过下调肝癌术后IL-8、TNF-α、VEGF、HIF-1α 水平,改善肝功能、调控微环境,抑制肿瘤血管生成,改善预后[68]。雷公藤红素通过下调SMMC-7721、HepG2 细胞中NF-κB、TNF-α 蛋白的表达,抑制肿瘤进展[69]。华蟾素通过降低人脐静脉内皮细胞(HUVEC)中VEGF-C、VEGFR2 的表达,下调HepG2 细胞IL-1β 水平,从而抑制HUVEC 的增殖、迁移和血管形成[70]。莪术二酮通过抑制人肝窦内皮细胞(HHSEC)中VEGF 和VEGFR2 的表达,对HepG2 细胞微环境下的HHSEC 具有抗增殖活性[71]。L-岩藻糖通过抑制大鼠肝癌射频消融术后HIF-1α、MMP-2、VEGF 的合成,改善微环境,抑制肿瘤的发生发展[72]。苦参素通过抑制VEGF/VEGFR2 信号转导通路,从而抑制HepG2 细胞条件培养基诱导的HUVEC 血管生成[73]。小豆蔻明通过抑制HepG2 细胞STAT3 信号通路,下调TGF-β、MMP-2、MMP-9 的表达,进而抑制肿瘤细胞增殖、迁移和侵袭[74]。麦冬皂苷B 通过降低肝癌MHCC97-H 细胞MMP-2、VEGF、VEGFR2 的表达,抑制肿瘤细胞活性、侵袭及增殖[75]。
4 讨论
炎性微环境对肝癌的发生发展和转移具有重要作用,炎性因子在肝癌中的动态变化与中医“因虚而实”“因实而虚”的动态病机有相似之处。肝癌炎性微环境可归属为中医学的本虚标实之证,肝、脾、肾亏虚(虚)为发病之本,气滞、血瘀、痰结、湿聚、热毒等病理变化(实)为发病之标。肿瘤因虚而致,表现为“虚”轻“实”重,而后发展为虚实夹杂之证,则表现为“虚”“实”并重,后因实致虚,表现为“虚”重“实”轻。“虚”“实”互为因果、相互促进、贯穿肝癌发展始终。通过文献分析可知,肝癌炎性微环境多见虚实夹杂证,治以补虚通实、攻补兼施,单一证少见。
炎性微环境是促进肝癌进展的关键因素,中药以益气滋阴、疏肝活血、解毒散结之功,下调炎性因子、促血管生成因子、趋化因子等表达,调控机体炎性微环境,提高机体免疫功能;以调和气血阴阳,延缓肝癌进展,提高临床疗效。但研究存在以下问题:其一,目前临床研究以肝癌术后为主,动物、细胞模型无法模拟人体肝癌分期,制备模拟人体肝癌生长过程的模型迫在眉睫;其二,肝癌炎性微环境发病机制复杂,目前研究局限于中药对炎性指标的影响,相关机制研究较少,研究深度不足;其三,中医药干预肝癌炎性微环境的研究,缺乏大量样本、多中心的临床试验,可重复性低,不能进行系统检验。中医药未来可借助代谢组学、蛋白组学等技术,揭示肝癌进程中证候与炎性微环境的关系,为临床治疗提供参考。

