桃仁-红花通过抑制NF-κB信号通路改善IL-1β诱导的软骨炎症和降解
揭立士,时孝晴,刘子修,吴鹏,茆军,张农山,殷松江,王培民(.南京中医药大学附属医院,江苏 南京 20029;2.南京中医药大学第一临床医学院,江苏 南京 20023)
膝骨关节炎(KOA)是一种以膝关节软骨退化、疼痛和畸形为特征的常见疾病[1]。膝骨关节炎的高发病率造成了巨大的社会成本,并且很难通过当前的生物医药和社会心理策略得到充分控制[2]。中草药治疗疾病具有悠久的历史和良好的临床疗效,据统计,世界上超过一半的人口正在使用药用植物[3]。然而,中草药成分复杂,作用机制不明确,阻碍了其临床的广泛使用。如何阐明中草药治疗疾病的具体机制,是目前研究人员的主要挑战。
一项分析[4]显示,在治疗膝骨关节炎的中药中,桃仁和红花联合使用具有较高的置信度。红花是菊科植物Carthamus tinctoriusL 的干花,具有活血化瘀止痛的作用,常用于治疗月经相关疾病、风湿病和心血管疾病[5]。红花的这些生物活性可归因于几类化合物,如喹诺酮类、黄酮类、生物碱、类固醇、酚类化合物和红花多糖[6]。羟基红花黄色素A(HSYA)是红花的重要活性成分,现代药理和分子生物学研究[7]证实,HSYA 具有抗炎、抗氧化、抗肿瘤和神经保护作用。红花中的山柰酚通常用作红花的定性和定量标准。研究[8]表明,山柰酚具有镇痛和抗炎作用。 桃仁是Prunus persica(L.)Batsch或Prunus davidiana(carr.)Franch的干燥成熟种子,主要成分包括脂肪油、蛋白质、氨基酸、挥发油、甾体和甙类[9]。基础研究[10]表明,桃仁具有抗炎、镇痛和解热等作用。苦杏仁苷是桃仁的主要药理成分之一,研究[11]表明,苦杏仁苷可明显抑制RAW 264.7 细胞中IL-1β 和TNF-α 的表达,降低LPS 激活的RAW 264.7 细胞炎症反应。
随着基因组学、蛋白质组学、系统生物学、数学和计算机科学的发展,越来越多的数据揭示了多靶点药物的特征。网络药理学可以利用计算机学和复杂网络等系统生物学的研究方法,更好地在分子水平上了解细胞和器官的行为,加速药物靶点的识别,识别新的生物标志物[12]。传统的药物发现既昂贵又耗时,将网络药理学引入能够显著降低研究的经济和时间成本[13]。因此,本研究采用网络药理学研究方法,探索桃仁-红花治疗膝骨关节炎的分子机制和靶点,以期为该药物的研究和临床应用提供依据。
1 材料与方法
1.1 桃仁-红花治疗膝骨关节炎的机制预测
1.1.1 药物活性成及作用靶点的筛选 使用中药系统药理学数据库(TMSP)和中药分子机制生物信息学分析工具(BATMAN-TCM)检索桃仁-红花的活性成分[14-15]。在TCMSP 中分别检索桃仁和红花的中药化学成分信息,其筛选条件设置为药物口服生物利用度(OB)≥30%,药物相似性(DL)≥0.18,获取药物的活性成分。按照BATMAN-TCM 操作步骤,设置“药物-靶标”间相似性得分Score cutoff ≥20,校正P值<0.05。
1.1.2 疾病靶点和共同靶点的筛选 GeneCard、DisGeNET、OMIM、DrugBank 和PharmGKB 数据库用于建立疾病靶点数据库以检索和筛选膝骨关节炎相关基因。维恩图用于显示药物和疾病靶点之间的逻辑关系,药物靶点和疾病靶点相映射,筛选得到桃仁-红花治疗膝骨关节炎的共同靶点。
1.1.3 药物-疾病靶点网络的构建 基于上述数据集,Cytoscape 3.7.2 建立了桃仁-红花治疗膝骨关节炎的药物-疾病靶点网络。对于靶点网络的可视化分析,各节点(node)代表桃仁-红花和膝骨关节炎的相关靶点,边(edge)代表这些生物分析之间的相互作用。
1.1.4 PPI 网络与核心目标分析 将获得的共同靶点导入STRING 数据库,进行蛋白互作网络分析,并绘制PPI 网络图。条件设定:Multiple Proteins,Homo sapiens,置信度为0.7。Cytoscape 软件中的“CytoNCA”插件用于拓扑属性分析,获得中介中心性(BC),接近中心性(CC),度中心性(DC),特征向量中心性(EC),网络中心性(NC),局部平均连通性(LAC)的拓扑学参数。首先筛选出DC 值大于两倍中位数的节点构成显著交集PPI 网络,在此基础上进一步筛选出同时满足BC、CC、DC、EC、NC、LAC 分别大于中位数的网络节点构成核心PPI 网络。
1.1.5 GO 和KEGG 富集分析 R 软件用于GO 和KEGG 富集分析。参数如下:最小基因数为5,最大基因数为5 000,P值<0.05,FDR<0.25。
1.1.6 分子对接 桃仁-红花的药物活性成分作为配体,靶标蛋白作为受体,运用Discovery Studio(DS)软件进行分子对接。配体的资料是从Chemicalbook、TCMSP 和PubChem 数据库获得的。受体蛋白的晶体结构是从RCSB PDB 数据库中下载的。首先通过DS软件对受体和配体进行自动化预处理(默认参数)。然后定义和编辑结合位点,即蛋白质晶体中原始配体的位置定义为活性口袋。运行Dock Ligands(LibDock)模块,条件设定为默认参数。LibDock 评分用于评价对接结果,得分越高表明药物的活性成分与靶标结合力越好。
1.2 实验验证
1.2.1 动物 30 只C57BL/6J 雄性小鼠(6~8 周龄)购自江苏集萃药康生物科技股份有限公司,生产许可证号:SCXK(苏)2018-0008,动物质量合格证号:202255970。动物饲养在控制温度为(26 ± 0.5)℃、湿度为50%、以及12 h 光/暗环境中。本实验经南京中医药大学动物伦理委员会批准,批准号:202104A017。
1.2.2 药物及试剂 DMEM 高糖培养基(货号:C11995500CP)和胎牛血清(货号:10099-141),购自美国GIBCO 公司;Recombinant Mouse IL-1β(货号:401-ML-010),购自美国R&D 公司;Cell Counting Kit-8(货号:C0038),购自上海碧云天生物技术有限公司;Sox9(货号:AF6330)、Collagen Ⅱ(货号:AF0135)、Aggrecan(货号:DF7561)、p-NF-kB p65(Ser536,货号:AF2006)、NF-kB p65(货号:AF5006)、JNK1/2/3(货号:AF6318)、IKB α(货号:AF5002)和p-JNK1/2/3(Thr183+Tyr185, 货号:AF3318),购自中国Affinity 公司;ERK(货号:4695)、p-ERK(Thr202/Tyr204,货号:4370),购自美国CST 公司;p38 MAPK(货号:sc-81621)、pp38 MAPK(货号:sc-166182),购自美国SANTA公司。
1.2.3 仪器 FreeZone 冷冻干燥机,美国Labconco 公司;N-1200B EYELA 旋转蒸发仪,上海爱朗仪器有限公司;Eclipse Ti 激光共聚焦倒置荧光显微镜,日本NIKON 公司;Enspire 多功能酶标仪,美国Perkin Elmer 公司。
1.2.4 药物制备 桃仁和红花购自南京中医药大学附属医院。根据实验设计,将桃仁10 g、红花10 g 加10 倍水量混合后在蒸馏水中煮沸并过滤。滤液用旋转蒸发仪蒸发,然后在低温真空干燥箱中冻干至恒质量,用于进一步的体外实验。
1.2.5 小鼠原代软骨细胞的提取 用过量的戊巴比妥钠处死小鼠。在无菌条件下提取股骨髁和胫骨平台的关节软骨。将组织切成小块(1 mm3),0.2% Ⅱ型胶原酶消化4~6 h。然后过70 μm 滤器,以1 200 r·min-1(离心半径8 cm),离心5 min。将软骨细胞以2×105个·mL-1的密度接种在10 cm2培养皿中,并置于37 ℃、5% CO2的环境中培养。
1.2.6 分组及给药 将小鼠软骨细胞分为5 组:对照组、IL-1β 组及桃仁-红花低、中、高剂量组。桃仁-红花各剂量组,先分别给予桃仁-红花(75、100、200 μg·mL-1)预处理4 h,然后IL-1β 组及桃仁-红花各剂量组再分别加入IL-1β(10 ng·mL-1)在37 ℃、含5% CO2的环境中共同孵育24 h。对照组仅给予正常细胞培养液培养。
1.2.7 CCK-8 法检测细胞活性 将细胞以6 000 个·孔-1的密度接种在96 孔板中,在培养箱内预培养24 h。使用不同浓度(0、25、50、75、100 和200 μg·mL-1)的桃仁-红花干预24 h;向每个孔中加入10 μL CCK-8 溶液,并在37 ℃下孵育2 h;多功能酶标仪测定450 nm 处的吸光度。
1.2.8 Western Bolt 法检测蛋白表达 使用RIPA(含1 %PMSF)裂解液将干预后的软骨细胞裂解并收集,于4 ℃、12 000 r·min-1(离心半径8 cm),离心30 min。BCA 法测定蛋白质浓度,确定上样体积。用凝胶电泳分离蛋白,转膜,5%的脱脂奶粉室温封闭2 h,按说明书比例配制Collagen Ⅱ、Aggrecan、Sox9、p65、p-p65、和IκB 抗体,4 ℃过夜孵育。第2 天,按1∶1 000 比例配制二抗,室温孵育2 h。滴加ECL显影液,凝胶成像系统显影,ImageJ 图像分析软件用于分析条带。
1.2.9 qRT-PCR 法检测基因表达 用TRIzol 试剂提取总mRNA,计算RNA 浓度。根据逆转录试剂盒PrimeScriptTMRT Master Mix 和 SYBR®Premix Ex TaqTMⅡ试剂盒的说明进行逆转录和qRT-PCR。在NCBI 上搜索目的基因的序列,运用primer 5 软件设计引物,由生工生物工程(上海)股份有限公司合成引物。目的基因及内参基因GAPDH 序列见表1。以2-ΔΔCt计算目的基因的相对表达量。
1.2.10 免疫荧光法检测软骨细胞p65 核转位 6 孔板内置细胞爬片,将软骨细胞接种于6 孔板内。按照“1.2.6”项下分组完成细胞造模及给药(200 μg·mL-1)。取细胞爬片以4%多聚甲醛固定,Block Buffer 室温封闭,加入p65 一抗4 ℃孵育过夜,加入二抗室温避光孵育1 h。滴加DAPI 对细胞核进行染色5 min,洗去DAPI,待干燥后用抗荧光淬灭封片剂封片,使用激光共聚焦倒置荧光显微镜观察p65 蛋白在细胞内的定位与表达。
1.2.11 HE 和番红O/Fast Green 染色对软骨进行组织学评估 将30 只小鼠随机分为假手术组、模型组、给药组,每组各10 只。其中假手术组仅切开膝关节部位皮肤予以对照,而模型组和给药组在麻醉后,通过手术构建不稳定内侧半月板(DMM)的膝骨关节炎小鼠模型[14]。在术后第14 天进行治疗,其中给药组按照3 g·kg-1对小鼠进行桃仁-红花药液灌胃,而假手术组及模型组则给予等容积的蒸馏水,每天灌胃给药1 次,连续56 d[15]。末次给药完成后,1%戊巴比妥钠腹腔注射麻醉小鼠,切取膝软骨组织,每组随机选取2 只小鼠软骨放入4%多聚甲醛保存,用石蜡包埋,切片,并进行HE、番红O/固绿染色。此外,用OARSI 评分评估小鼠的关节损伤[16]。
1.2.12 统计学处理方法 使用SPSS 22.0 版软件(SPSS)和GraphPad Prism 8.0 进行数据分析。结果以均数±标准差(±s)的形式表示。通过t检验、单向方差分析或双向方差分析进行统计比较,P<0.05 为差异有统计学意义。
2 结果
2.1 活性药物成分的筛选见表2。根据筛选条件进行检索筛选,共获得桃仁-红花有效成分45 种,删除无效及重复的15 种活性成分,最终得30 种活性成分以进一步分析。

表2 桃仁和红花的活性成分信息Table 2 Active components information of Persicae Semen and Carthami Flos
2.2 “药物-成分-疾病-靶点”网络构建和分子对接分析通过搜索TCMSP 和BATMAN-TCM 数据库,筛选出药物靶标,共588 个。之后将获得的靶标上传到UniProt 数据库,进行基因名称转换。删除无效和重复靶标后,共获得459 个活性成分靶点。在GeneCard、DisGeNET、OMIM、DrugBank 和PharmGKB数据库中,以“Knee osteoarthritis”“Osteoarthritis of Knee”和“Osteoarthritis,Knee”作为关键词进行检索,筛选得到1 952 个膝骨关节炎相关靶点。将疾病和药物靶点进行映射后,得到126 个共同靶点,见图1-A。
使用Cytoscape 软件构建了药物活性成分-共同靶点的网络图,包含152 个点和323 条边(图1-B)。以Degree 值作为拓扑分析的主要参考依据,前5 位的活性成分分别为槲皮素、β-谷甾醇、鞣花酸、天竺葵素和豆甾醇。这些排位靠前的药物成分可能是桃仁-红花治疗膝骨关节炎的关键化合物。
为进一步研究桃仁-红花治疗膝骨关节炎的作用机制,利用STRING 数据库平台预测蛋白质相互作用关系,绘制蛋白质关系网络图。我们将126 个共同基因导入STRING 数据库,得到桃仁-红花作用于膝骨关节炎的PPI 网络。之后依据拓扑分析结果进行核心靶点筛选,筛选过程及参数见图1-C。
对筛选得到的3 个核心靶点(JUN、IL-6 和RELA)和活性成分进行分子对接分析。通过靶点之间的结合程度来评价配体与受体的结合能力,即计算拟合后得到的LibDock 分数。拓扑分析表明,槲皮素的预测排第一位,我们展示了槲皮素与3 个核心靶点的对接过程,见图1-D。
2.3 GO 和KEGG 富集分析图2-A GO 富集分析结果表明,共富集了2 302 条生物学过程(Biological processes,BP),桃仁-红花治疗膝骨关节炎可能与脂多糖、氧化应激、活性氧和类固醇激素的反应有关。在分子功能(Molecular function,MF)类别中,富集了154 个过程,包括细胞因子活性、核受体活性、转录因子活性、受体配体活性等。在细胞组分(Cellular components,CC)类别中,富集了77 条,主要与膜筏、膜微区、膜区、小窝和囊泡腔有关。
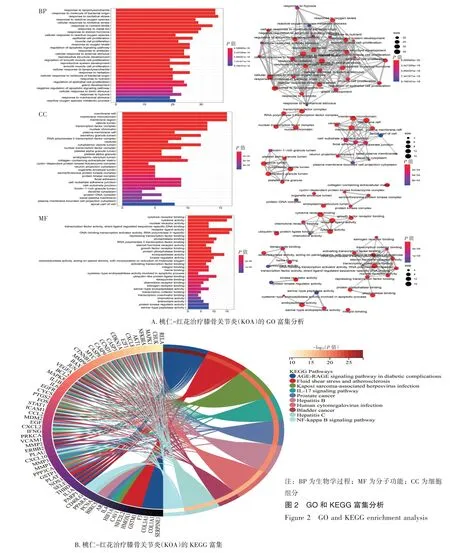
图2 GO 和KEGG 富集分析Figure 2 GO and KEGG enrichment analysis
图2-B 的KEGG 通路富集分析结果显示,流体剪切应力、IL-17 和NF-κB 信号通路可能与桃仁-红花治疗膝骨关节炎的作用机制密切相关。
2.4 桃仁-红花对小鼠软骨细胞活性的影响图3-A和图3-B 结果显示,桃仁-红花在25、50、75、100和200 μg·mL-1分别处理24 h 和48 h 后,桃仁-红花均不抑制软骨细胞的活力。故在随后的研究中,选用浓度分别为75、100 和200 μg·mL-1的桃仁-红花对软骨细胞进行24 h 的药物干预。

图3 CCK-8 法测定不同浓度桃仁-红花对软骨细胞活性的影响(±s,n=6)Figure 3 The effect of different concentration of Persicae Semen and Carthami Flos on the activity of chondrocytes by CCK-8 assay(±s,n=6)
2.5 桃仁-红花对IL-1β 诱导的小鼠软骨降解的影响Collagen Ⅱ、Aggrecan 和Sox9 常用于评估软骨退变[18]。软骨细胞在有或没有桃仁-红花的情况下暴露于IL-1β(10 ng·mL-1)24 h。采用Western Blotting 检测Collagen Ⅱ、Aggrecan 和Sox9 的表达。如图4 所示,桃仁-红花可以剂量依赖性地逆转IL-1β 诱导的Collagen Ⅱ、Aggrecan 和Sox9 在蛋白质水平上的下调。

图4 桃仁-红花对IL-1β 诱导的软骨细胞Collagen Ⅱ、Aggrecan 和Sox9 蛋白表达的影响(±s,n=3)Figure 4 The effect of Persicae Semen and Carthami Flos on the protein expressions of Collagen Ⅱ,Aggrecan and Sox9 in chondrocytes induced by IL-1β(±s,n=3)
2.6 桃仁-红花对细胞内炎症介质mRNA 的影响包括COX-2、iNOS 和IL-6 在内的炎症介质常用于评估细胞炎症反应[19]。软骨细胞在有或没有桃仁-红花的情况下暴露于IL-1β(10 ng·mL-1)24 h,采用RT-qPCR技术检测COX-2、iNOS 和IL-6 的mRNA 水平。如图5 所示,桃仁-红花可以剂量依赖性地降低IL-1β诱导的COX-2、iNOS 和IL-6 的mRNA 水平。

图5 桃仁-红花对IL-1β 诱导的软骨细胞中炎症因子COX-2、iNOS 和IL-6 mRNA 的影响(±s,n=3)Figure 5 The effect of Persicae Semen and Carthami Flos on the mRNA expressions of inflammatory factors(COX-2,iNOS and IL-6)in IL-1β-induced chondrocytes(±s,n=3)
2.7 桃仁-红花对IL-1β 诱导的软骨细胞NF-κB 信号激活的影响用Western Blot 法检测IκBα、p-p65和p65 的蛋白质水平,以进一步探索桃仁-红花的潜在抗炎机制。图6-A 的结果表明,IL-1β 诱导软骨细胞IκBα 蛋白表达下降,并增强p65 的磷酸化水平(P<0.05);然而,桃仁-红花逆转了这些影响,以200 μg·mL-1组效果为佳(P<0.05)。图6-B 免疫荧光结果显示,p65 蛋白主要位于未用IL-1β 处理的小鼠软骨细胞的细胞质中,经过IL-1β 刺激后,p65 蛋白易位进入细胞核,桃仁-红花可逆转IL-1β 诱导的p65 核转位。

图6 桃仁-红花对IL-1β 诱导的软骨细胞NF-κB 信号激活的影响(±s,n=3)Figure 6 The effect of Persicae Semen and Carthami Flos on activation of NF-κB signaling in IL-1β-induced chondrocytes(±s,n=3)
2.8 桃仁-红花改善膝骨关节炎小鼠的软骨退变使用HE 和番红O/固绿染色评估小鼠膝骨关节炎的严重程度。如图7-A 所示,桃仁-红花阻止了膝骨关节炎软骨的进一步退化。图7-B 显示,与假手术组比,模型组OARIS 评分升高,使用桃仁-红花处理后,给药组中膝骨关节炎小鼠的OARIS 评分降低(均P<0.05)。图7-C 的Western Blot 结果显示,模型组Collagen Ⅱ、Aggrecan 和Sox9 蛋白表达低于假手术组,而桃仁-红花可升高相应蛋白的表达量(P<0.05)。此外,图7-D 显示,桃仁-红花降低了模型组COX-2、iNOS 和IL-6 的mRNA 水平(P<0.05)。这些数据表明,桃仁-红花可改善膝骨关节炎小鼠的软骨退变和炎症状态。
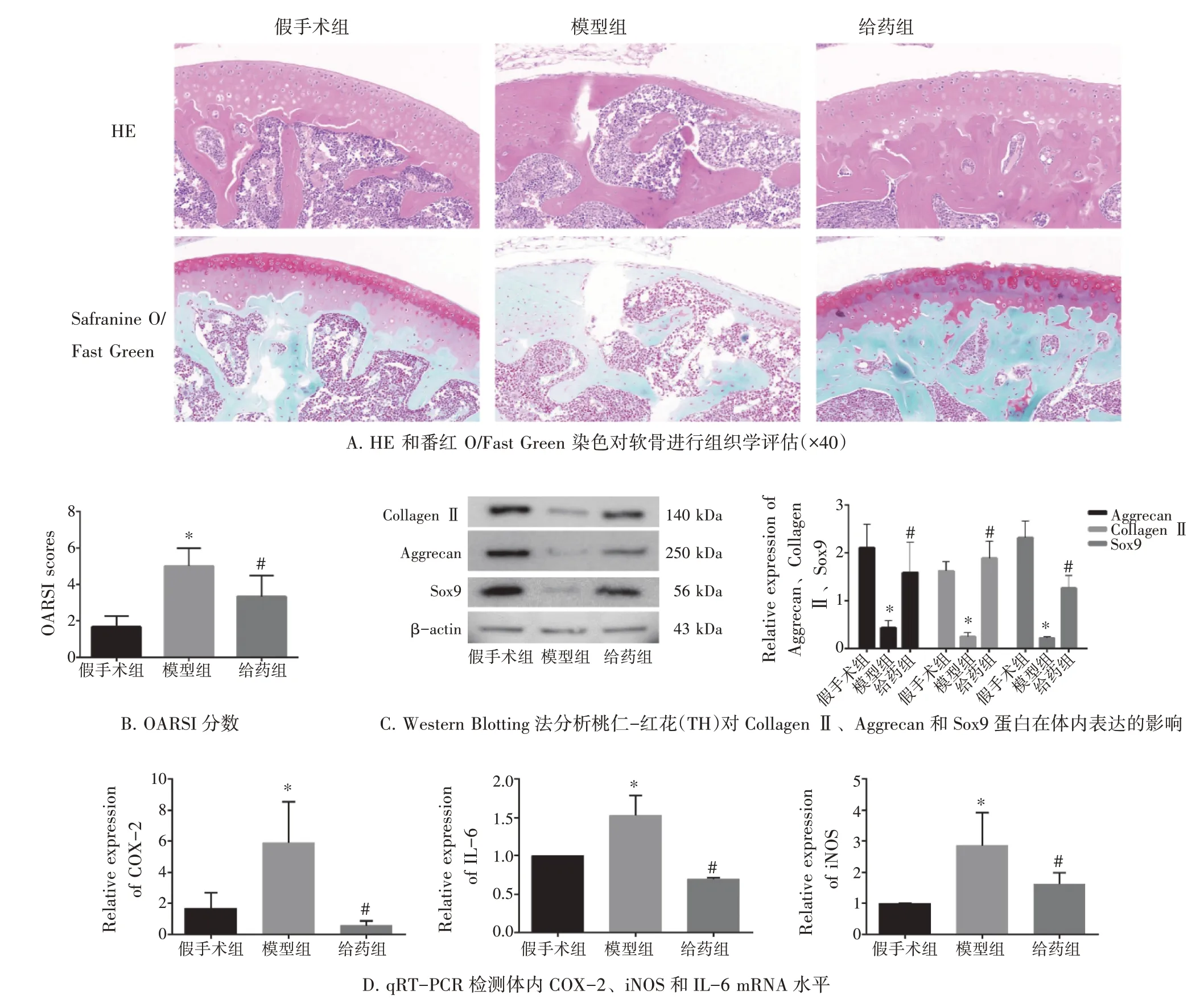
图7 桃仁-红花对膝骨关节炎小鼠软骨退变和炎症状态的影响(±s,n=3)Figure 7 The effect of Persicae Semen and Carthami Flos on cartilage degeneration and inflammatory state of KOA mice(±s,n=3)
3 讨论
膝骨关节炎的发病机制复杂,多种相互关联的免疫信号通路的激活和细胞因子产生的不平衡性促进了膝骨关节炎的炎症反应[17]。这种炎症反应一方面给患者带来了剧烈疼痛,另一方面对关节结构和周围组织也产生了负面影响[18]。目前,膝骨关节炎的主要治疗方式仍是非甾体抗炎药(NSAID)。然而,这些抗炎药只能减轻关节的疼痛和肿胀,并且长期服用会引起严重的副作用[19]。因此,我们需要探索一种有效的膝骨关节炎治疗策略。中医药为治疗膝骨关节炎提供了重要的附加选择。长期以来,中药一直用于治疗包括膝骨关节炎在内的多种疾病[20]。然而,大多数中草药治疗膝骨关节炎的分子机制尚不清楚,这在一定程度上限制了中药治疗膝骨关节炎的临床应用。本研究基于网络药理学方法,构建桃仁-红花治疗膝骨关节炎的药物活性成分目标网络。并通过共同靶点的富集分析、关键靶点信息和信号通路的筛选,系统探索了桃仁-红花治疗膝骨关节炎的分子机制。
基于网络药理学研究方法,本次研究利用中药靶点数据库和人类疾病基因数据库,筛选出桃仁、红花作用于膝骨关节炎的药物活性成分。槲皮素、β-谷甾醇、鞣花酸(EA)、天竺葵素(PEL)和豆甾醇是预测结果中的最优活性成分。槲皮素是一种广泛存在于蔬菜和水果中的类黄酮,具有多种药理作用,包括清除氧自由基、抗氧化应激作用和抗炎作用[21]。基础研究[22]表明,槲皮素显著降低IL-1β、TNF-α 和IL-6 的表达和分泌,在治疗膝骨关节炎方面具有潜在的药用价值。槲皮素通过SIRT1/AMPK通路抑制大鼠软骨细胞的内质网应激,从而减轻氧化应激诱导的细胞凋亡并阻止膝骨关节炎大鼠的病理进展[23]。此外,槲皮素还可能通过调节滑膜巨噬细胞向M2 巨噬细胞极化发挥软骨保护作用[24]。β-谷甾醇是一种植物甾醇,属于四环三萜类化合物,广泛存在于各种植物油、水果、蔬菜和植物种子中[25]。研究[26]表明,β-谷甾醇以浓度依赖性方式降低实验性结肠炎小鼠肠道组织中TNF-α、IL-6 和IL-1β 的水平。EA 是一种存在于浆果和坚果中的天然多酚,具有抗炎作用。体外研究[27]表明,EA 抑制IL-1β 诱导的iNOS、COX-2、NO、TNF-α 和PGE2 的表达,下调MMP-13 和ADAMTS-5 的表达,并且EA 也被证明可以上调Ⅱ型胶原蛋白和蛋白聚糖。豆甾醇是一种植物甾醇,能够显著抑制MMPs 的表达,抑制软骨的降解[28]。
软骨细胞的退化是膝骨关节炎进展的重要组成部分,IL-1β 等炎症因子被认为是软骨细胞代谢紊乱的主要原因[29]。本研究的数据表明,IL-1β 的刺激导致软骨细胞炎症因子上调。然而,桃仁-红花逆转了COX-2、iNOS 和IL-6 等炎症因子的增加。Ⅱ型胶原蛋白和聚集蛋白聚糖是关节软骨中细胞外基质(ECM)的关键成分[30]。充足的Ⅱ型胶原蛋白和聚集蛋白聚糖对于关节软骨的生理、生物力学特性非常重要[31]。本研究结果表明,桃仁-红花同样上调了软骨细胞的聚集蛋白聚糖和Ⅱ型胶原蛋白的表达。此外,SOX9 可抑制软骨细胞肥大,促进软骨形成[32]。研究[33]发现,在膝骨关节炎软骨组织中,SOX9 水平降低可能是祖细胞无法在受损部位再生完整的软骨的原因之一。此外,有研究[34]表明,SOX9 是控制软骨ECM 稳态的重要转录因子,也是通过促进Collagen Ⅱ表达来调节软骨细胞分化的关键因素。本项研究表明,IL-1β 的刺激导致软骨细胞SOX9 下调,而桃仁-红花逆转了这一现象。
本研究进行的通路富集分析表明,NF-κB 信号通路在桃仁-红花治疗膝骨关节炎中起重要作用。正如先前的论述[35-38],NF-κB 几乎影响膝骨关节炎炎症的所有阶段。NF-κB/Rel 家族的转录因子参与广泛的生物学过程,例如免疫反应、炎症、增殖、分化、细胞存活和凋亡。体外研究[39]表明,Rela/p65 是介导NF-κB 信号传导的关键亚基,并参与软骨形成、软骨细胞分化、细胞存活和分解代谢酶的产生。软骨细胞中的p65 过表达可诱导软骨细胞的增殖和分化,并通过增加BMP2 的表达来抑制细胞凋亡[40]。在生理条件下,p65 存在于细胞质中。当受IL-1β 刺激时,p65 释放增加并迅速转移至细胞核,进而促进大量炎症因子的表达。本项研究结果表明,桃仁-红花能够抑制p65 的表达和核转位。这表明桃仁-红花可能通过抑制NF-κB 信号通路的激活来保护软骨细胞。
在体内研究中,我们评估了桃仁-红花对体内膝骨关节炎发展的抑制作用,使用HE 和番红O/固绿染色评估了小鼠膝骨关节炎的严重程度。与Sham 组相比,DMM 组具有明显的形态学变化,包括粗糙的表面和无序且减少的软骨细胞。然而,桃仁-红花处理后软骨表面形态和细胞数量有所改善。与DMM 组相比,桃仁-红花还降低了OARIS 组织学评分。免疫组织化学结果还显示,DMM 组中Collagen Ⅱ和Aggrecan 阳性细胞的数量减少,但在桃仁-红花处理后恢复。Western Blot 结果显示,DMM 组CollagenⅡ、Aggrecan 和SOX9 蛋白表达高于Sham 组,使用桃仁-红花干预后有所改善。此外,桃仁-红花降低了DMM 刺激对炎症介质过度表达的影响。这些数据表明,桃仁-红花改善了小鼠模型中的膝骨关节炎进展。
本研究仍有一定的限制性,我们没有进行桃仁、红花药对的入血成分鉴定,只对可能有效的单体成分进行了预测。下一步,我们将对桃仁、红花中作用于软骨细胞的具体物质做出鉴定,并结合体内和体外实验,对我们的研究结果进一步论证。
综上所述,本研究通过多种靶点和多途径的联合作用初步探讨了桃仁-红花治疗膝骨关节炎的潜在机制。我们的研究结果表明,桃仁-红花可以通过抑制NF-κB 信号通路抑制软骨细胞炎症和软骨降解。本研究为桃仁-红花治疗膝骨关节炎的临床应用提供了理论依据和新的认识,初步揭示了桃仁-红花治疗膝骨关节炎疗效的物质基础和潜在机制。

