不同变质程度煤自燃特性及动力学研究
白亚娥,马 腾,尚秀全,燕利芳
(1.神木职业技术学院,陕西 榆林 719300; 2.西安科技大学 安全科学与工程学院,陕西 西安 710054)
煤自燃占矿井火灾总数的85%~90%[1],不仅造成众多人员伤亡和财产损失,还导致了大量资源浪费[2-3],如内蒙古乌达煤矿火灾燃烧40多年[4],贺兰山自燃火灾更是燃烧300多年而不灭,损失了大量优质煤炭。因此,研究煤自燃的发展过程,揭示自燃机理对预防煤火灾害十分必要。
目前利用热分析和红外技术对煤自燃机理的研究较多,张嬿妮等[5]用TG/DTG实验研究了煤自燃特征温度,提出煤氧复合过程及复合程度可以用特征温度来表征;秦汝祥等[6]利用TG实验研究了粒度、升温速率、试验量对煤自燃的影响,并依据TG/DTG曲线特征温度将煤自燃过程划分为5个阶段;姜峰等[7]利用TG-FTIR实验研究了不粘煤的氧化特性参数;李璕等[8]研究了哈密褐煤的TG曲线,发现随着温度的升高,TG曲线先升再降再升而后迅速降低;贾海林等[9]利用热量曲线将煤自燃过程划分为4个阶段。在煤自燃微观结构方面,李金亮等[10]结合热重分析仪和原位红外仪研究了含氧中间产物对煤自燃的影响,认为煤化程度越低的煤含氧中间产物越不稳定,越容易进行下一步,提出可从提高中间含氧产物稳定性实现防治煤自燃;于贵生等[11]通过对比原煤及水浸煤微观结构,发现外在水分可促进含氧官能团的含量,进而增强煤的自燃倾向性;郝长胜等[12]应用FTIR技术研究了不同变质程度煤的化学结构;董轩萌等[13]分析了3个不同地区煤样的微观结构,发现不同煤阶程度微观结构组成差别较大。在动力学研究方面,张凯等[14]应用FWO、Friedman和DAEM三种方法计算了神木煤的热解的平均活化能;王秋红等[15]采用Coats-Redfern积分法计算了3种不同变质程度的煤自燃的活化能,发现变质程度越高的煤活化能越大;邓军等[16]基于阿伦尼乌斯公式建立了CO与温度的计算模型,分析了不同变质程度煤动力学参数发现水分与活化能呈负相关;马腾等[17]结合Achar微分法与Coast-Redfern积分法对官能团动力学进行计算,发现各类官能团氧化过程遵循的动力学模型不同;仲晓星等[18]研究了等转换率法在动力学计算中的应用。
上述研究主要针对煤自燃的宏观或微观特性,但是从宏观及微观角度共同揭示煤自燃机理的研究较少,且多数学者通过动力学模型计算了煤自燃平均活化能,却少有能获得动力学参数在煤氧反应过程中的演变历程[18]。
本文采用热重—红外联用技术,分析了不同变质程度煤在氧化过程中阶段性特征及气体产物、微观分子结构的演化规律,从宏观和微观角度共同揭示煤自燃机理;同时,采用等转换率法计算煤氧化过程的活化能,消除了选取模型带来的误差,同时也可以得到活化能在煤氧反应过程中与转换率之间的对应关系。
1 实验
选取大南湖矿褐煤、顾北烟煤和阳泉无烟煤3种不同变质程度的煤样,剥去外皮,在实验室破碎筛分成粒度小于0.1 mm的样品装在密封袋内,分别编号HM、YM和WYM。
1.1 TG-FTIR联用实验
选用Netzsch STA449F3同步热分析仪,同时通入10 mL/min的O2和40 mL/min的N2,以5 ℃/min的速率将温度从30 ℃升至700 ℃。
1.2 傅里叶原位红外实验
采用VERTEX70v原位红外仪测试煤氧化过程中微观结构变化情况。实验时,先以干燥溴化钾粉末作为背景基矢采集,再将干燥好的煤样均匀填满坩埚,压平后盖上窗片密封,置于原位池中待测。反应池气体流量设定为50 mL/min,温度从30 ℃升到700 ℃,升温速率5 ℃/min,测量波数设置为600~4 000 cm-1,分辨率4.0 cm-1,累加扫描32次。
2 结果分析
2.1 煤氧化升温热重分析
煤样实验结果所得TG/DTG曲线结果如图1所示。图1中,TG为煤失重曲线,DTG为失重速率曲线,依据2条曲线,可将煤氧化过程分为5个阶段[19],并依据质量变化,得到6个特征温度,见表1。

表1 煤样特征温度Tab.1 Characteristic temperature of coal sample

图1 煤样TG/DTG结果Fig.1 TG/DTG results of coal samples
由表1可知,煤样特征温度整体随着变质程度的增加而增加,说明变质程度高的煤氧化反应需要的温度更高,相同条件下更不易被氧化。从室温至T2为水分蒸发及脱附阶段(Ⅰ阶段),该阶段煤孔隙中吸附的CH4等气体受热动能增大,开始逐渐解析为游离状态,且煤自身所含有水分开始蒸发,水分含量越高,则该阶段失重越明显。T2—T3为吸氧增重阶段(Ⅱ阶段),该阶段内煤中结构开始发生变化,对氧的化学吸附增多,导致大量氧分子附着在煤分子表面,抑制了气体产物的逃逸,导致煤样质量增加。与YM、WYM不同,图1中HM质量曲线没有表现出明显的增重,但从其失重速率来看,在第1个波谷之后,失重速率逐渐减小并保持一段稳定的趋势可以推测煤样对氧也有吸附,但是由于HM水分及挥发分较大,极易与氧反应释放气体,吸收的氧气不足以抵消释放出的气体。因此,没有出现明显的增重现象。随着温度的持续升高,T3—T4为受热分解阶段(Ⅲ阶段),该段煤分子中的活性结构被逐渐激活,在低温不易参与反应的部分结构也开始与氧反应,产生CO等气体,同时煤自身继续分解,导致煤样质量再次下降。T4—T6则为燃烧阶段(Ⅳ阶段),该段内煤分子内部发生剧烈燃烧反应,产生大量气体,煤样质量迅速减小,同时释放大量热,此时即使不再提供外界热源,燃烧仍可继续。从T6至实验结束,煤样质量不再变化,此过程为燃尽阶段(Ⅴ阶段),剩余质量接近煤中灰分含量。
2.2 煤氧化升温气体产物分析
CO、CO2、H2O随温度的变化如图2所示。由图2可以看出,气体随温度变化规律整体类似,随着温度的升高,产生气体的量由缓慢增长至迅速增长,在达到各煤样最大燃烧速率温度点T5时,释放量达到峰值,随后气体产生量又缓慢降至0,燃烧结束。HM在87 ℃前有一段明显的产生H2O的过程,这主要是由HM煤样中含有较多水分的蒸发所致。随着变质程度的增加,气体释放量最大时对应的温度越高,表明变质程度越高的煤燃烧需要的温度越高,越不易自燃。
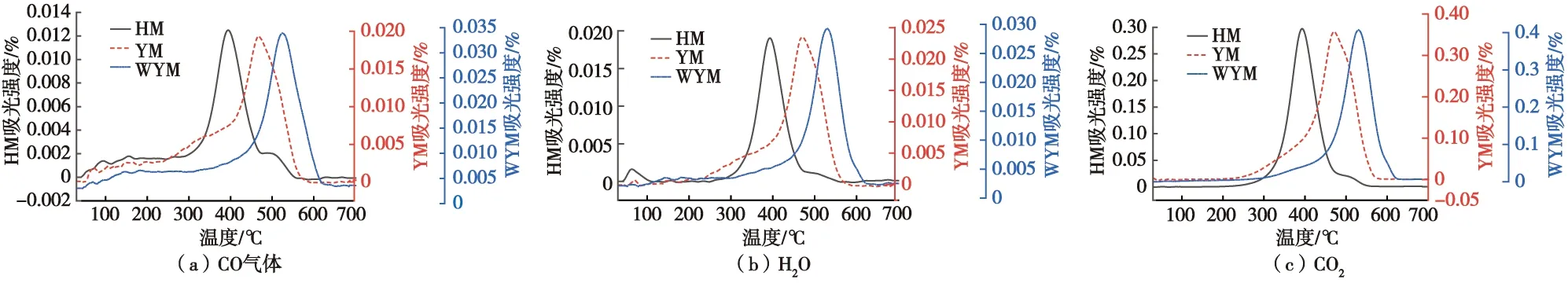
图2 不同煤样气体产物随温度的变化Fig.2 Variation of gas products of different coal samples with temperature
从阶段性看,在Ⅰ阶段产生的气体缓慢增加;在Ⅱ阶段,由于煤分子表面吸附的氧分子抑制了气体的逃逸,故释放的气体保持稳定状态;在Ⅲ阶段,煤受热分解,煤氧化学反应逐渐占据主导,大量活性结构被激活,产生的气体量快速增加;在Ⅳ阶段,煤样进入了自发反应期,更多的活性分子迅速反应,产生大量气体,直至Ⅴ阶段燃尽,产生气体量逐渐归0。
2.3 煤氧化升温主要官能团分析
(1)脂肪烃分析。依据学者们对煤微观结构的研究及红外光谱归属分析主要官能团演变规律[20-23]。甲基和亚甲基是生成碳氢类气体的主要官能团之一[24],主要有2 975~2 945 cm-1处CH3的反对称伸缩振动和2 930~2 880 cm-1的CH2反对称伸缩振动。根据测试结果,分别选取不同煤样谱峰振动强度最大时的位置,研究脂肪烃随温度的变化规律。煤样脂肪烃变化规律如图3所示。
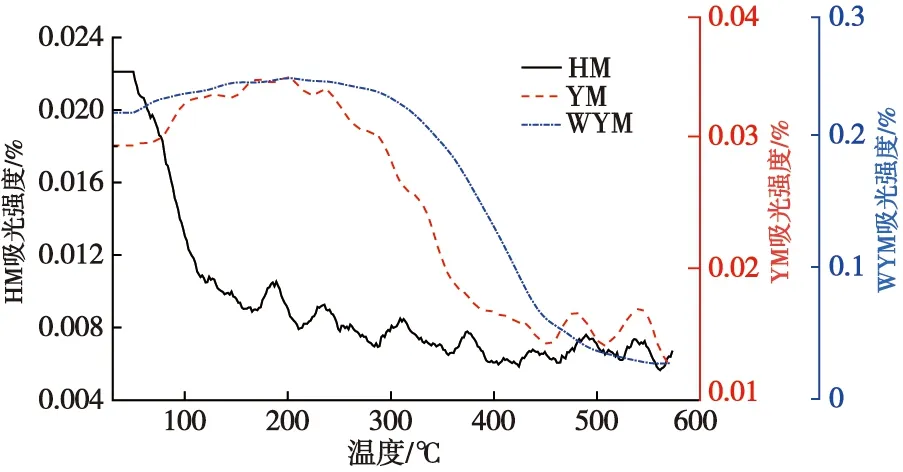
图3 煤样脂肪烃变化规律Fig.3 Variation of aliphatic hydrocarbon in coal samples
煤样甲基、亚甲基随温度的增加整体呈下降趋势,表明脂肪烃参与了煤氧反应而被消耗。不同变质程度的煤样曲线开始下降的温度不同,变质程度越低,脂肪烃开始消耗时对应的温度越低,表明变质程度越低煤分子结构越不稳定,发生氧化反应需要的能量越低,证实了低变质程度的煤越容易自燃的结论。
在受热分解温度前,YM、WYM的CH3、CH2变化曲线都出现了不同程度的增长,这是因为在低温阶段脂肪烃的侧链和桥键的断裂以及其他官能团的反应已经生成了一部分CH3、CH2,但是由于温度不足,煤氧初期化学反应不够剧烈,CH3、CH2还未来得及反应生成碳氢气体,所以含量会短暂增加[24]。
(2)芳香烃分析。芳烃是煤分子中芳香环的主要结构之一,如图4所示,不同煤样芳烃在干裂温度前基本保持不变,随着温度的升高,逐渐呈降低趋势,表明芳烃在低温阶段基本不参与反应;而在温度超过干裂温度后才逐渐开始反应,且变质程度越低的煤,芳烃开始反应的温度越低,表明低变质程度的煤更易发生氧化反应。

图4 煤样芳香烃变化规律Fig.4 Variation of aromatic hydrocarbons in coal samples
位于675~910 cm-1的取代苯类C—H面外弯曲振动可以反映出芳核的稳定程度[25]。取代苯在低温阶段随温度变化较小,表明取代苯结构较稳定,在低温阶段较少参与煤氧反应;而当温度超过燃点后,曲线出现上升趋势,表明取代苯在高温阶段参与了煤氧反应。
(3)含氧官能团。根据煤样红外光谱测试结果,分别在波数为3 700~3 625 cm-1和1 780~1 630 cm-1处选取振动强度最大时对应的位置,研究游离—OH和醛/酮/羧酸/酯CO伸缩振动键的演变过程,如图5所示。

图5 煤样含氧官能团变化规律Fig.5 Variation of oxygen-containing functional groups in coal samples
游离—OH曲线随温度的升高不断下降,表明游离—OH参与了煤氧反应。对比不同煤样—OH变化曲线发现,HM从56 ℃开始就出现了大幅降低的趋势,YM在290 ℃之后—OH开始降低,WYM则在365 ℃之后才开始消耗,表明变质程度越低,煤分子结构越不稳定,羟基参与反应的时间越早。对比煤样游离—OH下降幅度发现,HM下降幅度明显高于其他煤种,这主要与煤样含水量有关,HM含水量最高,在水分蒸发及脱附阶段被大量蒸发,因此游离—OH下降幅度最大。
2.4 煤氧化升温动力学分析
活化能表示煤氧反应需要的能量,表征煤氧反应的难易程度,结合阿仑尼乌斯(Arrhenius)方程得出非均相体系在非等温条件下的动力学微分方程表达式[26]。
(1)
式中,α为转换率;T为反应温度;A为指前因子;β为升温速率;f(α)为最概然机理函数;E为反应的表观活化能;R为普适气体常数,8.314 J/(mol·K)。
整理等式(1),并对等式两边分别进行0~α和T1~T2积分,得到下面等式:
(2)
为了能准确测算出动力学参数,Starink在此基础上,结合FWO法和KAS法,提出了更为精确的求解方程式[27],该方法避免了选取动力学模型函数导致的误差。
(3)
式中,βi为第i次实验的升温速率;Eα为转换率为α时对应的动力学参数;Tα,i为第i次实验转化率为α时对应的温度;C为常数。
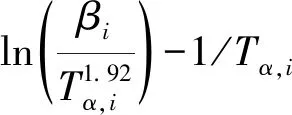
(4)
煤氧化升温的低温阶段是防灭火的关键时期,研究煤低温阶段动力学规律对防灭火更具意义。本文选择升温速率分别为3、5、8、12 ℃/min时的热重曲线,计算煤在水分蒸发及脱附阶段、吸氧增重阶段的活化能,结果如图6所示。
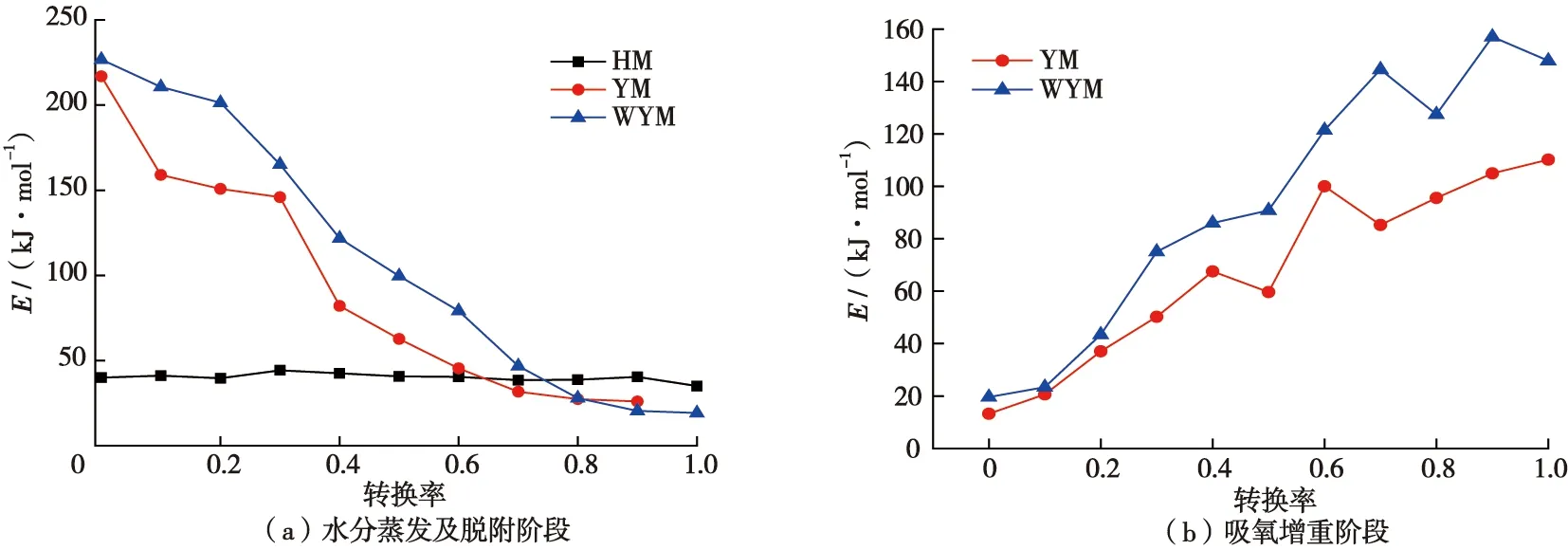
图6 煤样活化能计算结果Fig.6 Calculation results of activation energy of coal samples
在水分蒸发及脱附阶段,煤样随着温度的升高活化能逐渐降低,表明煤一旦热量积聚开始出现水分蒸发和气体脱附,则不需要更高的能量就能将这一阶段持续下去。对比不同变质程度煤样,HM需要的活化能最低,WYM最高,表明变质程度越高的煤,氧化需要的能量越高,越不易自燃,这与文章前述得出的结论一致。
在吸氧增重阶段,由于HM的失重曲线没有表现出增重,故只做了YM和WYM的活化能曲线。可以发现,在该阶段,随着温度的升高,活化能呈增加趋势,表明煤在该阶段要想持续反应需要的能量越来越高。如果在此时改变蓄热环境,则该阶段不能持续,就不会燃烧,因此,在现场煤氧化若发展到了吸氧增重阶段,可通过洒水等措施及时降低热量,防止进一步发展成燃烧。对于不同变质程度煤样,YM需要的活化能比WYM更低,再次说明变质程度低的煤更易自燃。
3 结论
(1)煤氧化升温过程可分为5个阶段,不同变质程度的煤各阶段对应的温度不同,变质程度越低,特征温度越低。
(2)煤氧化升温产生CO、H2O、CO2等气体,产生量随着温度增加先增后减,在394~528 ℃时产生的气体量最大,此时煤样的失重速率也最大。变质程度越高的煤在产生气体速率最大时对应的温度越高。在氧化升温初期,产生H2O的量与煤样的含水量有关。
(3)煤分子结构在氧化过程中变化不同,变质程度越低的煤分子结构越不稳定,相同条件下更容易反应。在受热分解温度前,煤氧化产生部分CH3、CH2,随着温度的升高,脂肪烃参与反应被消耗;芳烃、取代苯结构较稳定,在低温阶段基本不参与反应,超过干裂温度逐渐参与到反应中;游离—OH在氧化中不断被消耗,含水量越高的煤在反应过程中游离—OH消耗越多,—OH和其他官能团反映可生成CO,HM在最大燃烧速率温度点后CO又被消耗生成CO气体。
(4)高变质程度的煤氧化需要的活化能更高。煤开始出现水分蒸发及气体脱附时,不需要更高的能量就能持续反应,而在煤进入吸氧增重阶段后,需要更高的能量才能将反应持续。若煤进入了吸氧增重阶段,可通过改变蓄热环境防止发展到燃烧。

