二苯醚类除草剂降解菌Bacillus sp.Za微生物制剂的研发与初步应用①
滕 晓,沈心怡,张步瑶,罗子轩,赵天卓,徐铭阳,黄 星
二苯醚类除草剂降解菌sp.Za微生物制剂的研发与初步应用①
滕 晓,沈心怡,张步瑶,罗子轩,赵天卓,徐铭阳,黄 星*
(南京农业大学生命科学学院,南京 210095)
以二苯醚类除草剂高效降解菌株sp. Za为材料制备微生物制剂,优化液体制剂保护剂的物质配比,筛选固体制剂的最适材料,对固体制剂进行初步应用并评价其降解效果。研究结果表明:①液体制剂保护剂(0.20%柠檬酸钠、0.20% 羧甲基纤维素、0.30% KCl)可使活菌数提高35.71%,保存30 d的液体制剂对50 mg/L乳氟禾草灵的降解率为83.50%;②筛选得到猪粪有机肥作为固体制剂的最适材料,保存60 d时固体制剂活菌数为8.26×108cfu/g,对土壤中10 mg/kg乳氟禾草灵的降解率为85.52%;③添加固体制剂可有效缓解乳氟禾草灵残留对玉米所产生的药害。
sp. Za;二苯醚类除草剂;乳氟禾草灵;菌剂;微生物修复
农田杂草是一类产生持续性危害的农业有害生物。据统计,每年由草害产生的损失占农作物潜在产量的12%。施用化学除草剂是防治草害的主流方式。化学除草剂在我国三大类农药市场中所占份额位于首位,占总产量的68.70%[1-2]。其中,二苯醚类除草剂用于阔叶杂草的防除,被广泛应用于大豆、花生和水稻等多种作物田间。该类除草剂可抑制植物原卟啉氧化酶,进而干扰叶绿素的合成,并破坏细胞膜的完整性,最终导致杂草死亡[3]。
乳氟禾草灵是二苯醚类除草剂的代表品种之一[4]。由于近年来用量逐渐增加,该除草剂在施用后易通过飘移、吸附、沉降等方式产生残留,污染环境并对动植物有一定毒害。研究发现,乳氟禾草灵易对水生动物产生高度毒性,对浮萍和栅藻等水生植物也具有危害作用[5]。乳氟禾草灵诱导小鼠肝脏中过氧化物酶大量表达,造成肝脏肿瘤。高浓度的乳氟禾草灵会对人体产生伤害,引发癌症等疾病[6-8]。
目前主要通过微生物降解作用消除乳氟禾草灵在环境中的残留。微生物强化修复是农业环境污染治理的重要技术手段,通过添加有效的外源降解菌株可以对除草剂污染环境进行原位修复[9]。由单一菌株或复合微生物菌群制备而成的微生物菌剂,能够高效降解或矿化目标污染物。同时功能微生物在土壤环境中形成局部优势菌群,可抑制腐败菌和病原菌的增殖,对改善土壤质量和提高土壤微生物多样性都有明显的促进作用[10-12]。以江苏省太湖地区农药降解示范为例,该地通过实施农药残留降解成套技术有效减少了进入太湖水体的农药残留[13]。Zhang等[14-15]筛选到1株二苯醚类除草剂高效降解菌株sp. Za,二苯醚类除草剂主要包括乳氟禾草灵、乙羧氟草醚、氟磺胺草醚和三氟羧草醚等,sp. Za能够以乳氟禾草灵为唯一碳源进行生长,4 d可将50 mg/L乳氟禾草灵降解94.8%。本研究以sp. Za为出发菌株,设计系列试验优化液体制剂保护剂配比,筛选固体制剂最佳载体材料,并利用玉米苗期试验初探固体制剂的修复效果,以期为二苯醚类除草剂的污染修复提供可应用微生物制剂及理论依据。
1 材料与方法
1.1 供试菌株、材料与培养基
供试除草剂乳氟禾草灵购自上海安谱实验科技股份有限公司(纯度98%)。供试菌株sp.Za由本实验室分离并保藏。供试载体包括泥炭、米糠、秸秆肥、花生壳粉、鸡粪有机肥、蚯蚓粪有机肥、猪粪有机肥,均自然风干3 d并过40目筛,121℃高温灭菌2次后备用。供试玉米品种为美玉4号。供试土壤为黄棕壤,取自南京农业大学牌楼实验基地(32°03′ N,118°86′ E),pH 6.92,有效磷14.82 mg/kg,速效钾104.51 mg/kg,有机质12.66 g/kg,未施用过乳氟禾草灵等除草剂,去表层土及杂物后风干备用。
LB培养基:酵母浸出物5.0 g,蛋白胨10.0 g,NaCl 10.0 g,pH 7.0;无机盐培养基:NH4Cl 1.0 g,KH2PO40.5 g,K2HPO41.5 g,NaCl 1.0 g,MgSO4·7H2O 0.2 g,pH 7.0;发酵培养基:葡萄糖9.0 g,蛋白胨3.0 g,KH2PO40.9 g,MgSO4·7H2O 0.4 g,NH4Cl 0.8 g,NaCl 0.6 g,pH 7.0 ~ 7.2。以上分别添加去离子水定容至1 L,固体培养基加入1.8% 的琼脂。
1.2 液体制剂保护剂筛选试验
1.2.1 保护剂的单因素优化试验 在无菌条件下,将Za菌种活化后挑取单菌落于液体LB培养基中,30 ℃、160 r/min培养至对数生长期,按1% 接种量接入100 mL发酵培养基进行发酵培养,作为发酵液。将发酵液分装至100 mL锥形瓶中,其他条件保持一致,分别添加柠檬酸钠、乙酸钠、糊精、羧甲基纤维素、KCl、CaCl2等保护剂,使其终浓度分别为0.10%、0.20% 和0.30%,对照为等体积的无菌水,每组处理设3个重复,常温避光保存30 d后取样稀释涂布平板,计算加入保护剂后的菌株存活提高率。存活提高率(%)=(处理组活菌数–对照组活菌数)/对照组活菌数×100。
1.2.2 保护剂最佳物质组合的筛选 根据单因素优化试验的结果,将优化出的保护剂分为有机物(A:柠檬酸钠和乙酸钠)、稳定剂(B:糊精和羧甲基纤维素)、无机盐(C:KCl和CaCl2)3类,作为3个因素,每类保护剂选择上述两种物质作为两个水平,每种保护剂在发酵液中的浓度均为0.3%,进行3因素2水平L4(23)的正交试验。
1.2.3 保护剂最佳物质浓度的筛选 根据上述试验筛选出的最佳保护剂组合,选择3种保护剂(A:柠檬酸钠;B:羧甲基纤维素;C:KCl)作为3种因素,每种保护剂设置3个终浓度(0.10%、0.20% 和0.30%)作为3种水平,进行3因素3水平L9(33)正交试验筛选最佳物质浓度组合。
1.2.4 液体制剂对Za菌株的保存效果 将筛选的最优保护剂组合添加至Za发酵液中,常温保存30、60 d后进行梯度稀释涂布,培养3 d后计算活菌数。
1.2.5 液体制剂对除草剂的降解效果 将筛选的最优保护剂组合添加到Za发酵液中,常温避光保存30 d后,按照1% 的接种量分别加入到含有终浓度为50 mg/L乳氟禾草灵的20 mL液体无机盐培养基中,在30 ℃、160 r/min的恒温摇床中培养3 d后,使用高效液相色谱(HPLC)测定乳氟禾草灵浓度,并计算降解率。
1.3 固体制剂载体筛选试验
1.3.1 最适固体制剂载体的筛选 Za菌液以1% 接种量接入100 mL液体发酵培养基中,30 ℃、160 r/min培养至对数生长期。菌液5 000 r/min离心10 min收集菌体,用无菌水洗涤3次,重悬菌体,作为种子液。各取2 g载体加入20 mL灭菌水,30 ℃、160 r/min摇床振荡24 h,得到载体悬浊液。将100 mL Za种子液接种至5 mL载体悬浊液(108cfu/mL)中,再次振荡培养,于0、2、4 d取样测定不同载体处理下的活菌数,判断载体对菌株生长的影响。试验设置3个平行。
1.3.2 固体制剂的制备 将各载体自然风干后121 ℃、20 min高温高压灭菌2次,无菌条件下准确称取30 g载体于聚乙烯袋中,按照10 % 添加量将培养至对数生长期的菌株Za(108cfu/mL)添加至不同载体中,混合均匀后在聚乙烯袋表面用灭菌牙签随机扎5个孔径一致的透气孔,再套一层同样扎5个透气孔的聚乙烯袋。成品固体菌剂置于30 ℃培养箱培养,3 d后取出于干燥阴凉处保存待用。
1.3.3 固体制剂对Za菌株的保存效果 将各固体制剂常温保存0、30、60 d后取样,按照1.3.1中方法得到菌体悬浊液,分别进行梯度稀释涂布,30 ℃培养3 d后测定活菌数。
1.3.4 固体制剂对除草剂的降解效果 供试土壤中加入乳氟禾草灵使其终浓度为10 mg/kg,充分混匀后常温静置5 h,将固体制剂以1∶9质量比与上述土壤充分混匀,装入黑色塑料杯中置于光照培养箱,培养条件为:光照12 h,温度26 ℃,黑暗12 h,温度20 ℃ (24 h交替进行)。通过补加水分调节土壤含水量在25% ~ 30%,在1、3、5和7 d后分别取5 g土样检测乳氟禾草灵残留量。同时设置不加固体制剂的对照组,对照与处理均设3个重复。
1.4 固体制剂的应用
分别称取500 g供试土壤于0.7 L盆钵中,玉米种子消毒萌发后,挑取长势一致的6颗发芽种子移栽至盆钵,设置正常土壤空白对照、10 mg/kg乳氟禾草灵、10 mg/kg乳氟禾草灵+10% 固体制剂的3组处理,置于培养箱中如步骤1.3.4中所述条件培养,其间补加水分调节土壤含水量在25% ~ 30%,14 d后随机取样,测定根系长度、茎叶长度、植株鲜重等生理指标。
1.5 测定项目与方法
活菌数测定方法:制备菌株Za的OD600值与菌落数(cfu/mL)的活菌计数标准曲线。挑取菌株Za单菌落于液体LB试管培养基中,30 ℃、180 r/min培养12 h;将Za菌液以2% 接种量接入液体LB三角瓶培养基中,30 ℃、180 r/min培养,每隔2 h取样测定OD600值,同时以稀释平板涂布法测定菌落数(cfu/mL),制备标准曲线。后续活菌数测定试验根据该标准曲线公式进行计算。
乳氟禾草灵测定方法:取2 mL待测样品于10 mL离心管中,依次加入15 μL的20% 盐酸和等体积的二氯甲烷,涡旋振荡3 min,弃掉上层水相;向有机相中加入过量无水硫酸钠直至水分完全去除,将有机相转移至干净的2 mL离心管中,置于通风橱中待二氯甲烷吹干;加入400 μL甲醇(色谱纯)溶解,通过0.22 μm的有机相滤器过滤至干净的1.5 mL离心管中,待测。HPLC为Thermo scientific Ultimate 3000,色谱柱为Thermo scientific AcclaimTM 120 C18(5 μm 120 Å 4.6×250 mm)反向色谱柱,流动相为甲醇∶水∶乙酸(80∶19∶1),柱温为40 ℃,流速为1 mL/min,检测波长为230 nm和280 nm,进样量为20 μL。
植株生理指标测定方法:用无菌水洗涤植株3次,擦干根部和叶表面水分,测量整株重量作为植株鲜重,测量根茎分隔处至主根最远点的长度作为根系长度,测量根茎分隔处至植株最高点的长度作为茎叶长度。
1.6 数据统计与分析
使用Microsoft Excel TM软件对数据初步处理,采用SPSS 25.0进行单因素方差分析。
2 结果与分析
2.1 液体制剂保护剂的筛选
2.1.1 保护剂的单因素优化试验 如表1所示,各保护剂在各浓度梯度均能不同程度地提高菌株存活率。随着保护剂有效使用浓度的提高,各保护剂对菌株的保护效果随之提高。当有效使用浓度为0.30% 时,无机盐组(KCl和CaCl2)的保护效果相差不大,提高效果均达到20% 以上,而有机物组(柠檬酸钠和乙酸钠)和稳定剂组(糊精和羧甲基纤维素)组分间相差较大,柠檬酸钠的效果最好,菌株存活提高率为34.18%。因此,设置各物质使用浓度为0.30% 筛选最佳物质组合。

表1 Za液体菌剂保护剂的单因素试验
注:表中同列不同小写字母表示同一保护剂下不同浓度处理间在<0.05水平上差异显著)。
2.1.2 保护剂最佳物质组合的筛选 如表2所示,通过分析极差值发现各因素对菌株Za存活提高率的影响作用顺序为:稳定剂(B)>无机盐(C)>有机物(A),即稳定剂的影响较为显著,无机盐和有机物影响程度次之。综合分析3种因素的值,其最优水平是A1B2C2,即与其他物质组合相比,柠檬酸钠、羧甲基纤维素、KCl组合对菌株生长影响最大。由活菌提高率结果可知,该组合对菌株保护效果最佳,菌株存活提高率为27.64%。因此,选择该组合作为最佳保护剂组合开展后续浓度配比的研究。
2.1.3 保护剂最佳物质浓度的筛选 不同浓度保护剂组合对Za活菌数的提高效果差异明显。由表3可知,各因素间的主次顺序为:A>B>C,最优水平为A2B2C3,即0.20% 的柠檬酸钠、0.20% 的羧甲基纤维素和0.30% 的KCl,且该浓度组合下的菌株存活提高率为35.71%,保护效果最佳。由此,确定该浓度组合为Za菌株液体制剂保护剂的最佳配比。

表2 菌株Za液体制剂保护剂最佳物质组合正交表

表3 菌株Za液体保护剂的浓度组合正交表
2.1.4 液体制剂对Za菌株的保存效果 对筛选的最佳保护剂组合5进行菌株Za液体制剂的保存试验。如图1所示,在没有保护剂的情况下,活菌数在30 d内即出现明显下降。而随着保存期的延长,添加了保护剂(0.20% 柠檬酸钠、0.20% 羧甲基纤维素和0.30% KCl)的液体制剂保持较高的Za生物量,60 d活菌数仍达到8.19×108cfu/mL,即该保护剂组合可以在储存期内将活菌数维持在较高水平,从而延长液体微生物制剂的货架期,确保其在有效期内施用对农药的降解效果。
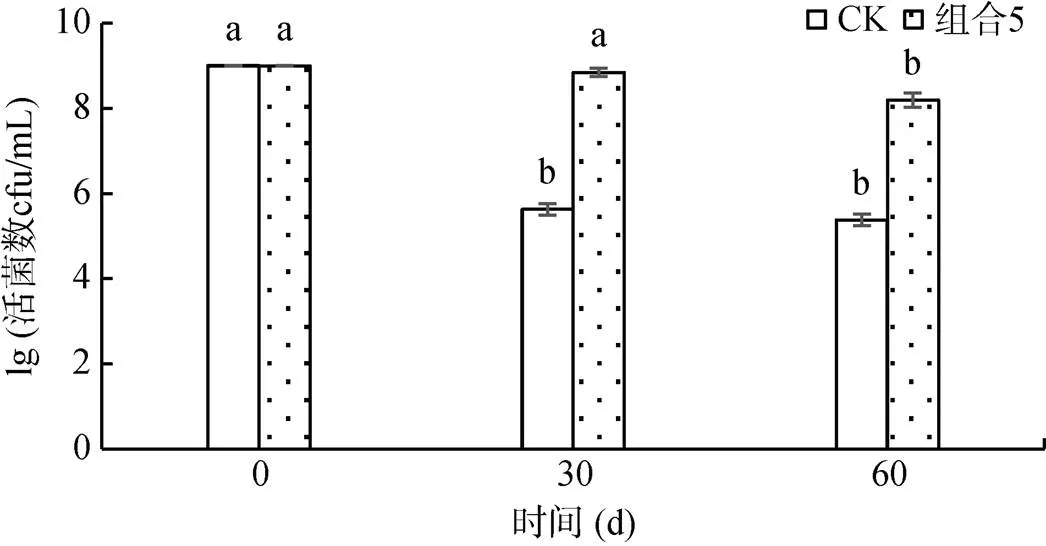
(图中不同小写字母表示不同样品间在P<0.05水平上差异显著,下同)
2.1.5 液体制剂对除草剂的降解效果 将筛选出的Za液体制剂保护剂最佳浓度组合1(0.10% 柠檬酸钠、0.10% 羧甲基纤维素、0.10% KCl)、组合3(0.10% 柠檬酸钠、0.30% 羧甲基纤维素、0.30% KCl)、组合4(0.20% 柠檬酸钠、0.10% 羧甲基纤维素、0.20% KCl)和组合5(0.20% 柠檬酸钠、0.20% 羧甲基纤维素、0.30% KCl)进行乳氟禾草灵除草剂降解效果的验证。如图2所示,加入4种保护剂保存30 d后的Za液体菌剂对乳氟禾草灵的降解效果均显著高于对照,降解率均保持在70% 以上,其中正交组合5对乳氟禾草灵降解率最高,其降解率可达83.50%。

图2 不同保护剂组合对Za液体菌剂降解乳氟禾草灵的影响
2.2 固体制剂载体的筛选
2.2.1 最适固体制剂载体的筛选 如图3所示,向各载体中接种Za菌株后,菌株均可生存及繁殖。储存4 d后发现猪粪有机肥载体中所含活菌数最高,达到8.88×108cfu/g,秸秆肥所含活菌数较少,为8.18×108cfu/g。猪粪有机肥载体可以为菌体提供良好的环境和营养,有利于菌体的生长繁殖。
2.2.2 固体制剂对Za菌株的保存效果 微生物固体制剂的载体是微生物生存的微环境,筛选能够最大限度维持微生物活性的载体对菌株制剂的保存效果尤为关键。如图4所示,随着固体制剂储存期的延长,几种载体中的活菌数均呈现不同程度的下降趋势。30和60 d时,活菌保存效果最好的均为猪粪有机肥,30 d时活菌数达到最高,为8.38×108cfu/g,60 d为8.26×108cfu/g。

(A:泥炭;B:米糠;C:秸秆肥;D:花生壳粉;E:鸡粪有机肥;F:蚯蚓粪有机肥;G:猪粪有机肥)

(A:泥炭;B:米糠;C:秸秆肥;D:花生壳粉;E:鸡粪有机肥;F:蚯蚓粪有机肥;G:猪粪有机肥)
2.2.3 固体制剂对除草剂的降解效果 图5为保存30 d后的各制剂载体对乳氟禾草灵7 d内的降解情况。添加各载体后,土壤中乳氟禾草灵降解率均明显上升。在相同条件下CK处理降解率仅为27.66%,而4组固体制剂的7 d降解率均高于70%,其中以猪粪有机肥为载体的固体制剂降解效果最优,为85.52%。综合考虑保存期活菌数和降解效果,选择以猪粪有机肥为载体开展固体制剂的初步应用。
2.3 固体制剂的应用
由表4可知,只添加除草剂处理组在培养期内玉米各指标均显著低于其他处理,说明乳氟禾草灵对玉米产生了持续的药害。向含有除草剂残留的盆钵中加入固体制剂,14 d后,茎叶长度和每株植株鲜重指标恢复至对照水平,可见,施加固体制剂有效降解了土壤中除草剂残留,减轻了作物所受药害。

(A:米糠;B:鸡粪有机肥;C:猪粪有机肥;D:蚯蚓粪有机肥;图中不同小写字母表示同一时间不同处理间差异在P<0.05水平显著)

表4 Za固体制剂对玉米除草剂药害的解除作用
注:表中同列不同小写字母表示处理间差异显著(<0.05)。
3 讨论与结论
农村劳动力老龄化程度不断加深,在农业生产中化肥农药的使用不减反增,农药残留污染现状不容乐观[16]。本试验针对二苯醚类除草剂的土壤残留污染,以高效降解菌株sp. Za为出发菌株开展其微生物制剂的相关研究。通过正交试验,优化Za液体制剂保护剂的配比,0.20% 柠檬酸钠、0.20% 羧甲基纤维素和0.30% KCl的物质组合可使液体制剂的有效活菌数提高35.71%,保存30 d后对50 mg/L乳氟禾草灵的降解率为83.50%。影响微生物液体制剂形成市场规模的主要原因在于产品货架期短,保护剂可以防止微生物制剂杂菌污染,调节渗透压以稳定菌体,确保高温、盐胁迫等不良条件下液体制剂的使用效果[17-19]。
面对土壤这一复杂的生态体系时,固体菌剂的释放率、抗逆性、传质性和定殖状况等均会不同程度地影响使用效果。土壤中少量残留的二苯醚类除草剂即可对玉米作物产生严重药害,对于幼苗根系抑制尤为强烈。本研究通过盆栽试验探究Za固体制剂的最适材料,并以玉米为试验材料研究其实际应用效果。结果表明,猪粪有机肥作为载体材料时,保存60 d活菌数为8.26×108cfu/g,对10 mg/kg乳氟禾草灵土壤降解率为85.52%。受到药害的玉米幼苗各项生长指标全面落后,而固体制剂的添加可有效减轻药害程度,其中对作物根系所受药害的解除效果尤为明显。
两种微生物制剂就保存效果看,固体制剂保存60 d后的有效活菌数高于液体制剂,猪粪有机肥载体既提供了良好的附着作用,又利用其本身的有机物质促进了菌体生长。就降解效果看,液体制剂保存30 d仍可达到固体菌剂保存7 d时的降解效率,与文献报道结果一致,即液体环境能够最大限度还原降解菌株的修复功能[20]。因此,Za固体制剂适用于对时效性和货架期要求较高的应用场景,而Za液体制剂则更注重满足降解要求。绿色生产关乎国家粮食安全和人民生计提升,更是自然生态与社会体系应对环境变化的重要环节[21]。本研究从土壤环境生态修复出发,探索不同类型微生物制剂的制备方案,可为除草剂高效降解菌株的产品化开发和规模化应用提供技术支持和理论依据。
[1] Hasan F, Ansari M S. Ecotoxicological hazards of herbicides on biological attributes ofPallister (Coleoptera; Chrysomelidae)[J]. Chemosphere, 2016, 154; 398–407.
[2] Peillex C, Pelletier M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity[J]. Journal of Immunotoxicology, 2020, 17(1); 163–174.
[3] Mehdizadeh M. Effect of pesticide residues on agricultural food production; A case study; Sensitivity of oilseed rape to triasulfuron herbicide soil residue[J]. Food Processing & Technology, 2016, 2(6); 288–298.
[4] 李杨, 马智宏, 李冰茹, 等. 我国主要作物中除草剂登记情况及存在问题[J]. 食品安全质量检测学报, 2018, 9(17); 4483–4488.
[5] Zhang J, Zhao M J, Yu D, et al. Biochemical characterization of an enantioselective esterase fromsp. LY-2[J]. Microbial Cell Factories, 2017, 16(1); 112.
[6] 阎峰, 丛璐, 刘晓霞, 等. 乳氟禾草灵对映体分离及手性拆分热力学研究[J]. 农药, 2007, 46(9); 604–606.
[7] Bhandari G, Zomer P, Atreya K, et al. Pesticide residues in Nepalese vegetables and potential health risks[J]. Environmental Research, 2019, 172; 511–521.
[8] 张猛, 王金信, 段敏, 等. 两种二苯醚类除草剂对花生苗期生长发育及氮素代谢的影响[J]. 植物保护学报, 2008, 35(1); 58–62.
[9] 褚翠伟, 阮志勇, 姚利, 等. 除草剂的微生物降解研究进展[J]. 生物资源, 2018, 40(2); 93–100.
[10] Alvarez A, Saez J M, Davila Costa J S, et al. Actinobacteria; Current research and perspectives for bioremediation of pesticides and heavy metals[J]. Chemosphere, 2017, 166; 41–62.
[11] Benner J, Helbling D E, Kohler H P E, et al. Is biological treatment a viable alternative for micropollutant removal in drinking water treatment processes?[J]. Water Research, 2013, 47(16); 5955–5976.
[12] 吴敏, 施柯廷, 陈全, 等. 有机污染土壤生物修复效果的限制因素及提升措施[J]. 农业环境科学学报, 2022, 41(5); 919–932.
[13] 农药残留降解技术减少农药排放量[J]. 中国植保导刊, 2009, 29(5); 15.
[14] Zhang J, Lu L Y, Chen F, et al. Detoxification of diphenyl ether herbicide lactofen bysp. Za and enantioselective characteristics of an esterase gene[J]. Journal of Hazardous Materials, 2018, 341; 336–345.
[15] 张晶. 除草剂乳氟禾草灵降解菌株的分离, 新种鉴定及降解机理研究[D]. 南京; 南京农业大学, 2013.
[16] 张宏胜. 中国农村人口老龄化对农业可持续发展的影响研究[J]. 农业经济, 2022(4); 83–85.
[17] 张春秀. 农药污染对农作物土壤的影响及可持续治理对策[J]. 现代农业, 2017(7); 39–40.
[18] 王胜涛, 卢琪, 王羽, 等. 樊庆生红球菌菌剂制备优化及其重金属修复促进效果研究[J]. 环境科学学报, 2022, 42(4); 403–411.
[19] Zhang Q M, Zhu L S, Wang J, et al. Effects of fomesafen on soil enzyme activity, microbial population, and bacterial community composition[J]. Environmental Monitoring and Assessment, 2014, 186(5); 2801–2812.
[20] 沈标, 邵劲松, 李顺鹏, 等. 假单胞菌DLL-1在土壤生物修复中的作用[J]. 中国环境科学, 2002, 22(4); 78–82.
[21] 张林秀, 白云丽, 孙明星, 等. 从系统科学视角探讨农业生产绿色转型[J]. 农业经济问题, 2021, 42(10); 42–50.
Development and Preliminary Application of Microbial Preparation of Diphenyl Ether Herbicede Degrading Strainsp. Za
TENG Xiao, SHEN Xinyi, ZHANG Buyao, LUO Zixuan, ZHAO Tianzhuo, XU Mingyang, HUANG Xing*
(College of Life Science, Nanjing Agricultural University, Nanjing 210095, China)
sp. Za, a biodegradable strain with diphenyl ether herbicide, was used as the material to prepare microbial preparation. The material ratio of liquid protective agent was optimized, and the most suitable material for solid preparation was screened. The results showed that: 1) The protective agent of liquid preparation (0.20% sodium citrate, 0.20% carboxymethyl cellulose, 0.30% KCl) increased the number of viable bacteria by 35.71%, and the degradation rate of 50 mg/L lactofen in liquid preparation stored for 30 days was 83.50%. 2) The optimum material for solid preparation of pig manure organic fertilizer was obtained. After 60 days of storage, the viable bacteria count of solid preparation was 8.26×108cfu/g, and the degradation rate of 10 mg/kg lactofen in soil was 85.52%. 3) Adding solid preparation can effectively alleviate the drug damage caused by the residue of lactofen on maize.
sp. Za; Diphenyl ethers herbicides; Lactofen; Microbial agent; Microbial remediation
X172
A
10.13758/j.cnki.tr.2023.03.026
滕晓, 沈心怡, 张步瑶, 等. 二苯醚类除草剂降解菌sp. Za微生物制剂的研发与初步应用. 土壤, 2023, 55(3): 682–688.
国家自然科学基金项目(41977119),江苏省重点研发计划项目(BE2020692)和江苏省农业科技自主创新资金项目(CX(22)3136)资助。
(huangxing@njau.edu.cn)
滕晓(1998—),女,山东济宁人,硕士研究生,主要从事环境微生物学研究。E-mail: tengxiao98@qq.com

