温度和氮添加对旱地红壤反硝化功能基因丰度的影响①
冯蒙蒙,林永新*,樊剑波,贺纪正
温度和氮添加对旱地红壤反硝化功能基因丰度的影响①
冯蒙蒙1,2,林永新1,2*,樊剑波3,贺纪正1,2
(1 湿润亚热带山地生态国家重点实验室培育基地,福州 350007;2 福建师范大学地理科学学院,福州 350007;3 中国科学院南京土壤研究所,南京 210008)
研究旱地红壤反硝化微生物功能基因Ⅰ和Ⅱ的丰度对温度和氮添加的响应,可为农田红壤养分管理和生态环境保护提供指导和建议。本研究以长期常规氮磷钾施肥的旱地红壤为研究对象,设置3个氮添加(N 0、25、50 mg/kg)处理和3个温度处理(15、25、35 ℃)进行微宇宙培养试验,在培养的7和30 d后破坏性采集土样,进行土壤DNA提取,测定反硝化微生物功能基因丰度。结果表明:培养7 d后,Ⅰ和Ⅱ基因丰度均在25 ℃ 时最高;培养30 d后,Ⅰ和Ⅱ基因丰度在15 ℃ 时最高,且随着温度升高而下降。氮添加对反硝化微生物功能基因丰度无显著影响。3因素方差分析表明,温度、氮添加和培养时间的交互作用显著影响反硝化微生物功能基因丰度。综上,旱地农田反硝化功能基因丰度受氮添加影响较小,但受温度显著影响,其丰度可能会呈现出日变化和季节变化,在土壤采样和氧化亚氮动态监测时应特别注意。
红壤;温度;氮添加;反硝化微生物
反硝化过程是指硝态氮被逐步还原成亚硝态氮、一氧化氮、氧化亚氮(N2O)和氮气的过程,是氮循环的重要组成部分。反硝化过程是农田N2O产生的主要途径[1],由微生物驱动完成,其中亚硝态氮还原基因和是N2O产生的关键基因,而N2O还原基因I和Ⅱ编码的酶是目前已知去除N2O的唯一生物途径[2]。因此,I和Ⅱ的丰度和活性直接影响着土壤N2O的排放强度[3],与全球气候变化息息相关。温度是影响微生物生长和活性的重要因素,而氮添加可为反硝化微生物提供底物,因此,研究温度和氮添加对反硝化微生物功能基因丰度的影响可为旱地农田红壤养分管理提供指导和建议。
在陆地生态系统中,温度可以通过影响土壤微环境、养分有效性、土壤呼吸和微生物群落结构等,从而影响反硝化微生物功能基因和N2O排放[4-5]。前人研究发现,在湿地土壤中基因丰度主要受温度影响,在低温条件下丰度最高,而受温度影响较小[6];在黑土中,只有基因的群落结构对温度敏感,且基因丰度与N2O排放显著相关[7];在红壤中,低温有利于维持反硝化微生物丰度,但显著抑制反硝化微生物活性[8]。另有研究表明,高温显著抑制红壤反硝化微生物的生长和活性[9]。因此,温度对土壤反硝化微生物丰度和活性的影响仍存在较大不确定性。此外,施用氮肥是提高土壤肥力和作物产量的重要田间管理措施,可为土壤微生物提供能量与基质[10]。施用氮肥对反硝化微生物功能基因的影响已有大量报道,但结果差异较大。例如,Hallin等[11]发现,长期施用硫酸铵显著降低和基因丰度;Ouyang等[12]则发现,施用氮肥可以提高和基因丰度。在红壤中,施用氮肥对反硝化微生物的影响同样存在争议。Xiao等[13]研究指出,有机无机肥配施显著增加红壤和基因丰度;宛颂等[14]则发现,施用化肥显著增加旱地红壤基因丰度,但对、Ⅰ和Ⅱ基因丰度无显著影响。然而,施用化肥也可能对红壤所有反硝化微生物丰度无显著影响[15]。因此,温度和氮添加对反硝化微生物功能基因丰度的影响仍存在较大争议,有待进一步研究。
另外,前人对基因的研究大多只关注Ⅰ,对后发现的Ⅱ关注较少。自2012年Ⅱ发现以来,截至2019 年仅有22% 的研究提到Ⅱ[16]。然而,Jones等[17]发现,环境样品中Ⅱ的基因丰度与Ⅰ相当或更高,暗示着Ⅱ基因可能在N2O还原过程中起着重要作用。Xu等[18]则进一步研究表明,Ⅱ在农田土壤中可能扮演着比Ⅰ更重要的角色。尽管Ⅱ不断引起国内外学者的关注,但农田土壤中Ⅱ对温度和氮添加的响应研究几乎处于空白,制约着对反硝化过程的整体认识。因此,系统研究Ⅰ和Ⅱ基因丰度对温度和氮添加的响应具有重要意义。
红壤广泛分布于我国热带和亚热带地区,总面积达204万km2,约占国土面积的21%[19],是重要的农业土壤资源。那么,红壤中反硝化微生物功能基因Ⅰ和Ⅱ的丰度对温度和氮添加响应如何?基于该科学问题,本研究设计了不同温度梯度和氮添加水平的培养试验,以期深入了解旱地红壤反硝化微生物功能基因对温度和氮添加的响应,为农田红壤养分管理和生态环境保护提供指导和建议。
1 材料与方法
1.1 试验地概况
试验地位于江西省鹰潭市中国科学院鹰潭红壤生态实验站(28°15′20″N,116°55′30″E),该区域属于中亚热带湿润季风气候,年平均降水量1 795 mm,年平均气温为17.6 ℃。供试土壤为第四纪红色黏土发育而来的典型红壤。
试验样地建设于1988年4月,在1995年以前耕作方式为花生和油菜连作,之后改为夏季花生、冬季休耕的耕作方式。选取当地常规施肥处理的土壤为研究对象,设置3个重复。该处理每年施肥量为N 120 kg/hm2的尿素、P 30 kg/hm2的钙镁磷肥和K 90 kg/hm2的氯化钾,每年4月10日一次性施肥,田间管理措施与当地常规田间管理措施一致。于2019年10月17日,在3个小区内分别按照五点采样法采集表层土壤(0 ~ 20 cm)5个,将每个小区的5个土芯混合均匀,形成1个混合样品,放置在装有冰袋的保温箱中立即送回实验室处理。在微宇宙培养前,用无菌镊子除去碎石和细根等杂物后过2 mm筛。土壤基本理化性质的测定按照文献[20]描述的方法进行,供试土壤的基本理化性质如表1所示。
1.2 微宇宙培养试验
称取10 g新鲜土壤(烘干重计)于100 mL血清瓶中,分别加入相当于N 0、25、50 mg/kg的硫酸铵溶液,并添加无菌水调节土壤含水量至60% 田间持水量。每个处理设置18次重复,随机分为3组,分别放在15、25、35 ℃恒温培养箱,作为温度处理,避光培养30 d。在培养过程中,每隔2 d打开一次血清瓶进行换气保证好氧培养条件,并根据重量补充培养过程中所损失的水分。在培养的7和30 d后破坏性采集土样,随后将采集的土壤储存在–80 ℃下用于土壤DNA提取。

表1 供试土壤理化性质
注:表中的数据表示为平均值±标准误;SOC代表土壤有机碳;DOC代表可溶性有机碳;TN代表全氮;NH4+-N代表铵态氮;NO3−-N代表硝态氮;AP代表有效磷。
1.3 土壤总DNA提取和实时荧光定量PCR
土壤总DNA提取使用FastDNA SPIN Kit for Soil (MP Biomedicals,Santa Ana,CA,USA)试剂盒,按照说明书操作步骤进行。、、I和II的基因丰度采用定量PCR(qPCR)方法利用CFX384 Optical Real-Time Detection System (Bio- Rad Laboratories Inc.,Hercules,CA,美国)仪器进行测定。使用的引物序列、反应体系、反应条件和标准曲线同宛颂等[14]。每个样品重复3次,并设置3个阴性对照。根据标准曲线计算反硝化功能基因的丰度。本试验中各反应的熔解曲线均为单峰,扩增效率均介于90% ~ 100%,2均为0.999。
1.4 数据处理
数据统计分析采用SPSS19.0软件进行。利用单因素方差分析(One-way ANOVA)比较各处理间反硝化功能基因丰度的差异。采用3因素方差分析(Three-factor ANOVA)探讨温度、氮添加和培养时间及其交互作用对反硝化功能基因丰度的影响。所有数据在分析之前进行同质性和正态分布检验。采用邓肯法(Duncan’s test)进行差异显著性检验(=0.05)。采用OriginPro 2021软件绘图。
2 结果与分析
2.1 温度和氮添加对nirS和nirK基因丰度的影响
从图1可以看出,不同处理土壤基因丰度为4.29×106~ 6.49×107copies/g。在培养7 d后,基因平均丰度在25 ℃ 时最高,为3.09×107copies/g;当温度升高至35 ℃ 时,基因平均丰度显著降低至6.22×106copies/g;而温度降低至15 ℃ 时,基因平均丰度与25 ℃ 时差异不显著。在培养30 d后,基因丰度在15 ℃ 时最高,为2.44×107~ 3.16×107copies/g。随着培养温度增加基因丰度显著降低,在35 ℃ 时最低,为6.38×106copies/g。
对于基因,在培养7 d后,其平均丰度在25 ℃ 时最高,为2.76×107copies/g;35 ℃ 时显著降低至7.28×106copies/g,而15 ℃ 时与25 ℃ 时无显著差异。在培养30 d后基因丰度随着温度增加而降低,在15 ℃ 时最高,为2.32×107copies/g (图1)。
此外,与无氮添加处理相比,氮添加处理对土壤和基因丰度均无显著性影响(图1)。通过3因素方差分析发现,温度、温度和培养时间、氮添加和培养时间、温度与氮添加和培养时间的交互作用显著影响和基因丰度(表2)。
2.2 温度和氮添加对nosZ I和nosZ II 基因丰度的影响
由图2可知,在培养7 d后,不同处理土壤中Ⅰ 基因丰度为9.60×106~ 7.80×107copies/g。在25 ℃ 时Ⅰ 基因平均丰度最高,为4.81×107copies/g,当培养温度升高至35 ℃ 或者降低至15 ℃时,Ⅰ 基因丰度显著下降。在培养30 d后,Ⅰ 基因丰度随着培养温度增加显著降低,在35 ℃ 时Ⅰ 基因丰度最低为1.13×107copies/g。
对于Ⅱ基因,在培养7 d后,3种温度处理对其丰度均无显著性影响。但培养30 d后,Ⅱ基因丰度随着温度升高而显著降低,在15 ℃ 时平均丰度最高,为5.72×107copies/g(图2)。
此外,不同氮添加处理土壤中Ⅰ和Ⅱ的基因丰度无显著性差异(图2)。3因素方差分析结果表明,温度、温度和培养时间、温度与氮添加和培养时间的交互作用会显著影响Ⅰ和Ⅱ基因丰度。此外,I基因丰度还受氮添加以及温度和氮添加的交互作用影响(表2)。
3 讨论
研究表明,增温会通过影响土壤微生物的活性,加速土壤氮素矿化,对土壤氮循环过程产生深远的影响[21]。反硝化过程是氮循环的重要组成部分,调控着氮素的还原与转化,在土壤N2O的排放中扮演重要角色。土壤反硝化微生物功能基因丰度可以一定程度上反映土壤的反硝化潜力[22]。本研究发现,培养7 d后,和基因丰度在25 ℃ 时最高,表明和基因型微生物在短期内更喜好25 ℃ 的生存环境,低温和高温均不利于其生长。然而,随着时间推移,在培养30 d后,和基因丰度在15 ℃ 时最高,且随着温度升高而下降。这可能是由于和基因型微生物对15 ℃ 有更好的适应性,能够将更多的能量用于自身的生长。这与Lee和Francis[6]在旧金山湾沉积物中的研究结果一致,他们发现的基因丰度在温度最低的冬季时最高,表明这类微生物喜好低温环境。最近的一项meta分析同样表明,增温分别降低陆地生态系统和基因丰度31% 和26%[5]。一方面,这可能是因为和基因型微生物喜好相对厌氧的环境[23],温度升高会促进土壤的水分蒸发,使得土壤水分含量下降,趋于干燥,从而不利于反硝化微生物的生长;另一方面,温度升高使土壤的氮素周转加快,反硝化微生物的底物供应不足,从而不利于和基因型微生物的生长[24]。
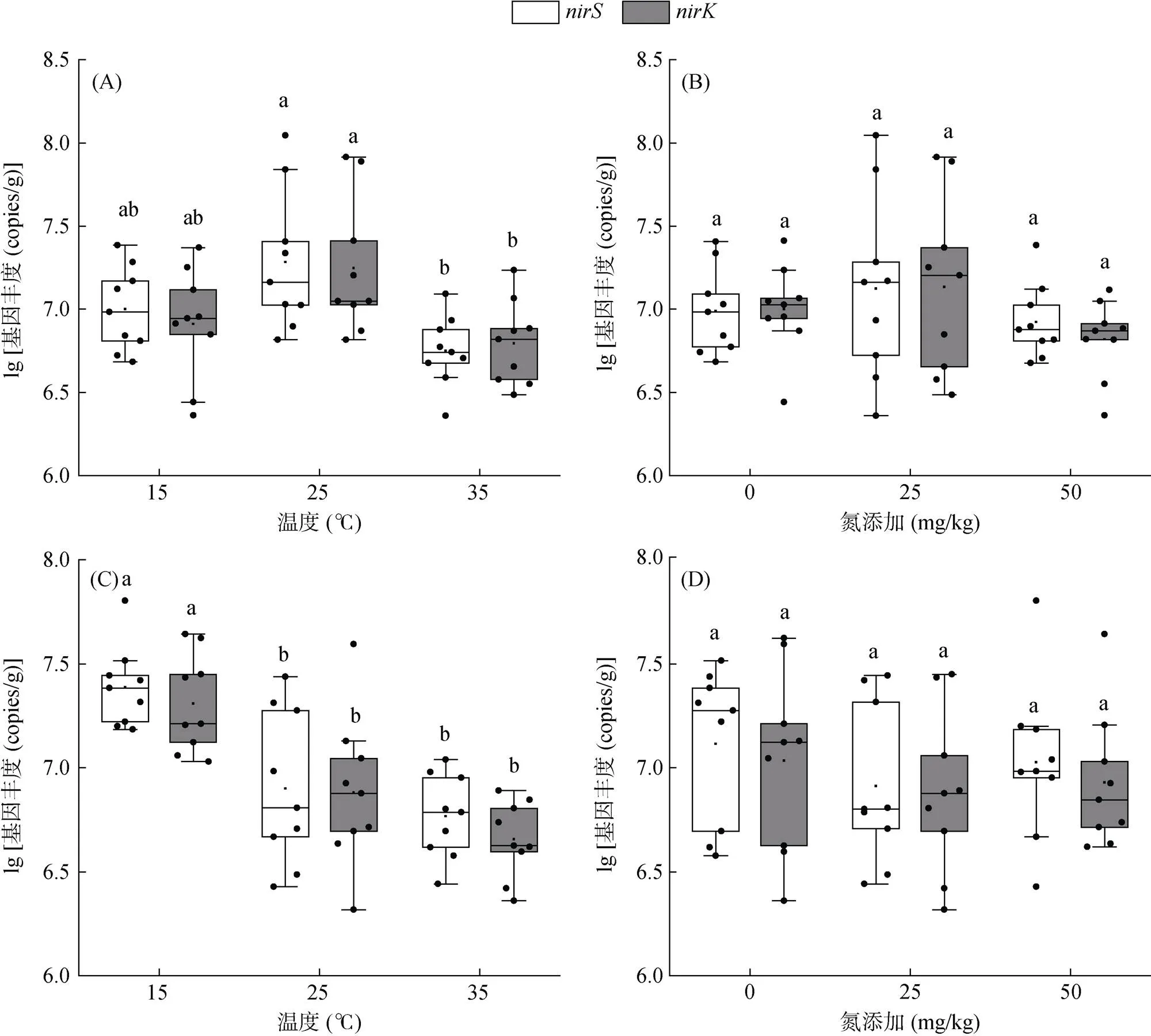
(图A、图C为培养7、30 d后温度对nirK和nirS基因丰度的影响;图B、图D为培养7、30 d后氮添加对nirK和nirS基因丰度的影响。不同小写字母表示处理间差异显著(P<0.05);框中的横线表示中位数,框的底部和顶部分别代表下四分位数和上四分位数,在框上方和下方延伸的线和点表示异常值;下同)
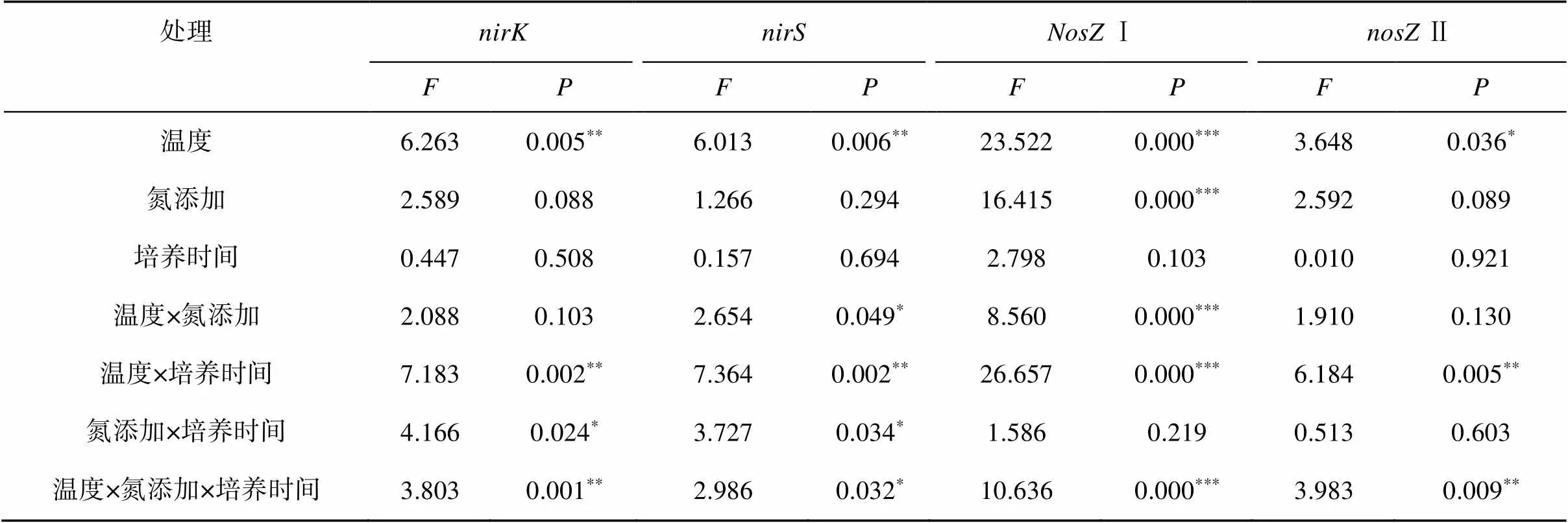
表2 温度、氮添加和培养时间对反硝化功能基因丰度影响的3因素方差分析
注:*表示在<0.05水平上影响显著,**表示在<0.01水平上影响显著,***表示在<0.001水平上影响显著。
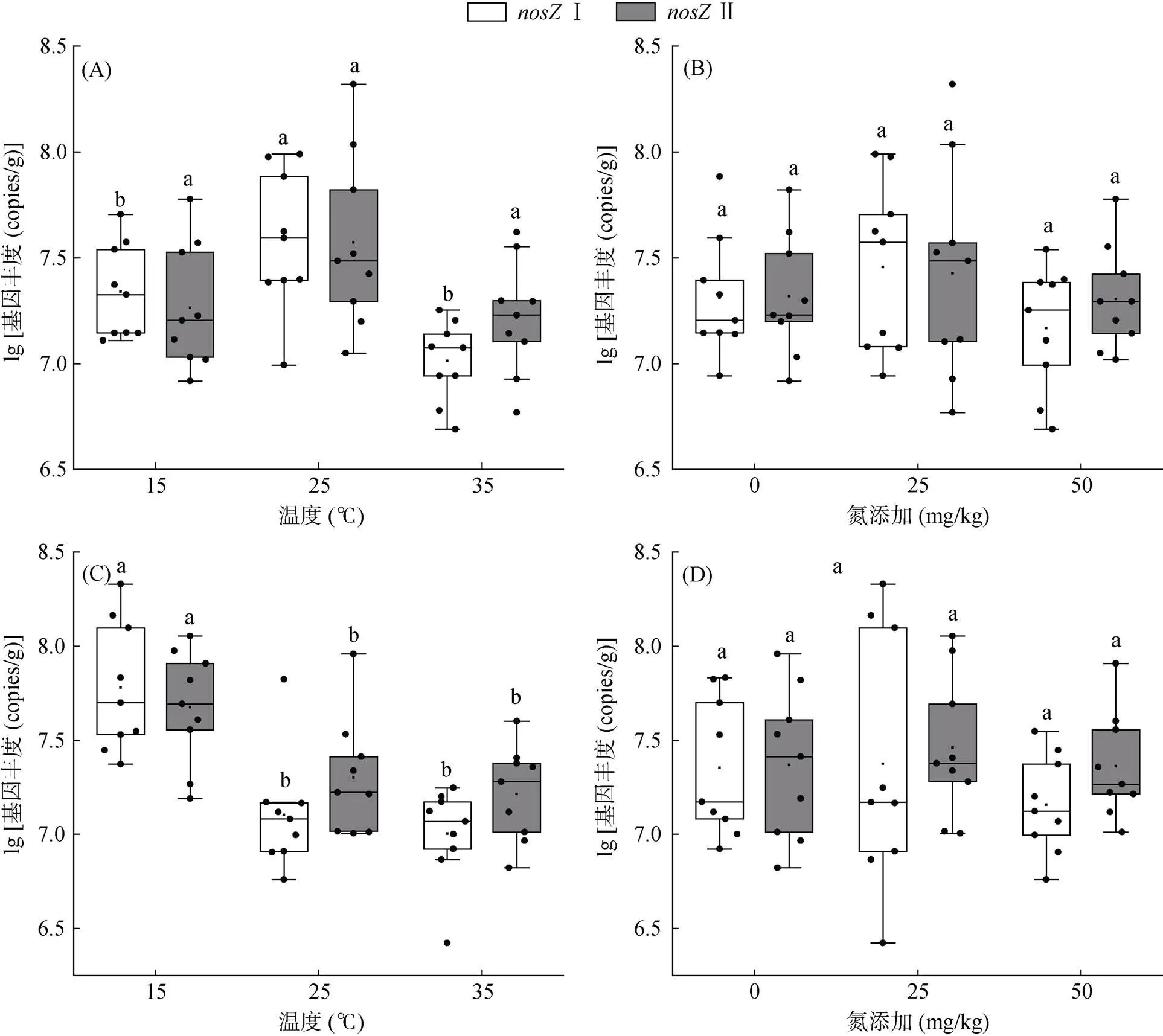
(图A、图C为培养7、30 d后温度对nosZ Ⅰ和nosZⅡ基因丰度的影响;图B、图D为培养7、30 d后氮添加对nosZ I和nosZ II基因丰度的影响)
本研究发现,氮添加对土壤和基因丰度没有显著影响,这和大多数以往的研究不同。一项针对农田土壤的meta分析发现,施用氮肥分别显著提高和基因丰度40% 和53%[12]。Yang等[25]同样发现,施用氮肥会显著影响农田土壤和基因丰度和群落结构。然而,Xiao等[13]认为,的基因丰度和群落结构受有机肥的影响更大,化肥的影响相对较小。本研究中,和基因丰度不受氮添加影响,这可能是由于供试土壤是长期(32年)施肥的土壤,土壤中的反硝化微生物已经长期适应氮添加的环境[26],因此,反硝化微生物丰度对氮添加响应不强烈。Tian等[27]同样发现,氮添加对土壤反硝化基因丰度没有显著影响。此外,Ning等[28]研究发现,低氮添加处理会显著增加基因丰度,而高氮添加处理会显著降低基因丰度,因此,氮添加量会显著影响反硝化微生物功能基因丰度对氮添加的响应。与Ning等[28]研究相比,本研究的氮添加量介于低氮和高氮之间,这可能是和基因丰度对氮添加没有响应的一个因素。当然,也有可能是由于30 d的培养时间还不足以使供试土壤反硝化微生物丰度发生变化。
和和基因类似,Ⅰ 和Ⅱ基因丰度培养7 d后在25 ℃ 时最高,而在培养30 d后随着温度升高而降低。反硝化和基因是产生N2O的关键基因,而N2O是Ⅰ 和Ⅱ型微生物的底物[29]。因此,Ⅰ和Ⅱ基因丰度可能受底物影响,与和基因丰度呈现出相似的变化趋势。Xing等[30]同样发现,微生物群落结构在15 ~ 35 ℃ 温度范围内受温度显著影响。相反,Li等[4]发现,基因丰度不受温度影响。因此,Ⅰ和Ⅱ基因丰度对温度的响应可能受土壤理化性质和微生物的群落结构控制。此外,本研究发现,氮添加对土壤Ⅰ和Ⅱ基因丰度无显著影响,一方面可能是由于Ⅰ和Ⅱ基因型微生物在土壤环境中具有较强的适应能力,对氮添加可能有较好的适应性[31];另一方面可能是由于和基因丰度不受氮添加影响,导致Ⅰ和Ⅱ基因型微生物的底物来源不变。综上,温度变化显著影响反硝化功能基因丰度,而氮添加对反硝化功能基因丰度的影响较小(图3)。因此,土壤反硝化微生物功能基因丰度可能会呈现出季节性差异,也可能随着昼夜温差发生改变,在土壤采样时应特别注意。此外,不同的反硝化微生物功能基因之间对温度和氮添加呈现出相似的响应规律,表明这几类反硝化微生物之间存在着一定的联系。
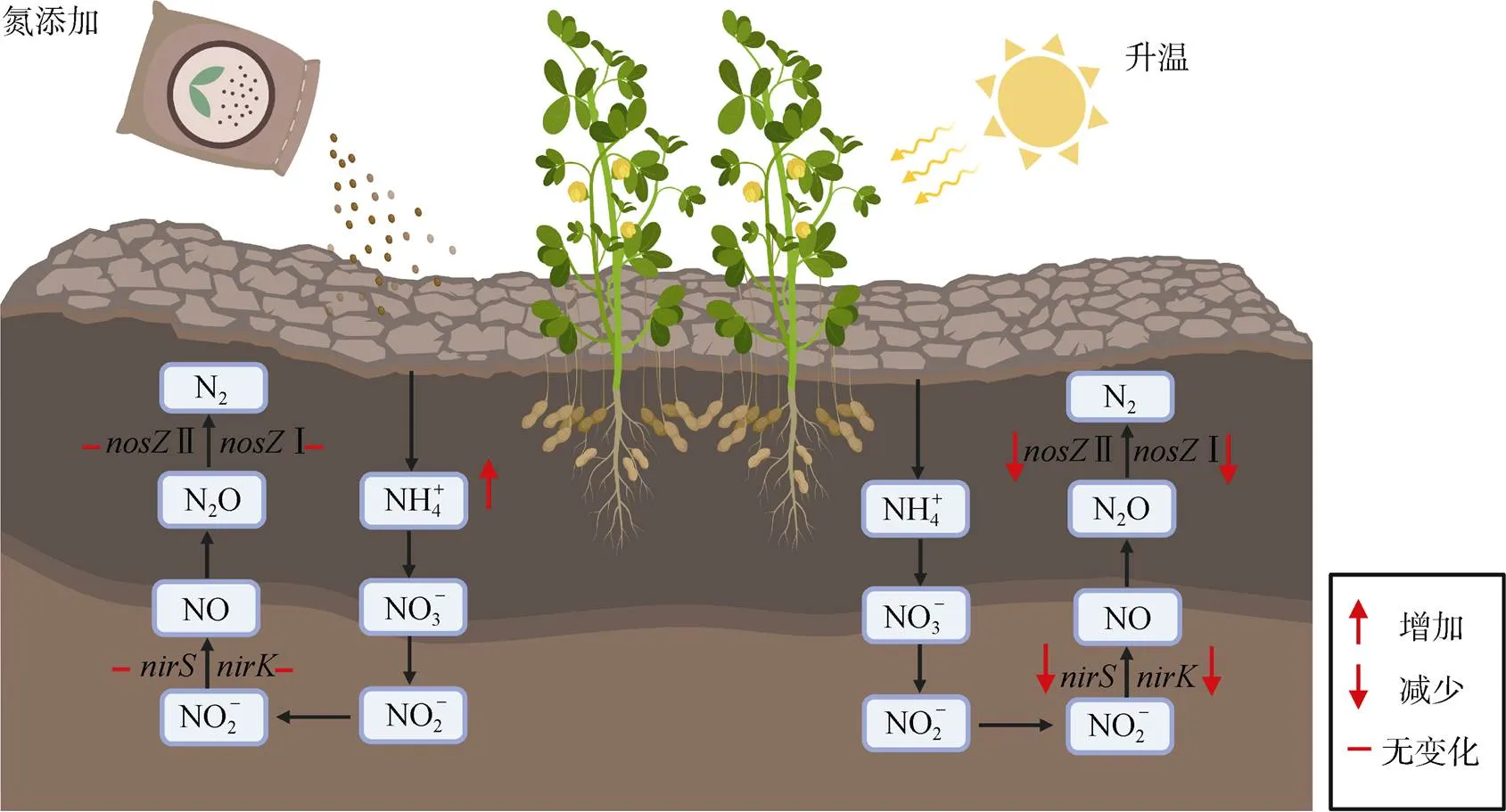
图3 温度和氮添加对反硝化基因丰度影响的概念图
4 结论
供试红壤在微宇宙试验中培养7 d后,Ⅰ和Ⅱ基因丰度均在25 ℃ 时最高;随着时间推移,在培养30 d后各基因丰度在15 ℃ 时最高,且随着温度升高而下降。氮添加对土壤Ⅰ和Ⅱ基因丰度无显著影响。可见,反硝化功能基因丰度受温度显著影响,而受氮添加的影响较小。
[1] 蔡延江, 丁维新, 项剑. 农田土壤N2O和NO排放的影响因素及其作用机制[J]. 土壤, 2012, 44(6): 881–887.
[2] Hallin S, Philippot L, Löffler F E, et al. Genomics and ecology of novel N2O-reducing microorganisms[J]. Trends in Microbiology, 2018, 26(1): 43–55.
[3] Pester M, Rattei T, Flechl S, et al. amoA-based consensus phylogeny of ammonia-oxidizing Archaea and deep sequencing of amoA genes from soils of four different geographic regions[J]. Environmental Microbiology, 2012, 14(2): 525–539.
[4] Li L F, Zheng Z Z, Wang W J, et al. Terrestrial N2O emissions and related functional genes under climate change: A global meta‐analysis[J]. Global Change Biology, 2020, 26(2): 931–943.
[5] Smith K. The potential for feedback effects induced by global warming on emissions of nitrous oxide by soils[J]. Global Change Biology, 1997, 3(4): 327–338.
[6] Lee J A, Francis C A. Spatiotemporal characterization of San francisco bay denitrifying communities: A comparison ofanddiversity and abundance[J]. Microbial Ecology, 2017, 73(2): 271–284.
[7] Cui P Y, Fan F L, Yin C, et al. Long-term organic and inorganic fertilization alters temperature sensitivity of potential N2O emissions and associated microbes[J]. Soil Biology and Biochemistry, 2016, 93: 131–141.
[8] 王连峰, 蔡祖聪. 水分和温度对旱地红壤硝化活力和反硝化活力的影响[J]. 土壤, 2004, 36(5): 543–546, 560.
[9] Xu X Y, Liu X R, Li Y, et al. High temperatures inhibited the growth of soil bacteria and Archaea but not that of fungi and altered nitrous oxide production mechanisms from different nitrogen sources in an acidic soil[J]. Soil Biology and Biochemistry, 2017, 107: 168–179.
[10] 吴汉卿, 张宝贵, 李强, 等. 基于Web of Science对农业土壤N2O排放影响因素研究的文献计量分析[J]. 土壤通报, 2021, 52(1): 221–232.
[11] Hallin S, Jones C M, Schloter M, et al. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J]. The ISME Journal, 2009, 3(5): 597–605.
[12] Ouyang Y, Evans S E, Friesen M L, et al. Effect of nitrogen fertilization on the abundance of nitrogen cycling genes in agricultural soils: A meta-analysis of field studies[J]. Soil Biology and Biochemistry, 2018, 127: 71–78.
[13] Xiao X, Xie G X, Yang Z H, et al. Variation in abundance, diversity, and composition ofandcontaining denitrifying bacterial communities in a red paddy soil as affected by combined organic-chemical fertilization[J]. Applied Soil Ecology, 2021, 166: 104001.
[14] 宛颂, 段春健, 樊剑波, 等. 旱地红壤反硝化功能基因丰度对长期施肥的响应[J]. 应用生态学报, 2020, 31(11): 3729–3736.
[15] Li W X, Wang C, Zheng M M, et al. Fertilization strategies affect soil properties and abundance of N-cycling functional genes in an acidic agricultural soil[J]. Applied Soil Ecology, 2020, 156: 103704.
[16] Shan J, Sanford R A, Chee-Sanford J, et al. Beyond denitrification: The role of microbial diversity in controlling nitrous oxide reduction and soil nitrous oxide emissions[J]. Global Change Biology, 2021, 27(12): 2669–2683.
[17] Jones C M, Spor A, Brennan F P, et al. Recently identified microbial guild mediates soil N2O sink capacity[J]. Nature Climate Change, 2014, 4(9): 801–805.
[18] Xu X Y, Liu Y W, Singh B P, et al.Z clade II rather than clade I determineN2O emissions with different fertilizer types under simulated climate change and its legacy[J]. Soil Biology and Biochemistry, 2020, 150: 107974.
[19] Xu R K, Zhao A Z, Li Q M, et al. Acidity regime of the red soils in a subtropical region of southern China under field conditions[J]. Geoderma, 2003, 115(1/2): 75–84.
[20] Lin Y X, Ye G P, Luo J F, et al.cluster 8a plays a predominant role in the nitrification process of a subtropical ultisol under long-term inorganic and organic fertilization[J]. Applied and Environmental Microbiology, 2018, 84(18): e01031-18.
[21] 徐小锋, 田汉勤, 万师强. 气候变暖对陆地生态系统碳循环的影响[J]. 植物生态学报, 2007, 31(2): 175–188.
[22] Cui Y X, Zhang Y L, Duan C J, et al. Ecoenzymatic stoichiometry reveals microbial phosphorus limitation decreases the nitrogen cycling potential of soils in semi- arid agricultural ecosystems[J]. Soil and Tillage Research, 2019, 197(2): 104463.
[23] Azziz G, Monza J, Etchebehere C, et al.and- type denitrifier communities are differentially affected by soil type, rice cultivar and water management[J]. European Journal of Soil Biology, 2017, 78: 20–28.
[24] Liang Y Q, Wu C F, Wei X M, et al. Characterization of- and-containing communities and potential denitrification activity in paddy soil from Eastern China[J]. Agriculture, Ecosystems & Environment, 2021, 319: 107561.
[25] Yang Y D, Zhao J, Jiang Y, et al. Response of bacteria harboringandgenes to different N fertilization rates in an alkaline northern Chinese soil[J]. European Journal of Soil Biology, 2017, 82: 1–9.
[26] Han X G, Shen W J, Zhang J B, et al. Microbial adaptation to long-term N supply prevents large responses in N dynamics and N losses of a subtropical forest[J]. Science of the Total Environment, 2018, 626: 1175–1187.
[27] Tian X F, Hu H W, Ding Q, et al. Influence of nitrogen fertilization on soil ammonia oxidizer and denitrifier abundance, microbial biomass, and enzyme activities in an alpine meadow[J]. Biology and Fertility of Soils, 2014, 50(4): 703–713.
[28] Ning Q S, Gu Q, Shen J P, et al. Effects of nitrogen deposition rates and frequencies on the abundance of soil nitrogen-related functional genes in temperate grassland of Northern China[J]. Journal of Soils and Sediments, 2015, 15(3): 694–704.
[29] Bian R X, Sun Y J, Li W H, et al. Co-composting of municipal solid waste mixed with matured sewage sludge: The relationship between N2O emissions and denitrifying gene abundance[J]. Chemosphere, 2017, 189: 581–589.
[30] Xing X Y, Tang Y F, Xu H F, et al. Warming shapes- and-type denitrifier communities and stimulates N2O emission in acidic paddy soil[J]. Applied and Environmental Microbiology, 2021, 87(12): e02965-20.
[31] Zhong L, Du R, Ding K, et al. Effects of grazing on N2O production potential and abundance of nitrifying and denitrifying microbial communities in meadow-steppe grassland in northern China[J]. Soil Biology and Biochemistry, 2014, 69: 1–10.
Effects of Temperature and Nitrogen Addition on Abundance of Denitrifying Functional Genes in Upland Ultisol
FENG Mengmeng1,2, LIN Yongxin1,2*, FAN Jianbo3, HE Jizheng1,2
(1 Cultivation Base of State Key Laboratory for Subtropical Mountain Ecology, Fuzhou 350007, China; 2 School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China; 3 Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
Investigating how the abundance of denitrifying functional genes,,ⅠandⅡ respond to temperature and nitrogen addition in upland Ultisol can provide guidance for agricultural nutrient management and environmental protection in this region. In this study, soils were sampled from a long-term fertilization experiment and used for a microcosm incubation experiment under the conditions of three nitrogen addition treatments: N 0, 25, and 50 mg/kg, and three temperature levels at 15, 25, and 35 °C. Soils were incubated in the dark and destructively sampled on days 7 and 30 of incubation. After sampling, soil DNA was extracted, and the abundances of denitrifying functional genes were determined by real-time quantitative PCR. Results showed that the abundances of,,ⅠandⅡ genes were the highest at 25 ℃ after 7-day incubation. However, after 30-day incubation, the abundances of,,ⅠandⅡ genes were the highest at 15 ℃ and were decreased with increasing temperature. Moreover, nitrogen addition had no significant effect on the abundances of all the denitrifying functional genes. In addition, three-way ANOVA showed that the interactions of temperature, nitrogen addition and incubation time significantly influenced the abundances of denitrifying functional genes. Overall, the abundances of denitrifying functional genes are substantially influenced by temperature but less affected by the nitrogen addition. The abundances of denitrifying functional genes may vary considerably on both a daily and seasonal basis, and this should be taken into consideration during soil sampling and nitrous oxide emission measuring.
Ultisol; Temperature; Nitrogen addition; Denitrifiers
S154.36
A
10.13758/j.cnki.tr.2023.03.013
冯蒙蒙, 林永新, 樊剑波, 等. 温度和氮添加对旱地红壤反硝化功能基因丰度的影响. 土壤, 2023, 55(3): 562–568.
国家自然科学基金项目(41930756,42077041)和福建省自然科学基金项目(2020J01187)资助。
(yxlin@fjnu.edu.cn)
冯蒙蒙(1996—),女,河南商丘人,硕士研究生,主要研究方向为土壤氮循环微生物。E-mail: 1923005353@qq.com

