生物硝化抑制剂对黔西南黄壤硝化作用及N2O排放的影响①
华 瑶,陆玉芳,高维常,祖韦军,施卫明,郭亚利
生物硝化抑制剂对黔西南黄壤硝化作用及N2O排放的影响①
华 瑶1,陆玉芳1,高维常2,祖韦军3,施卫明1,郭亚利4*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 贵州省烟草科学研究院烟草行业山地烤烟品质与生态重点实验室,贵阳 550081;3 贵州省毕节市农业生态环境与资源保护站,贵州毕节 551700;4 贵州省烟草公司黔西南州公司,贵州兴义 562400)
为探索生物硝化抑制剂对贵州黔西南地区黄壤硝化作用及氧化亚氮(N2O)排放的影响,通过3周的室内培养试验,研究两种生物硝化抑制剂(对羟基苯丙酸甲酯(MHPP)和丁香酸(SA))对黄壤中的无机态氮素含量、氨氧化微生物功能基因以及N2O排放量的影响。结果表明,与对照CK相比,MHPP和SA在黄壤上均能明显抑制硝化作用,对土壤硝化速率的抑制率分别为6% ~ 43% 和5% ~ 51%。MHPP和SA均抑制了黄壤氨氧化古菌AOA(12% ~ 22%,27% ~ 41%)与氨氧化细菌AOB(6% ~ 19%,26% ~ 46%)基因的丰度。整个培养期内,黄壤NO3–-N含量与AOB的基因丰度显著正相关,而与AOA的基因丰度无显著相关,表明AOB对黄壤硝化作用起了主导作用。在N2O排放方面,MHPP和SA分别显著抑制了黄壤51% 和21% 的N2O排放积累量,MHPP的减排效果优于SA。MHPP降低了黄壤N2O排放的峰值,而SA主要延缓了黄壤N2O排放高峰的出现。总之,生物硝化抑制剂MHPP和SA在贵州黔西南黄壤上具有氮肥减施增效的潜力,这为今后烤烟新型绿色专用肥的开发提供了理论依据。
硝化作用;生物硝化抑制剂;黄壤;硝化速率;氨氧化微生物;N2O
氮肥是农业生产中一直大量使用的肥料,我国氮肥利用率大约在30% ~ 40%,而其他未被植物利用的氮素通过淋溶作用、硝化、反硝化、挥发等多种途径流失[1-2]。硝化作用是土壤氮素循环中重要的一环,指NH4+-N通过微生物在好氧条件下转化为NO3–-N的过程[3]。硝化作用在未受到干扰的自然生态系统中并不强烈,但在现代农业生产系统中硝化速率大幅提高,相当量的氮素通过硝化–反硝化途径损失[4]。这不仅导致氮肥利用率低下,而且NO3–-N与土壤结合性差,易通过淋溶流失,污染环境。氧化亚氮(N2O)是一种强温室气体,目前全球因人类活动造成的N2O排放70% 来源于农业生产,其中硝化和反硝化过程是农业土壤N2O的主要来源[5-6]。因此,如何提高氮肥利用率以及减少N2O排放一直备受关注[7]。
硝化抑制剂是一种能够延缓硝化作用发生的化合物统称。研究表明,施用硝化抑制剂可有效减缓氮素转化和硝酸盐积累,对N2O也有减排效应[8]。目前硝化抑制剂可分为合成硝化抑制剂和生物硝化抑制剂。合成硝化抑制剂在农业上已经得到广泛使用,主要包括双氰胺(Dicyandiamide,DCD)、3,4-二甲基吡唑磷酸盐(3,4-dimethylpyrazole phosphate,DMPP)、2-氯-6-三氯甲基吡啶(2-chloro-6-trichloromethyl pyridine,CP)这三大类和其他一些化合物。已有大量研究表明合成硝化抑制剂能有效提高氮素利用和减少N2O排放[[9-13]。然而人工合成的硝化抑制剂也有其自身的缺点,例如成本较高、造成环境安全威胁等[14]。随着对植物根系分泌物的研究发展,人们逐步认识到一些植物根系能够释放一些抑制硝化作用的物质,被称为生物硝化抑制剂[15]。目前已从植物根系分泌物中提取鉴定的生物硝化抑制剂有热带牧草分泌的臂形草内脂(Brachialactone)[16],高粱源的对羟基苯丙酸甲酯(Methyl 3-(4-hydroxyphenyl)propionate,MHPP)[17]和高粱酮(Sorgoleone)[18],水稻源的1,9-癸二醇(1,9-Decanediol)[19]和丁香酸(Syringic acid,SA)[20],以及玉米分泌的玉米酮(Zeanone)[21]等。相比于合成硝化抑制剂,生物硝化抑制剂在土壤中抑制效果与机制研究还处于起步阶段[22],目前尚未在农业生产中应用。在我国现代农业绿色发展的要求下,环境友好型的生物硝化抑制剂具有良好的发展潜力和推广价值[23]。
黄壤是一种广泛分布于贵州高原地带的地带性土壤,也是黔西南地区的主要农业土壤,这种土壤质地黏、保肥能力弱,且所处地区水土流失严重[24]。有关提高黄壤烤烟氮肥利用率的农艺措施已取得了一定的进展,包括合理施氮量、施用氮肥增效剂、生物质炭及绿肥还田等[25-28],但还需寻求提高该区域烤烟氮肥减施增效的新策略。生物硝化抑制剂MHPP和1,9-癸二醇在碱性潮土、中性水稻土和酸性红壤中的室内培养研究发现,生物硝化抑制剂的硝化抑制效果与土壤类型密切相关[29-30]。生物硝化抑制剂还具有土壤N2O减排的潜力,1,9-癸二醇能明显减少酸性红壤N2O的排放量[30]。MHPP在石灰性紫色土上对N2O排放有较好的抑制作用,其抑制率达到76%[31]。此外,也有田间试验表明,MHPP与根区施肥配合能够减少水稻土的N2O排放[32]。然而,生物硝化抑制剂对黄壤硝化过程及N2O排放的调控效果尚未明确。本研究选取两种较易获得的生物硝化抑制剂MHPP和SA,通过室内培养试验,探讨其对贵州黔西南地区黄壤无机氮含量变化、硝化速率、氨氧化微生物功能基因丰度和N2O排放的影响,以期揭示上述两种生物硝化抑制剂对黄壤硝化作用及N2O排放的影响,为田间条件下进一步效果验证及研发烤烟新型绿色专用肥提供理论依据。
1 材料与方法
1.1 供试土壤
供试的酸性黄壤于2021年7月采自贵州省黔西南布依族苗族自治州兴义市(105°2'59"E,25°11'43"N)。该区域属亚热带山地季风湿润气候,平均海拔1 300 m,雨量充沛,日照长,年平均气温在15 ~ 18 ℃,年均降水量1 531.6 mm,无霜期达300 d左右。供试土壤采自耕地表层,剔除杂质后风干并过2 mm筛,储存于室温下备用。供试土壤基本理化性质见表1。
1.2 供试材料
供试氮肥(NH4)2SO4(分析纯)由南京化学试剂股份有限公司生产,供试生物硝化抑制剂为丁香酸 (SA,Sigma-Aldrich,美国)和对羟基苯丙酸甲酯(MHPP,Technologies GmbH,德国)。
1.3 试验方法
1.3.1 试验设计 试验分为两组,第一组试验采用100 mL塑料瓶于培养箱中培养,第二组采用100 mL玻璃瓶培养,两组试验各设3个处理,每个处理设置3个重复,分别为:①CK ((NH4)2SO4);②MHPP处理((NH4)2SO4+MHPP);③SA处理((NH4)2SO4+SA)。结合文献[20,30]中普遍采用的硝化抑制剂浓度和前期预试验测试筛选中得到的最佳浓度,各处理(NH4)2SO4加入量均为N 100 mg/kg土,MHPP和SA加入量均为500 mg/kg土。
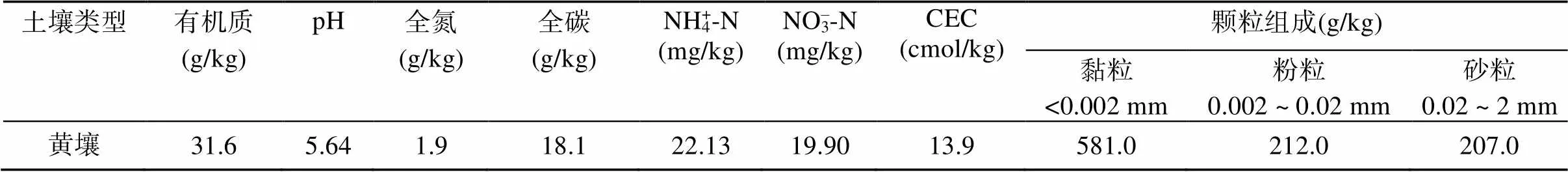
表1 供试土壤的基本理化性质
称取10 g干土置于培养瓶中,加蒸馏水调节土壤含水量至40% WHC(田间最大持水量),25 ℃恒温遮光培养,预培养1 d后,使用一次性针筒(带针头)吸取1.6 mL (NH4)2SO4和生物硝化抑制剂处理液施加,使其尽可能均匀地混入土壤中,此时土壤含水量调节至60% WHC。第一组试验使用封口膜封好瓶口并均匀扎小孔以保证通气,后放入25℃恒温培养箱继续遮光培养21 d。培养期间,每隔2 d打开封口膜称重加水使水分保持在60% WHC,在添加处理液后的第7、14、21 天进行土壤破坏性采样,一部分土壤样品用于基本理化性质分析,剩余部分经过冷冻干燥后在–80 ℃条件下保存用于土壤微生物分析。第二组试验用橡皮塞密封后放入25 ℃恒温培养箱遮光培养,在加入处理液后的第1、2、3、4、5、6、7、10、14、21 天进行气体收集,每次采样前将玻璃瓶排气后密闭23 h,用25 mL针筒注射器反复3次抽提后采集20 mL气体注入真空瓶内,用于测定N2O浓度。
1.3.2 测定方法 NH4+-N、NO3–-N使用1 mol/L的KCl溶液浸提。取5 g土样加50 mL KCl溶液振荡1 h,静置30 min后过滤得到浸提液,使用紫外可见分光光度计(D-8,南京菲勒仪器公司)测定浓度。N2O气体浓度使用气相色谱仪(GC7820A,Agilent Technologies, Inc., USA)测定。
称取约0.25 g土壤样品,土壤总DNA使用SPINeasy DNA Kit For Soil(MP Biomedicals公司)试剂盒提取,使用微量紫外分光光度计(Nanodrop ND-1000)检测提取DNA的浓度和纯度,提取完成后于4 ℃保存备用。使用定量PCR仪(Light Cyler 480Ⅱ,Roche Company)分别对氨氧化功能基因AOA-(引物基因为、)、AOB-(引物基因为、)进行扩增,其引物序列、扩增条件及标线制作详见Lu等[30]。PCR 扩增反应体系为10 μL,包括:5 μL的SYBR®Premix EX TaqTM(Takara),上、下游引物(10 μmol/L)各0.4 μL,1.0 μL的DNA 模板和3.2 μL无酶水。
1.4 计算公式
1)土壤硝化速率。
R= [(NO3–-N)–(NO3–-N)0] /(1)
式中:R表示硝化速率,mg/(kg·d);为间隔时间,d;(NO3–-N)0和(NO3–-N)分别为0、时的NO3–-N含量,mg/kg。平均硝化速率根据时间加权计算得出。
2)土壤N2O排放速率。
(/m)(dd)273/(273/(2)
式中:表示气体的排放速率,N2O-N μg/(kg·h);为N2O摩尔质量,28 g/mol;m为气体的摩尔体积,22.4 L/mol;d/d为单位时间内培养瓶内气体浓度增加量,10–9/h;为培养时的温度,℃;为培养瓶中气体的有效空间体积,L;为置于培养瓶中烘干土重,kg。
3)生物硝化抑制剂对土壤的硝化作用的抑制率和对N2O气体排放总量的抑制率。
(–)×100 (3)
式中:表示抑制率,%;为对照组处理的硝化速率或N2O排放总量,为添加生物硝化抑制剂处理组的硝化速率或N2O排放总量,mg/(kg·d) 或N2O-N μg/kg。其中N2O气体排放总量可根据上述排放速率公式由各时间段气体的平均排放速率进行时间加权计算得出。
1.5 数据处理
采用SPSS 21.0软件进行数据的统计与分析,其中不同处理之间样品的差异显著性比较采用单因素方差分析(One-way ANOVA)和Tukey检验。图表和土壤氨氧化菌基因拷贝数与土壤NO3–-N含量的关系用Origin 2018 进行绘制和线性分析。
2 结果与分析
2.1 不同生物硝化抑制剂处理对土壤无机氮含量的影响
如图1A所示,黄壤的NH4+-N含量随着培养时间的延长呈下降趋势,CK处理在21 d已被基本消耗完全。与CK相比,从培养开始到21 d内,SA处理显著抑制了NH4+-N的消耗(<0.05),而MHPP仅在培养0 ~ 14 d内具有显著抑制效应(<0.05),随着培养时间的延长抑制效应不显著。在培养0 ~ 14 d内,SA处理的NH4+-N含量均显著高于MHPP处理。培养期间3种处理下土壤中NO3–-N含量均呈上升趋势(图1B)。在0 ~ 14 d内,MHPP和SA处理下NO3–-N含量显著低于对照组CK(<0.05);并且SA处理的NO3–-N含量显著低于MHPP处理。从黄壤NH4+-N和NO3–-N含量的动态变化看出,MHPP和SA均显著抑制黄壤NH4+-N向NO3–-N的转化,且SA的抑制效果显著强于MHPP。土壤无机氮含量呈先下降后上升(图1C),与CK相比,SA处理下无机氮含量在不同的培养时间均无显著变化,而在7 d和14 d时,MHPP处理的无机氮含量有显著降低趋势(<0.05)。
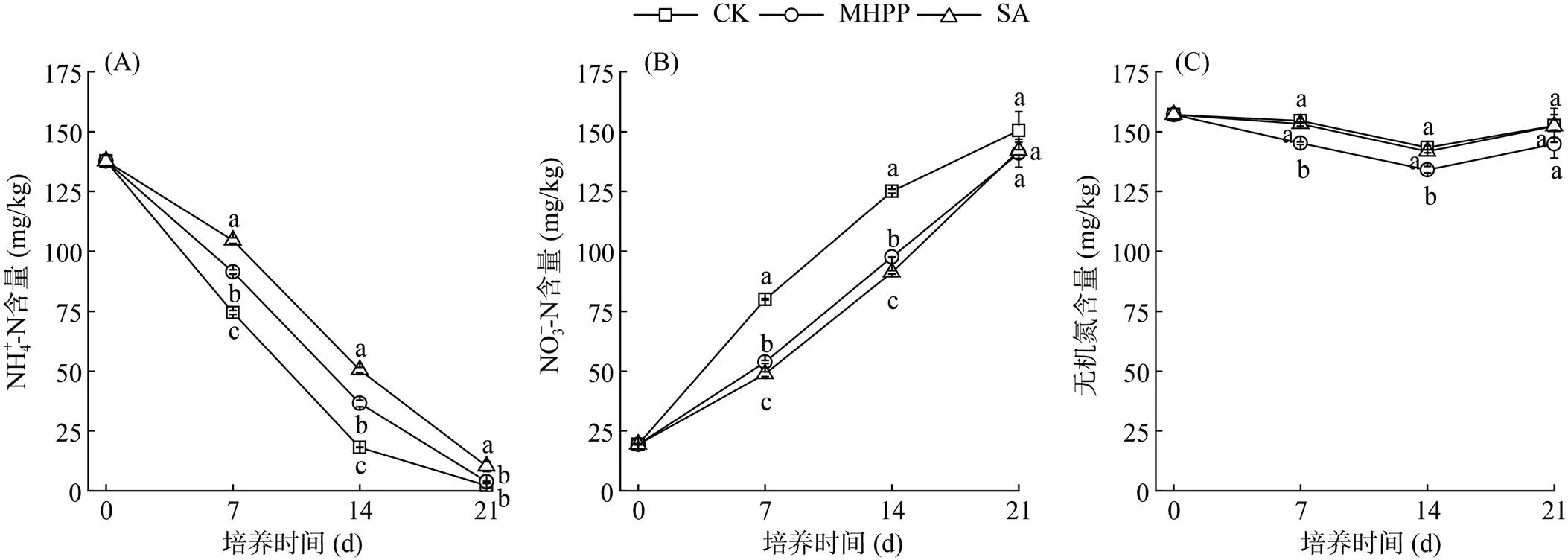
(图中小写字母不同表示同一时期不同处理间差异显著(P<0.05),下同)
2.2 不同生物硝化抑制剂处理对土壤硝化速率的影响
如表2所示,随着培养时间的延长,CK处理的硝化速率逐渐下降。在0 ~ 14 d内,与CK相比,MHPP和SA处理的硝化速率均显著降低(<0.05),后随培养时间延长到21 d无显著差异。在第7、14、21 天时,MHPP和SA的抑制率分别为43%、51%,26%、32% 和6%、5%。与对照组CK相比,前0 ~ 14 d期间,两者均能显著抑制黄壤的表观硝化速率,且0 ~ 7 d时抑制效果更强,SA对硝化速率的抑制强于MHPP。
2.3 不同生物硝化抑制剂处理下土壤氨氧化菌丰度及其与硝态氮含量的关系
通过荧光定量PCR测定了硝化作用关键功能菌——氨氧化古菌(AOA)和氨氧化细菌(AOB)的基因丰度(图2)。在整个培养期间内,CK处理下AOA丰度无明显变化(图2A)。与CK相比,0 ~ 21 d内MHPP和SA处理的AOA丰度均显著降低(<0.05),并且SA处理的AOA丰度均显著低于MHPP处理(<0.05)。MHPP和SA对AOA的抑制率分别在12% ~ 22% 和27% ~ 41%,其中第14 天时,两者的抑制效率均达到最高。
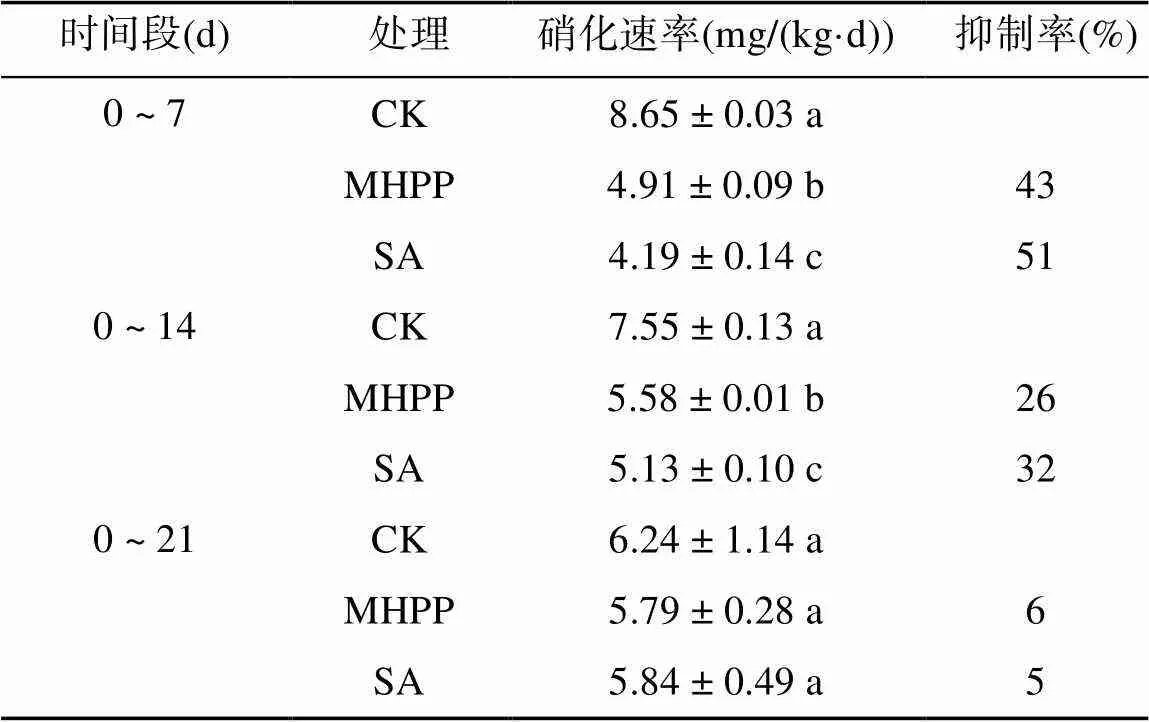
表2 不同时间段各处理下的土壤硝化速率及其硝化抑制率
注:同列数据小写字母不同表示同一时间段不同处理间差异显著(<0.05)。
从培养开始到结束,CK处理下AOB丰度呈持续增加趋势(图2B)。与AOA相似,整个培养期间内,与CK相比,SA处理的AOB丰度显著降低(<0.05);而MHPP处理在0 ~ 14 d内显著抑制了AOB丰度,随着培养时间延长,到21 d时已无显著抑制作用。并且0 ~ 21 d期间,SA处理的AOB丰度始终显著低于MHPP处理。MHPP和SA对AOB的抑制率分别在6% ~ 19% 和26% ~ 46%。综上,MHPP和SA对两种氨氧化微生物均有抑制作用,且SA的抑制效果均强于MHPP,这也与硝化速率抑制结果一致。
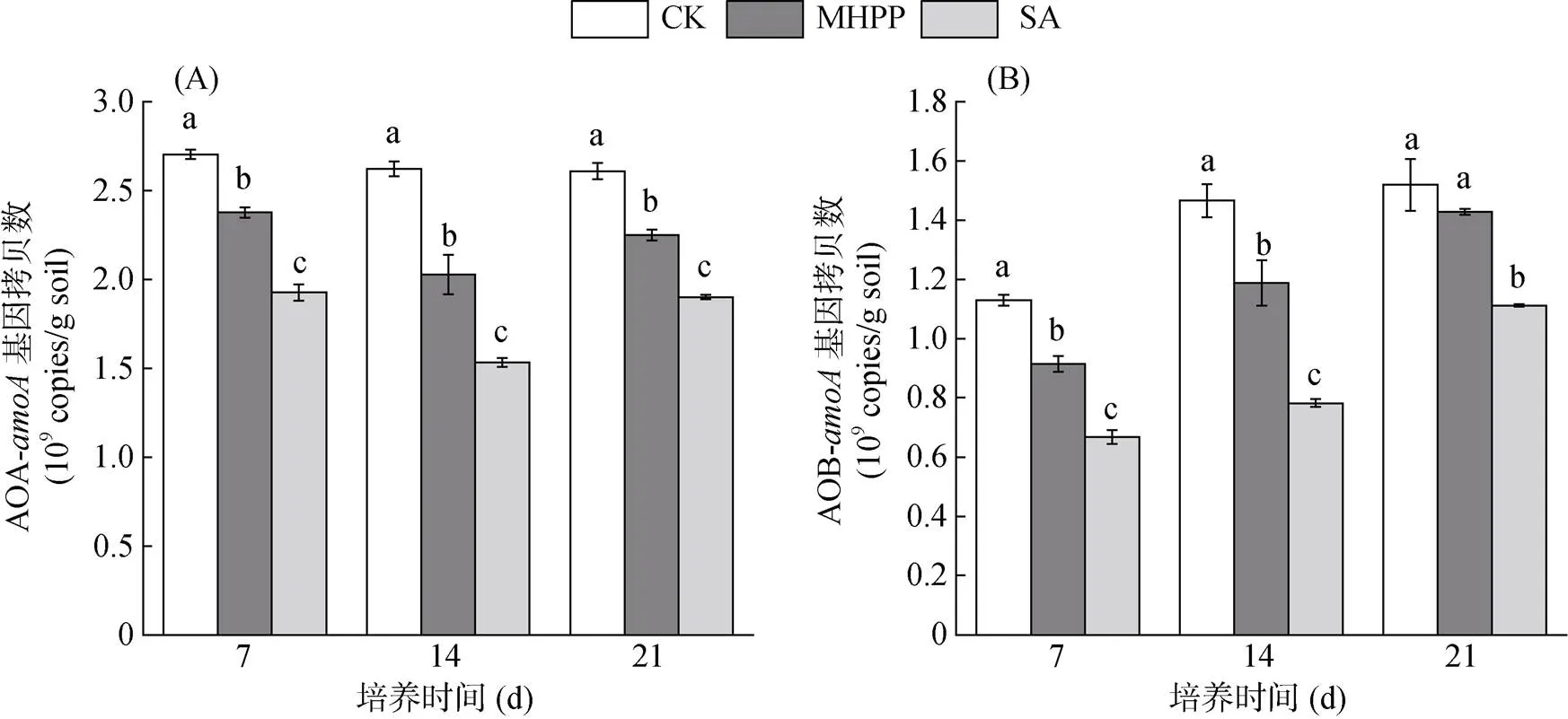
图2 不同处理下土壤中AOA-amoA(A)和AOB-amoA(B)基因拷贝数
如图3所示,Pearson相关性进一步分析表明,黄壤NO3–-N含量与AOB丰度呈显著正相关(2=0.641,<0.001),而与AOA丰度无显著相关性(2=0.031,0.375)。这表明MHPP和SA这两种生物硝化抑制剂在黄壤中的抑制效果主要是通过对AOB起主要调控作用。

图3 土壤中AOA-amoA(A)和AOB-amoA(B)基因丰度与NO3–-N含量的相关性
2.4 不同生物硝化抑制剂处理对土壤N2O排放的影响
由图4A可知,CK处理下N2O排放速率于第一天达到最高峰902.84 ng/(kg·h) 后,逐渐持续下降;MHPP处理下N2O排放速率也在第一天达到最高峰192.10 ng/(kg·h),之后开始缓慢持续下降。与CK和MHPP不同,SA处理下N2O排放速率在1 ~ 2 d处于非常低的状态,从第2天开始逐渐上升,第4天达到峰值281.59 ng/(kg·h)后开始逐渐下降,SA延缓了N2O排放的高峰时间与峰值。从N2O排放积累量来看(图4B),MHPP和SA处理下N2O排放量均得到显著抑制;其中SA对N2O排放的抑制率为21%,而MHPP达到51%,可见,MHPP对黄壤N2O的减排效果强于SA。
3 讨论
3.1 生物硝化抑制剂对土壤硝化作用的影响
尽管本研究供试黄壤pH为5.63,属于酸性土壤,但添加氮肥和两种生物硝化抑制剂后,黄壤中NH4+-N含量下降的同时伴随着NO3–-N含量的同步快速升高,表明酸性黄壤的硝化作用较强。这可能是由于农业生产中肥料的大量施用和耕作模式的改变大大加速了酸性土壤的硝化作用[33]。培养21 d内,MHPP和SA抑制剂处理下土壤NH4+-N消耗速率和NO3–-N产生速率均显著低于CK对照,可见生物硝化抑制剂MHPP和SA均能抑制酸性黄壤的硝化作用。已有研究表明MHPP在紫色土、酸性红壤和酸性火山灰土上均有显著的抑制效果[18,30–31,34]。对于新发现的生物硝化抑制剂SA,目前仅在中性水稻土上证实了其硝化抑制效应[20],本研究发现其在酸性黄壤上也能显著抑制NH4+-N的硝化过程,这进一步拓宽了SA潜在的作用范围。相对于化学合成硝化抑制剂,生物硝化抑制剂由于其对AOA的调控作用可能在酸性土壤上硝化抑制效应更好[30,35]。在培养的前14 d内,SA在黄壤上的抑制效果略强于MHPP,这可能是由于含有对位羧基的酚酸SA在酸性黄壤上比酚酸甲酯MHPP更稳定。此外,MHPP处理下的土壤无机氮含量有明显下降(图1C),这与MHPP在其他土壤上的效果一致[34,36],可能是因为MHPP易作为碳源被异养微生物分解利用,增强了微生物对氮的固定。然而,SA在整个培养周期内对黄壤无机氮含量没有显著影响,这与SA在水稻土上的结果类似[20],很大程度上能排除SA对土壤硝化作用的间接影响。MHPP和SA两者对土壤无机氮动态的不同响应表明不同化学结构的生物硝化抑制剂可能存在不同的硝化抑制机理,可能是与两者被微生物利用的难易程度有关。

图4 不同处理下土壤N2O排放速率(A)和N2O排放积累量(B)的变化
氨氧化微生物是土壤硝化作用的关键微生物[37]。本研究发现MHPP和SA均能显著抑制AOB-和AOA-的基因丰度,这与以往MHPP和SA在其他土壤类型上对AOA和AOB的双抑制作用一致[20,34,36]。其他生物硝化抑制剂1,9-癸二醇和高粱酮也能同时作用于土壤AOA和AOB[30,38]。然而,黄壤的硝化作用主要由氨氧化细菌AOB主导,本研究中相关性分析表明黄壤NO3–-N含量仅与AOB-基因丰度呈显著正相关,与AOA无显著相关性。由于以往研究发现DCD等化学合成硝化抑制剂主要在AOB占主导的土壤上起作用[39],这些合成硝化抑制剂在黄壤上可能也具有较好的抑制效应,未来可以与生物硝化抑制剂的效果进行比较。此外,从抑制效果看,SA对土壤AOB-的抑制效应强于MHPP,这能进一步解释为什么SA对黄壤硝化速率的抑制效果强于MHPP。通过研究不同生物硝化抑制剂在不同土壤中的生态适应机制将有助于更好地了解BNIs在农业中的应用前景[23]。
3.2 生物硝化抑制剂对N2O排放的影响
本研究还首次明确了生物硝化抑制剂MHPP和SA对黄壤N2O排放均有显著抑制作用。有意思的是,MHPP在黄壤上对N2O的减排效果优于SA,这与上述两者在黄壤上对硝化速率及氨氧化微生物的抑制效果相反。除硝化作用以外,土壤反硝化作用也是N2O排放的重要途径[40]。已有研究表明,合成硝化抑制剂DMPP等不仅能够抑制硝化作用,也能够通过促进N2O对N2的转化而影响反硝化作用来减少N2O排放[41-42]。因此,BNIs也有可能影响反硝化作用从而抑制N2O的排放,关于MHPP和SA对黄壤N2O排放的抑制机制问题还需进一步探索。
从N2O排放的动态过程来看,MHPP与SA抑制黄壤N2O排放的机制也可能不同。MHPP处理与CK对照的趋势一致,N2O排放的最高峰均是在第1天,MHPP主要通过降低N2O排放的峰值而起到减排作用。但SA处理不仅将黄壤N2O的峰值推后至第4天,而且基本上完全抑制了前2 d N2O的排放,后期又产生了较大的N2O排放量,可能原因有:①培养初期,高浓度的酚酸SA对土壤硝化微生物或反硝化细菌可能产生较大的毒性[43],导致初始2 d内SA处理下N2O排放被完全抑制了。随着培养时间的增加,SA逐渐分解,毒性降低,土壤微生物的硝化作用或反硝化作用快速恢复。②酚酸类SA具有抗氧化性,其具有较好的自由基清除活性[44],添加到土壤中会降低体系中的O2含量与氧化还原电位,从而抑制土壤硝化并可能促进反硝化过程中N2/N2O的比例[45]。SA对黄壤N2O排放的延迟效应,可能有利于烤烟前期吸收更多未被硝化的矿质氮,降低土壤中的氮浓度和反硝化潜力,从而减少烤烟生产中前期的氮损失[46]。
4 结论
生物硝化抑制剂MHPP和SA对黔西南黄壤的硝化作用和N2O排放均有显著抑制作用,其中SA对硝化速率的抑制效果强于MHPP,而MHPP对N2O排放量的抑制效果强于SA。MHPP和SA显著抑制了氨氧化菌AOA和AOB丰度,同时主要通过调节AOB丰度从而抑制黄壤硝化作用。可见,MHPP和SA在贵州黔西南黄壤上具有氮肥减施增效的潜力,这为今后烤烟新型绿色专用肥的开发提供了理论依据。MHPP和SA在黄壤上对N2O的减排机理及其田间效果验证有待进一步研究。
[1] 曾后清, 朱毅勇, 王火焰, 等. 生物硝化抑制剂——一种控制农田氮素流失的新策略[J]. 土壤学报, 2012, 49(2): 382–388.
[2] 于飞, 施卫明. 近10年中国大陆主要粮食作物氮肥利用率分析[J]. 土壤学报, 2015, 52(6): 1311–1324.
[3] Beeckman F, Motte H, Beeckman T. Nitrification in agricultural soils: Impact, actors and mitigation[J]. Current Opinion in Biotechnology, 2018, 50: 166–173.
[4] Subbarao G V, Yoshihashi T, Worthington M, et al. Suppression of soil nitrification by plants[J]. Plant Science, 2015, 233: 155–164.
[5] Jung M Y, Well R, Min D, et al. Isotopic signatures of N2O produced by ammonia-oxidizing Archaea from soils[J]. The ISME Journal, 2014, 8(5): 1115–1125.
[6] Braker G, Conrad R. Diversity, structure, and size of N2O-producing microbial communities in soils—What matters for their functioning? [M]//Advances in Applied Microbiology. Amsterdam: Elsevier, 2011: 33–70.
[7] 颜晓元, 夏龙龙, 遆超普. 面向作物产量和环境双赢的氮肥施用策略[J]. 中国科学院院刊, 2018, 33(2): 177–183.
[8] 沈晓忆, 夏围围, 张洁, 等. 硝化抑制剂与尿素配施对旱地土壤温室气体排放及硝化微生物的影响[J]. 土壤, 2021, 53(3): 512–521.
[9] Rajbanshi S S, Benckiser G, Ottow J C G. Effects of concentration, incubation temperature, and repeated applications on degradation kinetics of dicyandiamide (DCD) in model experiments with a silt loam soil[J]. Biology and Fertility of Soils, 1992, 13(2): 61–64.
[10] Zerulla W, Barth T, Dressel J, et al. 3, 4-Dimethylpyrazole phosphate (DMPP) - a new nitrification inhibitor for agriculture and horticulture[J]. Biology and Fertility of Soils, 2001, 34(2): 79–84.
[11] 吴晓荣, 张蓓蓓, 余云飞, 等. 硝化抑制剂对典型茶园土壤尿素硝化过程的影响[J]. 农业环境科学学报, 2017, 36(10): 2063–2070.
[12] Abalos D, Jeffery S, Sanz-Cobena A, et al. Meta-analysis of the effect of urease and nitrification inhibitors on crop productivity and nitrogen use efficiency[J]. Agriculture, Ecosystems & Environment, 2014, 189: 136–144.
[13] 孙海军, 闵炬, 施卫明, 等. 硝化抑制剂施用对水稻产量与氨挥发的影响[J]. 土壤, 2015, 47(6): 1027–1033.
[14] Woodward E E, Hladik M L, Kolpin D W. Nitrapyrin in streams: The first study documenting off-field transport of a nitrogen stabilizer compound[J]. Environmental Science & Technology Letters, 2016, 3(11): 387–392.
[15] Subbarao G V, Ishikawa T, Ito O, et al. A bioluminescence assay to detect nitrification inhibitors released from plant roots: A case study with[J]. Plant and Soil, 2006, 288(1): 101–112.
[16] Subbarao G V, Nakahara K, Hurtado M P, et al. Evidence for biological nitrification inhibition inpastures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(41): 17302–17307.
[17] Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root-exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by()[J]. New Phytologist, 2008, 180(2): 442–451.
[18] Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243–259.
[19] Sun L, Lu Y F, Yu F W, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. New Phytologist, 2016, 212(3): 646–656.
[20] Lu Y F, Zhang X N, Ma M K, et al. Syringic acid from rice as a biological nitrification and urease inhibitor and its synergism with 1, 9-decanediol[J]. Biology and Fertility of Soils, 2022, 58(3): 277–289.
[21] Otaka J, Subbarao G V, Ono H, et al. Biological nitrification inhibition in maize—Isolation and identification of hydrophobic inhibitors from root exudates[J]. Biology and Fertility of Soils, 2022, 58(3): 251–264.
[22] Coskun D, Britto D T, Shi W M, et al. Nitrogen transformations in modern agriculture and the role of biological nitrification inhibition[J]. Nature Plants, 2017, 3: 17074.
[23] 陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545–557.
[24] 张萌, 刘彦伶, 魏全全, 等. 酒糟生物炭短期施用对贵州黄壤氮素有效性及细菌群落结构多样性的影响[J]. 环境科学, 2020, 41(10): 4690–4700.
[25] 陈发元, 胡锦, 周俊成, 等. 施氮量及基追比对烤烟碳代谢产物及关键酶的影响[J]. 西南农业学报, 2022, 35(6): 1310–1317.
[26] 李明德, 肖汉乾, 易百科, 等. 氮肥增效剂在烟草上的应用效果研究[J]. 湖南农业科学, 2013(1): 49–52, 55.
[27] 祖韦军, 潘文杰, 张金召, 等. 耕作深度与翻压绿肥对植烟土壤微生物功能多样性及酶活性的影响[J]. 南方农业学报, 2020, 51(10): 2383–2393.
[28] 葛宸, 刘青丽, 李志宏, 等. 炭基复混肥对烤烟产质量的影响[J]. 中国土壤与肥料, 2022(2): 93–98.
[29] Lan T, Huang Y X, Song X, et al. Biological nitrification inhibitor co-application with urease inhibitor or biochar yield different synergistic interaction effects on NH3volatilization, N leaching, and N use efficiency in a calcareous soil under rice cropping[J]. Environmental Pollution, 2022, 293: 118499.
[30] Lu Y F, Zhang X N, Jiang J F, et al. Effects of the biological nitrification inhibitor 1, 9-decanediol on nitrification and ammonia oxidizers in three agricultural soils[J]. Soil Biology and Biochemistry, 2019, 129: 48–59.
[31] 赖晶晶, 兰婷, 王启, 等. 硝化抑制剂对紫色土硝化作用及N2O排放的影响[J]. 农业环境科学学报, 2019, 38(6): 1420–1428.
[32] Yao Y L, Zeng K, Song Y Z. Biological nitrification inhibitor for reducing N2O and NH3emissions simultaneously under root zone fertilization in a Chinese rice field[J]. Environmental Pollution, 2020, 264: 114821.
[33] 徐白璐, 钟文辉, 黄欠如, 等. 长期施肥酸性旱地土壤硝化活性及自养硝化微生物特征[J]. 环境科学, 2017, 38(8): 3473–3482.
[34] Nardi P, Akutsu M, Pariasca-Tanaka J, et al. Effect of methyl 3-4-hydroxyphenyl propionate, aroot exudate, on N dynamic, potential nitrification activity and abundance of ammonia-oxidizing bacteria and Archaea[J]. Plant and Soil, 2013, 367(1): 627–637.
[35] Subbarao G V, Searchinger T D. A “more ammonium solution” to mitigate nitrogen pollution and boost crop yields[J]. PNAS, 2021, 118(22): e2107576118.
[36] Lan T, Li M X, He X Q, et al. Effects of synthetic nitrification inhibitor (3, 4-dimethylpyrazole phosphate; DMPP) and biological nitrification inhibitor (methyl 3-(4-hydroxyphenyl) propionate; MHPP) on the gross N nitrification rate and ammonia oxidizers in two contrasting soils[J]. Biology and Fertility of Soils, 2022, 58(3): 333–344.
[37] Farooq M S, Uzair M, Maqbool Z, et al. Improving nitrogen use efficiency in aerobic rice based on insights into the ecophysiology of archaeal and bacterial ammonia oxidizers[J]. Frontiers in Plant Science, 2022, 13: 913204.
[38] Sarr P S, Ando Y, Nakamura S, et al. Sorgoleone release from sorghum roots shapes the composition of nitrifying populations, total bacteria, and Archaea and determines the level of nitrification[J]. Biology and Fertility of Soils, 2020, 56(2): 145–166.
[39] Shen T L, Stieglmeier M, Dai J L, et al. Responses of the terrestrial ammonia-oxidizing archaeon Ca.and the ammonia-oxidizing bacteriumto nitrification inhibitors[J]. FEMS Microbiology Letters, 2013, 344(2): 121–129.
[40] Wu D, Cárdenas L M, Calvet S, et al. The effect of nitrification inhibitor on N2O, NO and N2emissions under different soil moisture levels in a permanent grassland soil[J]. Soil Biology and Biochemistry, 2017, 113: 153–160.
[41] Barrena I, Menéndez S, Correa-Galeote D, et al. Soil water content modulates the effect of the nitrification inhibitor 3, 4-dimethylpyrazole phosphate (DMPP) on nitrifying and denitrifying bacteria[J]. Geoderma, 2017, 303: 1–8.
[42] Torralbo F, Menéndez S, Barrena I, et al. Dimethyl pyrazol-based nitrification inhibitors effect on nitrifying and denitrifying bacteria to mitigate N2O emission[J]. Scientific Reports, 2017, 7: 13810.
[43] 母容, 潘开文, 王进闯, 等. 阿魏酸、对羟基苯甲酸及其混合液对土壤氮及相关微生物的影响[J]. 生态学报, 2011, 31(3): 793–800.
[44] Srinivasulu C, Ramgopal M, Ramanjaneyulu G, et al. Syringic acid (SA) - A review of its occurrence, biosynthesis, pharmacological and industrial importance[J]. Biomedicine & Pharmacotherapy, 2018, 108: 547–557.
[45] Monaghan R M, Barraclough D. Nitrous oxide and dinitrogen emissions from urine-affected soil under controlled conditions[J]. Plant and Soil, 1993, 151(1): 127–138.
[46] van Groenigen J W, Kuikman P J, de Groot W J M, et al. Nitrous oxide emission from urine-treated soil as influenced by urine composition and soil physical conditions[J]. Soil Biology and Biochemistry, 2005, 37(3): 463–473.
Effects of Biological Nitrification Inhibitors on Nitrification and N2O Emissions of Yellow Soil in Southwestern Guizhou
HUA Yao1, LU Yufang1, GAO Weichang2, ZU Weijun3, SHI Weiming1, GUO Yali4*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 Upland Flue-Cured Tobacco Quality & Ecology Key Laboratory of China Tobacco, Guizhou Academy of Tobacco Science, Guiyang 550081, China; 3 Bijie Agricultural Ecological Environment and Resource Protection Station, Bijie, Guizhou 551700, China; 4 Qianxinan Branch Company, Guizhou Tobacco Company, Xingyi, Guizhou 562400, China)
In order to investigate the effects of biological nitrification inhibitors (BNIs) on nitrification and nitrous oxide (N2O) emission on yellow soil in Southwestern Guizhou, a three-week soil incubation experiment was conducted to explore the effects of two BNIs (methyl 3-(4-hydroxyphenyl) propionate (MHPP) and syringic acid (SA)) on soil inorganic nitrogen content,gene expression of ammonia-oxidizing microorganism and N2O production. The results show that compared with the control (CK), MHPP and SA can significantly inhibit the nitrification process with the inhibition rates of 6%–43% and 5%–51%, respectively. Moreover, MHPP and SA both reduce the abundance of ammonia-oxidizing archaea (AOA) by 12%–22% and 27%–41%, and the abundance of ammonia-oxidizing bacteria (AOB) by 6%–19% and 26%–46%. Meanwhile, nitrate nitrogen content in yellow soil is significantly positively correlated with AOB abundance during the whole incubation, but has no significant correlation with AOA abundance, indicating that AOB plays a dominant role in the nitrification process. In terms of N2O emission, MHPP and SA show strong inhibitory effects of 51% and 21% on total N2O cumulative production, respectively, and the reduction of MHPP is better than SA. MHPP decreases N2O peak while SA mainly delays the emergence of the peak of N2O production rate. This study indicates biological nitrification inhibitors MHPP and SA have the potential to reduce nitrogen fertilizer consumption and increase nitrogen use efficiency of the yellow soil in Southwestern Guizhou, which provides a theoretical basis for the development of new green fertilizers for flue-cured tobacco in the future.
Nitrification; Biological nitrification inhibitors; Yellow soil; Nitrification rate; Ammonia-oxidizing microorganisms; N2O
S143.1+6
A
10.13758/j.cnki.tr.2023.03.007
华瑶, 陆玉芳, 高维常, 等. 生物硝化抑制剂对黔西南黄壤硝化作用及N2O排放的影响. 土壤, 2023, 55(3): 512–519.
中国烟草总公司贵州省公司重点研发项目(2021XM19)资助。
(63806188@qq.com)
华瑶 (1996—),女,江苏无锡人,硕士研究生,主要从事生物硝化抑制剂方面的研究。E-mail: fjsk167@163.com

