九寨沟中华蟾蜍和中国林蛙肠道菌群差异分析
黄飞云, 向朋, 尚可, 杨宇, 赵春霖, 岳碧松
(四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都 610065)
中华蟾蜍Bufo gargarizans是东亚地区演化最成功的两栖类之一,分布范围广,从太平洋岛屿延伸至青藏高原,分布海拔750~3 500 m,在我国除新疆、台湾、海南外均有分布(李苹等,2020;杨巧等,2022)。中华蟾蜍还是传统中药,蟾酥、蟾衣均可入药(梁智佳,2021)。中国林蛙Rana chensinensis是我国北方地区广泛分布且具有较强陆地生活适应能力的无尾两栖类,分布区包括黑龙江、吉林、辽宁、内蒙古、河北、山西、陕西、甘肃、青海、新疆、山东、江苏、四川、西藏等,哈蟆油为中国林蛙雌蛙输卵管的干制品,是重要的中药(杨红玉,2021;孙敬蒙等,2022)。
肠道是动物机体最重要的消化器官,也是众多共生微生物的主要栖息场所。肠道微生物群落作为宿主生理活动的积极参与者,可调节宿主的代谢和生理功能,从而有助于其内稳态的平衡。同样,肠道微生物对于机体健康的维持等方面也发挥着至关重要的作用(申喻嘉等,2021)。肠道微生物菌群结构与多样性和免疫功能、营养代谢等息息相关(孙笑非等,2015;王文娟等,2017;赵零等,2022)。肠道微生物相关研究集中在人和大型脊椎动物,对两栖类肠道微生物的研究较少。蛙类的肠道微生物以拟杆菌门Bacteroidota、变形菌门Proteobacteria、梭杆菌门Fusobacteriota 和厚壁菌门Firmicutes 为主要优势菌群(马丽,2015;王建等,2018)。不同蛙类肠道微生物群落差异显示,中国林蛙、黑斑侧褶蛙Pelophylax nigromculatus和牛蛙Rana catesbeiana三者蝌蚪在疣微菌门Verru⁃comicrobiota、鲸杆菌属Cetobacterium、邻单胞菌属Plesiomonas和气单胞菌属Aeromonas中具有显著差异(慕丹阳,2018)。而中华蟾蜍肠道微生物结构在个体自身发育过程中具有显著变化,但相关研究还未引起广泛关注。白筱(2017)的研究显示,中华蟾蜍蝌蚪在发育过程中肠道变形菌门的丰度降低而拟杆菌门和梭杆菌门的丰度提高,厚壁菌门内的细菌种类发生变化,放线菌门Actinobacteri⁃ota基本消失且新出现了疣微菌门。两栖动物进化地位特殊,其肠道菌群结构对于解析脊椎动物与肠道菌群的共生机制意义重大。为了解成年中华蟾蜍和中国林蛙肠道微生物的组成,并探究两者肠道微生物的差异,本文以同时采自四川九寨沟国家级自然保护区的中华蟾蜍和中国林蛙为对象,采用16S rRNA 测序方法,对它们肠道内主要细菌类群及差异进行初步分析,为进一步深入研究提供基础数据。
1 材料及方法
1.1 实验材料
2021年5月,从四川九寨沟国家级自然保护区(海拔2 930 m)采集成体中华蟾蜍和中国林蛙各3 只,尽快送回实验室后,表面冲洗消毒后解剖取消化道,收集肠道内容物于无菌离心管中,液氮保存备用。
1.2 基因组DNA提取及16S rRNA测序
基因组DNA 提取按照试剂盒(Sigma-Aldrich,美国)要求进行,DNA 样品检测合格后送北京诺禾致源科技股份有限公司进行高通量测序。使用PCR 扩增通用引物343F 和798R 扩增16S rRNA基因的V3至V4可变区。
1.3 数据分析
基于Deblur 算法建立扩增序列变体(amplicon sequence variant,ASV)的特征表和特征序列,利用在线平台(Majorbio Biotech Co., Ltd)和QIIME 1.9.1进行肠道菌群的多样性分析:基于ASV 表生成稀释梯度数据用于评估高通量测序中的测序深度和数量是否足以反映该群落样品所包含的微生物多样性;生成物种累积曲线用以分析样品量是否充分;通过t检验分析2个物种的α多样性指数(Chaol指数、Shannon指数和Simpson指数)和Pielou指数;通过β 多样性研究2 个物种在细菌水平组成结构的相似性,基于ASV 丰度的Bray-curis 距离绘制主成分分析图。基于silva138/16s数据库对ASV 进行物种分类注释,对不同样本在门和属水平上的物种组成情况进行丰度统计分析。最后使用Kruskal-Wallis 秩和检验进行线性判别分析,以获得2个物种之间的标志性微生物。
2 结果分析
2.1 测序质量评估
3 只中华蟾蜍和3 只中国林蛙肠道细菌16S rRNA的有效序列数量为70 027~86 992,ASV数量为282~551,覆盖度均在96%以上(表1),中华蟾蜍和中国林蛙共有的ASV 为440,而特有的ASV 分别为313和539,表明中国林蛙肠道细菌具有更高的多样性。物种累积曲线趋于平缓(图1:A);稀释曲线也随着样本数的增加逐步趋于渐近线(图1:B),表明测序数据量已覆盖样品中的绝大多数物种,测序数据合理可靠。
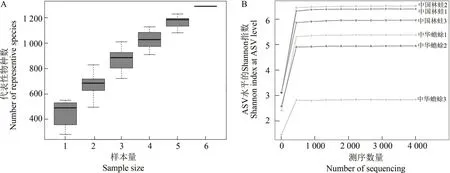
图1 样本测序可靠性分析Fig. 1 Reliability analysis of sample sequencing
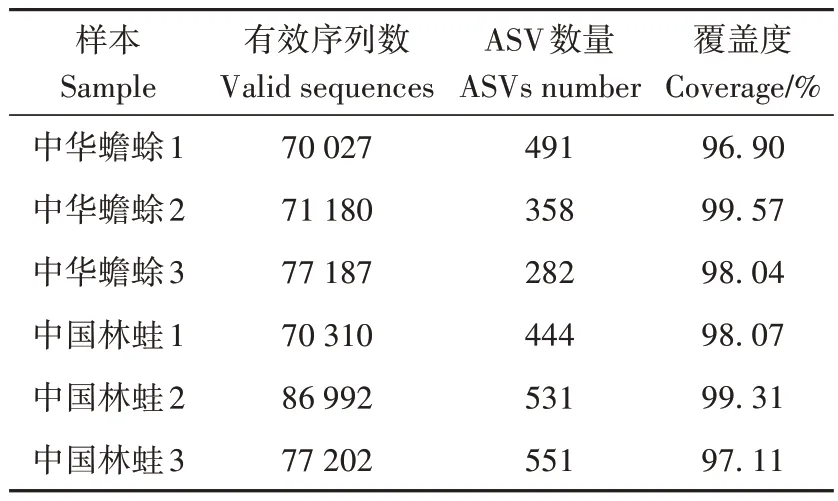
表1 样本ASVTable 1 Sample ASVs
2.2 菌群结构的α多样性分析
中国林蛙肠道菌群的群落丰富度和群落多样性均比中华蟾蜍的高(表2)。
2.3 菌群结构的β多样性分析
中华蟾蜍和中国林蛙的肠道菌群结构表现出明显差异,且中国林蛙肠道菌群结构在个体间差异较大(图2)。
2.4 肠道菌群在门级水平上的差异
在门级水平上,中华蟾蜍和中国林蛙的肠道细菌主要属于厚壁菌门、疣微菌门、拟杆菌门、脱硫杆菌门Desulfobacterota 和变形菌门,约占总数的99.00%。在中华蟾蜍肠道中,疣微菌门最丰富,占48.40%,其次是厚壁菌门和拟杆菌门,分别占30.89%和16.89%;而在中国林蛙肠道中,厚壁菌门和拟杆菌门细菌较丰富,分别占45.08% 和22.90%,其次是疣微菌门和脱硫杆菌门(图3)。
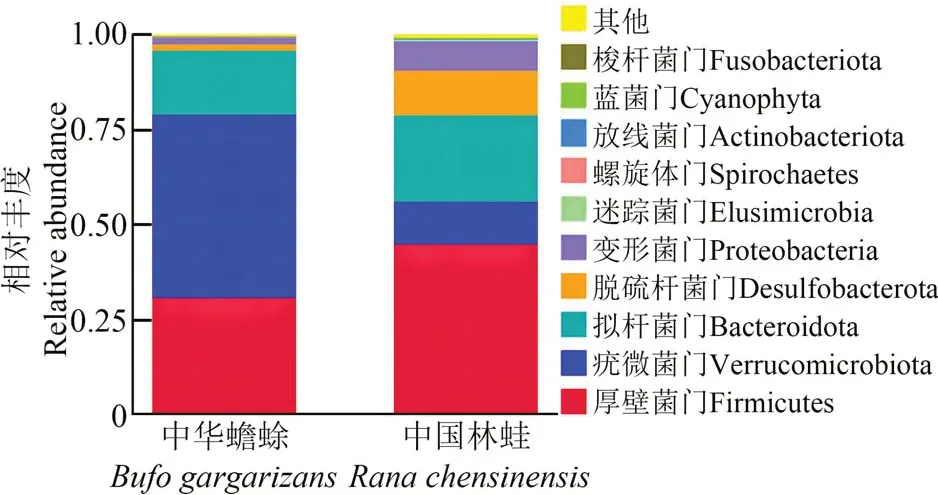
图3 中华蟾蜍和中国林蛙肠道菌群在门级水平的相对丰度Fig. 3 Relative abundance of the intestinal flora of Bufo gargarizans and Rana chensinensis at phylum level
2.5 肠道菌群在属级水平上的差异分析
中华蟾蜍和中国林蛙肠道菌群中,丰富度在1%以上的有17 个属级单元,分别占这2 种动物肠道菌群的69.82%和41.37%,其中,阿克曼菌属Ak‑kermansia最丰富,分别占48.35%和10.75%,其次是布雷兹纳基亚属Breznakia、脱硫弧菌属Desulfo‑vibrio、拟杆菌属Bacteroides、另枝菌属Alistipes和理研菌属Rikenella,其他各属占比较小(表3)。
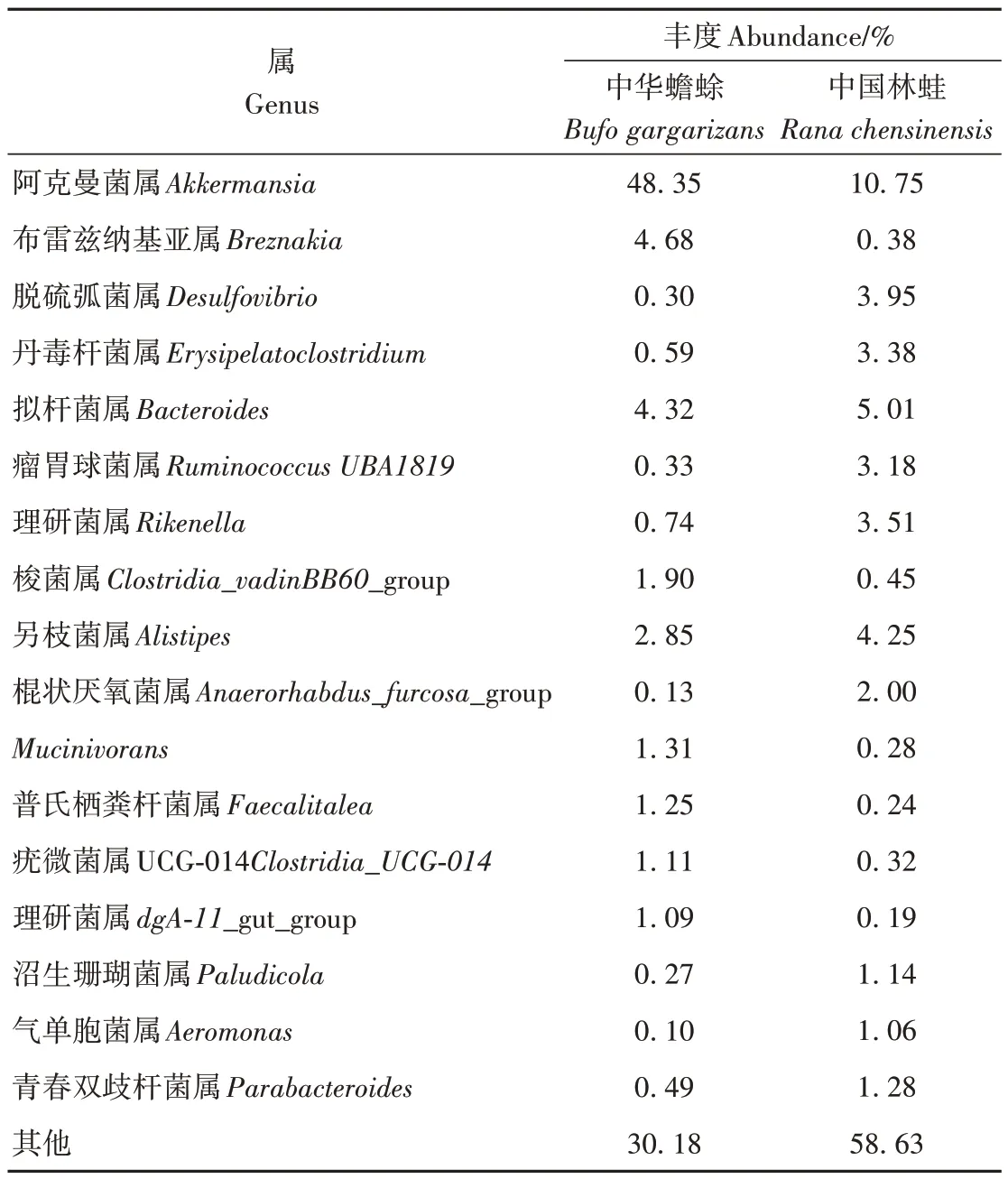
表3 中华蟾蜍和中国林蛙肠道菌群主要属(0.1%以上)的ASV丰度Table 3 Abundance of ASVs in the main genera (>0.1%) of the intestinal flora of Bufo gargarizans and Rana chensinensis
2.6 线性判别分析
线性判别分析显示,中华蟾蜍和中国林蛙肠道菌群中,有16 个类群的丰度存在显著差异(图4)。其中,中华蟾蜍肠道菌群中的疣微菌门、阿克曼菌科Akkermansiaceae、疣微菌目Verrucomi⁃crobiales 和阿克曼菌属的丰富度均显著高于中国林蛙(P<0.05),而振螺目Oscillospirales、疣微菌科Ruminococcaceae、沙氏别样杆菌Alistipes shahii、产己酸菌属Caproiciproducens、颤螺旋菌科Oscillospi⁃raceae、瘤胃球菌属Ruminococcus UBA1819、内脏臭气杆菌Odoribacter splanchnicus、酪酸梭菌属Anaer‑otruncus、肠杆菌属Intestinibacter、棍状厌氧菌属An‑aerorhabdus furcosa_group、巴斯德氏菌目Pasteurel⁃lales的丰度均显著低于中国林蛙(P<0.05)。
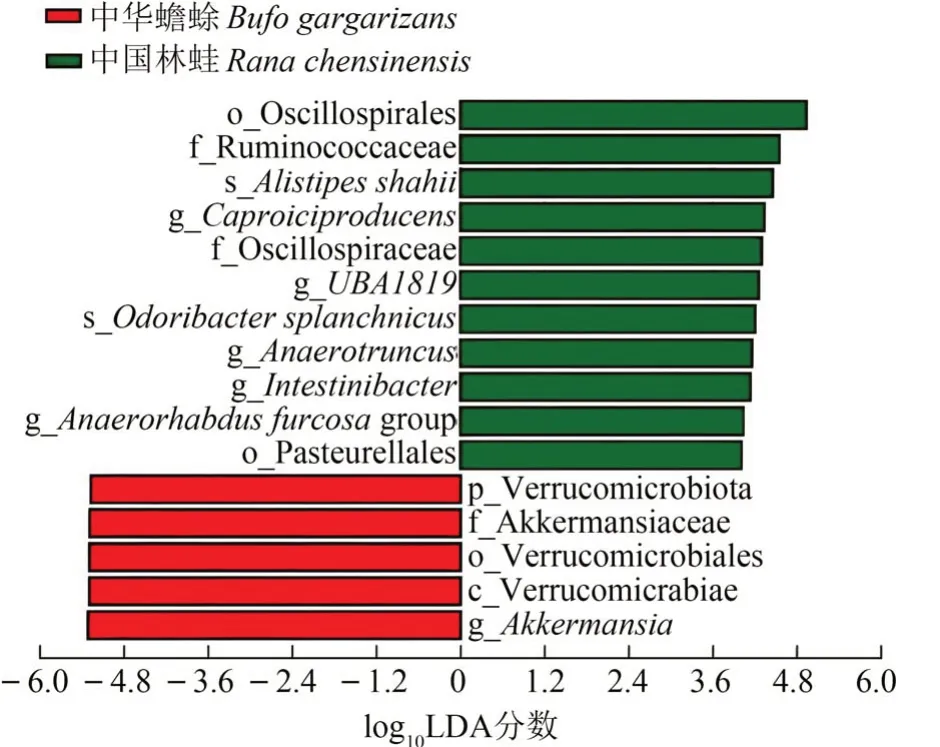
图4 线性判别分析Fig. 4 Linear discriminant analysis
3 讨论
肠道微生物菌群是动物健康和生理功能的重要参与者,它们在营养物质吸收与代谢、免疫应激与疾病等方面发挥着重要作用(Shiet al.,2017;Heet al.,2020)。在人类、家禽和哺乳动物微生物的研究中较广泛(林璋等,2016;Makiet al.,2019),但对蛙类的研究却少见报道。蛙类的肠道微生物菌群以拟杆菌门、变形菌门、梭杆菌门和厚壁菌门为主要优势菌群(马丽,2015;慕丹阳,2018;王建等,2018)。在本试验中,中华大蟾蜍的核心优势菌群为拟杆菌门、疣微菌门和厚壁菌门,这3 种占据了肠道微生物门级水平90%以上。中国林蛙的肠道优势菌群为拟杆菌门、厚壁菌门、疣微菌门和变形菌门,这4 种占据了肠道微生物门级水平80%以上。因此,推测厚壁菌门、拟杆菌门、变形菌门和疣微菌门是两栖类肠道中的固有菌群,菌群组成比例受基因、年龄、性别和环境等因素的影响。刘文舒等(2020)研究表明,两栖动物与人类和家禽等的肠道微生物菌群结构具有明显差异。说明在复杂的生长环境下,肠道微生物易受环境、发育等因素影响而产生明显差异。
为了实现有效调控肠道菌群以维持宿主健康,必须深入了解肠道菌群与驱动因子间的关系。肠道菌群通常是在多种驱动因子协同影响下,厘清这些因子的效应依然是一个挑战。Song 等(2021)研究发现,变形菌门是冬眠期成体中华蟾蜍小肠菌群的最丰富细菌门类,假单胞菌属Pseu‑domonas可能是中华蟾蜍小肠菌群适应冬眠过程的关键细菌。在个体发育层面,中华蟾蜍在变态过程中,肠道微生物种群多样性会减少,种群组成也会发生变化,这些变化与其采食、生活环境、肠道形态和体质量降低等因素改变有关。在这一过程中,中华蟾蜍肠道微生物中疣微菌门、阿克曼菌、肠杆菌属、双歧杆菌属Bifidobacterium和Alpin‑imonas菌的丰度均随着蝌蚪体重减少而改变(白筱,2018)。此外,由于水陆两栖的独特生活史及皮肤的高渗透性,两栖动物比其他类群对环境变化更加敏感,因此推测环境对其具有重大影响。黄皓(2019)的研究显示,来自伊春的东北林蛙Rana dybowskii与哈尔滨的黑龙江林蛙Rana amu‑rensis肠道中的微生物群落格局存在显著差异。综上所述,两栖类肠道菌群结构的差异应为物种本身及环境因素共同作用的结果。在门级水平显示,中华蟾蜍肠道中疣微菌门丰度最高,中国林蛙肠道中厚壁菌门丰度最高。在属级水平中,仅中华蟾蜍肠道微生物中的阿克曼菌属高于中国林蛙,其他水平均显著低于中国林蛙。推测中华蟾蜍较低的肠道多样性与其发育完全相关,而疣微菌门和阿克曼菌属的高丰度与其高海拔环境及体重降低相适应。此外,中国林蛙肠道中变形菌门水平显著高于中华蟾蜍,同时在属级水平分析中发现,Haemophilus、肠杆菌属、Ralstonia和Anaero‑stignum等的丰度也较高,表明中国林蛙比中华蟾蜍带有更多的条件致病菌。水生动物肠道中存在大量的条件致病菌,对宿主健康造成潜在威胁。宋萍(2011)的研究表明,弧菌属Vibrio、气单胞菌属是水生动物肠道中的常见病原菌属。当受到外界压力时,中国林蛙肠道中的条件致病菌会大量增殖,然而这些致病菌的来源还需要进一步探究,但这些发现为中国林蛙细菌疾病的防治提供了参考。
本研究中,相较中国林蛙,中华蟾蜍肠道中的阿克曼菌属这一类群显著升高,占48.35%的高丰度。阿克曼菌是一种革兰氏阴性厌氧菌,它可以利用肠道黏蛋白作为唯一的碳源和氮源进行生长(Macchioneet al.,2019;Zhanget al.,2019),其主要代谢产物为丙酸,因此它与宿主的肠道屏障功能、免疫功能、营养吸收和疾病息息相关(赵凡,李春保,2017;Hagi & Belzer,2021)。韩伟等(2019)在人类蛋白组分析中得知,阿克曼菌可以降解胃肠道黏蛋白的酶,如糖苷酶、硫酸酯酶等,说明阿克曼菌在肠道菌群中扮演着重要角色。之前的研究发现,阿克曼菌具有恢复肠道屏障功能、抑制肠道病菌、减少内毒素败血症的作用(冯泽猛等,2016;Derrienet al.,2017)。推测中华蟾蜍肠道中检测到的高丰度阿克曼菌对于其肠道内的条件致病菌有一定的抑制作用。同时,阿克曼菌也与肥胖密切相关,肥胖或者超重的孩子肠道中阿克曼菌含量显著降低,相比之下,正常孩子肠道中的含量则保持了一个较高的水平,在小鼠实验中也得到了相似的结果(Wang,2021;Wanget al.,2022)。益生菌在水生动物生产中的应用越来越广泛,可作为添加剂以提高动物生长、免疫和抗病性,作为调水剂改善水质,但是非宿主来源的益生菌在使用过程中存在潜在风险,宿主来源的益生菌更值得关注和挖掘。鉴于阿克曼菌的丰富功能且较为稀缺,后续可基于培养组学的方法分离中华蟾蜍源阿克曼菌进行评估、基因组测序和动物实验,探究该种源在动物饲养保护上的应用,丰富我国益生菌资源。

