普济消毒饮抑制慢性化脓性中耳炎炎症反应
李若曼,林锡泽,叶海骥,郑慧珍
·药物研究·
普济消毒饮抑制慢性化脓性中耳炎炎症反应
李若曼1,林锡泽2,叶海骥3,郑慧珍2
1.温州市第七人民医院耳鼻咽喉科,浙江温州 325000;2.温州市人民医院耳鼻咽喉科,浙江温州 325006;3.文成县人民医院耳鼻咽喉科,浙江文成 325300
探讨普济消毒饮抑制慢性化脓性中耳炎炎症反应的作用。采用经鼓膜穿刺途径向鼓室注射铜绿假单胞菌的方法构建慢性化脓性中耳炎小鼠模型。建模成功后,左氧氟沙星组小鼠给予1mg/(kg·d)左氧氟沙星灌胃,普济消毒饮低、中、高剂量组小鼠分别给予2.9g/(kg·d)、5.8g/(kg·d)、11.6g/(kg·d)普济消毒饮浓缩液灌胃,模型组和对照组小鼠均予以等量生理盐水灌胃,每日1次,持续14d。左氧氟沙星和普济消毒饮低、中、高剂量均可减轻中耳黏膜组织病变;与模型组比较,左氧氟沙星组和普济消毒饮低、中、高剂量组小鼠的血清肿瘤坏死因子-α、白细胞介素(interleukin,IL)-6、IL-1β、γ干扰素水平降低(<0.05),Toll样受体4(Toll-like receptor 4,TLR4)、髓样分化蛋白88(myeloid differentiation protein 88,MYD88)、核因子-κB p65(nuclear factor-κB p65,NF-κB p65)基因表达和蛋白水平及磷酸化NF-κB p65降低(<0.05),上述指标均呈剂量依赖性。普济消毒饮可抑制慢性化脓性中耳炎炎症反应,可能与抑制TLR4/MYD88/NF-κB信号通路相关。
普济消毒饮;慢性化脓性中耳炎;Toll样受体4;炎症反应
慢性化脓性中耳炎是指微生物感染中耳黏膜、骨膜、骨质后引起的慢性化脓性炎症反应,是耳鼻喉科最常见的感染性疾病。慢性化脓性中耳炎多发于青少年,据统计该病在青少年中的发病率为0.2%[1]。目前,临床常采用药物抗感染治疗和手术治疗,尽管有一定疗效,但多数患者病情迁延不愈[2]。中医认为慢性化脓性中耳炎属“脓耳”范畴[3]。普济消毒饮出自《东垣试效方》,主要有清热解毒、疏风散邪的功效,已有报道表明普济消毒饮可改善慢性化脓性中耳炎机体炎症反应[4]。Toll样受体4(Toll-like receptor 4,TLR4)能够识别病原体相关分子模式,参与机体的炎症反应过程,TLR4信号通路激活可参与慢性化脓性中耳炎的炎症反应[5]。本研究探讨普济消毒饮介导TLR4信号通路调控慢性化脓性中耳炎炎症反应的作用与机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与菌株 60只C57BL/6J健康小鼠,无特定病原体(specific pathogen free,SPF)级,6~8周龄,雌雄各半,体质量18~22g,购自南方医科大学[许可证号:SCXK(粤)2021-0041,使用许可证号:SYXK(粤)2021-0167]。铜绿假单胞菌菌株(编号BMZ134736)购自中国典型培养物保藏中心。接种前12h制备成浓度1×106CFU/ml菌液,4℃冰箱保存备用。本研究经温州市第七人民医院实验动物伦理委员会批准(伦理审批号:202004-007)。
1.1.2 实验药材与试剂 中药材(均购自录建药业);盐酸左氧氟沙星(购自浙江京新药业股份有限公司,生产批号:14202451919);苏木精-伊红染色(hematoxylin and eosin staining,HE染色)试剂盒(购自上海懋康生物科技有限公司,生产批号:MM1013);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-1β和γ干扰素(interferon-γ,IFN-γ)检测试剂盒(购自上海极威生物科技有限公司,生产批号:JW-E12364、JW-E12359、JW-E12353、JW-E12363);TLR4、髓样分化蛋白88(myeloid differentiation protein 88,MYD88)、核因子κB p65(nuclear factor-κB p65,NF-κB p65)和甘油醛-3-磷酸脱氢酶(glyceraldehyde- 3-phosphate dehydrogenase,GAPDH)聚合酶链反应(polymerase chain reaction,PCR)引物(由苏州泓迅生物科技股份有限公司合成);兔抗鼠TLR4、MYD88、NF-κB p65、磷酸化NF-κB p65(phosphorylation NF-κB p65,p-NF-κB p65)、GAPDH单克隆抗体(一抗)、羊抗兔TLR4、MYD88、NF-κB p65、p-NF-κB p65、GAPDH辣根过氧化物酶标记多克隆抗体(二抗)(购自赛默飞,生产批号:2219S、ab135693、69994、3033、2188;31462、A16124、A16116、A16096、A16104)。
1.1.3 实验设备 JS-750T型光学显微镜(购自德国LIOO);FC型酶标仪(购自赛默飞);H1650R型高速冷冻离心机(购自上海卢湘仪离心机仪器有限公司);7500型PCR仪(购自美国ABI);PowerPacUniversal型电泳仪(购自美国伯乐)。
1.2 方法
1.2.1 普济消毒饮制备 普济消毒饮组方药材:黄芩15g、黄连15g、陈皮6g、生甘草6g、玄参6g、柴胡6g、桔梗6g、连翘3g、板蓝根3g、马勃3g、牛蒡子3g、薄荷3g、僵蚕2g、升麻2g,加水常规煎煮2次,去除药物残渣,浓缩为1g/ml生药[6]。
1.2.2 构建模型及验证 将60只C57BL/6J小鼠分为对照组(10只)和建模组(50只)。根据既往研究采用经鼓膜穿刺途径[7]构建慢性化脓性中耳炎小鼠模型。建模组小鼠麻醉后,双侧外耳道消毒;使用无菌注射器接半腰椎穿刺针,经鼓膜紧张部后下象限穿刺,向小鼠双侧耳鼓室注射1×106CFU/ml铜绿假单胞菌菌液100μl,每3d注射1次,共注射3次。HE染色观察小鼠中耳黏膜组织病理切片,取对照组和建模组小鼠双侧中耳黏膜组织,常规石蜡包埋切片(4μm);脱蜡脱水及水化,苏木精染色5min;伊红染色1min,脱透明,中性树胶封片,光学显微镜下观察建模组中耳黏膜组织较对照组增厚,且炎症细胞大量浸润,证明造模成功[8]。
1.2.3 分组及给药方法 将造模成功小鼠根据随机数字表法分组,左氧氟沙星组(10只)给予1mg/(kg·d)左氧氟沙星灌胃,普济消毒饮低、中、高剂量组(各10只)分别给予2.9g/(kg·d)、5.8g/(kg·d)、11.6g/(kg·d)普济消毒饮浓缩液灌胃;模型组(9只)和对照组(9只)均予以等量生理盐水灌胃,每日1次,持续14d。
1.2.4 血清TNF-α、IL-6、IL-1β、IFN-γ水平检测 给药结束后24h,脱颈处死各组小鼠,取腹主动脉血1.5ml,静置30min分离获取血清,根据试剂盒操作说明检测各组小鼠的血清TNF-α、IL-6、IL-1β、IFN-γ水平。
1.2.5 中耳黏膜组织病理观察 给药结束后24h,取左耳中耳黏膜组织,常规石蜡包埋切片(4μm),HE染色同上;光学显微镜观察各组中耳黏膜组织病理切片。
1.2.6 TLR4、MYD88、NF-κB p65基因表达检测 给药结束后24h,取各组小鼠右耳1/2中耳黏膜组织,提取总RNA,逆转录合成互补脱氧核糖核酸,PCR引物序列见表1。反应条件:95℃ 5min;94℃ 15s,55℃ 30s,70℃ 30s,40个循环。以2–ΔΔCt[9]表示目的基因的相对表达量。
1.2.7 TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平检测 给药结束后24h,取右耳剩余1/2中耳黏膜组织,加入裂解液,4℃ 12 000转/min(有效离心半径7.1cm)离心10min,收集上清即为总蛋白;BCA法检测蛋白浓度,调整蛋白浓度为5μg/μl;上样6μl,电泳,转膜,封闭,加一抗(稀释比例1∶500)4℃孵育过夜,洗涤,加辣根过氧化物酶标记二抗(稀释比例1∶2000),室温孵育1h,洗涤,显色5min,使用Image J分析蛋白条带灰度值。

表1 PCR所需引物序列
1.3 统计学方法
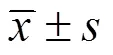
2 结果
2.1 建模结果
对照组小鼠的中耳黏膜组织无炎症细胞浸润;建模组小鼠的中耳黏膜组织可见大量炎症细胞浸润,见图1。
2.2 各组小鼠中耳黏膜组织病理切片
对照组小鼠中耳黏膜组织正常,无炎症细胞浸润;模型组小鼠中耳黏膜增厚,可见大量炎症细胞浸润;左氧氟沙星组和普济消毒饮低剂量组小鼠中耳黏膜增厚程度减弱,炎症细胞浸润减少;普济消毒饮中剂量组小鼠黏膜增厚程度进一步减弱,炎症细胞浸润进一步减少;普济消毒饮高剂量组小鼠中耳黏膜增厚及炎症细胞浸润基本消失,见图2。
2.3 各组小鼠的血清TNF-α、IL-6、IL-1β、IFN-γ水平比较
与对照组比较,模型组小鼠的血清TNF-α、IL-6、IL-1β、IFN-γ水平上升(<0.05);与模型组比较,左氧氟沙星组和普济消毒饮低、中、高剂量组小鼠的血清TNF-α、IL-6、IL-1β、IFN-γ水平降低(<0.05),且呈剂量依赖性,见表2。
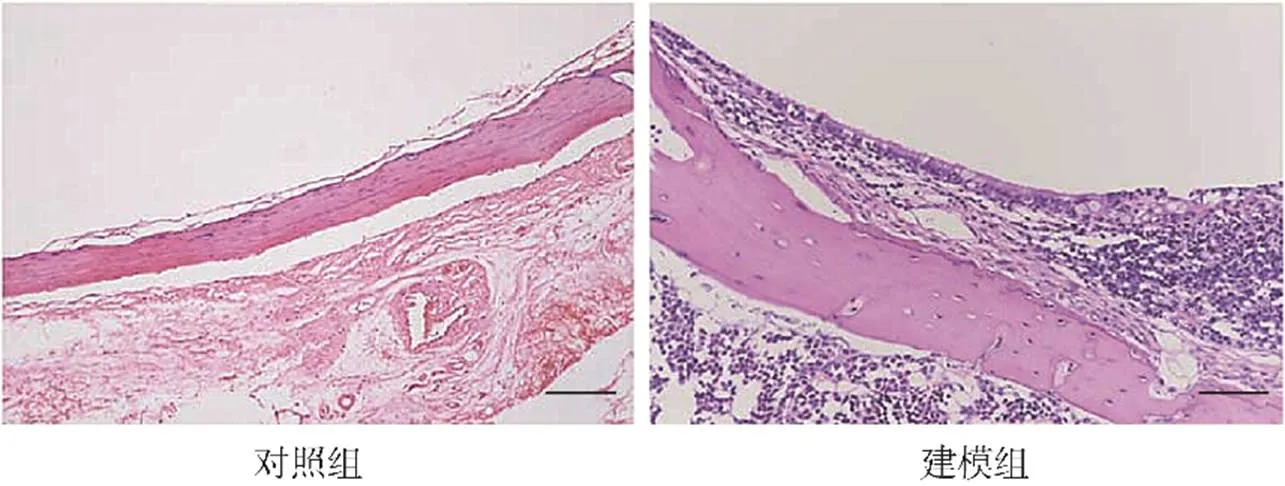
图1 小鼠中耳黏膜组织HE染色结果(×200,刻度尺:30μm)
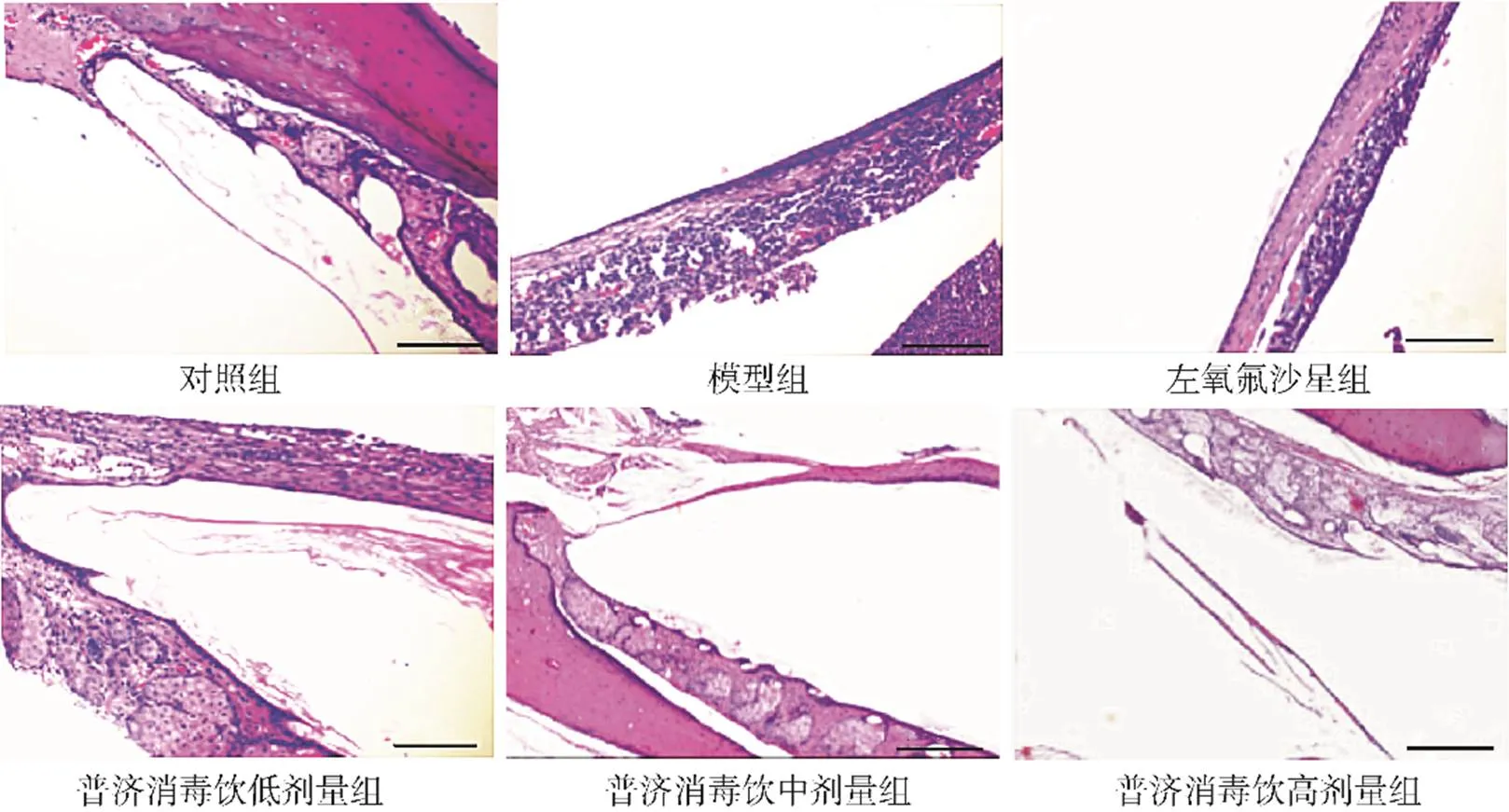
图2 各组小鼠中耳黏膜组织HE染色结果(×20,刻度尺:20μm)
2.4 各组小鼠的TLR4、MYD88、NF-κB p65基因表达比较
与对照组比较,模型组小鼠的TLR4、MYD88、NF-κB p65基因表达上调(<0.05);与模型组比较,左氧氟沙星组和普济消毒饮低、中、高剂量组小鼠的TLR4、MYD88、NF-κB p65基因表达下调(<0.05),且呈剂量依赖性,见表3。
2.5 各组小鼠的TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平比较
与对照组比较,模型组小鼠的TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平增加(<0.05);与模型组比较,左氧氟沙星组和普济消毒饮低、中、高剂量组小鼠的TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平下降(<0.05),且呈剂量依赖性,见图3、表4。
3 讨论
慢性化脓性中耳炎属中医学“脓耳”范畴。《诸病源候论·卷四十八》云:“耳,宗脉之所聚,肾气之所通。小儿肾脏盛,而有热者,热气上冲于耳,津液壅结,即生脓汁。”耳为肾窍,肾之精气亏虚,寒热之气循经上犯耳窍,津液困结而成脓耳。又如《丹溪心法·卷四》云:“热气乘虚随脉入耳,聚热不散,脓汁出,为之脓耳。”外感风热,上壅清窍,可致耳中流脓;故治疗上以祛除风热邪毒、补益正气、宣通脏腑为主要原则。

表2 各组小鼠血清TNF-α、IL-6、IL-1β、IFN-γ水平(,pg/ml)
注:与对照组比较,*<0.05;与模型组比较,#<0.05;与左氧氟沙星组比较,△<0.05;与普济消毒饮低剂量组比较,▲<0.05;与普济消毒饮中剂量组比较,※<0.05

表3 各组小鼠的TLR4、MYD88、NF-κB p65基因表达比较()
注:与对照组比较,*<0.05;与模型组比较,#<0.05;与左氧氟沙星组比较,△<0.05;与普济消毒饮低剂量组比较,▲<0.05;与普济消毒饮中剂量组比较,※<0.05
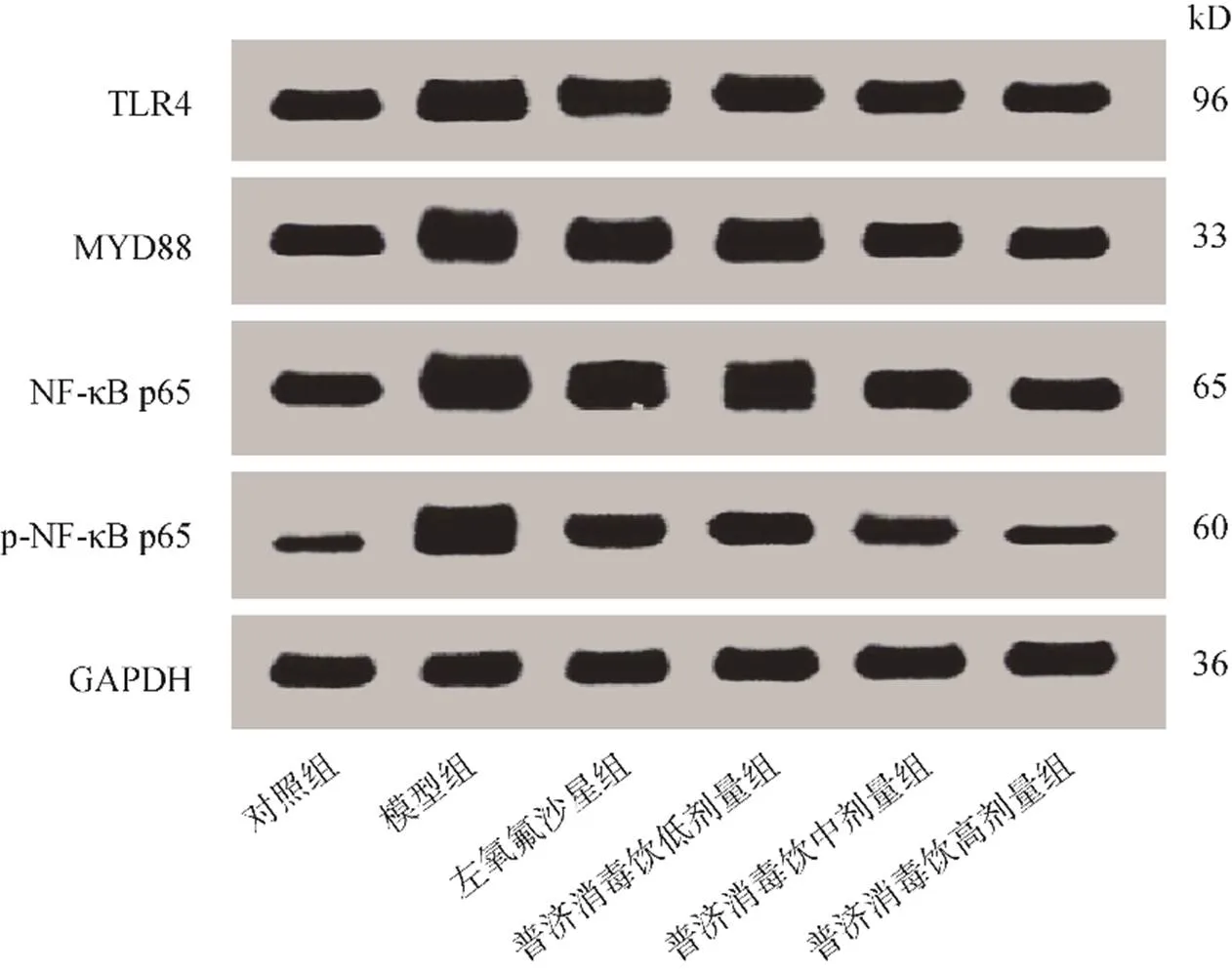
图3 各组小鼠的TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平

表4 各组小鼠的TLR4、MYD88、NF-κB p65蛋白表达及p-NF-κB p65水平比较()
注:与对照组比较,*<0.05;与模型组比较,#<0.05;与左氧氟沙星组比较,△<0.05;与普济消毒饮低剂量组比较,▲<0.05;与普济消毒饮中剂量组比较,※<0.05
本研究结果显示建模组小鼠中耳黏膜组织存在大量炎症细胞浸润,与既往研究病理情况一致[10],证明本研究成功构建慢性化脓性中耳炎模型。左氧氟沙星可有效治疗慢性化脓性中耳炎[11];因此本研究选取左氧氟沙星作为阳性药物,与普济消毒饮形成对照实验,确保研究的准确性和严谨性。本研究结果表明,普济消毒饮可抑制中耳黏膜组织增厚,减轻炎症因子浸润。普济消毒饮中黄芩、黄连共为君药,清热泻火、祛上焦头面热毒;牛蒡子、连翘、薄荷、僵蚕共为臣药,辛凉疏散头面风热;玄参、马勃、板蓝根加强清热解毒,配甘草、桔梗以清利咽喉,陈皮理气疏壅,以散邪热郁结,共为佐药;升麻、柴胡疏散风热,并引诸药上达头面,功兼佐使之用。诸药配伍,共奏清热解毒、疏散风热之功。研究表明普济消毒饮通过抗菌、抗炎作用发挥抑制慢性化脓性中耳炎炎症反应的功能[12]。
本研究结果表明,普济消毒饮可下调小鼠血清TNF-α、IL-6、IL-1β、IFN-γ水平,抑制中耳黏膜组织TLR4、MYD88、NF-κB p65 mRNA和蛋白表达,下调p-NF-κB p65水平。有报道指出慢性化脓性中耳炎患者的TNF-α、IL-6水平升高,对维持机体全身和局部炎症反应发挥重要作用[13]。TLR4识别微生物病原体相关分子后,可激活依赖性MYD88通路,活化的MYD88进一步激活NF-κB,进而促进促炎细胞因子转录,故TLR4/MYD88/NF-κB信号通路激活在炎症疾病发病过程中发挥重要作用[14]。罗伦才等[15]指出,通过抑制TLR4/MYD88/NF-κB信号通路,可下调IL-1β、IL-6、TNF-α水平,减弱中耳炎的炎症反应;Li等[16]认为抑制TLR4信号通路的激活能抑制分泌型中耳炎大鼠的炎症反应;Liu等[17]提出过表达TLR4后可促进中耳上皮细胞炎症反应。本研究结果与上述结论一致,提示普济消毒饮可通过抑制TLR4/MYD88/NF-κB信号通路,下调p-NF-κB p65、TNF-α、IL-6、IL-1β、IFN-γ水平,发挥抑制慢性化脓性中耳炎炎症反应的作用。
综上所述,普济消毒饮可通过抑制TLR4/MYD88/ NF-κB信号通路,下调TNF-α、IL-6、IL-1β、IFN-γ水平,发挥抑制慢性化脓性中耳炎炎症反应的作用。
[1] PEDERSEN C K, ZIMANI P, FRENDØ M, et al. Chronic suppurative otitis media in Zimbabwean school children: A cross-sectional study[J]. J Laryngol Otol, 2020, 1–5.
[2] MAHDIANI S, LASMININGRUM L, ANUGRAH D. Management evaluation of patients with chronic suppurative otitis media: A retrospective study[J]. Ann Med Surg (Lond), 2021, 67: 102492.
[3] 乔植, 史军, 陈晨, 等. 基于数据挖掘的国医大师干祖望治疗慢性化脓性中耳炎用药规律研究[J]. 湖南中医药大学学报, 2021, 41(12): 1830–1834.
[4] 封辉, 马晓军. 普济消毒饮加味治疗慢性化脓性中耳炎疗效及对听力和炎症反应的影响[J]. 现代中西医结合杂志, 2021, 30(3): 293–296.
[5] TUOHETI A, GU X, CHENG X, et al. Silencing Nrf2 attenuates chronic suppurative otitis media by inhibiting pro- inflammatory cytokine secretion through up-regulating TLR4[J]. Innate Immun, 2021, 27(1): 70–80.
[6] 黎同明, 王桂香, 全世建. 普济消毒饮对小鼠免疫功能的影响[J]. 广州中医药大学学报, 2005, 22(2): 141–143.
[7] KHOMTCHOUK K M, KOUHI A, XIA A, et al. A novel mouse model of chronic suppurative otitis media and its use in preclinical antibiotic evaluation[J]. Sci Adv, 2020, 6(33): eabc1828.
[8] KHOMTCHOUK K M, JOSEPH L I, KHOMTCHOUK B B, et al. Treatment with a neutrophil elastase inhibitor and ofloxacin reduces P. aeruginosa burden in a mouse model of chronic suppurative otitis media[J]. NPJ Biofilms Microbiomes, 2021, 7(1): 31.
[9] KUMAR A, LORAND D. Robust ΔΔct estimate[J]. Genomics, 2021, 113(1 Pt 1): 420–427.
[10] ABDEL-RAZEK O, LIU T, CHEN X, et al. Role of surfactant protein D in experimental otitis media[J]. J Innate Immun, 2021, 13(4): 197–210.
[11] 李新建, 刘明波, 刘军, 等. 海南地区慢性化脓性中耳炎患者术前病原菌培养结果分析[J]. 中华耳科学杂志, 2020, 18(3): 494–497.
[12] 路广义, 郭洁. 普济消毒饮对化脓性链球菌的体外抑菌作用[J]. 中国中医基础医学杂志, 2014, 20(9): 1288, 1305.
[13] ARTONO, SURARTO B, PURNAMI N, et al. The association of IL-1 alpha level and TNF alpha expressions on bone destruction in chronic suppurative otitis media and cholesteatoma[J]. Indian J Otolaryngol Head Neck Surg, 2020, 72(1): 1–7.
[14] WU L, DU L, JU Q, et al. Silencing TLR4/MyD88/ NF-κB signaling pathway alleviated inflammation of corneal epithelial cells infected by ISE[J]. Inflammation, 2021, 44(2): 633–644.
[15] 罗伦才, 童妍, 张兴国, 等. 基于TLR4/MyD88/NF-κB通路研究愈疡胶囊抗中耳炎的作用[J]. 西北药学杂志, 2021, 36(1): 66–71.
[16] LI T, ZENG W, LIU R. Effect of erdosteine on middle ear effusion in rats by mediating TLR4 signaling pathway[J]. Biomed Res Int, 2021, 2021: 9968907.
[17] LIU Z, LU T, LIU S, et al. Long non-coding RNA NEAT1 contributes to lipopolysaccharide-induced inflammation and apoptosis of human middle ear epithelial cells via regulating the miR-301b-3p/TLR4 axis[J]. Exp Ther Med, 2021, 22(6): 1360.
Pujixiaodu decoction inhibits inflammatory reaction of chronic suppurative otitis media
LI Ruoman, LIN Xize, YE Haiji, ZHENG Huizhen
1.Department of Otolaryngology, Wenzhou Seventh People’s Hospital, Wenzhou 325000, Zhejiang, China; 2.Department of Otolaryngology, Wenzhou People’s Hospital, Wenzhou 325006, Zhejiang, China; 3.Department of Otolaryngology, Wencheng County People’s Hospital, Wencheng 325300, Zhejiang, China
To investigate the effect of Pujixiaodu decoction on inhibiting inflammatory reaction of chronic suppurative otitis media.Models of chronic suppurative otitis media were established by injecting Pseudomonas aeruginosa into the tympanic cavity via tympanic membrane puncture. After successful modeling, levofloxacin group was given 1mg/ (kg·d) levofloxacin by gavage, the low, medium and high dose Pujixiaodu decoction groups were given 2.9g/ (kg·d), 5.8g/ (kg·d) and 11.6g/ (kg·d) concentrated Pujixiaodu decoction by gavage, respectively, model group and control group were given the same amount of normal saline by gavage, once a day for 14 days.Levofloxacin and low, medium and high dose Pujixiaodu decoction can reduce the pathological changes of middle ear mucosa. Compared with model group, serum tumor necrosis factor-α, interleukin (IL) -6, IL-1β and interferon-γ levels of mice in levofloxacin group and low, medium and high dose Pujixiaodu decoction groups decreased (<0.05), Toll-like receptor 4 (TLR4), myeloid differentiation protein 88 (MYD88), nuclear factor-κB p65 (NF-κB p65) gene expression and protein level and phosphorylation NF-κB p65 decreased (<0.05). The above indexes were dose dependent.Pujixiaodu decoction can inhibit the inflammatory response of chronic suppurative otitis media, which may be related to inhibition TLR4/MYD88/NF-κB signaling pathway.
Pujixiaodu decoction; Chronic suppurative otitis media; Toll-like receptor 4; Inflammatory response
R289;R276.1
A
10.3969/j.issn.1673-9701.2023.19.019
温州市科研项目(Y20201007)
郑慧珍,电子信箱:devil888999123@163.com
(2022–09–29)
(2023–06–19)

