不同类型藜麦萌发期抗旱性差异分析及萌发进程模型拟合
朱丽丽, 张业猛, 张发玉, 陈志国
(1.中国科学院西北高原生物研究所, 西宁 810008; 2.中国科学院大学生命科学学院, 北京 100049;3.海西州农牧业技术推广服务中心, 青海 德令哈 817099;4.中国科学院高原生物适应与进化重点实验室, 西宁 810008;5.青海省作物分子育种重点实验室, 西宁 810008)
干旱是主要的气候灾害之一,其出现频率高、持续时间长、波及范围广且后续影响大。而全球变暖进一步导致高温、干旱等极端天气的发生频率与强度增加。干旱造成的农作物减产非常严重,远大于其他因素导致产量损失的总和,在所有非生物胁迫中占首位。在我国,干旱的发生频率高达79.21%,每年旱灾面积约占全国播种总面积的14.6%,对国民经济特别是农业生产危害巨大[1]。另外,我国耕地资源缺乏且耕地面积持续下降,40%的干旱和半干旱地区耕地不同程度的沙漠化,水土流失面积严重扩大。因此,选择和培育优良的耐旱品种不仅能有效降低干旱对农业生产造成的损失,也是提升旱作土地利用率的重要保证[2-3]。
藜麦(ChenopodiumquinoaWilld.)作为一种新型粮食作物,对土壤贫瘠、干旱等逆境有较好的耐受性,是具有重要发展潜力的农作物之一,已经被越来越多的地区引种推广。我国是除原产国以外藜麦种植面积最大的国家[1]。对于大多数植物来说,种子萌发阶段是整个生活周期中最不耐受环境胁迫的时期,种子萌发期耐旱性强弱可以在一定程度上反映该植物的耐旱性[4]。因此,在藜麦萌发期筛选耐旱品种,对后期提高藜麦产量与品质非常关键。
在长期的进化过程中,耐旱植物会形成一些特殊的形态结构以减少水分丢失,从而适应干旱环境。此外,在生理上,植物还可通过渗透调节、抗氧化防御系统等措施来抵抗干旱环境胁迫。可以看出,植物的耐旱性是一个复杂的过程,应该采用多指标综合评价。同时,分析这些指标的变化对理解不同品种的耐旱特征、对比不同指标耐旱能力的指示作用具有重要意义[5-6]。PEG-6000模拟干旱胁迫是筛选耐旱植物的重要方法,具有操作简便、节约成本和实验周期短等优点,在其他植物抗旱品种筛选中被广泛应用,但关于干旱胁迫对藜麦种子萌发造成的影响及不同藜麦品种耐旱性比较研究报道较少[7-10]。
本研究利用PEG-6000溶液在藜麦籽粒萌发期模拟干旱胁迫,结合其形态和生理指标,对不同类型藜麦萌发期抗旱性进行综合评价,为藜麦抗旱性研究提供科学依据和理论参考。
1 材料与方法
1.1 试验材料与方法
本实验以5个藜麦品种为材料,青藜1号和雪藜为白粒藜麦,柴达木红和青海红为红粒藜麦,黑藜为黑粒藜麦,千粒重依次为黑藜(3.91 g)>青藜1号(3.86 g)>青海红(3.44 g)>柴达木红(3.35 g)>雪藜(3.13 g)。
采用PEG-6000溶液模拟干旱胁迫,设置6个PEG-6000浓度梯度(5%,10%,15%,20%,25%和30%),以蒸馏水为对照。挑选籽粒饱满、大小均匀、无病虫害且无机械损伤的种子,用0.3% NaClO消毒10 min后,再用蒸馏水反复冲洗5次,置于消过毒的发芽盒内(20 cm×14 cm)。每个发芽盒铺2张发芽纸,将10 mL不同浓度梯度胁迫液分别倒入发芽盒,每个发芽盒放置150粒种子,3次重复。标记好发芽盒,恒温培养,培养箱(LRX-350 D-LED冷光源低温人工气候箱,宁波普朗特仪器有限公司)条件:光照25 ℃ 16 h/黑暗20 ℃ 8 h,湿度70%。第2天开始记录种子萌发情况,每天适量补充相应浓度的胁迫溶液,以保证发芽床湿润,第8天结束种子萌发。
1.2 测定方法
1) 萌发指标测定:第2天起记录发芽种子数(由于藜麦极易发芽,以胚根长≥2 mm为萌发标准)[1-2]。
发芽率/%=(第8天发芽种子数/供试种子总数)×100%;
发芽势/%=(第3天发芽种子数/供试种子总数)×100%;
基于上述分析,增大直流电容可改善系统稳定性,从控制上引入虚拟电容,在不改变原电路的基础上起到等效电容增大的效果[13-14]。
发芽指数(GI)=∑(Gt/Dt),式中:Gt为时间t内的发芽数,Dt为相应的发芽天数;
活力指数(VI)=S×GI,S为第8天正常幼苗平均鲜重;
萌发耐旱指数(GDRI)=水分胁迫下种子萌发指数(PIS)/对照种子萌发指数(PIC),PI=1.0 Rd2+0.75 Rd4+0.5 Rd6+0.25 Rd8,Rd2、Rd4、Rd6、Rd8分别指第2,4,6,8天的种子萌发率。
种子萌发结束后,每个处理随机选取10株幼苗,用直尺测量幼苗长度,电子分析天平称量幼苗鲜重,计算根长、芽长和鲜重。根长:根和芽接点处到最长根尖的长度;芽长:子叶与根之间的长度;鲜重:种子的胚根和胚芽以及幼叶部分的重量,不包括种子生根发芽后脱落的种皮部分。
2) 生理指标测定:超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、脯氨酸(Pro)含量、可溶性糖(SS)含量、可溶性蛋白(SP)含量。采用试剂盒微量法进行检测,试剂盒从生工生物工程(上海)股份有限公司购买,检测方法和计算方法参考试剂盒说明书操作。
3) 为消除不同藜麦品种遗传背景差异,利用各指标的相对值进行综合评价。
各指标相对值/%=(胁迫处理的指标值/对照的指标值)×100%[11-13]。
1.3 数据分析方法
采用Excel 2003软件进行数据处理与统计,SPSS 23.0软件进行主成分分析,Graphpad Prism 8.0.2软件对Logistic方程Y=A/(1+Be-CX)进行曲线拟合和作图,式中:Y为发芽率,A为最大发芽率,X为胁迫时间,B、e和C为常数[14-17]。采用模糊数学隶属函数评估法进行综合评价[18]。
2 结果与分析
2.1 不同程度干旱胁迫对藜麦种子萌发进程的影响
在正常及干旱条件下,藜麦种子发芽率随时间的增加呈“慢-快-慢”的“S”型增长方式,与Logistic方程有较好的拟合度(表1)。从图1可以看出,不同干旱程度对藜麦种子萌发率及萌发进程有较大影响。当干旱程度较低的情况下(PEG-6000浓度为5%,10%和15%),藜麦种子萌发起步早,发芽率高且达到饱和所需的时间较短。当干旱程度不断增加时(PEG-6000浓度为20%和25%),萌发所需时间也逐渐延长,发芽率开始逐渐降低。当PEG-6000浓度为30%时,除黑藜有种子萌发外,其他参试品种均不能萌发。

图1 干旱胁迫对藜麦种子萌发的影响Fig.1 Effect of drought stress on seed germination of quinoa

表1 种子发芽率Logistic方程拟合度Table 1 Fitting degree of Logistic equation of seed germination rate
2.2 不同程度干旱胁迫对藜麦种子萌发的影响
种子的发芽能力会随胁迫条件发生变化,发芽率和发芽势是反映种子发芽能力的主要指标,发芽指数反映幼苗的生长情况,活力指数是对种子发芽速率和生长量的综合反映[19]。植物种子转化为幼苗所需的物质和能量由种子中贮藏的有机物提供,因此幼苗长度和鲜重能够体现种苗转化状况[20]。由表2可知,低浓度的PEG-6000对藜麦种子萌发具有促进作用,超过适宜浓度范围才会抑制其萌发。但由于品种间基因型差异,5个藜麦品种萌发期形态指标在胁迫条件下的变化略有不同,说明不同品种对干旱胁迫的适应方式不尽相同。
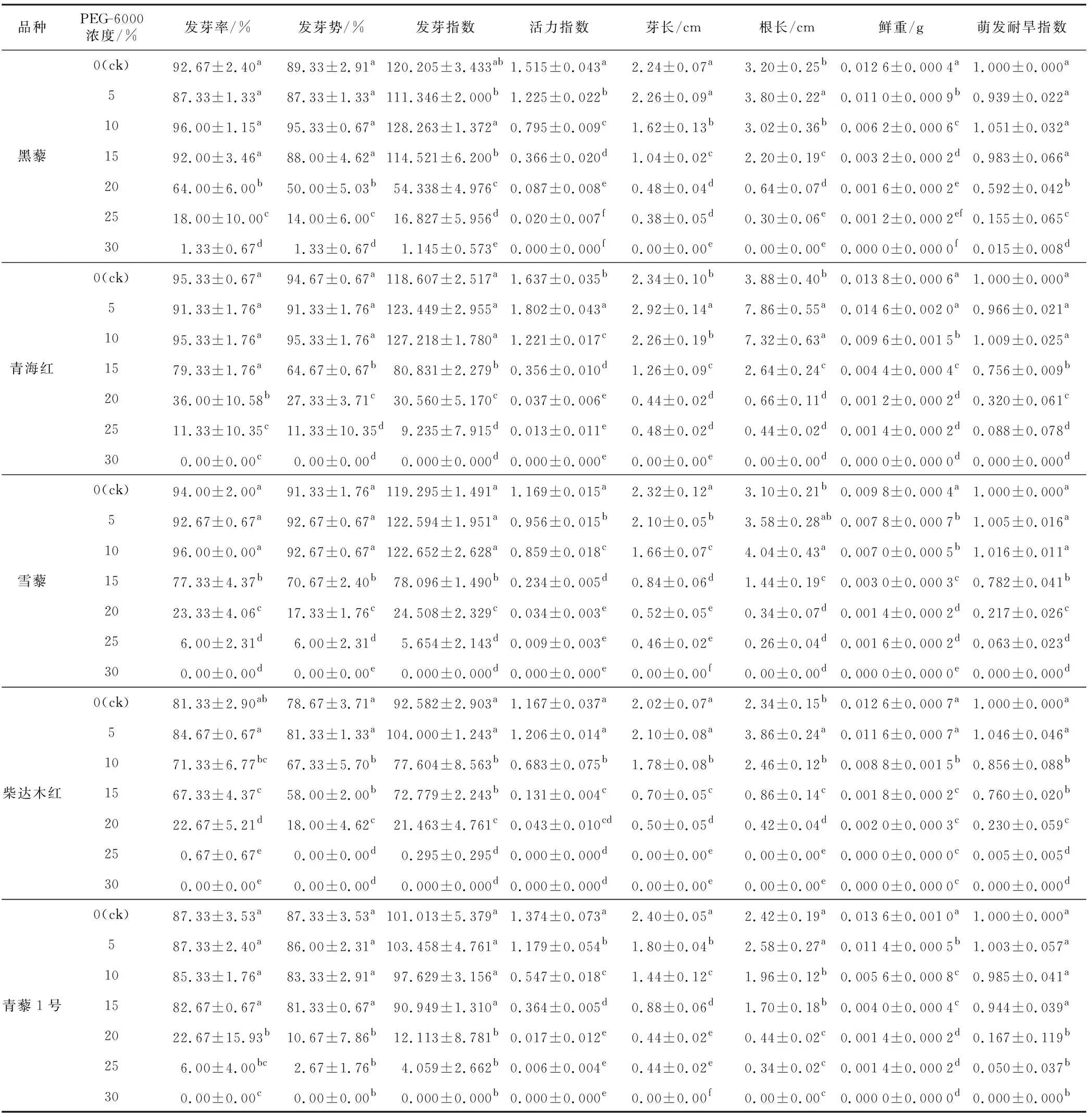
表2 不同PEG-6000浓度下藜麦种子萌发指标Table 2 Germination indexes of quinoa seeds under different PEG-6000 concentrations
从统计结果来看,黑藜、青海红和雪藜发芽率在PEG-6000浓度为10%时达到最大值。其中黑藜和青海红发芽势与发芽率变化一致,雪藜发芽势在PEG-6000浓度为5%时即为最大值,与10%时相等;柴达木红发芽率与发芽势在PEG-6000浓度为5%时达到最大值;青藜1号发芽率在PEG-6000浓度为5%时与对照保持一致,但发芽势略有下降。可以看出,不同藜麦品种的发芽能力对干旱程度的耐受阈值差异较大。
随着干旱胁迫增强,黑藜和柴达木红发芽指数在PEG-6000浓度为5%时有突然降低现象,而后才逐渐升高;青海红、雪藜和青藜1号发芽指数呈逐渐升高趋势;5个藜麦品种各自的发芽指数与其发芽率和发芽势达到最大值时的PEG-6000浓度一致。黑藜、雪藜和青藜1号活力指数呈逐渐降低趋势,而青海红和柴达木红活力指数在PEG-6000浓度为5%时较对照有所升高,然后再逐渐降低。这是由于其根长在PEG-6000浓度为5%时比对照显著升高,鲜重也随之升高。黑藜、青海红和柴达木红芽长均在PEG-6000浓度为5%时有所升高,然后再逐渐降低,而雪藜和青藜1号芽长随PEG-6000浓度的升高逐渐降低。与芽长相比,干旱环境对藜麦种子根长的影响较为明显:黑藜和青藜1号在PEG-6000浓度为5%时达到最大,随后逐渐降低,青海红、雪藜和柴达木红在PEG-6000浓度为5%和10%时其根长均高于对照。
整体来看,所有参试品种的萌发耐旱指数随胁迫程度增加而逐渐降低,但与对照呈显著差异时的干旱程度各不相同。在PEG-6000浓度为20%时,黑藜和青藜1号萌发耐旱指数与对照有显著差异,青海红和雪藜在PEG-6000浓度为15%时与对照有显著差异,柴达木红在PEG-6000浓度为10%时与对照有显著差异。5个藜麦品种在PEG-6000浓度为30%时,萌发耐旱指数均达到最低,且除黑藜外均为0。
2.3 藜麦萌发期干旱处理幼苗生理指标的变化
植物在遭受逆境胁迫时,体内会产生大量的活性氧,对细胞结构与功能造成损伤,从而抑制植物生长。但植物自身会通过抗氧化酶和渗透调节物质等防御系统来维持机体的稳定[21]。图2显示,试验品种抗氧化酶系统变化趋势并不一致。随PEG-6000浓度升高,SOD活性和POD活性逐渐下降,其中POD活性在PEG-6000浓度为20%时突然大幅降低,可能此时的胁迫程度已对POD造成严重抑制,使其失去活性。CAT活性随胁迫增强呈先升后降的趋势,但不同藜麦品种达到峰值时的PEG-6000浓度有差异:黑藜和柴达木红在PEG-6000浓度为25%时达到最大值,青海红、雪藜和青藜1号在PEG-6000浓度为15%时达到最大值。

图2 萌发期干旱处理藜麦幼苗生理指标变化Fig.2 Changes of physiological indexes of quinoa seedlings under drought treatment during germination
渗透调节物质在植物抗逆境过程中起重要作用。5个藜麦品种MDA、Pro、SS和SP等参与渗透调节物质的含量都随胁迫增强而先升后降,但品种间变化仍有差异。膜系统是干旱对植物体最初伤害的部位,主要表现为膜脂过氧化增强、细胞膜透性增大,而MDA含量能够反映膜脂过氧化程度,间接反映植物耐旱能力的强弱[5]。在逆境胁迫下,植物体内MDA会大量累积,破坏细胞结构,MDA含量越高,对细胞损伤就越重,耐旱性也越弱[2]。本研究中,黑藜MDA含量在PEG-6000浓度为15%时达到最大值,青海红和柴达木红的在PEG-6000浓度为25%时达到最大值,雪藜和青藜1号的在PEG-6000浓度为20%时达到最大值。当PEG-6000浓度为30%时,MDA含量降低,可能是因为胁迫破坏了其在细胞内的稳态。SS、SP和Pro含量为常用的抗旱筛选指标,其中Pro是植物抵抗渗透压胁迫的一个重要因素,SP和SS可以提高植物在干旱条件下的保水能力,对细胞的生命物质及生物膜起到保护作用。从SS含量的变化来看,黑藜、柴达木红和青藜1号在PEG-6000浓度为10%时达到最大值,青海红在PEG-6000浓度为25%时达到最大值,雪藜在PEG-6000浓度为15%时达到最大值。从SP含量来看,黑藜、青海红和雪藜在PEG-6000浓度为10%时达到最大值,柴达木红在PEG-6000浓度为15%时达到最大值,青藜1号在PEG-6000浓度为20%时达到最大值。据研究,正常情况下,植物体内Pro含量处于较低水平,而一旦受到胁迫,Pro含量会成倍增加以减轻逆境对植物的伤害[22]。根据Pro含量分析结果,黑藜、雪藜、柴达木红和青藜1号都在PEG-6000浓度为15%时达到最大值,青海红在PEG-6000浓度为25%时达到最大值。抗氧化酶系统和渗透调节物质在品种间变化差异可以看出,不同品种在生理层面上对干旱胁迫的响应机制不同。
2.4 藜麦幼苗耐旱性主成分分析
种子萌发期耐旱性是多种因素相互作用的复杂性状,各指标不仅存在重叠现象,而且在综合评价中所占比重也不均等,因此采用单一指标进行评价难以全面反映植物的耐旱能力。主成分分析能够消除指标间信息重叠带来的干扰,从多个测定指标中提取出包含大多数主要性状的因子,并得出这些主要性状所占权重,因此评价结果也较为客观[14,20]。
通过对参试品种在干旱胁迫下的13个形态指标及生理指标进行主成分分析,根据特征值大于1的原则,提取2个主成分,其贡献率分别为61.997%和15.636%,累积贡献率为77.633%。说明这2个主成分包含了干旱胁迫下13个测定指标的绝大多数信息,可以用来对5个藜麦品种的萌发期抗旱性进行综合评价(表3)。

表3 干旱胁迫下各测定指标主成分分析及权重值Table 3 Principal component analysis and weight value of each index under drought stress
2.5 藜麦幼苗耐旱性综合评价
通过模糊数学隶属函数法对参试品种13个测定指标的相对值进行综合分析,从而对其萌发期耐旱性强弱进行评价。由于各指标在耐旱性评价中所占比重差异较大(表3),若根据平均隶属函数值对5个藜麦品种进行耐旱性比较,结果并不可靠。因此本研究将指标权重考虑在内,通过加权隶属函数值(平均隶属函数值与各指标权重的乘积)对参试材料耐旱性强弱进行排序为黑藜>白藜>红藜(表4)。
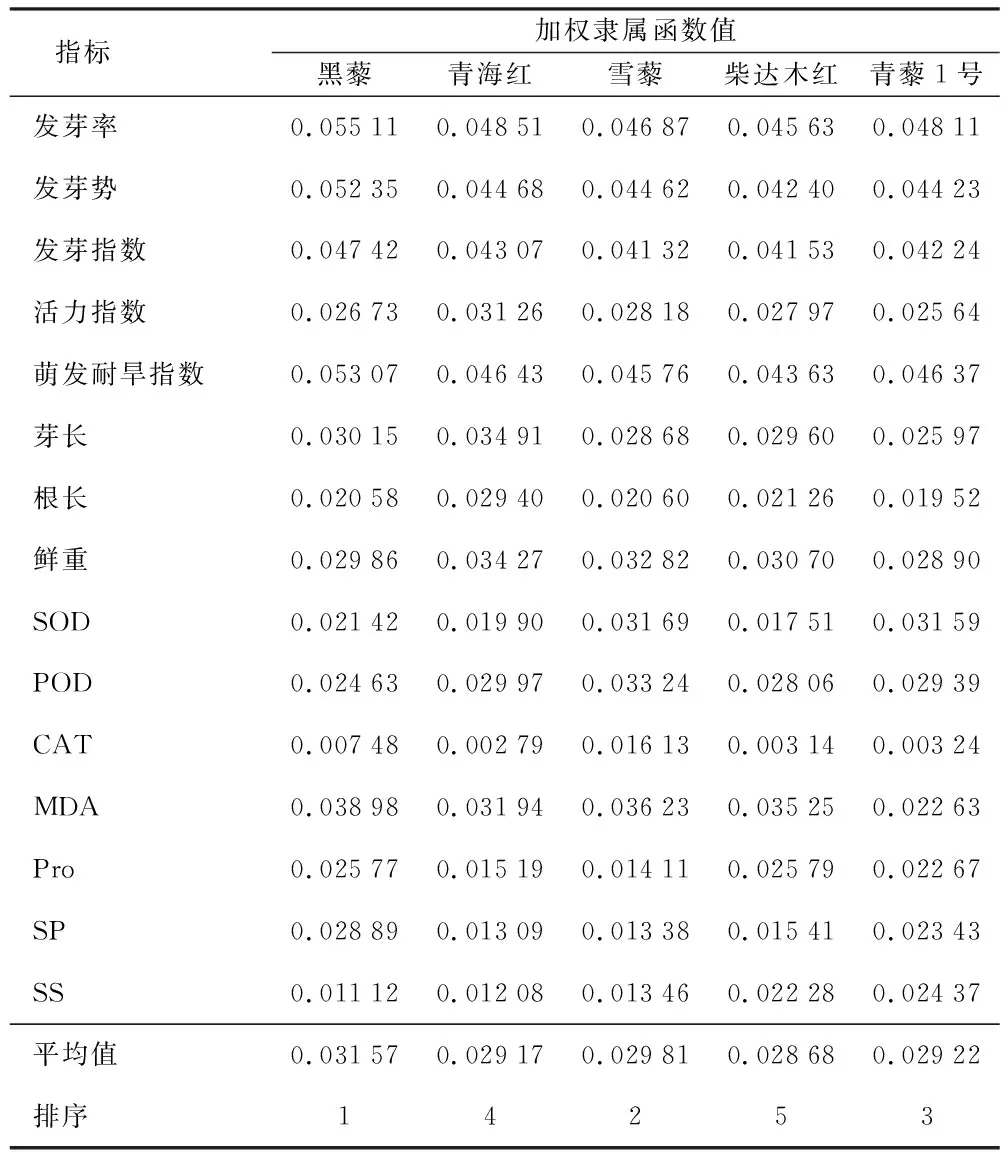
表4 耐旱系数隶属函数值及抗旱性综合评价Table 4 Membership function value of drought tolerance coefficient and comprehensive evaluation of drought resistance
3 讨论与结论
种子萌发是植物生长周期的起点,水分是种子萌发的第一要素。在自然条件下,植物种子在萌发期遇到干旱胁迫时,其耐旱能力的强弱是决定出苗数量和能否发育成健壮植株的关键,对种子萌发期耐旱性研究具有重要意义[23]。
有学者对植物在逆境条件下的电导率、发芽率等进行了Logistic方程拟合,拟合结果较好[16-17,24-25]。因此,本研究对干旱胁迫条件下的藜麦发芽率进行Logistic曲线拟合,发现所有参试品种发芽率随时间延长呈“S”型曲线变化,拟合度较好,能够反映不同浓度PEG-6000对种子萌发进程的影响。
形态变化是植物遭受逆境胁迫时最直接的反映。发芽率、发芽势、芽长和根长及幼苗重量是植物在胁迫条件下变化最明显的性状[26]。本次实验中,低浓度的PEG-6000(5%和10%)对藜麦萌发期形态指标具有促进作用,随着浓度升高,抑制作用逐渐增强,甚至导致种子不能萌发,这与前人[12-13,26]的研究结果一致。在植物形态建成期,非生物胁迫会使生物进程发生改变,并产生过量的活性氧,最终导致细胞内稳态的破坏,进而导致细胞死亡。为了维持其正常生长,植物会激活几种策略来清除多余的活性氧,也会产生SS、SP和Pro等渗透调节物质来保持适当的渗透势。研究表明,藜麦作为一种盐生植物,具有强大的构成型抗氧化防御系统,能够减轻盐或干旱胁迫下的氧化损伤[27-28]。干旱对抗氧化酶的影响因植物而异。王智威等[29]、高桐梅等[30]研究表明,玉米、芝麻中的SOD、POD和CAT等抗氧化酶对外界环境比较敏感,在胁迫下会升高。曹奕璘等[5]对苔藓的研究发现,随着干旱胁迫时间的推移,SOD和POD活性呈逐渐下降趋势。本研究中,适当的干旱促进CAT活性升高,当胁迫继续增强,CAT活性开始下降,而SOD和POD活性一直呈下降趋势。这可能是因为本实验参试品种抗旱性较强,没有产生过多的H2O2。由于抗氧化酶之间的互补性,少量的H2O2被CAT清除。MDA、SS、SP和Pro是植物体内重要的渗透调节物质。MDA含量能够反映细胞膜脂氧化程度,SS、SP和Pro使细胞保持较高的水势、增强细胞的吸水能力及保护细胞脱水[29]。实验表明,以上参与渗透调节的物质含量随胁迫增强而先升高后降低,与前人[28-30]的研究结果一致。
一方面,由于基因型的差异,不同类型藜麦品种籽粒耐旱机制有所不同,单项指标不能有效准确地判定品种间的耐旱性差异[31-32]。另一方面,不同干旱胁迫条件下的各指标变化有所不同。因此,必须结合多指标进行综合评价,才能客观和全面地比较不同类型藜麦品种间的耐旱性。主成分分析和模糊数学隶属函数法是目前被运用较多的综合评价方法,在多指标鉴定研究中,二者结合分析更为客观全面。所以,本研究先对藜麦萌发期形态指标和生理指标进行主成分分析并计算指标权重,再结合隶属函数法,以加权隶属函数平均值对3类藜麦品种籽粒萌发期抗旱性强弱进行排序。一般来说,千粒重高、籽粒大的种子长势比较好,籽粒所含水分和养分相对较多,自身抗逆性较强。本研究最终得到的参试品种抗旱性排序与千粒重高低基本相符。推测藜麦抗旱性与籽粒大小关系密切,其作用机制有待深入研究。
尽管种子萌发期耐旱性强弱可以在一定程度上反映品种的耐旱性,但耐旱性是一个非常复杂的现象,可表现在生长发育的各个阶段,不同生长阶段对干旱胁迫的反应存在差异。因此,对耐旱性的鉴定不能仅仅局限在某一个时期[33-34]。本研究只初步分析了干旱胁迫对藜麦萌发期的影响,而其他生长发育时期的抗旱表现还需要进一步探讨。

