辣蓼中性多糖单糖组成分析、抗小鼠大肠杆菌性腹泻作用及其分子机制
黎雨菲,罗露香,姜晓琳,黄嘉欢,张铭儒,杨全,程轩轩
(广东药科大学中药学院国家中医药管理局岭南药材生产与开发重点研究室,国家中药材产业技术体系广州综合试验站,广东省南药规范化种植与综合开发工程技术研究中心,广东 广州 510006)
腹泻是一种临床常见的消化道疾病。近年来,全球疾病、损伤和风险因素负担研究(Global Burden of Diseases,Injuries,and Risk Factors Study)分析数据显示,腹泻是造成<5 岁幼童死亡的第5 大病因[1]。从病因学方面,腹泻可分为感染性腹泻和非感染性腹泻两大类[2]。感染性腹泻可由细菌、病毒和寄生虫等病原微生物引发,在细菌性腹泻中大肠杆菌(Escherichia coli,E.coli)是发展中国家最常见的病原菌[2-6]。根据不同的生物学特性可将腹泻性大肠杆菌分为肠致病性大肠杆菌、产肠毒素大肠杆菌、肠侵袭性大肠杆菌、肠出血性大肠杆菌、肠黏附性大肠杆菌和肠凝集性大肠杆菌[7-8]。这些大肠杆菌诱导腹泻的途径相似,即黏附于宿主细胞并定植,进而破坏细胞骨架,释放促炎细胞因子和趋化因子,募集活化炎症细胞[7]。大肠杆菌性腹泻是一种人畜共患病,临床上多使用庆大霉素和土霉素等抗生素进行治疗。然而,抗生素不合理应用引发的细菌耐药性、不良反应及药源性疾病日趋严重[6,9]。在限制抗生素使用的情况下,采用中草药治疗感染性疾病日益受到关注[10]。中草药具有多来源、多成分、多靶点等特点,不易产生耐药性。多糖是一类广泛存在于植物中的天然高分子化合物,低毒或无不良反应,具有免疫调节活性,已成为药物开发及畜牧养殖领域的研究热点[10]。
辣蓼为蓼科植物水蓼(Polygonum hydropiperL.)的全草,具有祛风利湿、散瘀止痛和杀虫等功效,主要用于治疗腹泻、胃肠炎、痢疾、跌打损伤、疮疥和湿疹等症[11]。现代药理学研究表明,辣蓼提取物在体外对病原细菌(如粪肠球菌、肺炎克雷伯杆菌、大肠杆菌等)和真菌(如烟曲霉、黄曲霉、黑曲霉等)表现出广谱抗菌活性[12];可通过增加抗氧化能力、抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、NF-κB信号通路缓解肠道炎症[13-14];还具有镇痛、清除自由基、降血糖、镇静和驱虫等药理活性[15]。本课题组前期研究发现,辣蓼水提液能抑制大肠杆菌性腹泻小鼠肠组织炎症因子的释放,促进受损肠黏膜修复,进而通过活性追踪和导向分离初步确定中性多糖(neutral polysaccharide fromP.hydropiper,NPP)是辣蓼抗腹泻的药效物质基础,但作用机制尚不明确[16]。文献报道,药物抗腹泻作用机制主要包括调节水和电解质平衡、调节炎症因子及其相关信号通路、干预胃肠激素分泌、促进肠黏膜修复、改善肠道微生态和增强免疫力等[2,17-20]。转录组学是一门在整体水平上研究特定时空某一细胞中基因转录的情况及转录调控规律的学科。利用转录组学技术研究疾病的分子机制,构建基因调控网络已成为医药学研究领域的热点[21-22]。本研究基于高通量转录组测序技术探讨NPP 对大肠杆菌性腹泻小鼠十二指肠组织基因表达谱的影响,从转录组学水平揭示NPP 治疗大肠杆菌性腹泻的潜在作用机制。
1 材料与方法
1.1 药物、试剂和主要仪器
辣蓼采于江西省鹰潭市,经广东药科大学杨全教授鉴定为蓼科植物水蓼的干燥全草,标本保存于广东药科大学中药学院标本馆。恩氟沙星(enrofloxacin,ENR;批号:120152526),佛山市北沙制药有限公司;甘露糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、鼠李糖和葡萄糖醛酸(批号分别为:AF21051053,AF21071204,AF20110804,AF20060755,AF200-60854,AF20060753和AF20060751),成都埃法生物科技有限公司;木糖(批号:C12285705,纯度>98%),上海麦克林生化科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP),上海亨代劳商贸有限公司;三氟乙酸(TFA),上海阿拉丁生化科技股份有限公司;Trizol Reagent(批号:182805),美国Invitrogen公司;Evo M-MLV逆转试剂盒Ⅱ(AG11711)和SYBR®Green Pro Taq HS预混型qPCR 试剂盒(AG11701),湖南艾科瑞生物工程有限公司;通用型组织固定液(批号:183218)、HE染液(批号:G1005)、分化液(批号:G1005-3)和返蓝液(批号:G1005-4),武汉赛维尔生物科技有限公司;二乙胺基乙基纤维素-52(diethylamino ethyl cellulose-52,DEAE-52)和葡聚糖凝胶-75(Sephadex gel-75,Sephadex G-75),上海鼎国生物技术有限公司;牛肉浸膏(批号:3205105)、细菌学蛋白胨(批号:3205082)、技术琼脂粉(批号:3207029),广东环凯微生物科技有限公司。实时荧光定量PCR(RT-qPCR)引物(表1),上海生工生物工程有限公司合成。致病性大肠杆菌(CICC 10663),中国工业微生物菌种保藏管理中心。EX125ZH 十万分之一天平,奥豪斯仪器(常州)有限公司;LC-2030C高效液相色谱仪,日本岛津有限公司;UV-3100PC 紫外分光光度计,上海美谱达仪器有限公司;HiseTM2500 高通量测序仪,美国Illumina 公司;Nano-100微量分光光度计,杭州奥盛仪器有限公司;C1000 TouchTMThermal cycler 荧光定量PCR 仪,美国Bio-Rad公司;BX53 研究级生物显微镜,日本Olympus公司。

Tab.1 Primer sequences of real-time quantitative PCR(RT-qPCR)
1.2 NPP的提取分离和纯化
按照前期优化的提取方法[16],称取辣蓼粉末(过40 目筛)50 g,按料液比1∶38 加入蒸馏水,回流提取1.5 h,过滤,滤液浓缩至100 mL,离心取上清,按1∶4 体积比加入无水乙醇,静置过夜,1200×g离心15 min后取沉淀,冷冻干燥得辣蓼粗多糖。
取1 g辣蓼粗多糖溶于蒸馏水中,经0.45 μm微孔滤膜过滤,将溶液上样至DEAE-52 纤维素柱中,蒸馏水洗脱,流速1 mL·min-1,10 min 每管收集流分,苯酚-硫酸法检测490 nm 吸光度,合并流分、浓缩、透析、冷冻干燥得NPP。称取适量NPP 溶于蒸馏水,超声使溶解,经0.45 μm 微孔滤膜过滤后上样至Sephadex G-75色谱柱中,蒸馏水洗脱,流速为每滴10 s,每管10 min,苯酚-硫酸法检测,合并流分、浓缩、透析、冷冻干燥得纯化的NPP。
1.3 NPP相对分子质量测定
取NPP 适量,加蒸馏水配制成5 g·L-1溶液,12 000×g离心10 min,取上清液过0.22 μm 微孔滤膜。以Dextran 系列不同相对分子质量的葡聚糖标准品各2 mg 加蒸馏水配制成2 g·L-1标准品溶液,10 000×g离心10 min,取上清液过0.22 μm 微孔滤膜。采用高效液相色谱法(high performance liquid chromatography,HPLC)绘制标准曲线,根据标准曲线计算NPP 相对分子质量。色谱条件:BRT105-104-102 串联凝胶柱(8 mm×300 mm),RI-502 示差检测器,流动相为0.05 mol·L-1NaCl 溶液,流速0.6 mL·min-1,柱温40℃;进样量20 μL。
1.4 高效液相色谱法分析NPP单糖组成
1.4.1 样品水解液制备
参照文献方法[23]并结合预实验结果,确定NPP水解条件。精确称取NPP 50 mg,置10 mL 具塞试管中,加入2 mol·L-1TFA 溶液2 mL,混匀密封,于100℃水解6 h,冷却至室温,1100×g离心10 min,取上清液加1 mL 甲醇旋干(重复5 次),蒸干后加4 mL蒸馏水溶解,备用。
1.4.2 PMP衍生化
精密量取200 μL NPP 水解液,依次加入0.3 mol·L-1NaOH 和0.5 mol·L-1PMP 甲醇溶液各200 μL,混匀密封,70℃水浴60 min,冷却至室温,加入0.3 mol·L-1HCl 溶液200 μL,调节pH 至中性,混匀,用1 mL 氯仿萃取3 次,取水相经0.22 μm 微孔滤膜过滤,收集滤液备用。
1.4.3 空白溶液制备
精密量取蒸馏水200 μL,按1.4.2 方法进行PMP衍生化,备用。
1.4.4 对照品溶液制备
分别精密称取葡萄糖、半乳糖、阿拉伯糖和半乳糖醛酸4种单糖,加水定容,制成浓度分别为2.0,2.5,2.0 和2.0 g·L-1的混合对照品溶液。分別精确量取混合对照品溶液1.0,0.85,0.65,0.5,0.4,0.24和0.2 mL,加蒸馏水稀释至1 mL,按1.4.2 方法进行PMP衍生化,备用。
1.4.5 色谱条件
XSelectTMHSS T3 C18(4.6 mm×250 mm,5 μm)色谱柱,流动相为乙腈∶磷酸盐缓冲溶液(0.035 mol·L-1,pH6.8)18∶82(V/V),等度洗脱,流速1.0 mL·min-1,柱温28℃,检测波长250 nm,进样量10 μL。
1.5 大肠杆菌悬液制备
将致病性大肠杆菌接种于20 mL 培养基(蛋白胨5.0 g,牛肉浸膏3.0 g,NaCl 5.0 g,蒸馏水1.0 L,pH 7.0)中,37℃振荡培养18~24 h,采用平板培养计数法[24]进行细菌计数,调节菌液浓度为1.0×1012CFU·L-1。
1.6 动物、模型制备和分组给药
雄性BALB/c 小鼠120 只,6~8 周龄,体重18~22 g,广东省医学实验动物中心提供,动物许可证编号:SCXK(粤)2018-0002。小鼠预适应7 d后,随机分为正常对照组、模型组、模型+ENR 5 mg·kg-1组、模型+NPP 40 和80 mg·kg-1组,正常对照组20 只,其余每组25 只。根据前期预实验[25],除正常对照组外,其余各组小鼠以10 mL·kg-1的给药容积ip 给予1.5 制备的大肠杆菌菌液,每日1 次,连续8 d,正常对照组小鼠注射同体积生理盐水。首次攻菌后4 h,小鼠腹泻症状明显,剖检观察到胃内胀气,肠道充满黄色稀薄内容物,肠壁变薄,显示造模成功。给药组于造模前2 d ig给药,每日2次,连续给药10 d;正常对照组和模型组小鼠ig 给予等量生理盐水。于末次给药12 h 后,各组随机选取10 只小鼠麻醉后处死,取十二指肠组织,部分样品迅速置液氮中保存,部分样品用通用型组织固定液固定,剩余样品置-80℃冰箱保存。
1.7 HE染色观察十二指肠病理形态
取1.6 制备的固定液固定的小鼠十二指肠组织,经脱水、透明、浸蜡、包埋、制片、HE 染色、中性树胶封片后,置显微镜下观察病理形态。
1.8 小鼠十二指肠转录组测序与数据分析
从正常对照组、模型组和模型+NPP 80 mg·kg-1组中随机各取3只小鼠十二指肠组织样本,加Trizol裂解液提取总RNA 用于转录组测序。用带有Oligo(dT)的磁珠富集具有polyA 尾的mRNA,并进行随机打断,逆转录成cDNA 链,经过末端修复、加A 尾及连接测序接头,再经琼脂糖凝胶电泳回收目的片段,并进行PCR扩增,从而完成整个文库的构建。将构建好的测序文库用IlluminaHiSeqTM进行测序。文库构建与测序由广州基迪奥生物科技有限公司完成。
将测序得到的原始数据(raw data)经过去除接头、引物及低质量数据,获得待分析数据(clean data),并将过滤得到的待分析数据与参考基因组序列进行比对。采用FPKM(fragments per kilobase of transcript per million fragments mapped)对基因表达量进行标准化。采用DESeq2 方法筛选出正常对照组、模型组和NPP 组小鼠十二指肠组织的差异表达基因(differentially expressed genes,DEG),筛选标准为:错误发现率(false discovery rate,FDR)<0.05 且差异倍数|log2(fold change)|≥2。对DEG 进行GO 功能分类与富集、KEGG 信号通路富集分析以及趋势分析。
1.9 RT-qPCR 检测小鼠十二指肠趋化因子家族和Toll样受体信号通路中目标基因mRNA表达
采用Trizol 裂解液提取正常对照组和模型组十二指肠组织总RNA,紫外法检测RNA 浓度,按Evo M-MLV逆转录试剂盒Ⅱ操作说明合成cDNA。随机选取8 个DEG 进行RT-qPCR 验证,以β 肌动蛋白为内参基因。PCR反应条件:95℃预变性30 s,95℃变性5 s,55℃退火30 s,40个循环。采用2-△△Ct方法计算目的基因mRNA的相对表达量。
1.10 统计学分析
数据结果以x±s表示,采用SPSS 23.0 软件,两组间比较用Dunnettt检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 NPP的分离纯化和相对分子质量
将水提醇沉法制备的辣蓼粗多糖进行DEAE-52 柱色谱分离,蒸馏水洗脱,以管数为横坐标、吸光度值为纵坐标绘制流出曲线(图1A),收集流分、浓缩、透析、冻干后得NPP。将NPP 继续进行SephadexG-75 柱色谱分离,蒸馏水洗脱,绘制洗脱曲线(图1B),得纯化NPP。采用HPLC 法测得NPP 的数均相对分子质量为Mn=6305,重均相对分子质量Mw=7434,分布宽度D=1.18。
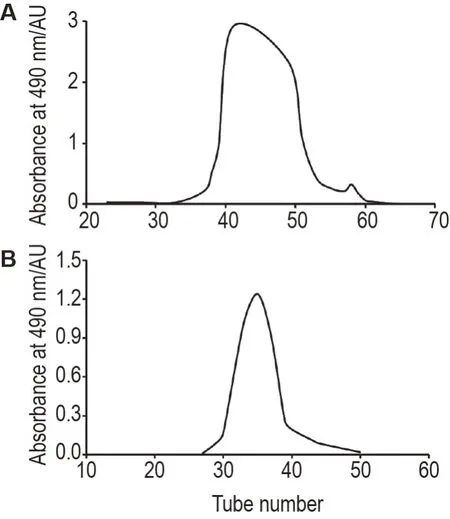
Fig.1 Elution curves of crude polysaccharide on DEAE-52 column(A)and neutral polysaccharide from P.hydropiper(NPP)on Sephadex G-75 column(B)by phenolsulfuric acid method.
2.2 方法学验证
2.2.1 线性关系
以各单糖对照品质量浓度(x,mg·L-1)为横坐标,色谱峰面积(y)为纵坐标,绘制标准曲线。葡萄糖、半乳糖、阿拉伯糖和半乳糖醛酸的回归方程分别为:y=13682x-315246(R2=0.9995),y=17616x-124149(R2=0.9998),y=17200x- 281840(R2=0.9996)和y=12402x-199125(R2=0.9996),4 种单糖的线性范围分别为:75~2000 mg·L-1,80~2000 mg·L-1,72~300 mg·L-1和8~200 mg·L-1。
2.2.2 精密度
连续测定6 次的葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸峰面积的RSD 值分别为0.26%,0.16%,1.31%和0.85%,表明仪器精密度良好。
2.2.3 稳定性
分别于0,4,8,12,18,24 h测得葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸峰面积的RSD 值分别为0.28%,0.50%,0.76%和0.29%。表明NPP 水解液在24 h内稳定性良好。
2.2.4 重复性
葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸峰面积的RSD 值分别为0.52%,2.22%,1.65%和1.65%,表明该方法重复性良好。
2.2.5 加样回收率
葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸的平均加样回收率分别为99.03%,102.41%,99.10%和100.47%;RSD分别为0.67%,0.95%,1.79%和2.42%,表明该方法准确度良好。
2.3 NPP的单糖组成分析
NPP 主要由葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸组成,各单糖摩尔比为13.66∶10.33∶2.34∶1.00,此外亦含有少量木糖(图2)。
2.4 NPP对大肠杆菌性腹泻小鼠十二指肠病理形态的影响
正常对照组小鼠十二指肠组织结构清晰,黏膜层、肌层、浆膜层清晰可见,肠绒毛丰富,排列紧密,绒毛上皮完整,肌层肌纤维形态正常。模型组固有层水肿,结构疏松;较多肠腺上皮细胞水肿变性,胞质疏松淡染,少量肠腺上皮细胞点状坏死或凋亡。模型+ENR 组黏膜层肠腺丰富,排列紧密,固有层轻度水肿,结缔组织疏松,少量炎症细胞浸润。模型+NPP 40 mg·kg-1组十二指肠组织结构清晰,黏膜层少量毛细血管淤血,少量肠腺腔内可见嗜酸性小团块。模型+NPP 80 mg·kg-1组黏膜层、肌层、浆膜层清晰可见,排列紧密,肠绒毛丰富,绒毛上皮完整,固有层内少量毛细血管淤血,黏膜层少量炎症细胞浸润(图3)。
2.5 小鼠十二指肠转录组数据质量评估与比对分析
通过Illumina Hiseq 2500 平台完成正常对照组、模型组、模型+NPP 80 mg·kg-1组各3 个随机十二指肠组织样本的转录组测序。原始数据过滤后,9 个样本待分析数据的数值大于30 的碱基占总体碱基的百分比(Q30)均高于93%,待分析数据比率均高于98%,比对到基因组上数据(clean reads rate)的比率均高于90%,比对到唯一位置的数据(uniquely mapped reads)比率均高于89%,说明转录组测序质量较高,符合后续分析要求(表2)。
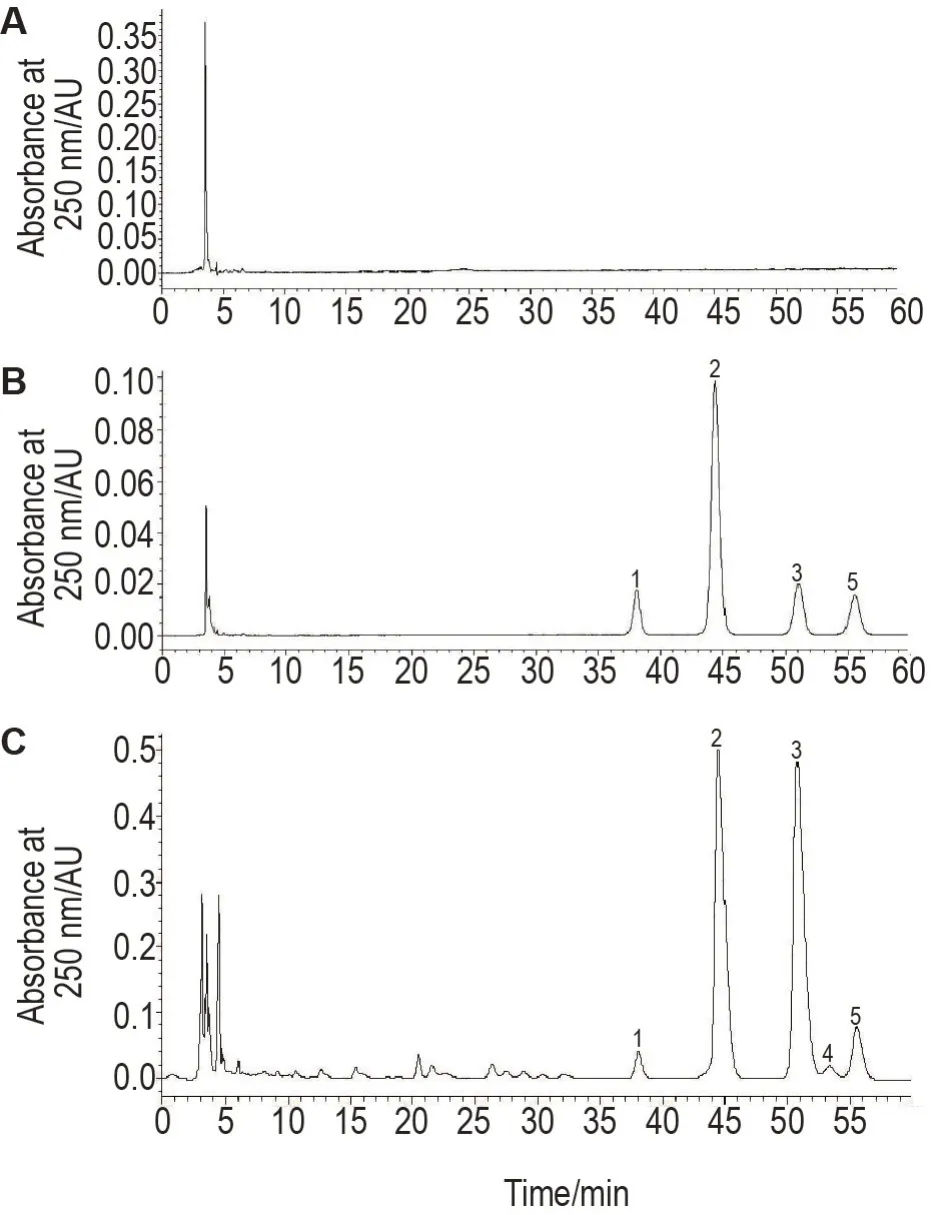
Fig.2 High performance liquid chromatography(HPLC)of blank control(A),mixed monosaccharide control(B)and NPP(C). HPLC separation was accomplished on an XSelect® HSS T3 C18 column(4.6 mm×250 mm,5 μm)with a mobile phase composed of acetonitrile 0.035 mol·L-1 phosphate buffer solution(18∶82,V/V)at a flow rate of 1.0 mL·min-1. 1:galacturonic acid;2:glucose;3:galactose;4:xylose;5:arabinose.
2.6 小鼠十二指肠组织DEG的筛选
与正常对照组比较(图4A),模型组共有1020个DEG,其中587 个上调,433 个下调;与模型组比较(图4B),模型+NPP组共有960个DEG,其中385个上调,575个下调。与正常对照组相比,在模型组上调,经NPP 干预后下调的基因有631 个;在模型组下调,经NPP 干预后上调的基因有498 个(图5)。表明致病性大肠杆菌可导致小鼠十二指肠内较多基因表达水平的改变,NPP 对这些基因的表达具有调节作用。

Fig.3 Effect of NPP on duodenal pathomorphology in mice with Escherichia coli(E.coli)-induced diarrhea. Except for the normal control group,the mice in other groups were ip given enteropathogenic E.coli(EPEC,1.0×1012 CFU·L-1,10 mL·kg-1)suspension once a day for 8 days. The mice in the normal control group were ip given saline. Two days before EPEC induction,the mice in the model+enrofloxacin(ENR)and model+NPP groups were ig given NPP twice a day for 10 days,and those in the model and normal control groups were ig given the same volume saline. Arrows show punctuate necrosis and apoptosis in intestinal glandular epithelial cells(in red),inflammatory cell infiltration and exudation,eosinophilic cytoplasm(in yellow),capillary congestion and edema in epithelial cells(in black).
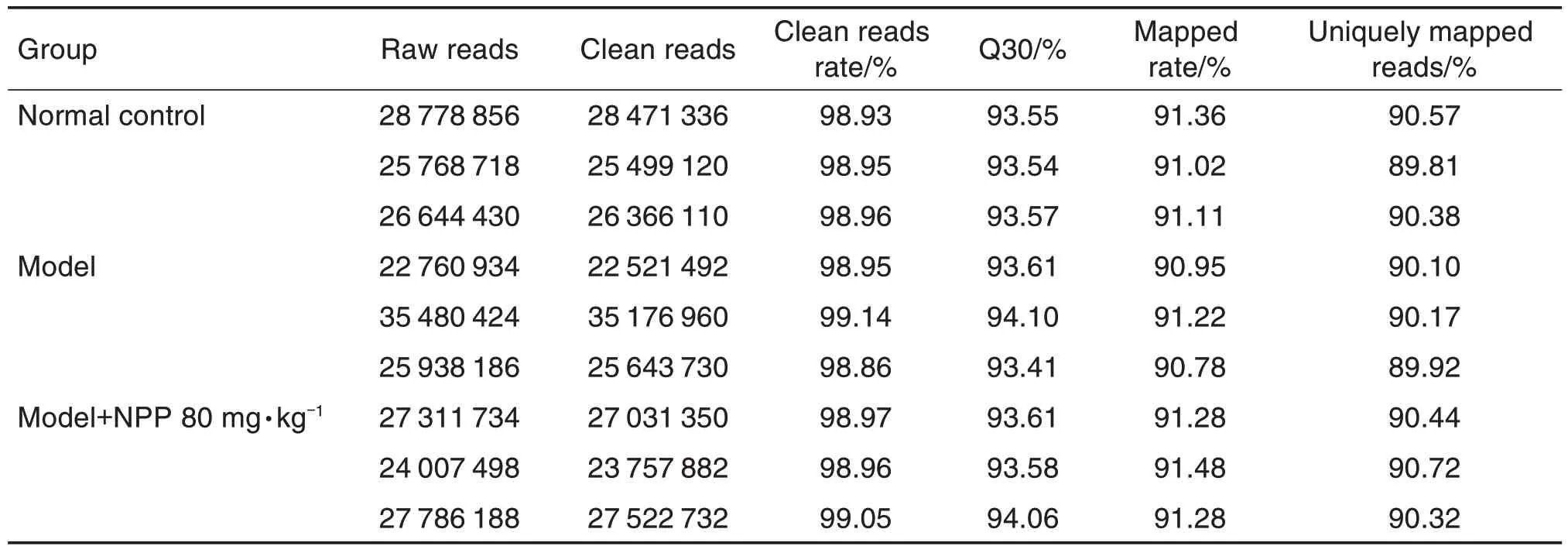
Tab.2 Statistical results of transcriptome sequencing data of mouse duodenum

Fig.4 Volcanic maps of differentially expressed genes(DEGs). See Fig.3 for the mouse treatment. Compared with the normal control group,433 genes(green)were down-regulated,and 587 genes(red)were up-regulated in the model group (A). Compared with the model group,575 genes(green)were down-regulated,and 385 genes(red)were up-regulated in the model+NPP 80 mg·kg-1 group(B). Nodiff:non-differential genes;FDR:false discovery rate.
2.7 GO富集分析DEG
模型组与正常对照组相比(图6A),DEG 富集于41 个功能项中,包括20 个生物学过程,13 个细胞组分和8 个分子功能。模型+NPP 80 mg·kg-1组与模型组相比(图6B),DEG 同样富集于20 个生物学过程、13 个细胞组分和8 个分子功能。在2 个比较组中,DEG 参与的生物学过程主要包括细胞过程、单有机体过程、代谢过程、应激反应、发育过程和生物调节等;参与的细胞组分主要包括细胞、细胞器、膜、胞外区等;参与的分子功能主要包括结合、催化活性和分子功能调节因子等。

Fig.5 Trend maps of DEGs.
2.8 KEGG富集分析DEG
KEGG 分析结果显示(图7),大部分DEG 归属于代谢、有机系统和人类疾病途径。模型组与正常对照组相比,DEG 主要富集于代谢相关通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、细胞因子-细胞因子受体相互作用、吞噬体、过氧化物酶体增殖物激活受体信号通路、Toll 样受体信号通路、趋化因子信号通路、MAPK 信号通路和磷脂酰肌醇-3-激酶(phosphatidylinositol-4,5-bisphosphate 3 kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路等。NPP组与模型组相比,DEG主要富集于代谢相关通路、TNF信号通路、Toll样受体信号通路、NF-κB信号通路、细胞因子-细胞因子受体相互作用、PI3K-Akt信号通路、趋化因子信号通路和MAPK信号通路等。可见与炎症相关的信号通路在2个对比组中均有显著富集。

Fig.6 GO enrichment analysis of DEGs. A:DEGs between the model and the normal control groups;B:DEGs between the model+NPP 80 mg·kg-1 and the model groups.
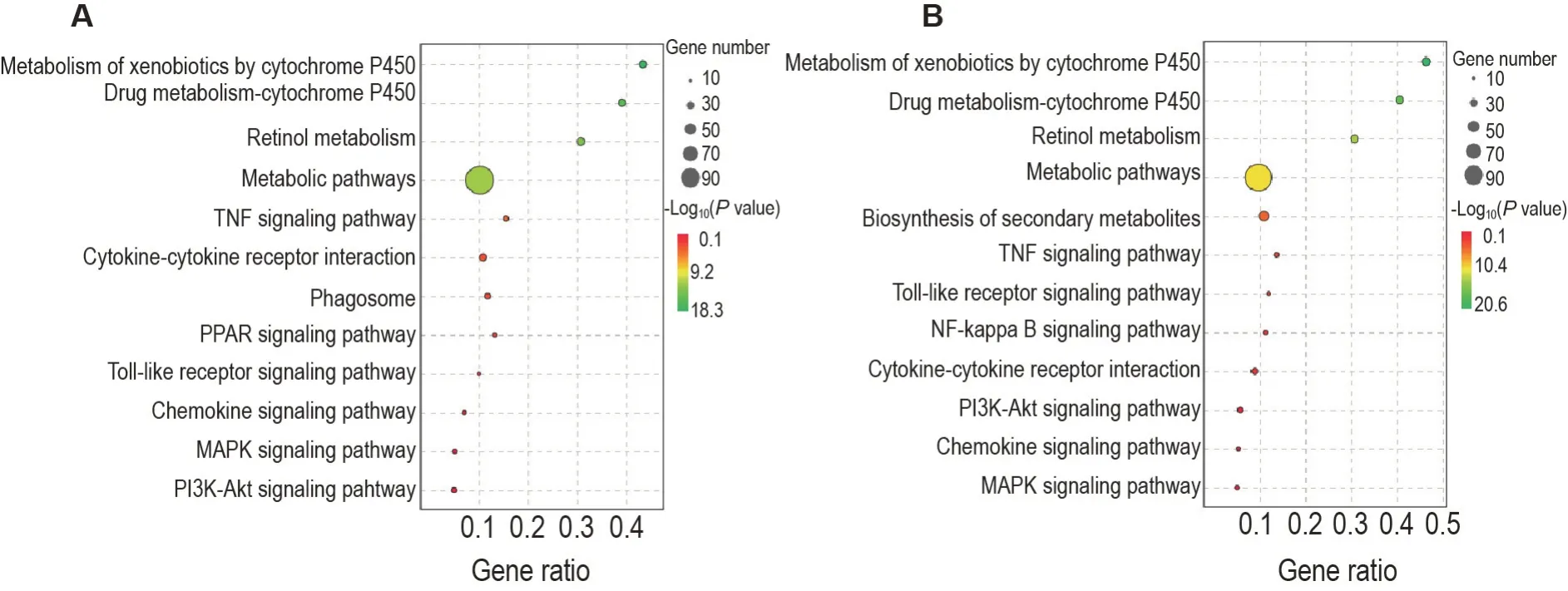
Fig.7 KEGG enrichment analysis of DEGs. A:DEGs between the model group and the normal control group;B:DEGs between the model+NPP 80 mg·kg-1 group and the model group. TNF:tumor necrosis factor;PPAR:peroxisome proliferator-activated receptor;PI3K:phosphatidylinositol-4,5-bisphosphate 3 kinase;Akt:protein kinase B.
2.9 DEG的验证
KEGG 分析结果显示,DEG 主要富集于细胞因子-细胞因子受体相互作用通路、Toll 样受体信号通路、趋化因子信号通路等炎症相关信号通路。为了验证转录组测序结果,从趋化因子家族和Toll样受体信号通路中随机选择8 个DEG,分别为C-C 趋化因子配体7(C-C motif chemokine ligand 7,CCL7)、CCL22、CCL2、C-X-C 趋化因子配体5(C-X-C motif chemokine ligand 5,CXCL5)、CXCL10、CXCL1、C-X-C 趋化因子受体2(C-X-C motif chemokine receptor 2,CXCR2)、Toll 样受体2(toll-like receptor 2,TLR2),采用RT-qPCR 法对上述DEG 在模型组的mRNA 表达水平进行检测,结果如图8 所示。与正常对照组比较,模型组CCL7,CXCR2,CXCL5,CXCL10,CXCL1,TLR2和CCL2mRNA 表达水平上调,而CCL22mRNA 表达水平下调,且差异均有统计学意义(P<0.05)。转录组测序与RT-qPCR 检测的上述基因表达差异倍数一致(图9),表明转录组测序结果可靠、重复性好。

Fig.8 Levels of DEGs mRNA in duodenal tissue of mice in normal control group and model group by RT-qPCR. See Fig.3 for the treatment.±s,n=3. *P<0.05, compared with normal control group.
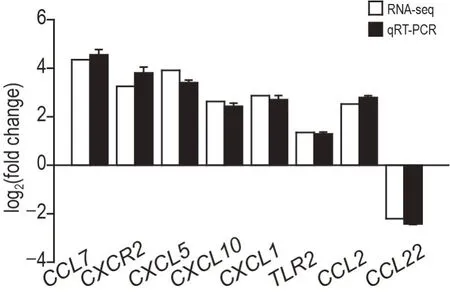
Fig.9 Verification of the RNA-seq results of DEGs expression by RT-qPCR. Logarithm of gene expression fold change detected by RNA-seq and RT-qPCR,respectively.
3 讨论
本研究采用HPLC 法测得NPP 数均和重均相对分子质量分别为6305 和7434。通过PMP 柱前衍生化HPLC 法分析发现,NPP 主要由葡萄糖、半乳糖、阿拉伯糖及半乳糖醛酸组成,在各自浓度范围内线性关系良好,平均加样回收率为99.03%~102.41%,各单糖摩尔比为13.66∶10.33∶2.34∶1.00。本实验分离得到的NPP 中含少量半乳糖醛酸,可能与采用DEAE-52 纤维素柱色谱进行纯化时,水洗脱用水量较多或上样量较多有关。采用ip给予致病性大肠杆菌的方法建立腹泻小鼠模型,HE染色结果表明,NPP 对腹泻小鼠的受损十二指肠具有明显修复作用。为进一步探讨NPP 的抗腹泻作用机制,采用高通量转录组测序技术获得了正常组、模型组和模型+NPP 80 mg·kg-1各3 个随机十二指肠样本的9个转录组数据。各组平均待分析数据为26.89×106条,Q30>93.4%,各组平均比对率>91.1%。通过对DEG进行GO富集分析和KEGG信号通路分析发现,除代谢相关通路外,这些基因主要涉及多条与炎症相关的信号通路:趋化因子信号通路、细胞因子-细胞因子受体相互作用通路、Toll样受体信号通路、TNF信号通路、PI3K-Akt信号通路和MAPK信号通路等,说明NPP抗大肠杆菌性腹泻的作用机制具有多途径、多靶点的特点。
细胞因子与膜受体的相互作用参与到疾病或药物调节机体状态的生命活动中,也是目前众多研究者重点关注的信号通路之一[26-29]。趋化因子是细胞因子超家族成员之一,是一类可趋化细胞定向移动的小分子蛋白质,大多数趋化因子属于CC 和CXC 2 个亚家族。趋化因子能参与炎症细胞的介导和招募过程,诱导病灶组织的炎症细胞浸润,在多种炎症疾病的发生发展过程中发挥关键作用[30-32]。TLR 是一类参与天然免疫的模式识别受体,当病原体入侵时,宿主体内的TLR 可引发一系列信号传导,导致细胞分泌炎症细胞因子和趋化因子,引发炎症反应[33]。本研究的转录组测序结果显示在模型组中,TLR2和趋化因子CCL7,CXCR2,CXCL5,CXCL10,CXCL1和CCL2mRNA表达水平上调,CCL22mRNA表达水平下调。采用RT-qPCR法对上述关键DEG表达量进行检测,验证了转录组测序结果。CXCR2 是CXCL1,CXCL2,CXCL3 和CXCL5等多种趋化因子受体,可募集中性粒细胞向炎症区域转移,与机体炎症免疫过程密切相关;CXCR2与其配体相互作用形成的信号轴在多种疾病中发挥作用[34]。近年来研究表明,CXCL1/CXCR2 生物轴在骨癌痛、化疗药物致疼痛、坐骨神经损伤致慢性疼痛的发生发展过程中以及炎症反应调节中均发挥重要作用[35-38]。CXCL5/CXCR2 生物轴在机体抗感染、抗病毒免疫过程、肠道炎症性疾病的调控过程中发挥重要作用,CXCL5 也是表达于克罗恩病、溃疡性结肠炎和急性阑尾炎小肠黏膜上皮细胞最主要的CXC 趋化因子[39-40]。已有研究报道TLR2在宿主对大肠杆菌感染的免疫和炎症反应中起重要作用[41]。
综上,NPP 可修复大肠杆菌性腹泻小鼠的受损肠黏膜,缓解炎症反应,其作用机制可能与调节CXCL1/CXCR2、CXCL5/CXCR2生物轴以及TLR2介导的炎症信号通路有关。后期还将对DEG富集的关键信号通路进行深入研究,采用分子生物学技术从基因和蛋白水平发现NPP抗大肠杆菌性腹泻的作用机制,为辣蓼的临床应用和资源开发提供理论依据。

