基于转录组测序技术分析穿心莲内酯抑制HepG2.CW细胞分泌乙型肝炎病毒表面抗原作用机制
黄曼琼,杨稳,魏振桥,王晓龙,齐冬梅,戚扬,邢雅玲,王升启
(1.山东中医药大学中医药创新研究院,山东济南 250355;2.军事科学院军事医学研究院微生物流行病研究所,北京 100850;3.山东中医药大学实验中心,山东 济南 250355)
乙型肝炎病毒(hepatitis B virus,HBV)感染,尤其是慢性感染,仍然是世界性的重大医学问题。HBV 持续感染能导致慢性乙型肝炎(chronic hepatitis B,CHB),并具有很高风险发展为肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)。据世界卫生组织估计[1],截止2019 年,全球有2.96 亿人罹患CHB,每年新增感染者约150 万人;2019 年,约82 万人死于HBV 感染导致的肝硬化、肝衰竭或HCC。临床上乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)血清学清除可降低肝硬化和HCC 风险[2-3],被认为是CHB 功能性治愈的目标[4]。目前CHB 的抗病毒治疗中,核苷类似物的HBsAg 血清学清除率极低,年血清学清除率约0.33%[5],聚乙二醇干扰素虽在清除HBsAg 方面有优势,但耐受性差,不良反应多,使用范围窄[6]。多种中草药在清除HBsAg等抗乙肝病毒方面疗效显著,不良反应少[7],但中药多成分、多靶点和多途径的特点给其作用靶点和机制的研究增加了难度。
穿心莲具有解热、抗癌、抗炎和保肝利胆等功效[8]。穿心莲内酯(andrographolide)作为穿心莲的主要生物活性成分,具有抗炎、抗癌、抗菌、保肝、抗氧化、抗疟疾和抗动脉粥样硬化等多种药理活性[9],同时对丙型肝炎[10]、流感[11]和艾滋病[12]及寨卡病毒[13]、腺病毒[14]和肠道病毒[15]等多种病毒性感染疾病有较好的治疗效果,具有广谱抗病毒潜质[16]。穿心莲内酯及其部分衍生物具有抑制HBsAg、乙型肝炎病毒e抗原(hepatitis B virus e antigen,HBeAg)分泌和HBV DNA复制的功效[17],但具体作用机制研究不够深入。
近年来,深度测序技术的应用使生物学和医学研究发生了革命性变化[18]。转录组测序技术是指利用高通量测序技术,将细胞或组织中的全部或部分mRNA、微RNA 和长链非编码RNA 进行测序分析。应用转录组测序技术,可对一定条件和时间下转录的RNA进行分析,比较来自不同组织和条件的基因表达谱,进而得到差异表达基因,以分析在确定表型中起主要作用的基因[19]。针对转录组进行研究,不仅能阐明组织或细胞基因的表达情况,同时有助于认识疾病发生发展过程和药物在生命体的作用机制[20]。
本研究旨在利用转录组测序技术,分析穿心莲内酯作用后小鼠肝基因表达水平的变化,得到差异表达基因,并应用含有HBV 基因组的细胞模型,对穿心莲内酯作用后所致差异基因进行表达和功能验证,探索其可能的作用靶标和机制。
1 材料与方法
1.1 药物、主要试剂和仪器
穿心莲内酯、羧甲纤维素钠(sodium carboxymethyl cellulose,CMC-Na)和细胞增殖及毒性检测试剂盒(CCK-8)增强型,大连美仑生物技术有限公司;二甲亚砜(dimethyl sulfoxide,DMSO),北京伊诺凯科技有限公司;胎牛血清和细胞冻存液,依科赛生物科技有限公司;青、链霉素,美国Gibco 公司;MEM 培养基、杜氏磷酸盐缓冲液和胰蛋白酶-EDTA 溶液,美国Sigma 公司;乙型肝炎病毒表面抗原测定试剂盒(化学发光法)和乙型肝炎病毒e抗原测定试剂盒(化学发光法),北京泰格科信生物科技有限公司;RNA Easy Fast 动物组织/细胞总RNA 提取试剂盒(离心柱型)、FastKing 一步法除基因组cDNA 第一链合成预混试剂和Talent 荧光定量检测试剂盒(SYBR Green),天根生化科技(北京)有限公司;细胞培养箱(HERA cell vios 160i)、光学显微镜(Evos XL Core)和实时荧光定量PCR仪(7500 Real-Time PCR System),美国Thermo Fisher Scientific 公司;PCR 仪(C1000 Touch Thermal Cycler),美国Bio-Rad Laboratories 公司;酶标仪(Epoch),美国BioTek 公司;化学发光免疫分析仪(MP180),北京泰格科信生物科技有限公司;内参基因GAPDH、ADP 核糖基化因子样蛋白4D(ADPribosylation factor-like protein 4D,Arl4d)、肝细胞核因子6(hepatocyte nuclear factor 6,HNF6)和ADP 核糖基化因子样蛋白8A(ADP-ribosylation factorlike protein 8A,Arl8a)基因序列(表1),生工生物工程(上海)股份有限公司。
1.2 实验动物、分组及给药
6 周龄BALB/c 雄性小鼠,体重18~22 g,购于北京维通利华实验动物有限公司,动物合格证号:SCXK(京)2021-0006,动物伦理审批号:IACUCDWZX-2021-748。所有实验动物均饲养于SPF 级动物房,采用12 h 间歇光照,环境温度为22~26℃,相对湿度为60%~70%,动物摄食、饮水自由。小鼠经过适应性喂养7 d 后随机分为正常对照组(0.4%CMC-Na)、穿心莲内酯6.25和18.75 mg·kg-1组,每组6只。穿心莲内酯均用0.4%CMC-Na配制为混悬液,ig给药,给药体积为10 mL·kg-1。给药24 h处死小鼠,立即取肝组织冻存于-80℃冰箱以备转录组测序。
1.3 小鼠肝组织转录组测序及分析
小鼠肝组织转录组测序由联川生物公司进行,对原始测序结果进行过滤,去除接头污染、低质量、含N 比例>5%的序列(reads)得高质量序列(cleandata)。应用Ensembl平台小鼠GRCm38基因组及v100注释文件构建参考基因组文件,Hisat2(v2.2.1)软件将高质量序列比对到参考基因组上,feature-Counts(v2.0.0)软件统计比对到每个基因上的个数,得基因的表达水平。应用edgeR v3.34.1软件对样本进行差异表达分析:首先,分别选取穿心莲内酯6.25 和18.75 mg·kg-1相对于正常对照组的差异基因〔log2FC>1 且错误发现率(false discovery rate,FDR)<0.05〕;然后,选取穿心莲内酯2个剂量组差异基因中的交集作为显著差异表达基因。

Tab.1 Sequences of primer for real-time fluorescence quantitative PCR(RT-qPCR)
1.4 细胞培养和分组
HepG2.CW 细胞系是由本课题组从我国慢性乙型肝炎患者的血清样本中分离出C 型HBV 基因组构建而成[21]。HepG2.CW 培养条件为含10%胎牛血清、1%青、链霉素的MEM 培养液,细胞培养箱CO2浓度为5%,温度为37℃。①将HepG2.CW细胞按每孔3×105接种于6孔板,24 h后细胞完全贴壁,更换为含穿心莲内酯〔0(细胞对照组),1.5625,3.125,6.25 和12.5 μmol·L-1〕的培养液,每个药物浓度设置3 复孔。孵育72 h 后收集细胞及细胞培养上清用于1.6和1.7实验。②将HepG2.CW 细胞按每孔5×105接种于6 孔板,24 h 后细胞完全贴壁,更换为含穿心莲内酯(0 或6.25 μmol·L-1)培养液,每个药物浓度设置3 复孔。孵育12,24,48 和72 h 后收集细胞用于1.6和1.7实验。
1.5 CCK-8法检测HepG2.CW细胞存活率
将生长良好的HepG2.CW 细胞按每孔5×103接种于96 孔板,置37℃,5% CO2培养箱培养24 h后,将细胞分为细胞对照组和穿心莲内酯组,每组设6复孔,分别加入穿心莲内酯0,1.5625,3.125,6.25,12.5,25和50 μmol·L-1,每组溶剂均为1‰ DMSO。另设空白组,只加细胞培养液,不接种细胞。加药72 h后,将培养液更换为含10 μL CCK-8试剂总体积为100 μL的MEM培养液,在细胞培养箱中继续培养约40 min,用酶标仪测450 nm 吸光度(A450nm)值,计算各组细胞存活率。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。
1.6 实时荧光定量PCR 检测HepG2.CW 细胞内差异基因表达水平
取1.4 收集的细胞,应用RNA Easy Fast 动物组织/细胞总RNA 提取试剂盒(离心柱型)提取细胞内RNA,测定RNA 浓度后,应用FastKing 一步法除基因组cDNA第一链合成预混试剂试剂盒将提取的RNA 逆转录为cDNA(反应条件:去除基因组及逆转录反应42℃15 min;酶灭活过程95℃3 min),应用Talent 荧光定量检测试剂盒(SYBR Green)进行相关基因的定量检测(反应条件:预变性95℃15 min;PCR 反应95℃10 s,56℃32 s 共40 个循环),以GAPDH为内参基因,采用2-ΔΔCt法计算目标基因的相对表达量。
1.7 化学发光法检测HepG2.CW 细胞培养上清中HBsAg和HBeAg含量
取1.4 收集的细胞培养上清,应用乙型肝炎病毒表面抗原测定试剂盒(化学发光法)和乙型肝炎病毒e抗原测定试剂盒(化学发光法)检测细胞培养上清中HBsAg 和HBeAg 的含量(检测HBsAg 时细胞培养上清稀释5 倍,检测HBeAg 时细胞培养上清稀释25倍)。
1.8 统计学分析
所有细胞实验结果采用x±s表示,采用Graph-Pad Prism 9 软件进行统计分析,多组均数比较采用单因素方差分析(one-way ANOVA),两组间比较采用两独立样本t检验,两变量之间关系采用双侧Pearson 检验行直线相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 穿心莲内酯灌胃小鼠肝转录组数据分析
穿心莲内酯ig 小鼠24 h,取肝组织进行转录组测序,分析得到穿心莲内酯6.25 和18.75 mg·kg-1组差异基因。结果(图1)显示,与正常对照组相比,穿心莲内酯6.25 mg·kg-1组检出151 个差异基因,其中72个基因上调,79个基因下调(图1A);穿心莲内酯18.75 mg·kg-1组检出50个差异基因,其中25个基因上调,25 个基因下调(图1B)。取穿心莲内酯6.25 和18.75 mg·kg-1组差异基因的交集,得穿心莲内酯ig 小鼠后,肝显著变化的基因共17 个(图2A),其中Arl4d基因上调,Onecut1和Arl8a基因下调(图2B)。

Fig.1 Volcano maps of differentially expressed genes(DEGs)in livers of mice. Mice were randomly divided into normal control,andrographolide(6.25 and 18.75 mg·kg-1)groups. After a week adaptive feeding,mice were ig given andrographolide or 0.4% CMC-Na solution(normal control group). Mice were executed at 24 h and liver tissues were immediately frozen at -80℃for transcriptome sequencing and differential analysis. Up represents up-regulated genes;down represents down-regulated genes;no-significant represents genes with no significant difference.FC:fold change;FDR:false discovery rate.

Fig.2 Volcano plots of significant DEGs in liver of mice. See Fig.1 for the mouse treatment. A:the differential gene situation in the liver of mice treated with andrographolide 6.25 and 18.75 mg·kg-1,both-significant means that the gene appears in the differential genes of the two groups of data,one-significant means that the gene appears in one of the differential genes of the two groups of data,No-significant means that the gene is not a differential gene in the two sets of data;B:expression heat map of both-significant gene in Fig.A.1,2 and 3 represents the number of sample,respectively.
2.2 穿心莲内酯对HepG2.CW细胞存活率的影响
CCK-8 检测结果(图3)显示,与细胞对照组相比,穿心莲内酯1.5625,3.125和6.25 μmol·L-1组细胞存活率显著提高(P<0.01),12.5和25 μmol·L-1组细胞存活率无显著差异,50 μmol·L-1组细胞存活率显著降低(P<0.01)。因此选用穿心莲内酯1.5625,3.125,6.25和12.5 μmol·L-1用于后续实验。
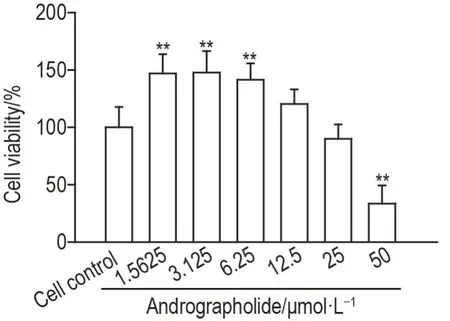
Fig.3 Effect of andrographolide on viability of HepG2.CW cells by CCK-8 assay. HepG2.CW cells were treated with andrographolide for 72 h. x±n=6. **P<0.01,compared with cell control group.
2.3 穿心莲内酯对HepG2.CW 细胞内差异基因表达的影响
结果(图4)显示,与细胞对照组相比,穿心莲内酯1.5625,3.125,6.25 和12.5 μmol·L-1组细胞内Arl4dmRNA 表达水平均显著降低(P<0.01);穿心莲内酯12.5 μmol·L-1组Onecut1mRNA 表达水平显著降低(P<0.05);穿心莲内酯各浓度组Arl8amRNA 表达无显著差异。提示穿心莲内酯能降低HepG2.CW细胞内Arl4dmRNA的表达。
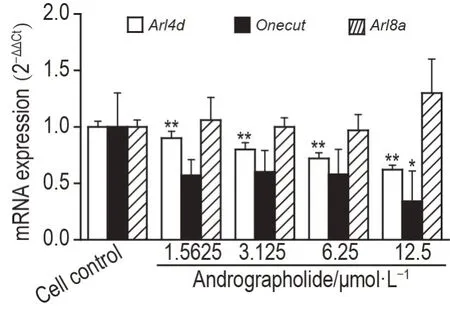
Fig.4 Effect of andrographolide on mRNA expressions of Arl4d ,Onecut1 and Arl8a in HepG2.CW cells by RTqPCR. See Fig.3 for the cell treatment.±s,n=3. *P<0.05,**P<0.01,compared with cell control group.
2.4 穿心莲内酯对HepG2.CW细胞分泌HBsAg和HBeAg的影响
结果(图5)显示,与细胞对照组相比,穿心莲内酯1.5625,3.125,6.25和12.5 μmol·L-1组细胞培养上清中HBsAg 含量均显著降低(P<0.01);穿心莲内酯12.5 μmol·L-1组HBeAg 含量显著降低(P<0.01)。提示穿心莲内酯能抑制HepG2.CW 细胞分泌HBsAg。

Fig.5 Effect of andrographolide on secretion of hepatitis B virus surface antigen(HBsAg)(A)and hepatitis B virus e antigen(HBeAg)(B)in HepG2.CW cells by chemiluminescent method. See Fig.3 for the cell treatment.x±s,n=3.**P<0.01,compared with cell control group.
2.5 Arl4d mRNA表达水平与HBsAg的相关性分析
将穿心莲内酯0,1.5625,3.125,6.25和12.5μmol·L-1组作用HepG2.CW 细胞72 h,对细胞内Arl4dmRNA 表达水平与细胞培养上清中HBsAg 含量进行Pearson 直线相关分析[22],结果(图6)显示,细胞内Arl4dmRNA 表达水平与细胞培养上清HBsAg含量呈显著正相关(r=0.8525,P<0.01)。

Fig.6 Correlation analysis between Arl4d mRNA expression and HBsAg.
2.6 穿心莲内酯影响HepG2.CW细胞内Arl4d mRNA表达的时间依赖性分析
与细胞对照组相比,穿心莲内酯6.25 μmol·L-1作用HepG2.CW 细胞12,24 和48 h,细胞内Arl4dmRNA 的表达量均显著降低(P<0.05,P<0.01)。随着时间的延长,穿心莲内酯抑制细胞内Arl4dmRNA 表达的作用逐渐减弱,72 h 时与细胞对照组相比无统计学差异(图7)。

Fig.7 Effect of andrographolide on expression level of Arl4d mRNA in HepG2.CW cells at different time points. HepG2.CW cells were treated with andrographolide 0 and 6.25 μmol·L-1.±s,n=3. *P<0.05,**P<0.01,compared with cell control group.
2.7 穿心莲内酯影响HepG2.CW 细胞分泌HBsAg的时间依赖性分析
穿心莲内酯6.25 μmol·L-1作用HepG2.CW 细胞48 h 时,细胞培养上清HBsAg 含量较细胞对照组有降低趋势,但无统计学差异;作用72 h 时,细胞培养上清HBsAg 含量较细胞对照组显著降低(P<0.01)(图8)。
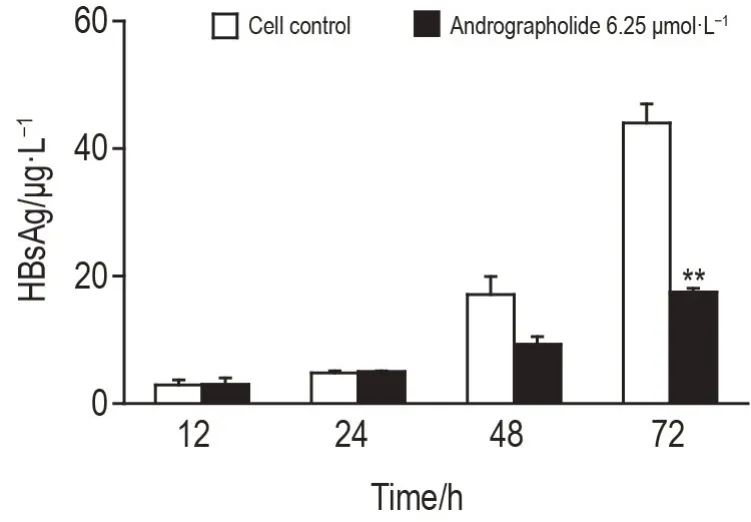
Fig.8 Effect of andrographolide on secretion of HBsAg in HepG2.CW cells at different time points. See Fig.7 for the cell treatment.±s,n=3. **P<0.01,compared with cell control group.
3 讨论
本研究应用穿心莲内酯ig 小鼠24 h,取肝组织进行转录组测序,分析得到穿心莲内酯ig 小鼠后肝显著变化的基因共17 个,其中Arl4d基因上调,Onecut1和Arl8a基因下调,提示Arl8a,Arl4d和Onecut1基因可能是穿心莲内酯的作用靶标。Arl4d作为细胞程序性死亡配体1 诱导的调节肝窦内皮细胞介导的CD8 T 细胞启动通路的组成部分,可调节白细胞介素2 的产生,并抑制免疫系统中适应性CD8 T细胞应答[23]。此外,Arl4d作为细胞黏蛋白2/ARNO 的上游调节因子,可调节肌动蛋白重构[24],而肌动蛋白的重构促进免疫突触的形成和T 细胞受体的激活[25]。表明Arl4d可能对T 细胞的功能有深远影响。经GeneCards 分析,Arl8a也参与免疫反应。Onecut1主要在肝富集,参与细胞周期调节[26],与肝细胞增殖、肝炎和肝癌等肝生理病理进程相关[27-29]。因此,本研究选用含有HBV 基因组的HepG2.CW 细胞作为疾病模型,研究穿心莲内酯对上述3 个基因表达与功能的影响,进而分析穿心莲内酯对HBV感染可能作用与潜在机制。
细胞水平验证发现,穿心莲内酯能够抑制Arl4d基因表达,而对Onecut1和Arl8a基因表达无显著影响。转录组测序结果和细胞实验结果不太相符,可能与以下原因有关:①实验方法不同,动物体内得到的差异基因是应用转录组测序技术,细胞水平验证差异基因是应用RT-qPCR 技术,2种检测方法的灵敏度和精确度有差异,对于转录组测序技术分析得到的结果,需要再次进行表达和功能的验证,两者协同可信度更好。②细胞与整体模型所反映的机体病理生理状态不同,转录组测序得到的结果是基于动物体内肝组织的基因变化,而进行表达验证时是在细胞水平,局部无法完全反映整体状态,后续仍需进行整体水平的全面深入验证。③乙肝所致炎症的调控机制比较复杂,单一基因仅能解释部分机制。Arl8a作为溶酶体胞内定位和蛋白质溶酶体膜转运的关键调控因子[30],主要在依赖溶酶体的自噬、吞噬作用和质膜修复等过程中发挥作用[31],在小鼠肝脏整体水平上,Arl8amRNA 的表达变化可能与单一的肝实质细胞不完全一致。同时细胞实验结果显示穿心莲内酯能够抑制HBsAg分泌,且Arl4dmRNA 表达水平与HBsAg 含量呈显著正相关,Arl4dmRNA 的表达降低早于HBsAg 分泌的下降,提示抑制Arl4dmRNA 的表达可能是抑制HBsAg 分泌的机制之一。但是Arl4dmRNA 表达的抑制与HBsAg 蛋白分泌的抑制之间相差时间较久,可能与以下原因有关:①转录翻译关系复杂,且不同蛋白分泌至细胞表面途径不同,速率亦不同;②HBsAg 是通过复杂的机制产生和分泌的,目前仍不完全清楚,不排除由此导致HBsAg蛋白分泌的抑制产生滞后性;③由Arl4dmRNA 表达抑制到HBsAg 分泌抑制,中间可能涉及多条信号通路调控,二者产生关联的机制仍需进一步研究。
病毒感染是炎症与免疫反应的重要诱因之一。在HBV 感染过程中,宿主免疫反应充当一把双刃剑,它通过破坏病毒感染的细胞来防御感染,同时诱导肝炎症,加重肝损伤。先天免疫细胞和适应性免疫细胞在控制HBV 感染中虽发挥关键作用,但它们也易造成炎症损伤,随后导致肝病理改变[32]。调节免疫反应、控制肝炎症损伤是目前治疗乙型病毒性肝炎的潜在策略[33],同时也可能是穿心莲内酯的药理作用新机制。在慢性HBV 感染中,HBV 特异性T 细胞功能严重失调[33],HBsAg 的低清除率也与HBV 特异性T 细胞对HBsAg 的弱反应有关[34];而Arl4d可能通过PI3K/Akt 轴干扰信号转导,在病毒感染过程中抑制细胞因子白细胞介素2 的产生,并抑制免疫系统中适应性CD8 T 细胞应答[23]。因此,抑制Arl4d基因的表达可能增强T 细胞功能,从而有利于HBsAg清除。
药物靶标,包括人体可用于药物作用并改善健康的所有效应分子,是药物治疗疾病的桥梁,是创新药物发现的源头[35]。本研究通过转录组测序以及细胞水平的表达与功能验证,发现Arl4d可能是穿心莲内酯作用于肝并改善健康的效应分子之一,依托HBV 感染的细胞模型,初步揭示了穿心莲内酯可能通过Arl4d抑制HBsAg 分泌的作用机制,为挖掘其作用靶标提供了新思路新方法。但穿心莲内酯作用于机体其他组织器官并改善炎症反应的效应分子与机制仍需进一步探索。

