水产用微生物制剂源细菌的分离鉴定及耐药性分析
王红莉,刘丽娟,张德锋,尹纪元,石存斌,任 燕,夏苏东,王 庆
(1.天津农学院水产学院,天津 300384;2.中国水产科学研究院珠江水产研究所,农业农村部渔用药物创制重点实验室,广州 510380)
随着我国水产养殖设施化、集约化和规模化的快速发展,高密度养殖已成为当前的主流[1]。在追求高密度养殖过程中,养殖水环境承受巨大压力,水产养殖经济动物病害频发,制约了水产养殖业的健康可持续发展。为了防控养殖动物病害暴发,需要大量使用抗生素、消毒剂等化学药物。然而,这些药物的长期使用,不仅加剧了细菌耐药性的产生和耐药基因的传播,而且水产品中的药物残留也危害人类健康。在当前我国努力遏制细菌耐药,维护人民群众健康的政策下,绿色健康养殖是今后水产养殖发展的必由之路。
微生物制剂指一类在自然环境中筛选得到的有益微生物及其代谢产物经过特殊加工制备而成的生物制剂[2]。目前,光合细菌、硝化细菌、酵母菌、肠球菌、芽孢杆菌、乳酸菌等广泛应用于净化养殖环境、提高动物生产性能和抗病力等方面,是常用的微生物制剂[3]。例如,光合细菌、芽孢杆菌和硝化细菌等,因其能够降解养殖水体中的有机物、氨氮和亚硝酸盐等,常被用作水体改良剂[4]。一些具有拮抗抑菌活性的益生菌如贝莱斯芽孢杆菌(Bacillusvelezensis)、乳酸菌因其能够产生抑菌物质从而控制病原菌的生长繁殖,具有良好的生防作用效果,是常有的生防菌[5,6]。芽孢杆菌、酵母菌、肠球菌等益生菌具有增强消化酶活性,提高饲料利用率,改善肠道菌群,提高水产动物的免疫力等功能,通常用于饲料添加剂[7,8]。
我国水产用微生物制剂的发展较晚,缺乏完善的市场监管系统,产品良莠不齐,其安全性难以保证。本实验旨在通过分离市售水产微生物制剂中的细菌,并进行耐药性分析以及耐药基因检测,进而评估水产用微生物制剂的安全性,为水产养殖中益生菌的筛选和安全应用提供科学依据。
1 材料和方法
1.1 实验材料
从市场上购买35个厂家常见的45种微生态制剂(表1)。乳酸菌培养基(MRS)、牛肉膏蛋白胨培养基(LB)和水解酪蛋白胨培养基(MH)均购于广州环凯微生物科技有限公司;琼脂粉购于北京奥赛星生物技术有限公司;药敏纸片购于杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒购于天根生化科技(北京)有限公司。

表1 微生态制剂产品信息Tab.1 Information of the microbial agents in this study
1.2 实验方法
1.2.1 细菌的分离与培养
将购买的微生物制剂进行10倍系列梯度稀释为10、100、1 000和10 000倍稀释液,分别吸取100 μL涂布于LB固体平板和MRS固体平板,LB固体平板置于28 ℃培养24 h,MRS固体平板置于28 ℃培养48 h。挑取形态、大小不同的菌落进行二次划线培养,并根据菌落形态特征进行第三次划线培养,直至获得纯培养物。收集纯培养物,加入LB或MRS液体培养基,并加入无菌甘油使其终浓度为20%,转移至菌种保藏管中置于-80 ℃冰箱中保存。
1.2.2 分离菌株的基因组DNA提取
将获得的纯培养物接种到LB或MRS液体培养基中,其中MRS平板上筛选的菌株接种于MRS液体培养基,其它细菌接种于LB液体培养基,置于28 ℃、200 r/min恒温摇床培养8~12 h,收集菌体,使用细菌基因组DNA提取试剂盒分别提取分离菌株的基因组DNA,将提取的DNA样品置于-18 ℃冰箱中保存备用。
1.2.3 分离菌株的鉴定
以提取的细菌基因组DNA为模板,通过PCR扩增分离菌株的16S rRNA和gyrB基因,16S rRNA的上游引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′,芽孢杆菌属gyrB[9]的上游引物:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′下游引物:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s;52~56 ℃退火30 s;72 ℃延伸1 min;35个循环;72 ℃终延伸10 min。PCR扩增产物经琼脂糖凝胶电泳检测后,阳性PCR产物委托广州艾基生物技术有限公司测序。测序结果在NCBI中的Blastn上进行序列初步的比对分析。
1.2.4 药敏实验
参考美国临床与实验室标准协会(CLSI)规定的纸片琼脂扩散法(K-B法)检测分离菌株对11种抗生素的敏感性[10]。以金黄色葡萄球菌ATCC25923(芽孢杆菌和肠球菌的质控菌株)和大肠杆菌ATCC25922(乳杆菌和片球菌的质控菌株)作为质控菌株对分离菌株进行11种抗生素的药敏实验。所用抗生素为氯霉素、恩诺沙星、罗红霉素、复方新诺明、链霉素、四环素、庆大霉素、青霉素、氟苯尼考、万古霉素、头孢氨苄。药敏实验的具体操作步骤参考文献[11,12],将分离得到的乳杆菌和片球菌在MRS固体平板上培养48 h,然后挑取单克隆菌落接种于MRS液体培养基,其它菌株在LB固体平板上培养24 h后,挑取单克隆菌落接种于LB液体培养基,将液体培养基于37 ℃、200 r/min 摇床培养12 h,收集菌体,以0.65%生理盐水重悬,使用麦氏比浊仪将菌液浓度调整为0.5个麦氏标准单位,吸取200 μL菌悬液均匀涂布于MRS固体平板、MH固体平板,乳杆菌和片球菌的菌悬液涂布于MRS固体平板,其它菌株涂布于MH固体平板,待干后再使用无菌镊子将药敏片贴于平板上,MRS固体平板于37 ℃培养箱培养48 h,MH固体平板于37 ℃培养箱培养24 h,每组三个平行,培养结束后测量并记录抑菌圈直径,受试菌株药敏性的判定标准参考文献[10],对于缺乏耐药、中度敏感(中介)和敏感范围的芽孢杆菌、乳杆菌和片球菌参考其质控菌株金黄色葡萄球菌ATCC25923和大肠杆菌ATCC25922的判定标准,芽孢杆菌参考葡萄球菌的药敏性判定标准,乳杆菌和片球菌参考肠杆菌的判定标准。各药敏纸片的含药量及主要分离菌株药物敏感性的判定标准见表2。

表2 抗菌药物敏感性判定标准Tab.2 Decision criteria of antimicrobial susceptibility test
1.2.5 抗生素抗性基因的检测
以提取的细菌基因组为模板,采用PCR的方法检测以下抗性基因(antibiotics resistance genes,ARGs)[13-15]:磺胺类耐药基因(sul1、sul2、sul3)、四环素类耐药基因(tetA、tetB、tetC、tetD、tetE、tetM)、氨基糖苷类耐药基因(strA、strB、aac2、aadA、aadK)、大环内酯类耐药基因(ermB、mefA、mphA)、β-内酰胺类耐药基因(blaOXA、blaTEM)。引物序列和退火温度见表3,PCR反应程序参考“1.2.3”,阳性PCR扩增产物委托广州艾基生物技术有限公司进行测序,测序结果用NCBI官网中的Blastn程序与GenBank数据库进行比对。
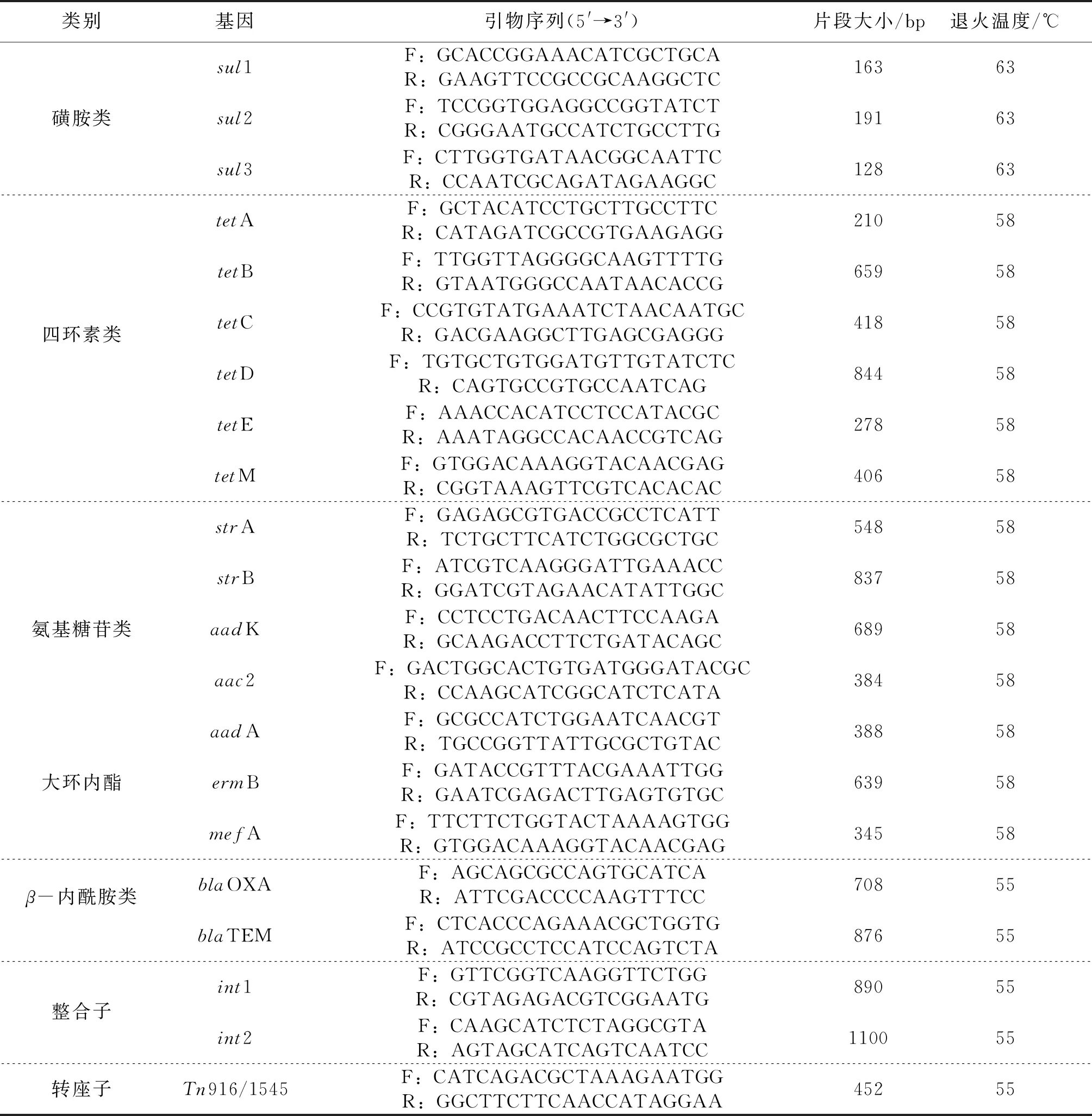
表3 耐药基因引物Tab.3 The primer sequences of ARGs
2 结果
2.1 细菌的分离与鉴定
从45种微生态制剂中共分离纯化获得211株细菌,分离菌株的16S rRNA基因的PCR扩增产物测序结果进行在线Blastn(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&BLAST_SPEC=&LINK_LOC=blasttab)比对分析,初步确定分离菌株的种属分类地位。此外,下载NCBI中与分离菌株16S rRNA基因序列同源性高的芽孢杆菌、肠球菌、乳杆菌等细菌的16S rRNA基因序列,利用MEGA11软件采用N-J法(Neighbor-Joining,NJ)构建分离菌株的16S rRNA基因系统发育树(图1)。除芽孢杆菌属的细菌外,其余菌株均可与其相对应的细菌16S rRNA基因归于一簇,能够利用16S rRNA基因的比对结果和构建的系统发育树将这些细菌确定到种。而芽孢杆菌种属间的16S rRNA基因同源性较高,考虑到芽孢杆菌不同菌种的gyrB基因具有明显的差异性,故采用gyrB基因进一步确定其所属菌种[9]。下载NCBI上与芽孢杆菌同源性高的各菌种gyrB基因序列,利用MEGA 11软件构建芽孢杆菌的gyrB系统发育树(图2)。在gyrB系统发育树中,不同种类的芽孢杆菌被划分为8簇,基于gyrB基因序列的比对结果和构建的gyrB系统发育树从而确定芽孢杆菌的菌种。根据Blastn比对分析结果、16S rRNA 和gyrB系统发育树的结果,确定分离菌株隶属于9个属20个菌种,并且以芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)和乳杆菌属(Lactobacillus)为主,其比例分别为71.1%、16.6%、7.6%;产品中菌株的具体分离结果见表4和表5。

图2 基于芽孢杆菌gyrB基因序列的系统发育树Fig.2 Phylogenetic tree was constructed based on gyrB gene sequences of Bacillus

表4 微生物制剂源菌株分离情况Tab.4 Information of the strains isolated from microbial agents
2.2 药敏实验
质控菌株对各抗生素的药敏实验结果在规定的质控范围内,表明药敏实验结果可靠。从微生物制剂中分离的211株细菌中有98(46.7%)株菌株表现不同程度的耐药性(图3),分离菌株中对磺胺类、氨基糖苷类和大环内酯类抗生素的耐药率最高,分别为27.9%、23.7%、19.9%;头孢类、糖肽类和青霉素类抗生素的耐药菌株比例分别为17.0%、15.6%、13.7%;四环素类、喹诺酮类和酰胺醇类抗生素表现耐药的菌株比例较低,分别为7.6%、6.2%和1.4%。其中,150株芽孢杆菌中有45株表现耐药,耐药芽孢杆菌对除氟苯尼考以外的抗生素表现出不同程度的耐药,对庆大霉素、氯霉素、恩诺沙星、头孢氨苄、链霉素、万古霉素、四环素、罗红霉素、复方新诺明、青霉素表现耐药的菌株比例分别为0.7%、0.7%、0.7%、1.3%、2.0%、6.7%、6.7%、10.7%、13.3%、15.3%(表6)。分离菌株中多重耐药菌株的比例为30.8%(图4),芽孢杆菌主要表现为2重耐药和3重耐药;乳酸菌和肠球菌的耐药性较强,乳杆菌和乳球菌主要表现为4重和5重耐药,肠球菌主要表现为3重、4重和5重耐药。

图3 分离菌株药敏实验结果Fig.3 The results of the antibiotic sensitivity test of isolates
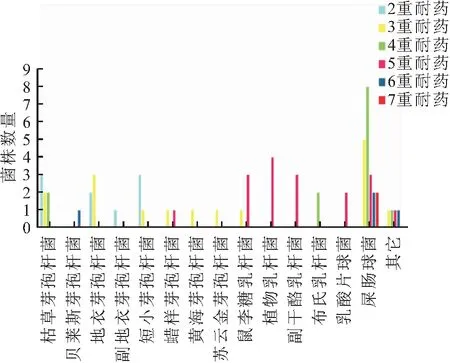
图4 分离菌株的多重耐药情况Fig.4 The distribution of multi-drug resistance of isolates
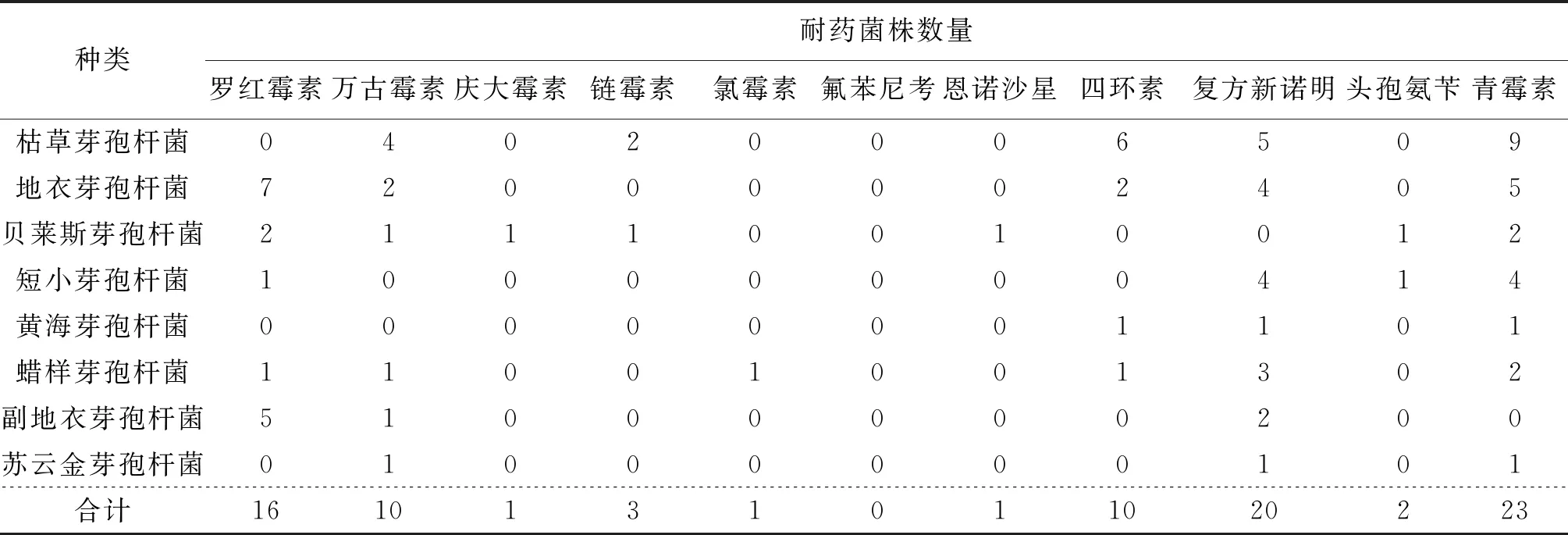
表6 芽孢杆菌对不同药物的敏感性Tab.6 Susceptibility of Bacillus to different antibiotics
2.3 ARGs的定性检测及分布
根据药敏实验结果,挑选79株耐药性较强和耐药重数较高的耐药菌株,其中有28株芽孢杆菌(11株枯草芽孢杆菌、6株地衣芽孢杆菌、5株短小芽孢杆菌、2株贝莱斯芽孢杆菌、2株蜡样芽孢杆菌、1株副地衣芽孢杆菌、1株苏云金芽孢杆菌)、28株肠球菌、16株乳杆菌、3株醋杆菌、2株片球菌、1株邻单胞菌和1株肠杆菌,进一步对其耐药基因和可移动遗传元件(整合子int1、int2和共轭转座子Tn916/1545)进行检测。耐药基因的PCR电泳检测结果如图5,对阳性PCR扩增产物进行测序,测序结果用NCBI官网中的Blastn程序与GenBank数据库进行比对,序列与数据库的相应基因的序列相似性≥97%,确定扩增产物为目的耐药基因。本研究发现79株耐药菌株中检出耐药基因的共计59株,不同种属检出耐药基因的菌株结果见表7,并且sul2、sul3、tetC、aadK、aadA、ermB、mefA耐药基因的检出率分别为34.2%、26.6%、7.6%、53.2%、19.0%、10.1%、2.5%,其他耐药基因检测结果为阴性(表7)。氨基糖苷类和磺胺类耐药基因的检出率显著高于其它耐药基因,分别为53.2%和40.5%,并且79株耐药菌株中携带多重耐药基因的菌株比例为40.5%,以肠球菌同时携带氨基糖苷类和磺胺类耐药基因为主。可移动遗传元件(共轭转座子Tn916/1545)检出率为13.9%,未检测到int1和int2。

图5 耐药基因PCR扩增产物的电泳图谱Fig.5 Detection of drug resistance genes by electrophoresisMarker:DL1000;1-7:sul3,sul2,tetC,aadK,aadA,ermB,mefA。
3 讨论
本研究从45种水产用微生物制剂中分离到211株细菌,分离菌株经过分子生物学鉴定,结果显示这些菌株可分为9个属,其中芽孢杆菌属比例最高(72.0%);其次是肠球菌属(16.6%),再次是乳杆菌属(7.6%)。根据2013年农业部发布的饲用添加菌种名单,本研究中分离的菌株符合上述名单的菌株只有137株[16],其比例为64.9%。从微生物制剂里还分离得到4株潜在的致病菌,分别是3株蜡样芽孢杆菌(Bacilluscereus)和1株类志贺邻单胞菌(Plesiomonasshigelloides),只有一株蜡样芽孢杆菌不具有溶血活性,其余3株菌株均具有溶血活性,并且,分离得到的蜡样芽孢杆菌携带溶血性肠毒素基因(hblA、hblB),不符合我国饲用微生物添加剂使用菌株的安全标准;对分离的4株潜在致病菌进行了其对斑马鱼(Daniorerio)的致病性实验,斑马鱼在攻毒7天内均有不同程度的死亡现象(25%~90%),表明这4株细菌均具有一定的致病性。蜡样芽孢杆菌是引起食源性疾病的常见细菌之一,当食品中蜡样芽孢杆菌的数量超过103CFU/g时,会对食用者造成潜在的危害,因此,诸多国家为防止蜡样芽孢杆菌导致食物中毒对其在食品中的含量进行了明确规定,蜡样芽孢杆菌能够通过产生肠毒素和呕吐毒素导致食物中毒,主要症状表现为呕吐、腹泻,临床上偶尔会通过菌体感染导致眼部疾病、心内膜炎、脑膜炎、菌血症等疾病[17];蜡样芽孢杆菌同样可以导致多种水产经济动物如半滑舌鳎(Cynoglossussemilaevis)[18]、罗非鱼(Oreochromisniloticus)[19]等发病甚至死亡。类志贺邻单胞菌是一种可导致人、畜、鱼共患病的条件致病菌,类志贺邻单胞菌感染能够引起急性肠胃炎、脑膜炎、蜂窝组织炎、骨髓炎、菌血症等疾病[20]。这两种致病菌均可使人、畜、鱼患病,水产用微生物制剂中含有致病菌不仅对养殖动物造成潜在的致病风险,而且可能会危害水生态环境,进而威胁公共卫生安全。

表8 抗生素抗性基因检出率Tab.8 Detection rate of ARGs
抗生素的长期使用引起养殖环境中的细菌普遍具有耐药性和抗性基因,微生物制剂中的菌株主要来源于养殖环境和健康动物,若生产厂家开发微生物制剂时未对其进行耐药性检测或者生产过程不规范引入了其他的耐药性细菌等,均会增加市售微生物制剂中存在耐药菌和耐药基因的可能性。通过对微生物制剂中分离得到的菌株进行实验室常用抗生素的耐药性检测,我们发现46.7%的菌株表现不同程度的耐药性,其中对氨基糖苷类、β-内酰胺类和磺胺类抗生素耐药的菌株比例最高,可能与这些抗生素作为兽药的使用历史悠久,以及抗生素的滥用有关,因为每年的水产品样品检测中时常有关于检出禁用抗生素和可用抗生素超限量使用的报道[21]。根据药敏实验结果,本研究进一步对耐药菌的耐药基因及可移动遗传元件进行检测,耐药基因sul2、sul3、tetC、aadA、aadK、ermB、mefA、Tn916/1545的PCR扩增序列与数据库的相应序列相似性≥97%,进一步验证了阳性PCR产物扩增的结果。氨基糖苷类、磺胺类耐药基因的检出率与药敏实验结果的氨基糖苷类、磺胺类耐药菌耐药比例相符;然而,β-内酰胺类和大环内酯类耐药基因检出率与药敏实验结果不符,这可能是由于乳酸菌对β-内酰胺类抗生素具有天然的耐药性,而肠球菌细胞壁坚厚,抗生素难以进入菌体,并且肠球菌可产生一种特殊的青霉素结合蛋白(PBPS)导致其对青霉素耐药[22],而大环内酯类耐药基因的检出率低于其耐药表型,可能是由于大环内酯类耐药基因众多,本研究中仅检测了几种常见的大环内酯类耐药基因,存在部分耐药基因未被检测到,可能正是由于这些原因造成了β-内酰胺类和大环内酯类耐药菌数量多但耐药基因检出率低的原因。
本研究中74.7%耐药菌株携带耐药基因,耐药基因sul2、sul3、tetC、aadK、aadA、ermB、mefA检出率分别为34.2%、26.6%、7.6%、53.2%、19.0%、10.1%、2.5%,表明大规模使用相关产品会造成耐药基因扩散的安全风险。耐药基因的水平转移是细菌获得性耐药的主要方式,即使携带ARGs的菌株死亡,仍然可以将携带ARGs的DNA释放环境中,并可以转移到其它微生物体内[23]。施嘉琛等[24]发现北京温榆河流域大肠杆菌(Escherichiacoli)对氨苄青霉素、四环素、磺胺和左氧氟沙星耐药率分别为10%~35%、5%~25%、10%~35%、0~15%,且随着抗生素使用时间的增加,耐药率也逐渐增高。魏文娟等[25]检测了36株对虾源副溶血弧菌(Vibrioparahaemolyticus)对16种抗生素的耐药性及相关耐药基因携带情况,发现检测菌株均表现耐药以及检出耐药基因,但耐药基因的检出率与耐药表型并不完全相符,与本研究结果一致,体现了细菌耐药机制的复杂性和耐药基因的多样性。洪斌等[26]分析了凡纳滨对虾((Litopenaeusvannamei)和罗氏沼虾(Macrobrachiumrosenbergii)肠道微生物的耐药性,凡纳滨对虾肠道微生物携带15种ARGs,tetA、tetS、strA、strB、floR、sul2耐药基因的检出率为100%,罗氏沼虾肠道微生物携带14种ARGs,其中,SHV、tetA、tetS、aadA、qnrS、sul1、sul2耐药基因的检出率为100%。由于不同地区抗生素的使用剂量和使用频率不同,养殖环境、养殖动物体内耐药菌和耐药基因的分布和丰度也有相应的差异,农业农村部在《直接饲喂微生物和发酵制品生产菌株鉴定及其安全性评价指南》中将携带获得性耐药基因的微生物制剂产品判定为具有危害[27],微生物制剂中耐药基因的检出,表明这些不合格的微生物制剂产品具有一定的安全风险,在实际应用时,可能会大量使用这些不合格的微生物制剂,具有成为耐药基因储存库的可能性,从而影响环境中耐药菌及耐药基因的分布和丰度,尤其对抗生素抗性基因丰度低的环境,风险更大,并且,耐药菌携带的耐药基因可以通过多种方式转移到其它微生物和动物体内,进而威胁人类健康和生态安全。
耐药菌可通过整合子、转座子、接合性质粒等遗传元件在细菌间水平传播耐药基因,整合子和转座子不仅是ARGs实现水平转移的重要媒介,同时也介导细菌产生多重耐药[28]。刘淑梅等[29]调查了390株多重耐药肠球菌的耐药性及整合子的携带情况发现,53.1%的粪肠球菌(Enterococcusfaecalis)和51.5%的屎肠球菌(E.faecium)携带Ⅰ类整合子int1,所有整合子均携带aadA2基因。左志晗等[30]研究发现天津市周边地区凡纳滨对虾肠道中β-内酰胺类和磺胺类的耐药菌的数量显著高于其它类抗生素耐药菌,磺胺类和青霉素类耐药基因的检出率最高为63%、61.4%,整合子int1和int2的检出率分别为42.7%和41.5%。陈招弟等[13]研究发现100株微生物制剂源耐药菌转座子Tn916/1545、整合子int1、插入序列ISaba1和接合型质粒遗传标记traA的检出率分别为100%、91%、78%、23%,两种及两种以上的可移动遗传元件检出率为95%。因此,本研究对整合子int1、int2和转座子Tn916/1545进行检测,只有13.9%的耐药菌株携带共轭转座子Tn916/1545,并未检测到整合子int1和int2,这也间接表明本研究中耐药菌株携带可移动遗传元件的比例较低,其耐药基因水平转移的风险相对较小。微生物制剂中可遗传元件的检出,表明其存在将耐药基因水平转移给其它微生物的可能性,具有一定的安全风险。
市售微生物制剂中检测出潜在的致病菌、耐药菌及抗生素抗性基因,表明相关产品存在一定的安全风险。不合格或不规范的微生物制剂可以成为耐药基因的储存库,不仅增加耐药菌的扩散,还会促进耐药基因的水平传播,带来更多的生物安全风险。相关部门应完善生产和检测标准,加强对微生物制剂的市场监管,培养专业人员建立完整的监管和可追溯体系,完善微生物制剂的标准体系,从而确保渔用微生物制剂的安全、高效,促进水产行业的绿色健康发展。

