99mTc-MDP SPECT/CT显像在盆腔肿瘤放疗后骨盆功能不全骨折诊断中的应用
严肃 杨建忠 周程敏 程鹏
骨盆功能不全骨折(pelvic insufficiency fracture,PIF)是盆腔肿瘤放疗后常见的远期并发症,常引起腰骶部、腹股沟持续性疼痛[1-2]。如果对放疗后PIF认识不足,极易将其误诊为骨盆转移瘤、椎间盘突出或骶髂关节病变,从而导致不必要的活检或过度治疗,这些对患者是非常不利的。因此,正确诊断PIF对指导临床治疗至关重要[3-4]。本研究拟探讨99mTc-MDP SPECT/CT显像在盆腔肿瘤放疗后PIF诊断中的价值。
方法
1. 研究对象
收集2015年1月—2021年12月本院50例因盆腔肿瘤放疗后行CT及SPECT/CT检查疑似PIF患者的资料,其中男性15例,女性35例,年龄45~84(52.3±12.5)岁。根据国际妇产科联盟(FIGO)分期,宫颈癌ⅠA1~ⅠB2期29例,ⅠB3~ⅣA期4例;接受根治性放疗8例,术后辅助放疗21例,同步放化疗4例。前列腺癌12例,在根治性前列腺切除术后1年内进行辅助放疗。直肠癌5例,术后分期为Ⅱ~Ⅲ期,术后4~8周进行辅助放疗。所有患者放疗前均行CT、MRI检查,42例行双能X线骨密度检查。放疗后3~9个月进行CT、MRI随访。怀疑发生PIF时均行CT和SPECT/CT检查,35例行MRI检查,29例行骨密度检查。PIF纳入标准:①骨盆病灶位于放疗区域内,有不同程度腰骶部、髋部或腹股沟疼痛,持续4周以上。②无明显外伤史,无长期连续、反复过度应力运动。③1周内行CT和SPECT/CT检查,CT表现为骨皮质连续性中断,骨小梁变形、减少或消失,同时可能出现骨痂形成的硬化区域。④最终诊断以病灶穿刺活检的病理结果,或之后影像检查随访至少6个月、无可疑肿瘤复发转移为准。本研究符合《赫尔辛基宣言》。
2. CT检查
使用Siemens Somatom Definition Flash双源CT,管电压120 kV,管电流240 mA;图像重建层厚5 mm,标准算法重建(B30f),回顾性薄层重建(层厚0.75 mm,间隔0.5 mm)。
3. SPECT/CT显像检查
采用Philips Precedence16型 SPECT/CT扫描仪;显像剂99mTc-MDP由上海欣科医药有限公司苏州分公司提供,放化纯度>95%。静脉注射99mTc-MDP 740~925 MBq(20~25 mCi),嘱患者多饮水、勤排尿,注射后2 h嘱患者排空膀胱检查。先行全身骨显像:取仰卧位,采用低能平行准直器,双探头对全身行前、后位显像,扫描速度150 mm/min,窗宽20%,采集矩阵512×1024。再对骨盆行CT和SPECT断层显像,CT扫描参数:管电压120 kV,管电流150 mA,螺距0.938,重建层厚5.0 mm,间隔2.5 mm;SPECT采集64帧,10 s/帧,窗宽20%,采集矩阵64×64,连续采集360°。在EBW-NM 2.0工作站进行图像融合,获得横断面、矢状面和冠状面SPECT、CT断层图像以及融合图像。
4. 图像分析
由2名从事影像诊断的副高及以上医师采用双盲进行阅片,分析显像剂浓聚分布特点、骨质CT改变及有无软组织肿块,诊断意见不同时协商达成一致。PIF影像诊断标准[2]如下:
(1)CT:局部骨皮质不连续,松质骨内见低密度骨折线,周围有(或无)硬化带.
(2)SPECT/CT显像:全身骨显像表现为骶骨“H”形或“蝶”形显像剂浓聚,平行于骶髂关节的双侧骶骨翼浓聚,平行并垂直于单侧骶髂关节的单侧骶骨翼和骶骨体浓聚,垂直于骶髂关节的骶骨体浓聚,耻骨或坐骨的“纺锤”形浓聚;融合显像表现为显像剂浓聚沿骨折线和/或硬化带分布或者仅有显像剂浓聚而无骨折线和/或硬化带。
(3)排除诊断:骨质异常区出现软组织肿块。
5. 统计学分析
采用SPSS 19.0软件分析数据,分别计算CT和SPECT/CT显像诊断PIF的灵敏度、特异度、准确度、阳性预测值、阴性预测值,采用χ2检验比较2种检查方法之间的差异,P<0.05表示差异有统计学意义。
结果
1. 一般资料
50例疑似PIF患者经穿刺活检或影像随访确定诊断,随访6~48个月。最终20例诊断为PIF(1例穿刺活检确诊,19例影像随访确诊),其余30例排除PIF(宫颈癌骨盆转移12例,直肠癌骨盆转移2例,前列腺癌骨盆转移10例,单纯骨质疏松4例,骶髂关节炎2例)。20例PIF患者中,宫颈癌15例,前列腺癌2例,直肠癌3例;从开始放疗至影像发现PIF中位时间为11个月(5~32个月)。放疗前后均行DXA检查18例,其放疗前T值为-2.6±0.4SD,放疗后T值为-3.1±0.6SD;2例仅放疗后行DXA检查,T值分别为-2.8SD和-3.0SD。
2. PIF的CT和SPECT/CT表现
CT检查12例显示骨折线和硬化带,8例漏诊中2例仅显示硬化带而无明确骨折线,其余6例显示骶骨翼骨质密度减低而未见骨折线及硬化带。
全身骨显像联合骨盆SPECT/CT融合显像共发现显像剂浓聚灶25处,其中骶骨19处,L5椎体3处,耻骨2处,坐骨1处。全身骨显像中6例表现为典型的骶骨“H”形或“蝶”形显像剂浓聚(图1),3例表现为平行于骶髂关节的双侧骶骨翼浓聚,3例表现为平行并垂直于单侧骶髂关节的单侧骶骨翼和骶骨体浓聚,1例表现为垂直于骶髂关节的骶骨浓聚,1例表现为单侧耻骨的“纺锤”形浓聚并单侧骶髂关节浓聚,1例为单侧坐骨的“纺锤”形浓聚并双侧骶骨翼浓聚。
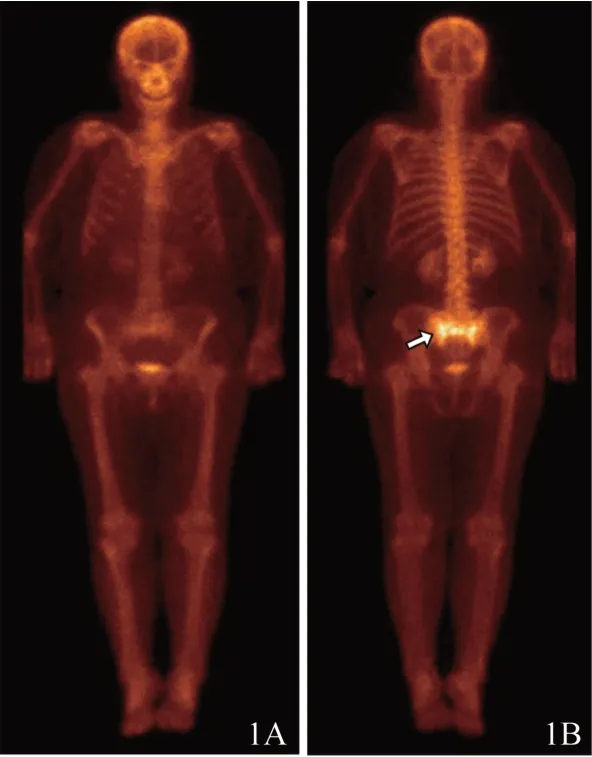
图1 73岁宫颈癌放疗后PIF患者的99mTc-MDP SPECT全身骨显像图A. 前位;B. 后位,骶骨“蝶”形显像剂浓聚(箭示)。
SPECT/CT融合显像12例表现为骶骨翼、骶骨体显像剂浓聚沿骨折线分布,骨松质内骨小梁稀疏伴点条状骨质硬化带(图2)。1例双侧骶骨翼显像剂浓聚,而CT未见明显骨折线及硬化带,3个月后复查CT见骨痂形成(图3)。2例耻骨与坐骨的“纺锤”形浓聚沿骨折线和硬化带分布,3例同时伴有L5椎体骨折呈“楔形”和“鱼椎”样改变。1例骶骨体浓聚伴左侧股骨颈浓聚,相应CT示股骨颈骨折,而未见骨质破坏及软组织肿块。1例骶骨翼浓聚处,CT显示骨小梁消失呈类圆形低密度区,周围见硬化带。8例行MRI检查的患者,CT显示的骨折线有6例可在MRI上观察到,表现为骶骨线状低信号伴周围弥漫性T2WI STIR高信号骨髓水肿;另外2例仅显示为骶骨翼的骨髓水肿而未见明确骨折线。
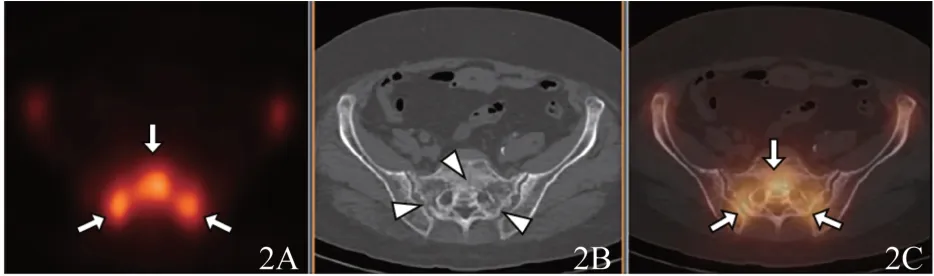
图2 71岁宫颈癌放疗后PIF患者的SPECT/CT融合图像A. 骨盆SPECT断层显像,双侧骶骨翼和骶骨体显像剂浓聚(箭示);B. 同机CT图像,相应部位低密度骨折线及硬化带(箭示);C.SPECT/CT融合图像,放射性浓聚沿骨折线和硬化带分布(箭示)。
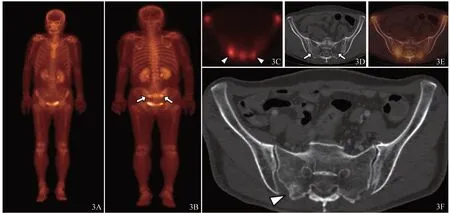
图3 66岁宫颈癌放疗后PIF患者的全身骨显像、SPECT/CT融合显像及复查CT图A和B均为全身骨显像,后位示双侧骶骨翼显像剂浓聚(箭示);C. 骨盆SPECT断层显像,双侧骶骨翼显像剂浓聚(箭示);D. 同机CT图像,未见骨质异常改变(箭示);E. SPECT/CT融合图像,显像剂浓聚区未见骨质改变;F. 3个月后复查CT,显示右侧骶骨翼骨痂形成(箭示)。
3. CT和SPECT/CT显像比较
CT检出PIF 12例,8例为假阴性;SPECT/CT显像检出PIF 19例,1例假阴性(表1)。SPECT/CT显像诊断PIF的灵敏度、准确度高于CT,特异度低于CT,阳性预测值和阴性预测值也均高于CT(表2),2种方法诊断PIF差异有统计学意义(χ2=24.253,P<0.001)。

表1 2种检查方法诊断PIF结果比较(例)
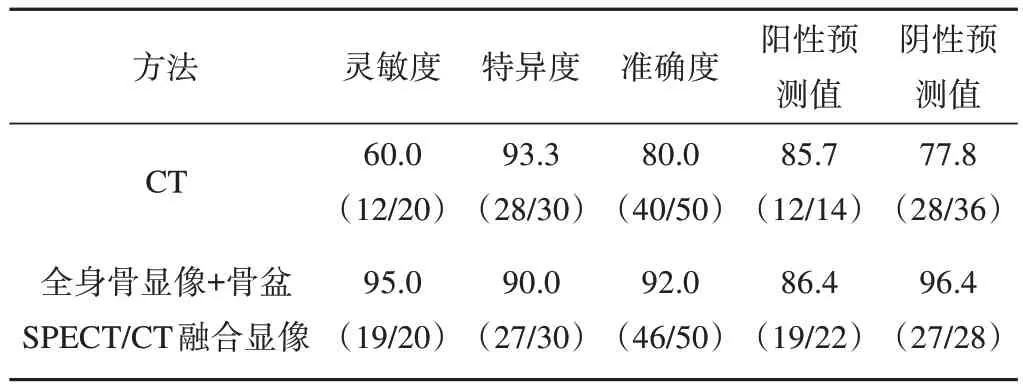
表2 2种检查方法诊断PIF结果比较(%)
讨论
放射治疗是盆腔肿瘤的一种重要治疗方法,自引入以铂为基础的放化疗以来,患者的存活率有所提高,但治疗的不良反应也随之而来,尤其是放疗后发生PIF常引起腰骶部、腹股沟顽固性疼痛,临床上容易误诊为骨盆转移瘤、椎间盘突出或骶髂关节炎从而导致不恰当的治疗。PIF属于应力性骨折(stress fracture,SF),是由于骨矿含量减低、骨弹性抵抗力减弱,不能承受正常生理活动的肌肉牵拉,从而引起骨皮质和/或骨小梁骨折[5]。骨质疏松是PIF的根本原因,放疗是重要的诱发因素,在骨质疏松的基础上加剧了PIF的发生。本组PIF中,15例宫颈癌患者及1例女性直肠癌患者放疗前骨密度检测提示骨质疏松,放疗后骨质疏松加剧且并发功能不全骨折。此外激素治疗、类风湿性关节炎、甲旁亢、成骨不全等也增加了PIF的发生率[6]。有学者报道前列腺癌患者采用雄激素剥夺治疗后,骨密度减低增加了骨折的风险[7]。本研究中2例前列腺癌患者放疗前骨密度检测未见骨质疏松,经放疗和雄激素剥夺治疗后出现明显骨质疏松伴PIF发生,与文献报道相符。PIF好发于骶骨,其次是椎体和耻骨。放疗时,骨盆诸骨及下腰椎均位于照射野内,而骶骨作为脊柱负重转移力量到骨盆的直接位置,是PIF的好发部位。
PIF的影像检查中,CT对细微骨折的显示较好,诊断PIF的准确性较高,可以清晰显示病变区骨折线及骨痂形成的硬化带,但对早期PIF的细微骨小梁骨折或骨挫伤容易漏诊。MRI显示骨髓水肿较好,T1WI表现为弥漫性低信号,T2WI STIR呈高信号,但对骨折线显示不敏感[8]。本组病例中2例骶骨功能不全骨折,T1WI和T2WI均不能显示明确骨折线,仅在T2WI STIR序列上显示骶骨翼高信号骨髓水肿。Adrian等[9]认为T1增强图像有助于诊断骨折线,当骨髓水肿部位出现不强化的线状低信号被认为是骨折线。但当病变部位同时存在骨折线和硬化带时,则不容易区分骨折线和骨痂。
SPECT/CT全身骨显像诊断PIF的灵敏度比较高,能够早期反映骨组织代谢异常。当病灶位于骶骨时,表现为典型的“H”形或“蝶”形显像剂浓聚,即2条平行于骶髂关节的骶骨翼浓聚区和一条垂直于骶髂关节的骶骨体浓聚区组成[10]。本组病例有6例表现为此典型征象,概率为40%(6/15),与文献[11]报道相近。不典型表现包括平行于骶髂关节的双侧骶骨翼浓聚、平行并垂直于单侧骶髂关节的单侧骶骨翼和骶骨体浓聚以及耻骨或坐骨的“纺锤形”浓聚。
虽然全身骨显像对放射性核素摄取增加比较敏感,但不具特异性[12],当骨骼退变、炎症、肿瘤均表现为显像剂浓聚时,很难与PIF鉴别。联合局部SPECT/CT融合显像可以观察放射性浓聚灶的骨质改变及周边软组织,明显提高PIF的诊断准确率。本组病例全身骨显像联合骨盆SPECT/CT融合显像诊断PIF 19例,均表现为放射性浓聚灶沿骨折线及硬化带分布,诊断准确率达92.0%(46/50),明显高于CT。
此外,SPECT/CT融合显像对部分仅有放射性浓聚而无骨质改变的早期PIF的诊断具有较高的价值。单纯CT对隐匿性骨折或骨挫伤极易漏诊,而SPECT断层显像则表现为放射性浓聚。本组病例中有1例患者放疗后6个月全身骨显像和SPECT断层显像均显示双侧骶骨翼显像剂浓聚,但同机CT未发现骨质异常;3个月后复查CT骶骨翼出现硬化带。
PIF需与骨盆转移瘤、外伤性骨折和骶髂关节炎相鉴别。骨盆转移瘤大多表现为结节状或团块状显像剂浓聚,病灶的显像剂摄取往往高于PIF;同机CT可见骨质破坏及成骨改变,周围伴有软组织肿块。此外,PIF经治疗后复查,病灶显像剂摄取逐渐减低;而骨盆转移瘤常进展,骨质破坏范围增大、转移灶增多。外伤性骨折则有明确外伤史,骨折线周围没有硬化带。骶髂关节炎常是双侧发病且对称,X线和CT表现为关节面糜烂和骨质硬化,MRI表现为软骨下骨髓水肿。
总之,全身骨显像表现为典型的骶骨“H”形、“蝶”形显像剂浓聚、耻骨和坐骨的“纺锤形”显像剂浓聚容易诊断PIF。当病灶不典型时,联合骨盆SPECT/CT融合显像可以显著提高PIF的诊断准确率。
本研究尚存在一定的局限性:首先,样本数量较少,统计数据存在偏倚;其次,未比较与MRI影像之间的差异,尚缺乏对放疗后PIF的全面、深入的认识。今后将扩大样本量进一步研究。

