基于增强CT影像组学预测糖尿病状态下急性胰腺炎复发
钟舒婷 黄小华 杜青林 陈雨薇 贾清 李曼
复发性急性胰腺炎(recurrent acute pancreatitis,RAP)是指2次或2次以上急性胰腺炎(acute pancreatitis,AP)发生,2次发作至少间隔3个月且发作AP间期恢复或几乎达到正常水平[1]。目前大概有10%~30%AP患者复发[2]。2型糖尿病(type 2 diabetes mellitus,T2DM)是最常见的糖尿病类型,全世界大约95%的糖尿病病例是T2DM[3]。T2DM患者与非糖尿病患者相比,患AP的风险可能增加84%[4],且中国糖尿病患者患AP的风险较高[5]。糖尿病促进和加重AP,导致AP反复发作成为RAP[6]。而RAP会增加患者患慢性胰腺炎和胰腺癌的风险[7-8]。因此,对T2DM患者首发AP时制定个性化治疗方案降低糖尿病对AP的影响尤为重要。近年来,国内鲜有糖尿病状态下RAP的报道。已有研究[9]基于临床数据和资料,探讨其糖尿病合并RAP的危险因素,然而基于双期增强CT影像组学模型在T2DM状态下预测AP复发的研究较少。因此,本研究的目的是研究基于CT动静脉联合成像影像组学特征的模型在T2DM状态下预测AP复发的价值。
方法
1. 临床资料
本回顾性研究免除受试者知情同意,并获得川北医学院附属医院医学伦理委员会的批准。回顾性收取2016年1月至2019年12月期间于我院确诊的129例T2DM合并AP的患者为研究对象,所有患者均符合AP、RAP及T2DM的诊断标准。
(1)T2DM纳入标准:符合2021年更新的WHO诊断T2DM标准[10]:空腹血糖≥7.0 mmol/L(126 mg/dL),负荷后2 h血糖≥11.1 mmol/L(200 mg/dL),糖化血红蛋白≥6.5%(48 mmol/dL),或随机血糖≥11.1 mmol/L(200 mg/dL)。
(2)AP纳入标准:参考2012年国际共识对亚特兰大分类和定义的修订[11],当符合以下情况≥2种时即可诊断为AP。①上腹部痛(急性发作、持续性、严重的上腹部疼痛,通常辐射到背部);②血清脂肪酶活性(或淀粉酶活性)≥正常上限的3倍;③在增强CT(CECT)和MRI或经腹超声检查中的特征表现。
(3)RAP纳入标准[1]:①≥2次AP发作;②2次发作间隔至少3个月;③发作间期几乎或完全恢复到正常水平。排除标准:①慢性胰腺炎;②胰腺肿瘤及其他恶性肿瘤;③妊娠期糖尿病;④胰腺炎治疗后;⑤1型糖尿病;⑥临床资料不完整、失访患者;⑦图像不清晰、扫描参数不一致;⑧年龄<18岁。
通过电话随访、查看住院记录和询问病史,最终将129例T2DM合并AP患者纳入本次研究。将患者分为T2DM合并首发AP组62例和T2DM合并RAP组67例,再随机地将129例患者以7∶3的比例分为训练集90例(AP 43例,RAP 47例)和测试集39例(AP 19例,RAP 20例)。
2. 检查方法
采用64排(联影UCT710)和64排(BrillianceiCT Elite,美国飞利浦医疗)CT仪行螺旋扫描。扫描参数:管电压120 kV,管电流150 mA,矩阵334×334,采集层厚0.625 mm×64,重建层厚5.0 mm。先行腹部CT平扫,再采用高压注射器经肘静脉以2.5~3.0 mL/s速率团注碘海醇(350 mgI/mL)1.2~1.5 mL/kg进行CT增强扫描,分别于注射后25~30 s、65~75 s扫描获取动脉期和静脉期图像。
3. 图像感兴趣区分割及特征提取
首先对原始图像进行拉普拉斯-高斯变换和小波变换,由2名具有5年以上胰腺疾病诊断经验的腹部放射科医师采用3D Slicer(V4.10.2,https://www.slicer.org)软件在CT动脉期及静脉期图像集上手动绘制胰腺实质,避开血管(图1),分别从动脉期和静脉期中感兴趣区(region of interest,ROI)分别提取了1223个提取影像学特征,包括一阶特征、形状特征和纹理特征,后者包括灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度依赖矩阵(gray level dependence matrix,GLDM)、灰度游程长度矩阵(gray level run-length matrix,GLRLM)、灰度大小区域矩阵(gray level size zone matrix,GLSZM)和相邻灰度差矩阵(neighboring gray tone difference matrix,NGTDM))[12]。从动脉期和静脉期图像中提取了2446个特征。
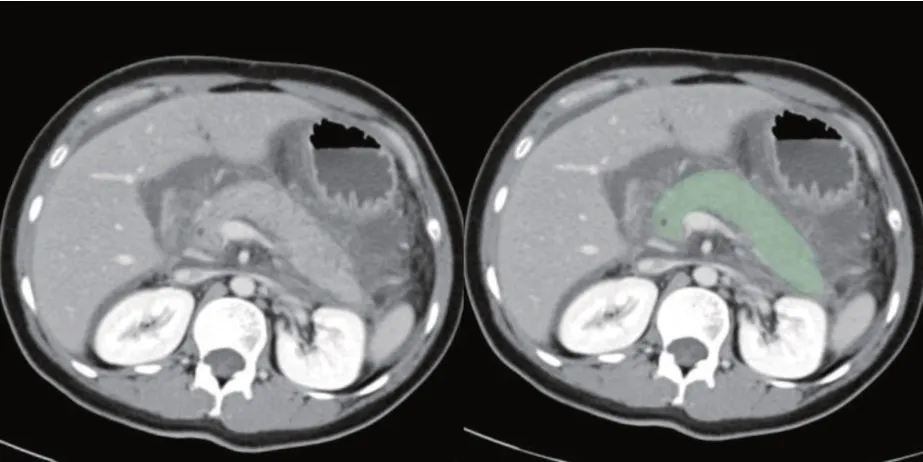
图1 胰腺实质的原始图像(左)和感兴趣区的勾画图像(右,避开血管和胆总管)
4. 评估测量者之间的一致性
从所有患者中随机抽取三分之一,分别由上述2名放射科医生逐层重新勾画,以评价影像组学特征的可重复性。采用组间相关系数(interclass correlation coefficients,ICC)评价各指标间的一致性。ICC>0.75表明影像组学特征具有良好的一致性。
5. 影像组学特征筛选
本研究采用方差阈值法、单变量选择法和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)针对影像组学特征进行筛选。最后通过绘制计算受试者工作特征(receiver operating characteristic,ROC)曲线下面积(AUC)来评价模型的预测效能。
6. 预测模型的构建
将入组患者以7∶3比例随机分成训练集和测试集,训练集∶测试集=90(首发AP∶RAP=43∶47)∶39(首发AP∶RAP=19∶20)。采用随机森林分类器将降维后保留的影像组学特征建立预测模型。为了评估模型的预测价值,记录AUC、灵敏、特异度、准确度和精确度,并使用DeLong检验比较动静脉联合模型和临床模型之间的AUC差异,P<0.05为差异有统计学意义。临床特征分析、模型建立,均在联影uAI Research Portal(V730)软件和R语言(version 4.1.1,https://www.r-project.org)完成。DeLong检验运用Python(3.9.12)进行分析。
结果
1. 临床特征分析
129例入组患者的临床资料显示,T2DM合并首发AP 62例,年龄(53±14)岁,其中男36例,女26例;T2DM合并RAP 67例,年龄(44±11)岁,其中男44例,女23例。t检验用于符合正态分布定量资料,卡方检验用于完全随机设计样本率或构成比的定性资料,非参数秩和检验用于等级资料。T2DM合并AP组和T2DM合并RAP组在性别、严重程度、并发症、有无结石之间无显著差异(均P>0.05),年龄和高脂血症之间有显著差异(均P<0.05,表1)。所有统计学分析均在SPSS 26.0上完成。
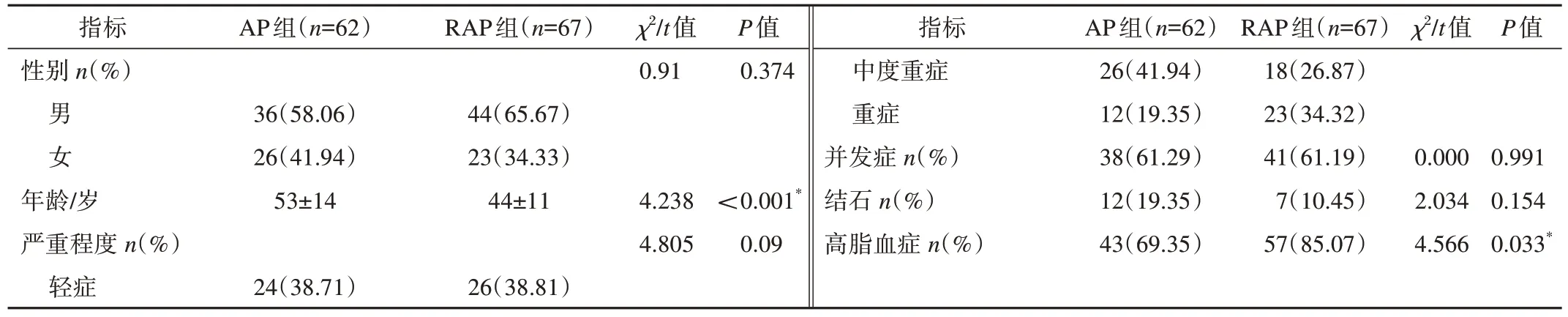
表1 AP组和RAP组的临床特征
2. 影像组学特征分析
总共为每位患者提取2446个放射组学特征。从这些特征中,分别从动脉期和静脉期图像中选择具有高一致性(组间ICC>0.75)的特征,动脉期保留740个稳定特征(图2A),静脉期保留762个稳定特征(图2B),采用方差阈值法消除方差小于0.8的特征;采用单变量选择法消除T2DM状态下首发AP与RAP之间无统计学意义(P>0.05)的特征;最后采用LASSO保留最终对预测复发最重要的特征(图3),动静脉联合模型联合动脉期及静脉期特征筛选之后最终留下的影像组学特征。LASSO选择的非零系数特征名称及各特征系数见表2。
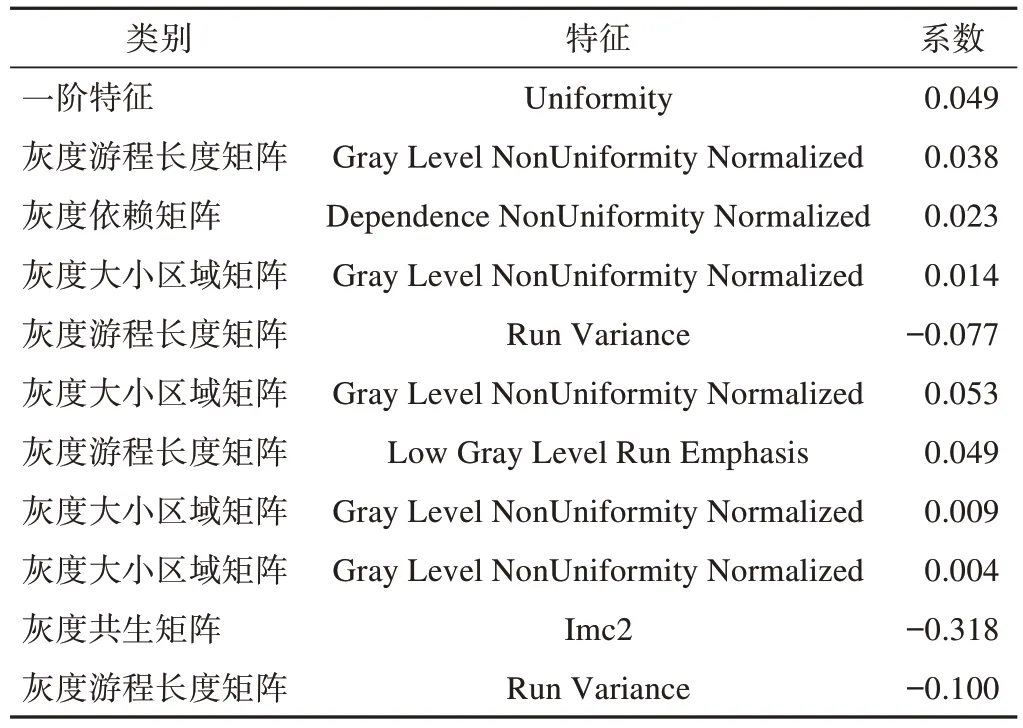
表2 筛选后11个影像组学特征及系数
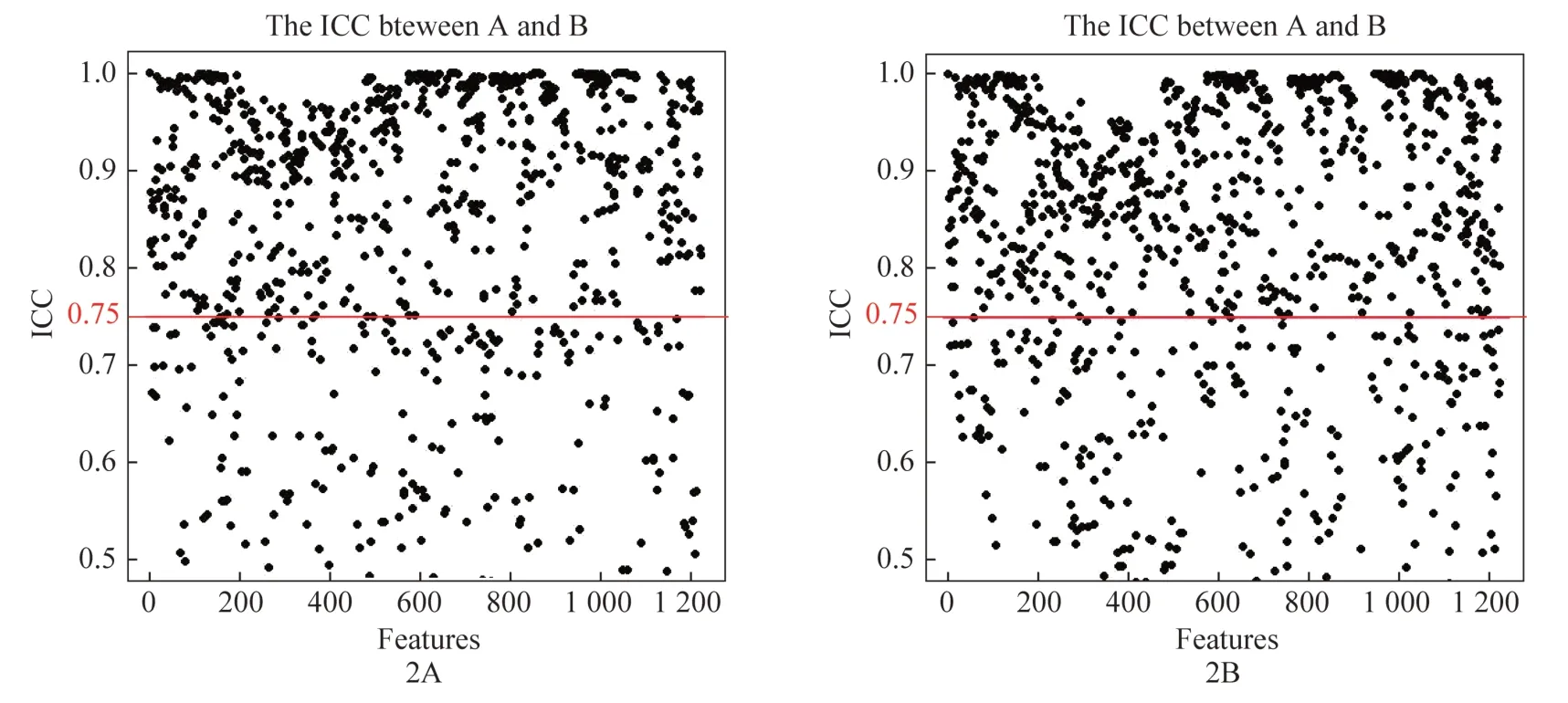
图2 动脉期(A)和静脉期(B)组间一致性检验图
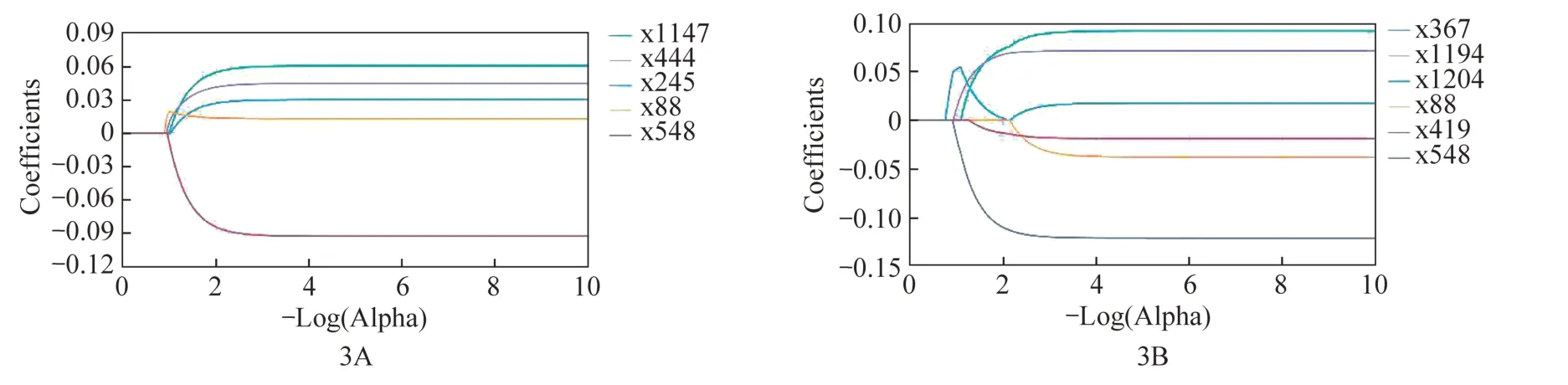
图3 动脉期(A)和静脉期(B)LASSO系数变化曲线
3. 联合模型的建立与评估
动脉期及静脉期最终留下5个和6个影像组学特征,动静脉联合通过随机森林建立基于以上11个特征的影像组学模型和基于年龄和高脂血症的临床模型,基于动静脉期联合模型训练集AUC为0.903(95%CI 0.842~0.964),特异度为 0.767,精确度为0.804,灵敏度为0.872;测试集中AUC为0.843(95%CI 0.720~0.967),特异度为0.737,精确度为0.762,灵敏度为0.800(图4)。基于年龄和高脂血症临床模型训练集 AUC为0.785(95%CI 0.691~0.879),特异度为 0.581,精确度为0.660,灵敏度为0.745;测试集中AUC为0.758(95%CI 0.590~0.926),特异度为0.737,精确度为0.737,灵敏度为0.700(图4)。DeLong检验结果表明,动静脉联合模型的预测效能比临床模型的预测效能高(P<0.05)。详见表3。
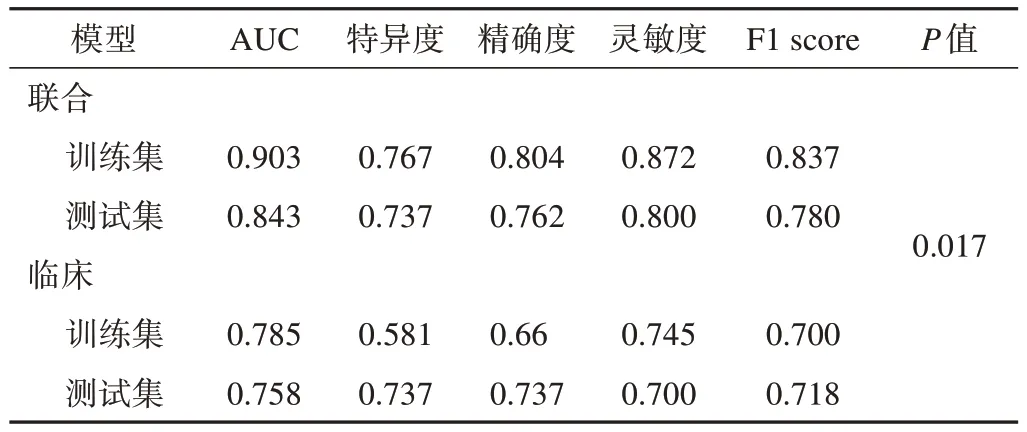
表3 2个模型的预测效能及DeLong检验结果
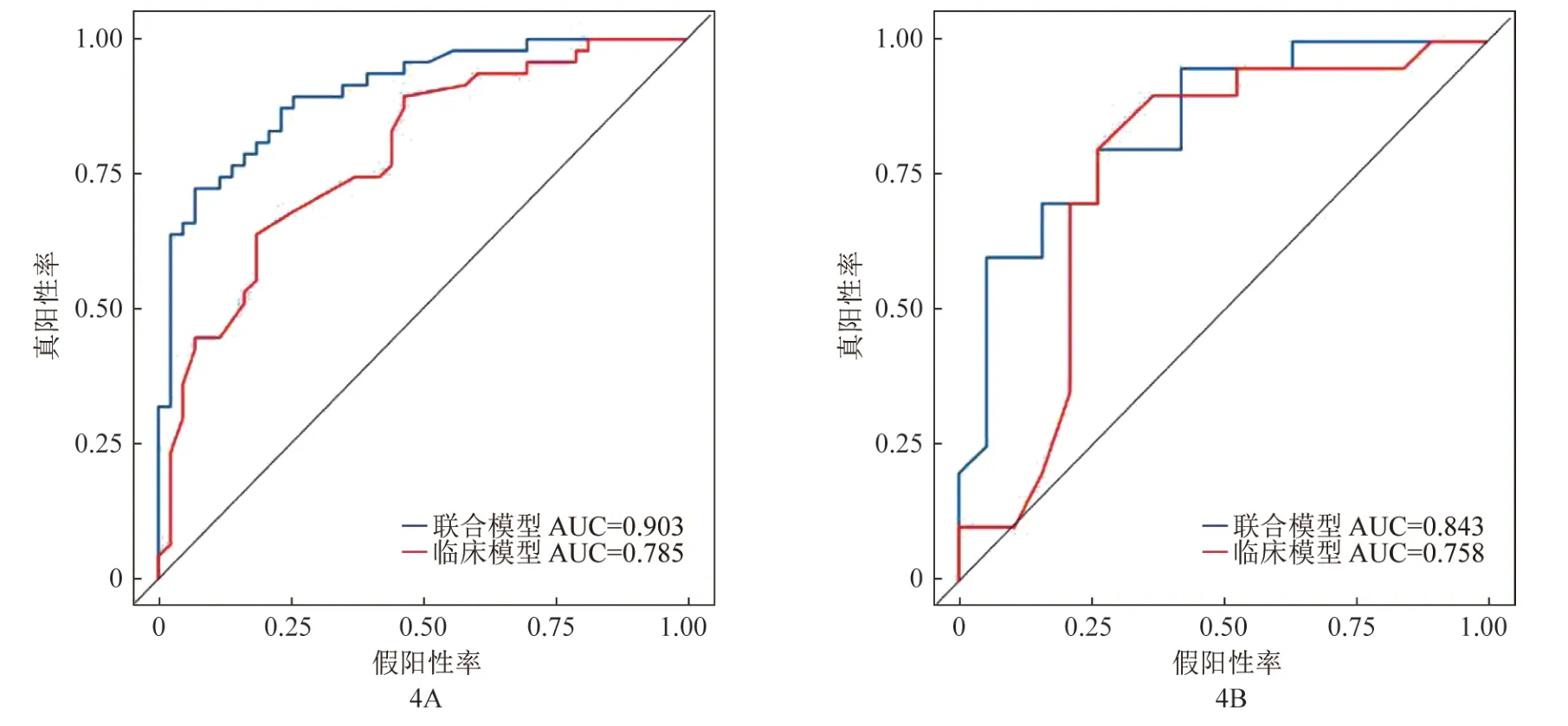
图4 联合模型和临床模型在训练集(A)和测试集(B)的ROC曲线
讨论
这项研究中,采用动脉期和静脉期的11个影像组学特征以及临床数据,建立随机森林预测模型,来预测T2DM状态下AP复发,发现在训练集和测试集中都取得了较好的预测效能。本研究将动静脉期联合以及采用Delong检验比较动静脉联合模型以及临床模型之间的统计学差异,得出预测效能最好的模型,为指导T2DM患者首发AP的治疗提供了一定地临床价值。
1. 相关研究进展
目前,已有研究[13-14]通过建立影像组学模型来预测RAP。但鲜有报道探讨基于影像组学来预测T2DM状态下AP的复发。有部分研究基于临床数据来分析糖尿病和RAP之间的相关性。国外有报道[15]指出了AP与糖尿病的相关性,表明糖尿病是AP发生的独立因素。更有研究[16]利用多因素分析得出糖尿病和高脂血症是RAP发生的独立危险因素。这与杨宁梅等[9]的研究结果一致。而Chen等[17]报道糖尿病患者和非糖尿病患者在严重急性胰腺炎的发生率和复发风险方面没有显著差异,这可能与地域因素和随访时间的差异有关。以上研究均是基于临床数据分析说明糖尿病与RAP之间的相关性,但目前仍鲜见对T2DM状态下首发AP后复发风险进行定量评估的有效手段。本研究基于临床数据和影像组学建立预测模型来进行定量评估。
2. 主要研究结果分析
影像组学分析为从放射成像中提取临床相关信息提供了强有力的工具。影像组学可以通过自动化的高通量特征提取来预测患者的结果,使用大量的训练队列来阐明图像特征和疾病状态之间的微妙关系[18]。相较于CT平扫,增强扫描可以获取更多的影像组学特征,并能显示大部分组织和血管的密度改变。因此本文选择联合动脉期及静脉期提取的11个影像组学特征建立联合模型,其中包括4个GLRLM、1个GLDM、4个GLSZM、1个一阶特征和1个GLCM,其中GLRLM反映用具有同样灰度级的像素点分析纹理图像的复杂程度,主要用于线性结构的方向和变化幅度的分析;GLDM反映了图像中灰度值的依赖性,从一定程度上刻画了邻域中灰度值的分布情况,反映了纹理模式灰度的内在联系;GLSZM描述图像中的灰度区域,表征纹理一致性、非周期性或斑点状纹理效果显著,图像纹理越均匀,矩阵宽度越大,越平坦;一阶特征基于单像素或单体素,通过基本指标定量描述图像中病变区域的像素或体素强度分布;GLCM即对图像内部特征进行定量描述,反映出组织病变处的异质性。基于动静脉联合的11个影像组学特征的预测模型在训练集中的AUC为0.903(95%CI 0.842~0.964),特异度为0.767,精确度为0.804,灵敏度为0.872,在测试集中AUC为0.843(95% CI 0.720~0.967),特异度为0.737,精确度为0.762,灵敏度为0.800。此结论表明联合模型可较好地预测T2DM状态下的RAP。
此外,既往的研究[13,16,19-20]表明高脂血症、年龄、性别、结石、吸烟是发生RAP的危险因素。但本研究获取的临床资料经过统计学分析后,其中只有年龄和高脂血症是T2DM状态下RAP的预测因素,基于年龄和高脂血症的临床模型训练集的AUC为0.785(95% CI0.691~0.879),特异度为0.581,精确度为0.660,灵敏度为0.745;测试集中AUC为0.758(95%CI 0.590~0.926),特异度为0.737,精确度为0.737,灵敏度为0.700。2个模型经过DeLong检验可知,其预测效能差异有统计学意义(P<0.05),表明联合CT双期增强影像组学模型比临床模型的预测效能高。
3. 局限性
本研究的局限性:①本研究的数据是从单个中心获取的,不同中心的扫描协议和参数可能会有所不同,将导致模型的泛化能力较差。②本研究中的数据相对较少,可能导致模型出现过拟合现象。③胰腺实质的勾画范围有时因各种原因导致边界不清,需要有一定影像临床实践经验的医生。④本研究比较了CT双期增强影像组学模型和临床模型,但未来应在扩大样本量的同时联合双期影像组学特征和临床数据建立预测模型。
综上,影像组学模型可以较好地预测T2DM状态下AP的复发,且构建的预测模型可为T2DM患者首发AP时提供个性化治疗方案,减少糖尿病对AP的进一步影响,为临床治疗提供一定的参考价值。

