基于Shapley additive explanations(SHAP)分析乳腺X线检查假阴性乳腺癌的特征
杨蔚 张宁妹 张朝林 尹清云
乳腺癌仍然是全球女性最致命的恶性肿瘤,早期诊断可显著改善患者预后和生存率[1]。乳腺X线摄影(mammography,MG)筛查的广泛推荐应用使死亡率下降20%~40%[2]。由于费用低廉、操作简单、省时、对钙化极其敏感等优势,MG仍然是目前乳腺癌首选的筛查和诊断工具[3]。然而MG作为一种二维成像技术,通过识别可疑病灶的形态特征来判断良恶性,具有较高的假阳性和假阴性率。
MRI是检查乳腺癌最敏感的影像技术,具有最高的准确性和较高的特异性。大量研究[4]建议补充乳腺MRI以提高乳腺癌的检出率,特别是对于乳腺密度较高的女性,MRI能够发现MG检查以外的大约16%~20%的额外病灶。
Shapley additive explanation(SHAP)分析是一种统计学方法,通过R软件,将预先设计好的模型中包含的各个变量的贡献价值用长短不等的直方图展示出来,能够可视化的对整体系统中的每个变量的贡献进行公正的评估,这意味每个变量的价值都能在整体中单独考虑,发挥作用[5]。该方法已被广泛用于数据分析中。
本课题旨在利用一个相对较大的、单中心的长期数据库来回顾性地探讨能够在MRI发现而MG假阴性的乳腺癌相关的临床病理及影像学特征,并应用SHAP分析导致MG假阴性检查结果的主要因素。让影像科医生和临床医生加强认识,提高警惕,适当的补充乳腺MRI检查以提高癌灶的检出率。
方法
1. 临床资料
该研究通过了宁夏医科大学总医院伦理委员会批准(伦理编号:KYLL-2022-0251)。回顾性收集2018年1月—2022年5月来我院就诊的可疑乳腺癌患者2769人。纳入标准:①病理证实为一侧单灶,浸润性或非浸润性乳腺癌伴/不伴导管原位癌(ductal carcinoma in situ,DCIS);②均有MG及MRI检查,且两者相隔时间不超过45 d[6];③临床、病理资料完整,影像图像质量清晰可用;④既往无乳腺癌病史,无放疗、激素治疗或化疗史。排除例数:经病理证实为良性病变的患者983例;MRI和/或MG缺失或MRI和MG检查时间间隔>45 d的147例;病理数据缺失或不完整的56例;既往有乳腺癌病史,或纵隔淋巴瘤、肺癌或卵巢癌史接受了放疗和化疗的38例;单乳多灶性乳腺癌患者67例;MG和MRI检查均为阴性而腋窝淋巴结被病理证实为乳腺癌转移的临床隐匿性乳腺癌6例。最终,1472例患者(包括33例同时性双乳癌)共1505个病灶纳入研究。包括124个DCIS、1个小叶原位癌(lobular carcinoma in situ,LCIS)、10个导管内乳头状癌、1207个浸润性导管癌(invasive ductal carcinoma,IDC)、30个浸润性小叶癌(invasive lobular carcinoma,ILC)和133个其他癌(包括44个髓样癌,43个浸润性微乳头状癌,20个黏液癌,6个大汗腺癌,5个恶性叶状肿瘤,5个淋巴瘤,3个癌肉瘤,3个化生癌,2个浸润性乳头状癌,1个内分泌癌和1个转移癌)。
2. 影像检查方法
为保证图像的真实可靠,所有患者均在穿刺活检,微创旋切或手术前接受MG及乳腺MRI检查。
2.1 MG检查
用Siemens Mammomat Novation DR全数字化乳腺X线机,每例患者均获得双侧乳腺头尾位(craniocaudal,CC)及内外斜位(medio-lateral oblique,MLO)图像。
2.2 MRI检查
所有患者均在GE 1.5 T 或3.0 T MR上进行扫描,包括动态对比增强MRI(dynamic contrast enhancement MRI,DCE-MRI)及弥散加权成像(diffusion-weighed imaging,DWI),使用8通道专用乳腺表面线圈。患者取俯卧位,双乳自然状态置于乳腺线圈中,分别行以下扫描。①横断位DWI:TR/TE 5000 ms/70 ms,层厚4 mm,视野320 mm×320 mm,矩阵132×132,b值分别取0、1000 s/mm2;②矢状位脂肪抑制(fat suppression,FS)快速自旋回波(fast spin-echo,FSE)T2WI:TR/TE 3800 ms/94 ms,层厚2 mm,视野200 mm×200 mm,矩阵288×224;③横断位DCE-MRI梯度回波序列(gradient echo sequence,GRE) FS T1WI:翻转角15°,TR/TE 5 ms/2 ms,层厚2 mm,视野320 mm×320 mm,矩阵448×352。对比剂采用钆喷酸葡胺注射液(Gd-DTPA,商品名为马根维显,拜耳医药保健有限公司生产,0.2 mmol/kg),经肘静脉以2.5 mL/s快速团注,然后10 mL生理盐水冲洗导管内对比剂。注射前后连续采集8个时相,总持续时间432 s。
3. 图像分析
2名放射科医师(分别为21年工作经验的主任医师和4年工作经历的住院医师)在不知晓患者术后病理的情况下独立阅片,若有不一致经商量达成共识。根据第5版美国放射学会(American College of Radiology, ACR)乳腺影像报告和数据系统(Breast Imaging Reporting and Data System Atlas 5th Edition,BI-RADS®5th)标准[7],对MG的表现进行描述及评估。肿块大小(RECIST 1.1标准)在横断位DCEMRI晚期时像上选取肿瘤的最大径线测量。
4. 病理分析
记录患者的组织病理学检查结果,包括病理类别、浸润性导管癌级别、激素受体(hormone receptor,HR)状态、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)状态、Ki-67表达等病理学指标。激素受体阳性为雌激素受体(oestrogen receptor,ER)和/或孕激素受体(progesterone receptor,PR)阳性,即标准免疫组化方法核染色>1%[8]。HER2阳性为HER2评分3+,或HER2评分2+的肿瘤通过荧光原位杂交技术显示基因有扩增。
5. 统计学分析
应用SPSS 26.0软件和R v. 4.1.1(R Development Core Team,Vienna,Austria)软件进行统计分析。连续资料以均数±标准差或中位数(上,下四分位数)表示。临床、病理和影像特征比较使用Mann-WhitneyU检验、独立样本t检验或χ2检验。采用logistic回归分析明确MG假阴性乳腺癌的独立危险因素,并构建联合模型。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评估独立危险因素及联合模型的诊断效能。应用SHAP分析联合模型中各独立危险因素导致MG假阴性结果的贡献价值。通过组内相关系数(intraclass correlation coefficient,ICC)和Kappa检验对病灶大小、MG密度、钙化状态和病灶MRI强化类型的观察者间变异性进行评估。P<0.05为差异有统计学意义。
结果
入组1472例患者,平均年龄(51.64±9.92)岁,范围20~86岁,包括33例双侧乳癌;共1505个病灶,其中373个MG假阴性乳腺癌(图1为MG假阴性乳腺癌病例的影像学表现),1132个MG阳性乳腺癌。
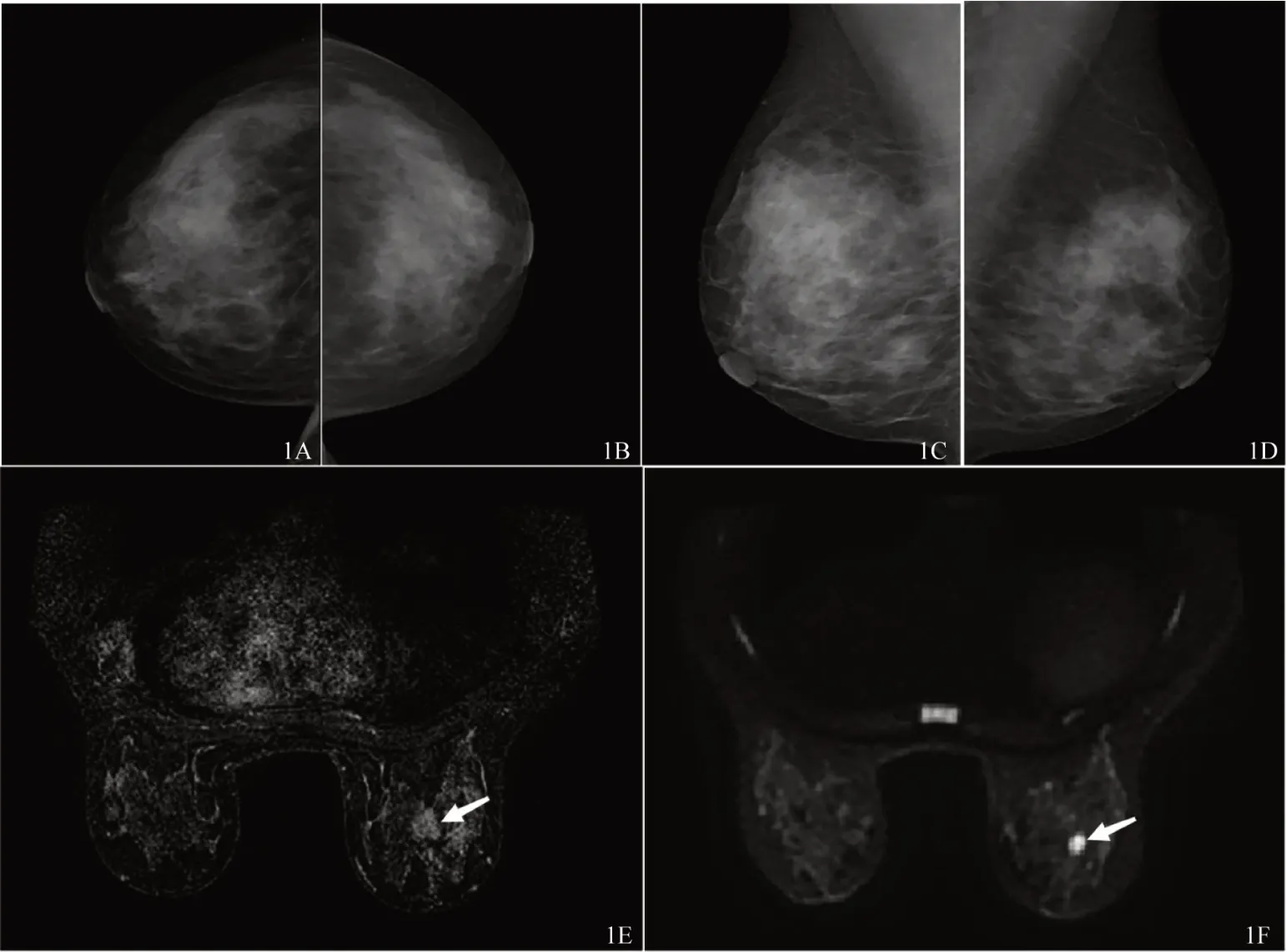
图1 典型病例影像女,44岁,表现为MG假阴性的乳腺癌患者,病理证实为右乳非特殊型浸润性癌2级,三阴性,Ki-674%。双侧乳腺头尾位(CC位)图像(A、B)和内外斜位(MLO位)图像(C、D)显示,双侧乳腺不均匀致密,双乳未见可疑钙化;横断位DCE-MRI图像(E)示右乳外上象限可见一17.3 mm的强化肿块(箭所指);横断位DWI图像(F)示肿块明显高信号(箭所指)。
2名诊断医师对病灶大小、MG密度、钙化状态及病灶强化类型评估均有良好的一致性。病灶大小:ICC=0.936(95%CI 0.801~0.967);MG密度:κ=0.912(95%CI 0.792~0.959);钙化状态:κ=0.895(95%CI 0.774~0.923);病灶MRI强化类型:κ=0.903(95%CI 0.810~0.944)。
373个MG假阴性乳腺癌[平均年龄(48.43±9.04)岁,范围23~80岁]和1132个MG阳性乳腺癌组[平均年龄(52.58±10.75)岁,范围20~86岁]在年龄、绝经状态、病灶大小、MG密度、钙化状态、病灶MRI强化类型、病理类型、病理分级、PR状态、Ki-67指数、分子亚型、腋窝淋巴结状态等方面均有显著性差异(均P<0.05),而在ER状态和HER2状态上没有统计学差异(均P>0.05)。详见表1。
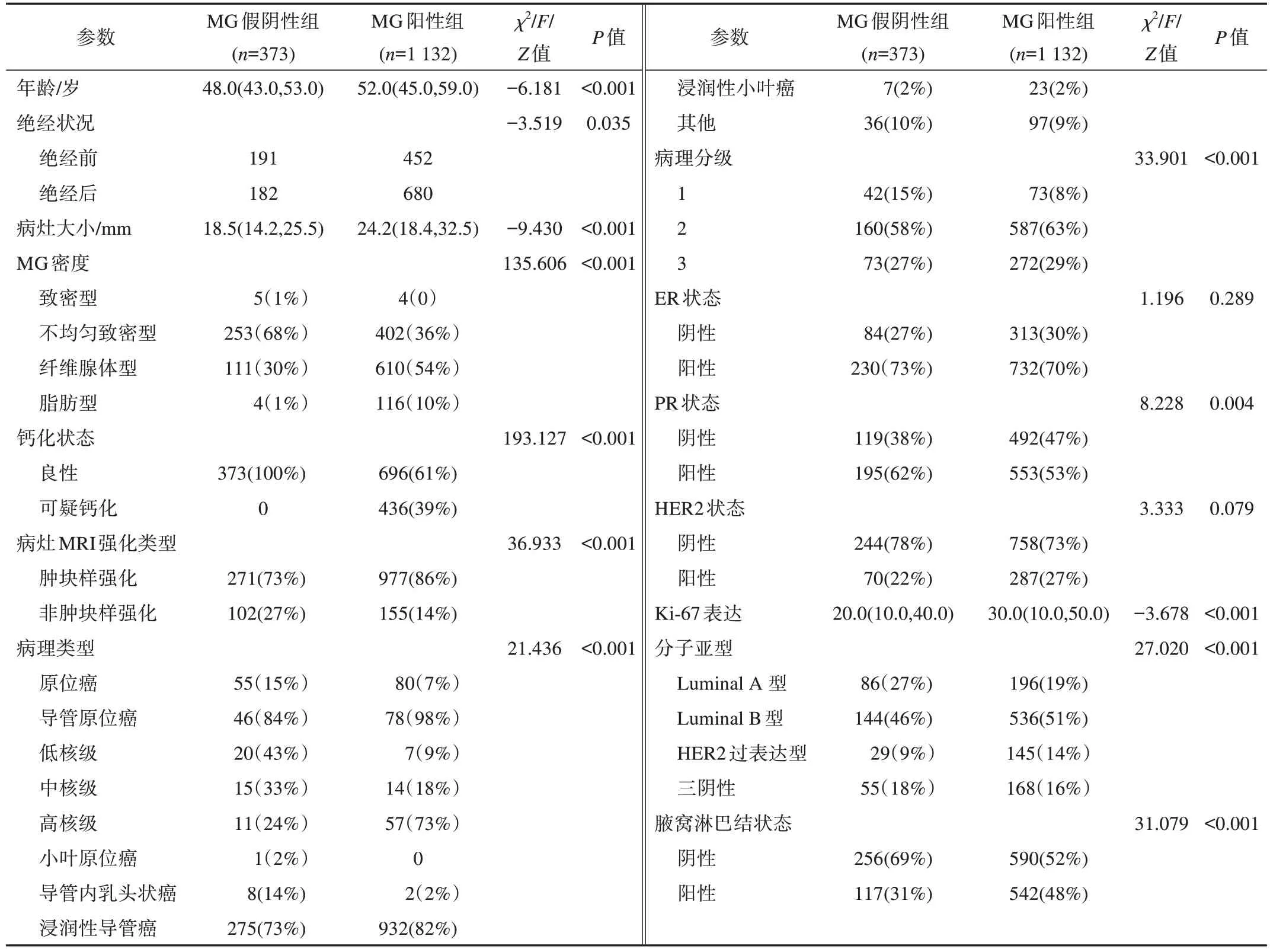
表1 MG假阴性乳腺癌与MG阳性乳腺癌临床、病理及影像学特征比较
此外,373 个MG假阴性乳腺癌中原位癌/浸润性癌比率约为 17%(55/318);1132个MG阳性乳腺癌中原位癌/浸润性癌比率约为8%(80/1052),两者具有统计学差异(P<0.001)。
多因素logistic回归分析结果显示,较小的病灶(OR=1.066,95%CI 1.048~1.083,P<0.001)、致密或不均匀致密MG密度(OR=0.006,95%CI 0.001~0.060,P<0.001)、无可疑钙化(OR=0.002,95%CI 0.001~0.010,P<0.001)、非肿块样强化(non-mass enhancement,NME)(OR=0.034,95%CI 0.017~0.067,P<0.001),、原位癌(主要为导管原位癌)(OR=0.360,95%CI 0.152~0.850,P=0.02)和腋窝淋巴结阴性(OR=0.516,95%CI 0.369~0.723,P<0.001)与MG假阴性乳腺癌独立相关(表2)。将上述6个独立相关因素构建联合模型,显示出较高的预测效能,AUC为0.871(95%CI 0.851~0.890),灵敏度为84.06%,特异度为80.71%,阳性预测值为93.11%,阴性预测值为62.49%(表3)。
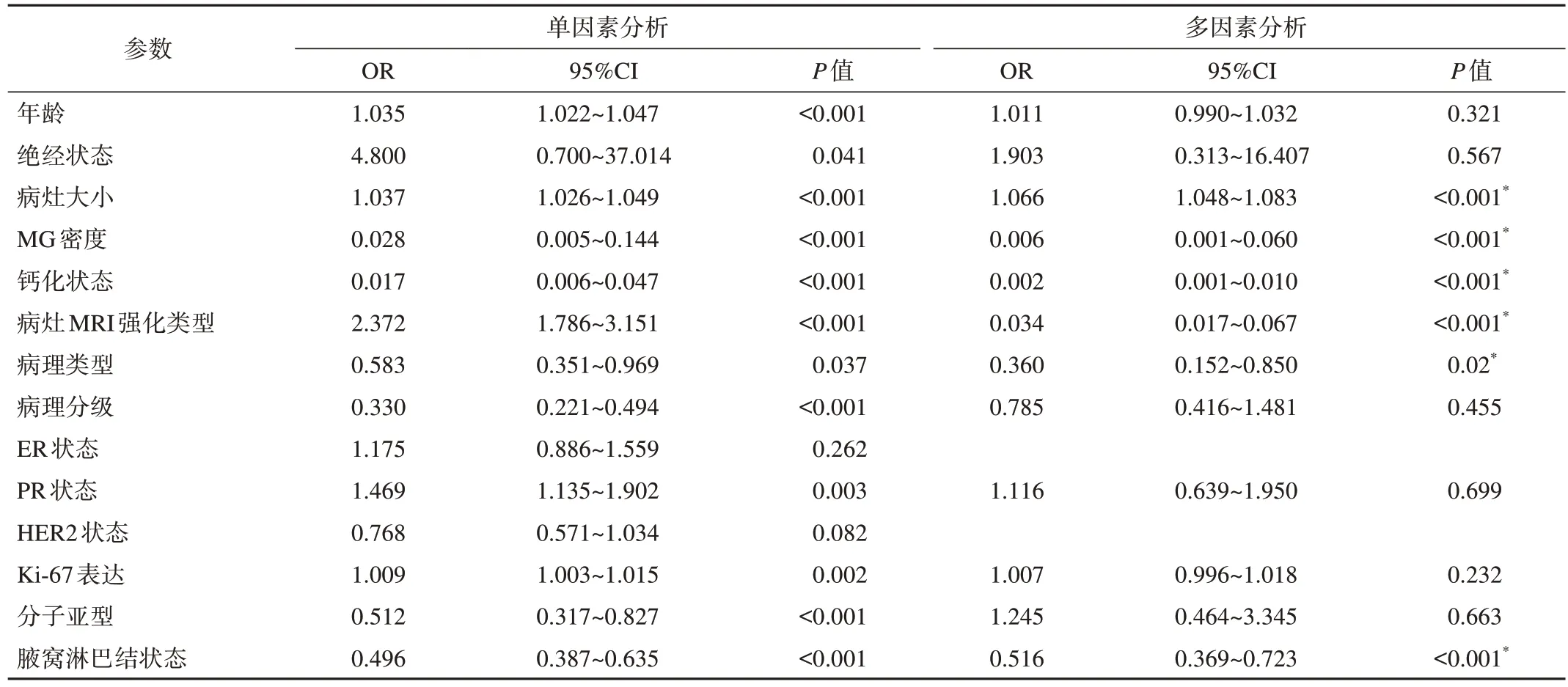
表2 MG假阴性乳腺癌相关特征的logistic回归分析结果
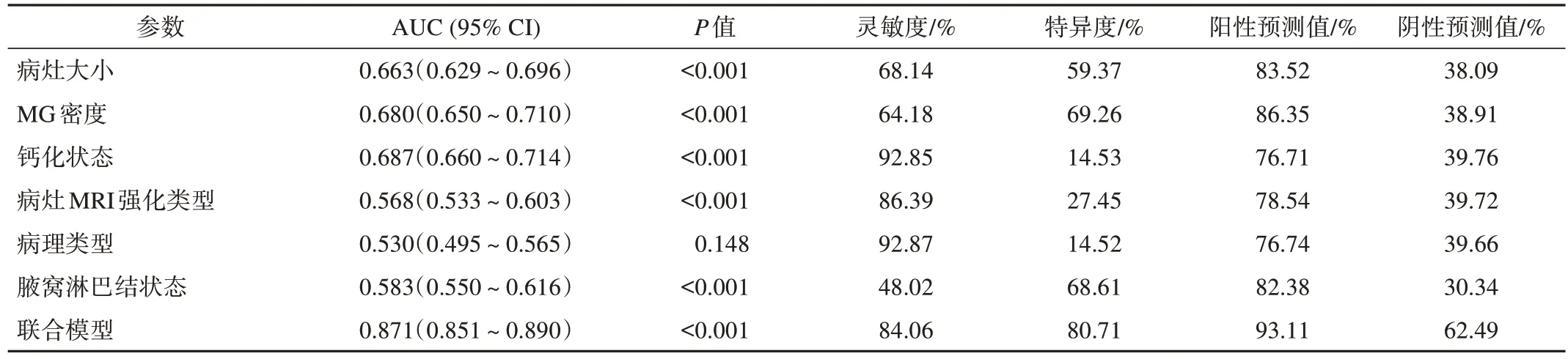
表3 ROC分析MG假阴性乳腺癌独立相关特征的诊断效能
应用SHAP对联合模型中单个独立相关因素进行的评估(图2)显示,病灶大小、MG密度和病灶MRI强化类型是导致MG假阴性结果的主要因素,而病理类型、钙化状态和腋窝淋巴结状态是重要补充。
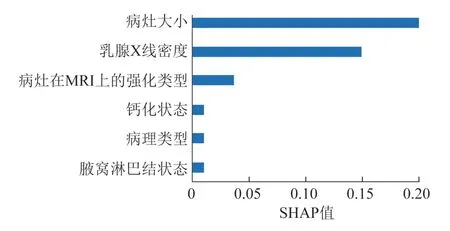
图2 应用SHAP分析导致乳腺癌MG假阴性结果的因素
讨论
这项回顾性单中心研究旨在探讨仅能够在MRI发现而MG假阴性的乳腺癌相关的临床、病理和影像学特征,有助于影像科医生或临床医生提高警惕,适当补充乳腺MRI检查,以提高癌灶的检出率,避免漏诊而影响治疗方案的选择,改善预后。
在本研究中,我们回顾相对较大的1505个样本量,发现MG假阴性乳腺癌发生率约为25%,该数据与Choudhery等[6]研究相一致。
本研究中,病灶较小、致密或不均匀致密MG密度、NME、无可疑钙化、原位癌(主要为DCIS)和腋窝淋巴结阴性与MG假阴性乳腺癌独立相关。根据SHAP分析(图2),病灶大小、MG密度和病灶MRI强化类型是导致MG假阴性检查结果的主要因素,而病理类型、钙化状态和腋窝淋巴结状态是重要补充。
我们的结果表明,致密或不均匀致密腺体是导致MG假阴性乳腺癌的一个危险因素,与最近报道[9]的一项前瞻性随机研究结果相仿。该研究表明,乳腺密度极高的女性通过补充MRI检查提高了癌灶检出率。事实上,致密的乳腺很难通过MG对病灶进行准确评估,并且可能具有更高患癌风险[10]。MRI不受乳腺密度的影响,通过多方位,多序列成像显示病灶,尤其DCE及DWI显著提高乳腺癌的诊断率。
小病灶与MG假阴性的检查结果显著相关。先前的研究证实:小病灶,多灶性或多中心性病变大多不能通过MG完全检出,通常检出率低于50%[11],而未发现的额外恶性病灶是保乳术后复发的主要原因。另外,在我们的研究中,有33例同时性双乳癌(占2%)都是通过MRI检查发现,而它们中的12例(占36%)为双侧MG假阴性,MG假阴性率高于本研究的平均值(约25%)。笔者认为导致这一结果可能是双乳癌降低了MG对照观察之间的差异,故强调在可能存在多中心、多灶性乳腺癌或同时性双乳癌病例中应当补充MRI以提高癌灶检出率。
在我们的研究中,DCIS与MG假阴性检查结果独立相关。近年来DCIS的发病率显著提高,约占新发乳腺癌病例的30%[12]。DCIS通常在MG中表现为钙化,尤其是高核级DCIS更容易出现恶性钙化[13]。在我们这项研究中共有124个DCIS病例,MG假阴性组和MG阳性组中分别为46和78例。假阴性组和阳性组的低核级DCIS病例分别为20例(43%)和7例(9%);中核级DCIS病例分别为15例(33%)和14例(18%);高核级DCIS病例分别为11(24%)和57(73%),2组之间低、中、高核级DCIS比例具有统计学差异(P<0.001)。低核级和中核级DCIS因病灶小且多无钙化而被遗漏。
在我们的研究中,NME与MG假阴性检查结果紧密相关。根据第5版ACR BI-RADS,相对于MRI上肿块样强化病灶,非肿块样强化病灶是指增强扫描后病灶无空间占用效应的区域反映。由于没有空间形态,在MG中不易发现。人工智能的应用,将显著提高诊断率[14]。
当然,如果在MG中存在其他间接体征,例如乳房变形、乳头凹陷、皮肤增厚和乳头牵拉移位等,尽管未见到恶性病灶的直接征象,也要高度警惕,以防假阴性的可能,需补充乳腺MRI以提高癌灶检出率。
这项研究有一些局限性。首先,这是单中心回顾性研究,病例的选取可能会导致偏倚;其次,作为金标准的病理仅涉及乳腺MRI的可疑区域,很少检查整个乳腺,可能导致MG假阴性结果被低估;第三,未应用数字乳腺断层摄影(digital breast tomography,DBT)、全数字化乳腺摄影(full-field digital mammography,FFDM)及对比增强光谱乳腺X线摄影(contrast-enhanced spectral mammography,CEM)等更敏感的检查技术,或人工智能和影像组学等更先进的方法,导致MG假阴性结果可能被高估。
总之,较小的病灶、致密或不均匀致密的MG密度、NME病灶、无可疑钙化,原位癌和腋窝淋巴结阴性与MG假阴性乳腺癌独立相关。SHAP分析显示,病灶大小、MG密度和病灶MRI增强类型是导致MG假阴性的主要因素,病理类型、钙化状态和腋窝淋巴结状态是重要补充。对此类患者需补充乳腺MRI检查以防止漏诊。

